苯并[a]芘(B[a]P)是一种广泛存在于环境中的多环芳烃类化合物,主要来源于工业生产生活中煤炭、石油、天然气燃烧和机动车辆排出产生的废气,加工橡胶、熏制食品以及纸烟与烟草的烟气等,可通过呼吸道、消化道和皮肤进入人体,是国际公认的化学致癌物[1]。B[a]P具有亲脂性,可通过血脑屏障进入中枢神经系统,引起中枢神经系统的毒性损伤,但是其主要机制尚不明确。
DNA甲基化是重要的表观遗传机制,是在DNA甲基化转移酶(DNMTs)的作用下使CpG二核苷酸5’端的胞嘧啶转变为5’甲基胞嘧啶,进而调控基因的转录和表达[2]。DNA甲基转移酶(DNMTs)是调控DNA甲基化的关键酶,哺乳动物中已经发现并鉴定了三种DNMTs,分别为DNMT1、DNMT3a和DNMT3b[3],在海马中学习记忆的形成以及突触可塑性中是必需的[4-5]。本研究拟探讨DNMT1、DNMT3a和DNMT3b基因表达和蛋白激酶活力在B[a]P致小鼠学习记忆功能障碍中的可能作用,为研究B[a]P神经毒性机制的研究提供一定的科学依据。
1 材料与方法 1.1 实验动物健康雄性ICR小鼠48只(5周龄,体重为18~20 g),购自北京海淀兴旺实验动物养殖场,动物合格证号:SCXK(京)2014-0013。
1.2 试剂与仪器B[a]P(纯度>97%),Sigma公司;ELISA试剂盒(生工生物工程有限公司);RNAiso Plus、反转录试剂盒PrimerScript RT Master Mix、PCR引物、SYBR®Premix Ex TaqTMⅡ(日本TaKaRa)。Morris水迷宫(中国医学科学院药物研究所),Line Gene 9600荧光定量PCR仪(杭州博日科技有限公司),酶标仪(美国伯乐)。
B[a]P溶液的配置:准确称取B[a]P粉剂170 mg,溶于34 mL压榨花生油(金龙鱼牌)中,配制成5 mg/mL的B[a]P储备液,超声振荡至全部溶解,室温避光储存备用。使用前用花生油稀释到相应的使用浓度。
1.3 动物的分组和染毒SPF级雄性ICR小鼠48只,在动物房(自然节律采光,室温为18℃~23℃,湿度为40%~70%)适应性喂养1周后,按体重随机分为4组(每组12只),分别为溶剂(花生油)对照组,低、中和高剂量B[a]P染毒组。染毒组腹腔注射0.5,2.0和10.0 mg/kg B[a]P,溶剂对照组注射等体积的花生油,隔天染毒1次,连续染毒30次。染毒时间固定在上午9:00。隔天肌肉注射青霉素(2万单位/只)以防感染。每天记录动物的饮水和饮食量以及生活状态,每周称量1次体重。
1.4 样本采集染毒结束后,将小鼠用水合氯醛麻醉,颈椎脱臼处死,迅速取出大脑组织并在冰皿上分离出大脑皮质,放于EP管中,-80℃冻存。
1.5 Morris水迷宫实验Morris水迷宫实验(Morris water maze test):为时6 d,前5天为定位航行实验,第6天为空间探索实验。定位航行实验是将小鼠放入水中,利用小鼠天生会游泳但是怕水的特点,迫使小鼠找到平台逃离水中,小鼠通过固定训练,逐渐会在大脑中形成认知和记忆,实验前1天让小鼠适应性游2 min。设置水温20±1℃,平台直径约为6.5 cm,高度为28 cm, 水面高出平台1.5 cm,平台位于NE象限。将小鼠头朝池壁放入水中,记录小鼠找到平台的时间,如果时间超过60秒,则通过简单引导让小鼠到平台上,等待10秒,潜伏期记60秒,接着将小鼠移出水面,简单擦拭。每天训练4回,训练的间隔为15 min,训练天数5 d。空间探索实验:撤掉平台,将小鼠由原平台所在象限的相对象限(SW象限)入水,记录小鼠在目标象限所花的时间和进入该象限的次数,同时利用图像分析采集系统(Smart v3.0)记录小鼠的游泳路径,游泳时间等。
1.6 实时荧光定量PCR(qPCR)测定DNMT1、DNMT3a和DNMT3b基因的表达量称取50 mg小鼠大脑皮质组织,按照TaKaRa试剂盒说明书提取总RNA,检测RNA的纯度和浓度,纯度在1.8~2.2之间认为合格,可用于后续实验。按50 ng/μL的浓度将其反转录为cDNA,进行qPCR扩增,引物由TaKaRa公司设计并合成(表 1)。
| 引物名称 | 引物序列(5’→ 3’方向) | 退火温度/(Tm,℃) | 扩增产物/bp |
| Mus Dnmt1-F | CTTCGGCAACATCCTGGACA | 60 | 103 |
| Mus Dnmt1-R | ACTGGACAGCAGGCAGAGCTTA | ||
| Mus DNMT3a-F | TGCGCCAGAAGTGCAGAAAC | 60 | 141 |
| Mus DNMT3a-R | CGTCATACTGGTAAGCACACTCCAA | ||
| Mus DNMT3b-F | GAATGCGCTGGGTACAGTGG | 60 | 100 |
| Mus DNMT3b-R | GCCAGATTAAAGTGCTGGCTGAA | ||
| Mus actin-F | CATCCGTAAAGACCTCTATGCCAAC | 60 | 171 |
PCR反应体系包括:2×SYBR Green qPCR Master Mix 12.5 μL,10 μmol/L的上、下引物各1 μL,cDNA 10 ng,ddH2O补足体积至25 μL。扩增程序如下:95℃ 10 min;95℃ 30 s,60℃ 30 s,40个循环。反应结束后确认qPCR的扩增曲线和熔解曲线,采用2-△△Ct法计算实验组相对于对照组目的mRNA表达的变化倍数[△△Ct=(Ct实验组目的基因-Ct实验组内参)-(Ct对照组目的基因-Ct对照组内参)]。
1.7 酶联免疫吸附试验(ELISA)法检测DNMTs激酶活性的变化称取50 mg的小鼠大脑皮质样本,加入450 μL PBS,充分匀浆,离心20 min(2 000~3 000 r/min),仔细收集上清。BCA蛋白定量,将所有样本稀释到同一浓度。具体实验操作按试剂盒说明书进行。
1.8 统计学分析实验结果用x ± s来表示,用SPSS 22.0软件进行统计学分析,多组间比较用方差齐性检验和单因素方差分析(One Way ANOVA)。进一步组间两两比较,方差齐时,采用LSD检验;方差不齐时,用Dunnet-t法检验,双侧P < 0.05认为差异有统计学意义。
2 结果 2.1 小鼠的一般情况染毒期间,溶剂对照组和低剂量组小鼠进食、饮水情况基本接近,而中、高剂量组小鼠进食、饮水明显减少,尤以高剂量组最为明显。与溶剂对照组相比,低剂量组小鼠有中枢神经功能轻度兴奋的表现,主要为易激惹,好斗、打架次数明显增多。而中、高剂量组小鼠明显受抑制,精神萎靡、情绪低落、活动减少、反应迟钝,毛发光泽度降低、干枯易脱落等现象。
2.2 小鼠的体重变化从图 1可以看出,随着染毒过程的进行,与溶剂对照组相比,低剂量组小鼠体重变化无明显差异,中剂量和高剂量组体重增重逐渐减少,高剂量组体重明显低于溶剂对照组,差异有统计学意义(P < 0.05)。染毒结束后,与溶剂对照组相比,低、中剂量组小鼠体重没有显著变化,但高剂量组小鼠体重降低了约7 g左右,并且中、高剂量组部分小鼠出现腹部隆起,体态笨重,活动减少,解剖后发现有不同程度的腹水。
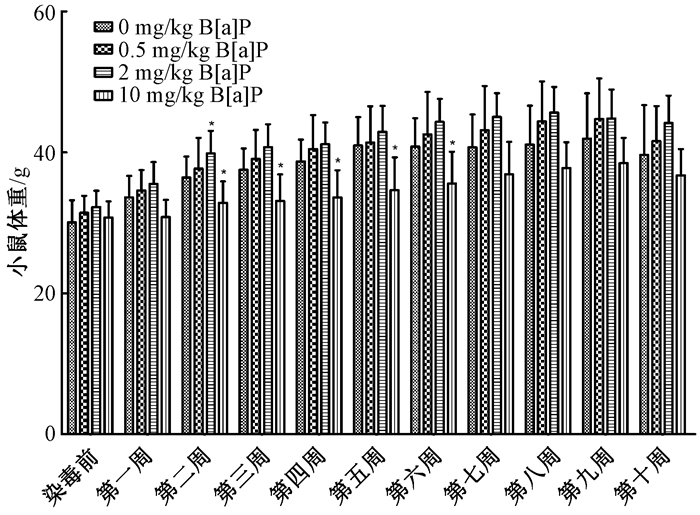
|
| 注:*表示与0 mg/kgB[a]P组比较,差异有统计学意义(P < 0.05) 图 1 小鼠体重随时间的变化(n=12) |
2.3 水迷宫结果
各染毒组与对照组小鼠的平均游泳速度几乎相当(P>0.05)(图 2A),提示各组小鼠的体力是均衡可比的。随着染毒剂量的增加,小鼠到达平台的潜伏期逐渐延长,高剂量组潜伏期显著高于溶剂对照组,差异有统计学意义(P < 0.05)(图 2B);小鼠进入目标象限的总次数和在目标象限的游泳路程逐渐减少,高剂量组显著低于溶剂对照组,差异有统计学意义(P < 0.05)(图 2C和图 2D)。
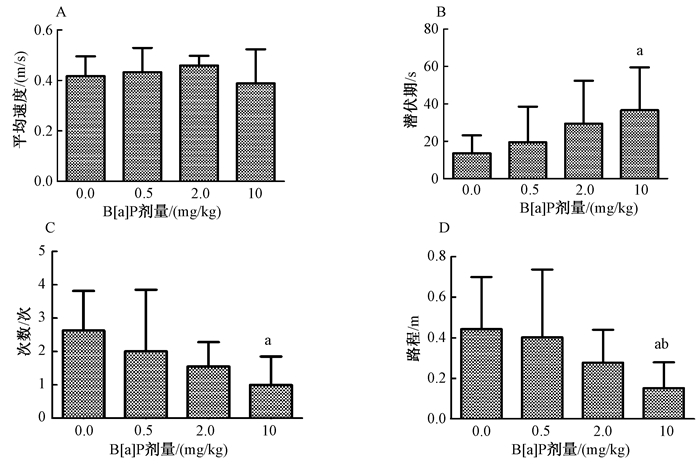
|
|
A小鼠平均游泳速度;B到达平台潜伏期;C进入目标象限总次数;D目标象限游泳路程 注:a为与0 mg/kgB[a]P组比较,差异有统计学意义(P < 0.05);b为与0.5 mg/kgB[a]P比较,差异有统计学意义(P < 0.05) 图 2 水迷宫检测小鼠空间学习记忆能力的结果(n=6) |
2.4 小鼠皮质中DNMTs基因表达量和蛋白激酶活力的改变
B[a]P染毒第10次、第20次、第30次后,各染毒组小鼠大脑皮质中DNMT1、DNMT3a和DNMT3b基因表达量和蛋白激酶活力均逐渐增高,与相应的溶剂对照组相比,差异均具有统计学意义(P < 0.05)(表 2);随着染毒剂量的增加和时间的延长,小鼠大脑皮质DNMT1基因和蛋白激酶活力在中、高剂量组增加最为明显;小鼠大脑皮质DNMT3a基因和蛋白激酶活力在B[a]P染毒第20次和第30次后中、高剂量组增加最为显著;而DNMT3b基因和蛋白激酶活力随着染毒剂量的增加亦逐渐增加,但增加幅度较为缓慢,但仍维持在较高的水平。
| 染毒 次数 |
组别 | DNMTs基因表达的改变 | DNMTs蛋白激酶活力的改变 | |||||
| DNMT1 | DNMT3a | DNMT3b | DNMT1/(ng/L) | DNMT3a/(ng/L) | DNMT3b/(ng/L) | |||
| 第10次 (n=3) |
0 mg/kgB[a]P | 1.01±0.14 | 1.01±0.14 | 1.01±0.14 | 97.56±6.55 | 105.02±19.47 | 48.14±4.05 | |
| 0.5 mg/kgB[a]P | 1.54±0.12a | 1.19±0.01 | 1.17±0.07 | 96.47±14.15 | 87.21±4.18 | 57.44±3.76a | ||
| 2 mg/kgB[a]P | 1.59±0.13a | 1.37±0.10a | 1.39±0.15a | 142.34±4.70ab | 120.70±9.33 | 65.45±5.16ab | ||
| 10 mg/kgB[a]P | 1.73±0.05ab | 1.66±0.14ab | 1.64±0.07abc | 151.04±1.87ab | 326.53±46.19abc | 74.41±3.11abc | ||
| 第20次 (n=3) |
0 mg/kgB[a]P | 1.00±0.08 | 1.01±0.18 | 1.01±0.18 | 98.81±3.23 | 113.93±25.00 | 53.34±9.96 | |
| 0.5 mg/kgB[a]P | 1.03±0.07 | 1.42±0.10a | 1.32±0.10a | 95.07±15.16 | 118.23±26.10 | 60.73±3.58 | ||
| 2 mg/kgB[a]P | 1.39±0.05ab | 1.54±0.06a | 1.35±0.16a | 148.56±16.72ab | 263.55±7.60ab | 72.42±5.86ab | ||
| 10 mg/kgB[a]P | 1.55±0.15abc | 1.88±0.07abc | 1.75±0.19abc | 154.78±21.19ab | 490.97±33.02abc | 78.37±2.55ab | ||
| 第30次 (n=6) |
0 mg/kgB[a]P | 0.95±0.138 | 1.01±0.130 | 1.01±0.146 | 96.01±6.19 | 83.52±7.60 | 48.14±5.27 | |
| 0.5 mg/kgB[a]P | 1.04±0.087 | 1.16±0.166a | 1.14±0.098 | 96.94±13.88 | 80.45±18.51 | 54.43±2.51a | ||
| 2 mg/kgB[a]P | 1.25±0.095ab | 1.28±0.171a | 1.38±0.074ab | 142.96±3.88ab | 99.49±9.43b | 61.76±2.79ab | ||
| 10 mg/kgB[a]P | 1.38±0.067abc | 1.66±0.290abc | 1.44±0.070ab | 157.26±9.20ab | 260.48±9.90abc | 71.94±1.71abc | ||
| 注:a为与0 mg/kgB[a]P组比较,差异有统计学意义(P < 0.05);b为与0.5 mg/kgB[a]P组比较,差异有统计学意义(P < 0.05);c为与2 mg/kgB[a]P组比较,差异有统计学意义(P < 0.05) | ||||||||
3 讨论
B[a]P由于其高亲脂性而容易通过血脑屏障存在于中枢神经系统,与学习和记忆密切相关。本课题组率先发现,长期职业暴露B[a]P的人群,认知功能和自主神经调节功能显著下降,其严重程度与B[a]P的高暴露密切相关[6-7];并通过脑室注射B[a]P复制了B[a]P引起SD大鼠学习记忆能力损伤的动物模型[8],但脑室注射的染毒途径与人群实际暴露途径之间有较大的差异。本次研究采用腹腔注射染毒B[a]P,具有给药剂量准确,吸收效率高、操作方便的特点,复制了通过消化道接触B[a]P致ICR小鼠学习记忆功能障碍的动物模型。但B[a]P致学习记忆功能损害的机制尚不清楚。
本研究发现,随着染毒剂量的增加和染毒时间的延长,小鼠大脑皮质中DNMT1、DNMT3a和DNMT3b基因表达量和蛋白激酶的活性均显著增强,并维持在较高的水平。提示DNMTs可能参与B[a]P所致小鼠学习记忆功能损伤的作用过程。
表观遗传学是指DNA序列没有发生变化,其他机制引起的可遗传改变[9]。DNA甲基化是最早发现的表观遗传修饰之一, 大量研究表明,DNA甲基化可以导致染色质结构、DNA构象的改变,也可以影响DNA的稳定性和DNA与蛋白质之间的相互作用,进而影响基因的表达[10-11]。DNA甲基化主要是在DNMTs的作用下,以S-腺苷甲硫氨酸(SAM)为甲基供体,将其甲基转移到胞嘧啶5位碳原子上的过程。DNMTs是DNA甲基化过程的关键酶,哺乳动物中目前发现的与DNA关系密切的DNMTs有3种[12],维持机体现存的甲基化的DNMT1[13]和从头合成新的甲基化的DNMT3a、DNMT3b[14]。目前还没有关于B[a]P致神经细胞损伤中,大脑皮质中DNMTs变化的相关报道。在本研究中,随着B[a]P染毒剂量的增加和时间的延长,小鼠大脑皮质的DNMT1、DNMT3a和DNMT3b基因和酶活力均显著提高。Leonardo等[15]研究发现,DNMT1基因敲除小鼠出现学习记忆缺陷。庞伟等[16]研究发现,缺锌处理神经细胞24 h后,DNMT1 mRNA表达增加,DNMT3a mRNA表达降低,而DNMT3b mRNA的表达无明显变化。虽同样是引起神经损伤,但是DNMTs的变化有一些出入,可能是因为庞伟等的研究对象是神经细胞,且短时间染毒可能出现一过性的改变。居玲莎等[17]研究表明七氟烷致新生大鼠远期认知功能损伤的模型中,海马区DNMT3a和DNMT3b的mRNA和蛋白水平随作用时间的延长显著增加,该结果与本研究结果一致。Subbanna等[18]研究发现,给出生7天的小鼠摄入酒精后,成年时小鼠记忆能力下降,海马内DNMT3a蛋白含量显著增加。一项动物研究显示[19],早期母婴分离可导致小鼠成年后探索行为受损并伴随DNMTs水平的增加。本研究结果显示,随着B[a]P染毒剂量的增加和时间的延长,小鼠大脑皮质的DNMT1、DNMT3a和DNMT3b基因和酶活力均显著提高,尤其以DNMT3a的变化最为显著,提示B[a]P致小鼠认知功能损伤过程中,大脑皮质的DNA甲基化模式正在发生改变,有新的甲基化过程在进行。但具体发生了什么样的甲基化模式改变,以及发生甲基化的基因有哪些,将是下一步研究的核心内容。本研究结果,为后续从甲基化模式改变方面探讨B[a]P致学习记忆损伤的作用机制提供了明确的科学线索,也为B[a]P神经毒性的防治提供了一定的作用靶点。
| [1] | Juhasz AL, Naidu R. Bioremediation of high molecular weight polycyclic aromatic hydrocarbons:a review of the microbial degradation of benzo[a]pyrene[J]. Int Biodeter Biodegr, 2000, 45(1-2): 57–88. doi: 10.1016/S0964-8305(00)00052-4 |
| [2] | Dahl C, Guldberg P. DNA methylation analysis techniques[J]. Biogerontology, 2003, 4(4): 233–250. doi: 10.1023/A:1025103319328 |
| [3] | Margot JB, Cardoso MC, Leonhardt H. Mammalian DNA methyltransferases show different subnuclear distributions[J]. J Cell Biochem, 2001, 83(3): 373–379. doi: 10.1002/(ISSN)1097-4644 |
| [4] | Miller CA, Campbell SL, Sweatt JD. DNA methylation and histone acetylation work in concert to regulate memory formation and synaptic plasticity[J]. Neurobiol Learn Mem, 2008, 89(4): 599–603. doi: 10.1016/j.nlm.2007.07.016 |
| [5] | Miller CA, Sweatt JD. Covalent modification of DNA regulates memory formation[J]. Neuron, 2007, 53(6): 857–869. doi: 10.1016/j.neuron.2007.02.022 |
| [6] | 聂继盛, 张红梅, 孙建娅, 等. 焦炉作业工人神经行为功能改变的特征分析[J]. 中华预防医学杂志, 2008, 42(1): 25–29. Nie JS, Zhang HM, Sun JY, et al. Characteristic of the neurobehavioral functional changes in coke oven workers[J]. Chin J Prev Med, 2008, 42(1): 25–29. (in Chinese). |
| [7] | Zhang HM, Nie JS, Wang F, et al. Effects of benzo[a]pyrene on autonomic nervous system of coke oven workers[J]. J Occup Health, 2008, 50(4): 308–316. doi: 10.1539/joh.L7155 |
| [8] | 张红梅. 苯并[a]芘致神经细胞凋亡的机制研究[D]. 太原: 山西医科大学, 2008. Zhang HM. Study on the mechanisms of Benzo[a]pyrene-induced neural cell apoptosis[D]. Taiyuan:Shanxi Medical University, 2008. |
| [9] | Wolffe AP, Matzke MA. Epigenetics:regulation through repression[J]. Science, 1999, 286(5439): 481–486. doi: 10.1126/science.286.5439.481 |
| [10] | Zhou JC, Yang LH, Zhong TY, et al. H19 lncRNA alters DNA methylation genome wide by regulating S-adenosylhomocysteine hydrolase[J]. Nat Commun, 2015, 6: 10221. doi: 10.1038/ncomms10221 |
| [11] | Klughammer J, Datlinger P, Printz D, et al. Differential DNA methylation analysis without a reference genome[J]. Cell Rep, 2015, 13(11): 2621–2633. doi: 10.1016/j.celrep.2015.11.024 |
| [12] | Jones PA. Functions of DNA methylation:islands, start sites, gene bodies and beyond[J]. Nat Rev Genet, 2012, 13(7): 484–492. doi: 10.1038/nrg3230 |
| [13] | Chen T, Li E. Establishment and maintenance of DNA methylation patterns in mammals[M]//Doerfler W, Böhm P. DNA Methylation:Basic Mechanisms. Berlin, Heidelberg:Springer, 2006:179-201. |
| [14] | Goll MG, Bestor TH. Eukaryotic cytosine methyltransferases[J]. Annu Rev Biochem, 2005, 74: 481–514. doi: 10.1146/annurev.biochem.74.010904.153721 |
| [15] | D'Aiuto L, Di Maio R, Mohan KN, et al. Mouse ES cells overexpressing DNMT1 produce abnormal neurons with upregulated NMDA/NR1 subunit[J]. Differentiation, 2011, 82(1): 9–17. doi: 10.1016/j.diff.2011.03.003 |
| [16] | 庞伟, 胡艳丹, 卢豪, 等. DNA甲基化在缺锌致海马神经细胞损伤中的作用[C]//中国营养学会微量元素营养第十一次学术会议论文集. 哈尔滨, 2012: 95-101. |
| [17] | 居玲莎. DNA甲基化在七氟烷暴露致新生大鼠远期认知功能损伤中的作用[D]. 南京: 南京大学, 2016. Ju LS. DNA Methylation is involved in neonatal sevoflurane exposure-induced cognitive impairments in rats[D]. Nanjing:Nanjing University, 2016. |
| [18] | Subbanna S, Nagre NN, Shivakumar M, et al. Ethanol induced acetylation of histone at G9a exon1 and G9a-mediated histone H3 dimethylation leads to neurodegeneration in neonatal mice[J]. Neuroscience, 2014, 258: 422–432. doi: 10.1016/j.neuroscience.2013.11.043 |
| [19] | Anier K, Malinovskaja K, Pruus K, et al. Maternal separation is associated with DNA methylation and behavioural changes in adult rats[J]. Eur Neuropsychopharmacol, 2014, 24(3): 459–468. doi: 10.1016/j.euroneuro.2013.07.012 |



