2. 北京市延庆区疾病预防控制中心
挥发性有机物(VOCs)主要源自于大自然和人为排放,在室温下容易蒸发,部分VOCs组分对人体健康有害[1-3]。VOCs通过呼吸道、皮肤进入人体后,一部分进入血液循环系统发生代谢反应,一部分随着尿液以原形的方式排出体外[4]。同时,机体自身代谢异常时,也可产生VOCs。因此,通过检测尿液中VOCs的含量,可反映外界环境污染和体内代谢情况。尿液中VOCs在检测有以下难点:① 实验室环境中含有VOCs,检测本底值较高。② 吹扫捕集在吹扫过程中,尿液会产生大量泡沫,容易堵塞仪器。③ 尿液基质复杂,基质效应影响检测结果。目前,尿液中VOCs的检测方法有吹扫捕集气相色谱/质谱法[5],该方法建立了尿液中苯乙烯的检测方法,但是不适合多种目标化合物的检测,同时检测尿液体积为5 mL,检出限较高(0.4 μg/L)。Silva[6]建立了固相微萃取(SPME)气相色谱/质谱法测定癌症患者尿液中的己酸,该方法使用的萃取纤维,使用寿命较短,仪器普及率低,实验成本较高,不适合开展人群中生物样品的检测。苯系物和挥发性卤代烃容易富集在生物体中,对生态环境和人体健康都有危害[7]。本文在高纯氮气吹扫环境下处理样品,采用“倍比稀释法”和经过吹扫处理的尿液建立工作曲线,利用消泡剂和同位素内标,以普及率较高的吹扫捕集—气质联用为平台,大体积进样(尿液进样体积为30 mL),建立了测定尿液中6种苯系物、7种挥发性卤代烃的方法。该方法检出限低,减小了尿液的基质效应,解决了尿液在吹扫过程中产生泡沫堵塞仪器的问题。
1 材料与方法 1.1 材料 1.1.1 试剂与材料VOCs检测专用甲醇(Fluka公司);法国Milli-Q EliX3纯水仪;SIGMA公司生产的Anifoam 204消泡剂;40 mL棕色玻璃瓶附螺旋盖及聚四氟乙烯垫片(随机取50个样品瓶,加满纯水,天平称量,均值为42.8 mL,RSD=0.9%,在计算时,尿液稀释后的体积以43 mL计算。);Rtx-VMS石英毛细管柱(30 m ×0.25 mm ×1.4 μm)或同等性能色谱柱;高纯氦气(99.999%);挥发性有机物标准品均购自Accustandard公司,纯度均大于99%;内标购自CDN和CIL公司,纯度均大于99%。
1.1.2 样品的采集采集晨尿中段尿液在经过处理的40 mL棕色玻璃瓶中,样品加满后旋紧瓶盖送至实验室检测。
1.1.3 样品的保存尿液采集送入实验室后立即放入4℃冰箱中冷藏保存。样品在24 h内上机测定。
1.2 仪器及测定条件 1.2.1 仪器Agilent-GC7890/MS5975气相色谱/质谱联用仪;吹扫捕集装置为PT9800&Aquatek 100 (美国Tekmar公司),25.0 mL吹扫管,25.0 mL定量环;自动进样装置为TELEDYNE TRKMAR AQUATek 70vial Autosamper (美国Tekmar公司)。
1.2.2 仪器条件色谱条件:色谱柱为Rtx-VMS石英毛细管柱(30 m × 0.25 mm ×1.4 μm);柱温起始温度为35℃,保持5 min,以6℃/min升至160℃,保持6 min,20℃/min升至210℃, 保持2 min;载气为氦气,11 mL/min,恒流方式。质谱条件:离子源温度为230℃,四级杆温度为150℃。选择离子见表 1。吹扫捕集条件:以高纯氦气(99.999%)为吹扫气,吹扫流速40 mL/min;吹扫时间为11 min。解吸温度为250℃,解吸时间为4 min。
| 化合物 | 保留时间/ min |
定量离子/ (m/z) |
定性离子/ (m/z) |
内标 | 内标离子/ (m/z) |
| 三氯甲烷 | 5.91 | 83 | 85 | 13C1 | 86 |
| 四氯化碳 | 6.02 | 117 | 119 | 13C1 | 120 |
| 苯 | 6.58 | 78 | 77 | 2H5 | 84 |
| 三氯乙烯 | 7.34 | 130 | 132 | 13C1 | 133 |
| 二氯一溴甲烷 | 8.17 | 83 | 85 | * | * |
| 甲苯 | 9.49 | 91 | 92 | 2H5 | 98 |
| 四氯乙烯 | 10.11 | 166 | 164 | * | * |
| 一氯二溴甲烷 | 10.76 | 127 | 129 | * | * |
| 乙苯 | 12.22 | 91 | 106 | 2H10 | 97 |
| 间/对二甲苯 | 12.52 | 91 | 106 | 2H10 | 97 |
| 邻二甲苯 | 13.29 | 91 | 106 | 2H4 | 112 |
| 三溴甲烷 | 13.37 | 173 | 175 | 13C1 | 174 |
| 注:*为四氯乙烯用甲苯内标定量,一氯二溴甲烷和二氯一溴甲烷用三溴甲烷内标定量 | |||||
1.3 操作步骤
以下操作步骤均在高纯氮气环境(将底部打孔的塑料盆倒置在操作平台上部,将氮气管插入孔中,通气后,高纯氮气提供正压条件)下进行。
1.3.1 标准贮备液准确称量12种VOCs标准物质(表 1),配制成浓度为200.0 μg/mL的标准贮备液,分装入1 mL棕色安瓿瓶中,封口后置于冰箱中,冷藏保存。
1.3.2 标准曲线将标准贮备液(1.3.1) 取出,放与室温平衡后,用甲醇稀释10倍,摇匀混合,配制成浓度为20.0 μg/mL的标准工作液,经过“倍比”稀释后,加到经过处理的尿液中,配制得到梯度为0、0.045、0.090、0.180、0.360、0.720、1.44、2.88、5.76 ng/mL的工作曲线系列。
1.3.3 同位素内标的配制准确称取5种苯系物、4种VOCs同位素内标(表 2),用甲醇定容至50.0 mL,得到浓度为200 μg/mL的同位素混标贮备液,取同位素混标贮备液200.0 μL,用甲醇稀释至10.0 mL,得到浓度为400.0 ng/mL的同位素内标使用液,分装入1 mL棕色安瓿瓶中,封口后置于冰箱中,冷藏保存。
| 序号 | 中文名 | 分子式 | 纯度% | 公司 |
| 1 | 三氯甲烷 | CHCl3-13C | 99.0 | B |
| 2 | 四氯化碳 | CCl4-13C | 100.0 | B |
| 3 | 苯 | C6H6-D5 | 99.9 | C |
| 4 | 三氯乙烯 | CHCl=CCl2-13C | 98.0 | B |
| 5 | 甲苯 | C6H5CH3-d5 | 99.0 | C |
| 6 | 乙苯 | C6H5CH2CH3-d10 | 98.2 | C |
| 7 | 间/对二甲苯 | C6H4(CH3)2-d10 | 99.6 | C |
| 8 | 邻二甲苯 | C6H4(CH3)2-d4 | 98.6 | C |
| 9 | 三溴甲烷 | CHBr3-13C | 98.0 | B |
| 注:C为CDN isotopes公司; B为Cambridge Isotope Laboratories公司 | ||||
1.4 测定
分析前将样品和标准品恢复至室温。在氮气环境下,利用排液装置(进样瓶盖中插入两个玻璃管,一管接入氮气,一管排液),调节排液管的高度,使剩余尿液体积为30 mL,然后依次加入一滴(0.039 g)消泡剂、200 μL浓度为400.0 ng/mL的同位素内标使用液,充分震荡摇匀后(反复20次),用纯水将样品瓶加满后,密封样品瓶(注:垫片的聚四氟乙烯面朝下),放置在超声振荡器中震荡1 min,上机测定。
1.5 计算为了降低尿液的基质效应,在标准系列和待测尿液中加入相同浓度的内标。每种待测物和相对应的内标分别绘制内标标准曲线,以待测物定量离子峰面积Ai与对应同位素内标物定量离子峰面积Ais之比为横坐标(Ai/Ais),以待测物的浓度ρi与同位素内标浓度ρis之比为纵坐标(ρi/ρis),用式(2)、(3) 计算尿液中被测组分的浓度
| $ {\rm{ \mathsf{ ρ} i/ \mathsf{ ρ} is = a + b}} \times {\rm{Ai/Ais}} $ | (1) |
| $ {\rm{ \mathsf{ ρ} i = }}\left( {{\rm{a + b}} \times {\rm{Ai/Ais}}} \right) \times {\rm{ \mathsf{ ρ} is}} $ | (2) |
| $ {\rm{Ci = }}\left( {{\rm{a + b}} \times {\rm{Ai/Ais}}} \right) \times {\rm{ \mathsf{ ρ} is}} \times {{\rm{V}}_{\rm{1}}}/{\rm{V}} $ | (3) |
式中:Ci—实际样品中目标物的浓度,ng/mL;
ρi—样品测定液中被测组分的浓度,ng/mL;
ρis—样品测定液中内标物的浓度,ng/mL;
Ai—各组分定量离子峰面积;
Ais—内标物定量离子峰面积;
V1—尿样稀释后的体积,43 mL;
V—尿样体积,30 mL;
a—标准曲线截距;
b—标准曲线斜率。
2 结果与分析 2.1 消泡剂的优化 2.1.1 消泡剂的消泡原理当体系在产生泡沫前加入消泡剂,消泡剂分子杂乱无章地分布在液体表面,抑制弹性膜的形成,制止产生泡沫。当体系产生大量泡沫后,加入消泡剂,其分子立即分布于泡沫表面,形成很薄的双膜层,同时,进一步扩散、渗透,取代原泡膜薄壁,泡沫受到周围表面张力大的膜层的强力牵引,导致泡沫周围应力失衡,从而“破泡”,达到消泡的效果。消泡剂的种类很多,包括有机硅类、聚醚类等。
2.1.2 消泡剂的选择目前消泡剂已工业化生产,可供选择的消泡剂种类较多,对比了三种消泡剂(粉末状固体、油状、乳液状)除泡效果,粉末状固体消泡剂不溶于水,会残留在吹扫管中。乳液状消泡剂不能完全溶于水,消泡效果不如油状消泡剂,最终选择使用油状消泡剂(SIGMA公司生产的Anifoam 204) 去除尿液中的泡沫。Anifoam 204为有机聚醚分散体的混合物,该物质易于以平卧状的形式聚集在气液界面,表面活性较强,消泡效率高。
2.1.3 消泡剂的净化使用前将消泡剂放于真空干燥箱中80℃烘烤12 h,取一滴消泡剂加入到进样瓶中,加满纯水,上机测试。消泡剂中的VOCs本底含量低,均低于检出限,能够满足实验要求。
2.1.4 消泡剂体积的优化当进样体积为30 mL时,对比不同体积消泡剂的除泡效果,实验结果表明一滴消泡剂(约0.023 g)即可满足实验要求。
2.2 同位素内标的优化本方法中选择内标物遵循以下两点:① 首选目标物的同位素内标。② 用不同内标物定量计算目标物的线性系数和加标回收率,如果线性系数>0.995,同时加标回收率在85%~120%,则选用该同位素内标。三氯甲烷、四氯化碳、苯、甲苯、乙苯、邻二甲苯、间/对二甲苯、三氯乙烯、三溴甲烷均采用同位素内标进行定量,四氯乙烯、一氯二溴甲烷、二氯一溴甲烷使用以上9种同位素内标,分别定量计算的本底值和加标回收率,四氯乙烯选用甲苯同位素为内标物(表 3)。
| 序号 | 目标物 | 内标物 | 线性系数 | 加标回收率*/% |
| 1 | 四氯乙烯 | 甲苯(2H5) | 0.997 | 91.0 |
| 2 | 一氯二溴甲烷 | 三溴甲烷(13C1) | 0.999 | 92.0 |
| 3 | 二氯一溴甲烷 | 三溴甲烷(13C1) | 0.998 | 106.0 |
| 注:*加标质量浓度为0.553 ng/mL | ||||
2.3 进样批次的优化
实验过程中发现,进样瓶放置一段时间后(8 h左右),消泡剂会悬浮于进样瓶上部,进样瓶内的液体处于不均匀体系,只有少量消泡剂进入吹扫管中,影响消泡效果。本实验采用分批次进样(7个样品加1个空白样品为一个批次),当上批次样品运行到空白样品时,再开始准备下一批次的样品。通过分批次进样,既能保护仪器,也提高了工作效率。
2.4 进样体积的优化本方法加入的消泡剂必须充分混匀在液体中才具有消泡效果,对比超声波震荡和手摇混匀两种方式,当进样瓶中剩余空间越大,手摇混匀除泡效果越好。综合大体积进样和适宜的除泡效果,本方法选择了30 mL尿液进样。
2.5 空白分析VOCs如氯仿、苯、甲苯普遍存在于实验室环境中。本实验在高纯氮气吹扫环境下操作,尽量避免环境污染被测样品。实验中使用空白水样来检测环境污染本底值,在纯水机的空白水样中加入内标,与样品一起上机测定。如果空白中分析物含量超过了检出限,证明样品已经受到污染。
2.6 工作曲线的建立本实验对比了纯水建立的标准曲线和经过处理的尿液建立的工作曲线。由于基质效应,纯水建立的工作曲线无法定量测定目标化合物。采集志愿者尿液,将300 mL尿液放入玻璃过滤漏斗装置中,通入氮气吹扫12 h,取30 mL尿液上机检测,确保尿液中无13种挥发性有机物成分,用以制备工作曲线。
2.7 方法线性范围与检出限目标化合物线性范围和相关系数见表 4。参照美国EPA SW-846提供的方法测定本方法检出限(LOD=tn-1, 0.99×s,LOQ=10×s,加标浓度为美国EPA方法检出限的(1~5) 倍,s为加标浓度测定值的标准偏差,n为加标次数)。
| 化合物 | 线性方程 | 线性范围/ (ng/mL) |
相关系数 | 检出限/ (ng/mL) |
检测限/ (ng/mL) |
| 三氯甲烷 | Y=10.208X-0.241 | 0.090~5.76 | 0.998 | 0.055 | 0.27 |
| 四氯化碳 | Y=1.897 2X-0.067 1 | 0.090~5.76 | 0.999 | 0.067 | 0.21 |
| 苯 | Y=1.307 9X-0.044 8 | 0.045~5.76 | 0.999 | 0.037 | 0.10 |
| 三氯乙烯 | Y=0.588 3X-0.080 8 | 0.090~5.76 | 0.997 | 0.068 | 0.22 |
| 二氯一溴甲烷 | Y=1.001 1X-0.071 6 | 0.090~5.76 | 0.999 | 0.060 | 0.19 |
| 甲苯 | Y=0.65 4X-0.048 5 | 0.023~5.76 | 0.999 | 0.008 | 0.020 |
| 四氯乙烯 | Y=5.098 5X-0.012 3 | 0.090~5.76 | 0.997 | 0.017 | 0.060 |
| 一氯二溴甲烷 | Y=1.212 9X-0.066 8 | 0.090~5.76 | 0.998 | 0.044 | 0.14 |
| 乙苯 | Y=0.919 3X+0.021 5 | 0.023~5.76 | 0.999 | 0.007 | 0.020 |
| 间/对二甲苯 | Y=1.018 2X+0.035 7 | 0.023~5.76 | 0.997 | 0.003 | 0.010 |
| 邻二甲苯 | Y=0.699X-0.035 2 | 0.023~5.76 | 0.999 | 0.004 | 0.010 |
| 三溴甲烷 | Y=1.771X-0.114 9 | 0.090~5.76 | 0.999 | 0.045 | 0.14 |
| 注:表中 X代表目标物峰面积与对应内标物峰面积的比值 | |||||
2.8 精密度和回收率
取尿样分别作高浓度和低浓度两个水平的加标测定回收率,每个加标样品做六个平行样测定精密度。采用上述前处理及分析方法。其回收率和精密度结果见表 5。
| 化合物 | 本底值/ (ng/mL) |
加标量(0.184 ng/mL) n=6 |
加标量(0.553 ng/mL) n=6 |
|||
| 回收率/% | 精密度/% | 回收率/% | 精密度/% | |||
| 三氯甲烷 | <LOQ | 88.0 | 2.5 | 88.6 | 2.7 | |
| 四氯化碳 | <LOQ | 76.3 | 2.9 | 94.1 | 3.0 | |
| 苯 | <LOQ | 78.1 | 2.8 | 91.3 | 2.2 | |
| 三氯乙烯 | <LOQ | 77.0 | 5.0 | 96.0 | 2.4 | |
| 二氯一溴甲烷 | <LOQ | 79.0 | 4.1 | 104.8 | 2.5 | |
| 甲苯 | 0.089 | 76.6 | 4.4 | 89.9 | 2.3 | |
| 四氯乙烯 | <LOQ | 92.5 | 7.0 | 99.0 | 2.3 | |
| 一氯二溴甲烷 | <LOQ | 101.5 | 11.2 | 91.8 | 2.7 | |
| 乙苯 | 0.023 | 92.3 | 2.5 | 89.6 | 1.7 | |
| 间/对二甲苯 | 0.046 | 87.6 | 4.2 | 90.2 | 2.1 | |
| 邻二甲苯 | <LOQ | 88.2 | 4.0 | 82.9 | 2.0 | |
| 三溴甲烷 | <LOQ | 105.1 | 5.9 | 86.2 | 2.0 | |
| 注:LOQ表示检测限 | ||||||
2.9 色谱图
挥发性有机化合物的标准色谱图见图 1。
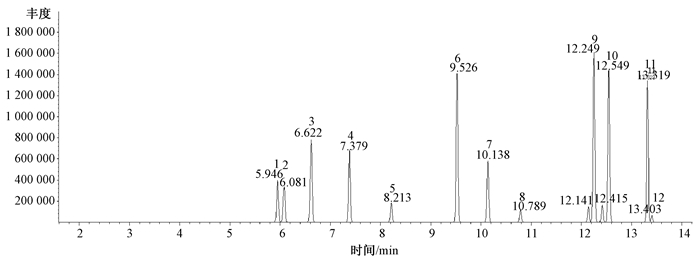
|
| 1三氯甲烷;2四氯化碳;3苯;4三氯乙烯;5二氯一溴甲烷;6甲苯;7四氯乙烯;8一氯二溴甲烷;9乙苯;10间/对二甲苯;11邻二甲苯;12三溴甲烷 图 1 挥发性有机物TIC(总离子流图) |
图 1为VOCs标准物质总离子流图,横坐标为出峰时间,纵坐标为丰度。13种VOCs出峰顺序依次为1三氯甲烷、2四氯化碳、3苯、4三氯乙烯、5二氯一溴甲烷、6甲苯、7四氯乙烯、8一氯二溴甲烷、9乙苯、10间/对二甲苯、11邻二甲苯、12三溴甲烷。
图 2为四氯化碳标物定量离子(m/z 117, m/z 119) 色谱图,四氯化碳内标定量离子(m/z 120) 色谱图。
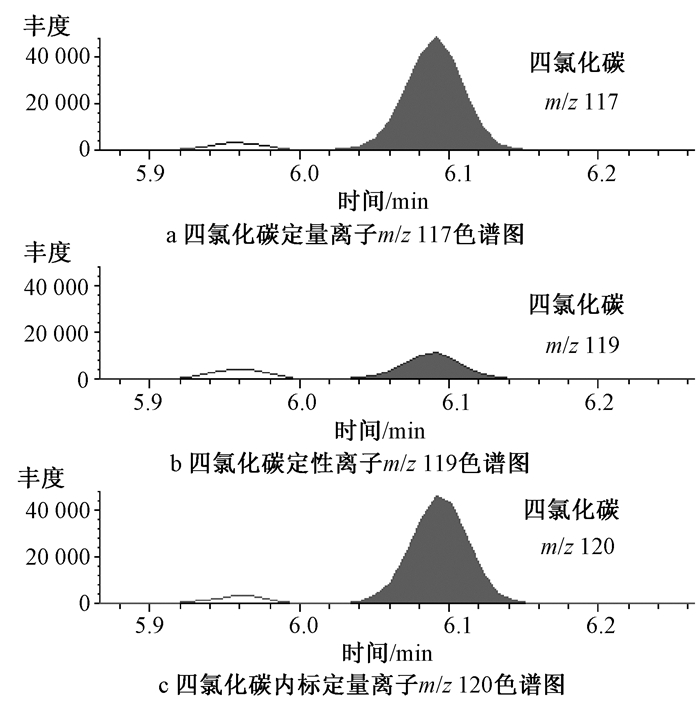
|
| 图 2 尿样中四氯化碳色谱图 |
2.10 样品测定
对20份样品利用上述方法进行了测定,在样品中检出甲苯浓度为(0.078~0.099) ng/mL。乙苯浓度为(0.021~0.056) ng/mL。间/对二甲苯浓度为(0.034~0.056) ng/mL。其他目标物均未检出。
3 小结本文建立的吹扫捕集—气相色谱质谱同位素内标法,可在短时间内测定尿液中12种挥发性有机物。该方法检测效率高、成本低、方法易推广,适合大量生物样品的检测,适用于环境中VOCs的暴露评价和疾病的诊断。
| [1] | Derwent RG, Jenkin ME, Saunders SM, et al. Photochemical ozone formation in north west Europe and its control[J]. Atmos Environ, 2003, 37(14): 1983–1991. doi: 10.1016/S1352-2310(03)00031-1 |
| [2] | Kalabokas PD, Hatzianestis J, Bartzis JG, et al. Atmospheric concentrations of saturated and aromatic hydrocarbons around a Greek oil refinery[J]. Atmos Environ, 2001, 35(14): 2545–2555. doi: 10.1016/S1352-2310(00)00423-4 |
| [3] | Cetin E, Odabasi M, Seyfioglu R. Ambient volatile organic compound (VOC) concentrations around a petrochemical complex and a petroleum refinery[J]. Sci Total Environ, 2003, 312(1-3): 103–112. doi: 10.1016/S0048-9697(03)00197-9 |
| [4] | Paaso N, Peuravuori J, Pihlaja K. Extraction efficiency of chloroethenes from contaminated dry cleaner's sludge with three different methods[J]. Waste Manag, 2000, 20(1): 69–74. doi: 10.1016/S0956-053X(99)00299-8 |
| [5] | Prieto M J, Berenguer V, Marhuenda D, et al. Purge-and-trap gas chromatographic determination of styrene in urine and blood: Application to exposed workers[J]. J Chromatogr B Biomed Sci Appl, 2000, 741(2): 301–306. doi: 10.1016/S0378-4347(00)00088-8 |
| [6] | Silva CL, Passos M, Cȃmara JS. Investigation of urinary volatile organic metabolites as potential cancer biomarkers by solid-phase microextraction in combination with gas chromatography-mass spectrometry[J]. B J Cancer, 2011, 105(12): 1894–1904. doi: 10.1038/bjc.2011.437 |
| [7] | 张景明, 刘建琳, 周雯, 等. 水样中痕量有机物分析的前处理方法[J]. 中国环境监测, 2001, 17(3): 31–33. ZHANG JM, LIU JL, ZHOU W, et al. Pretreatment Methods of Organic Compound analysis in water[J]. Environmental Monitoring in China, 2001, 17(3): 31–33. (in Chinese). |



