2. 吉林大学公共卫生学院劳动卫生与环境卫生学教研室
自2004年发现石墨烯的二十多年以来,随着其性质的深入发掘,被人们广泛应用[1]。氧化石墨烯(graphene oxide, GO)作为石墨烯的衍生物,不仅具有石墨烯的优良导热性能、机械性能和巨大比表面积,还因其具有含氧基团而在水和多数有机溶剂中具有良好的分散稳定性[2]。目前,氧化石墨烯在生物医学领域被广泛应用,如药物运载、光热疗法、生物检测以及吸附重金属和废气等[3-6]。也有研究将氧化石墨烯加入到口腔义齿的基托材料中,可在一定范围内加强义齿的拉伸强度[7]。氧化石墨烯的广泛应用,也使其生物安全性越来越受到人们的关注。Wang等[8]研究发现GO浓度超过50 μg/mL时,人成纤维细胞出现存活率降低、漂浮、凋亡等细胞毒性现象。有研究者将1 mg/(kg·bw)和10 mg/(kg·bw)氧化石墨烯尾静脉注入昆明鼠体内发现,低剂量组无病理变化,而高剂量组出现肺部肉芽肿和炎细胞浸润[9]。本实验研究了氧化石墨烯通过不同途径进入小鼠体内的急性毒性和体外对细胞的急性毒性,为其进一步的研究及应用提供依据。
1 材料与方法 1.1 材料与仪器、药品纳米氧化石墨烯由吉林大学材料学院采用改良Hummers法合成。合成的纳米材料用原子力显微镜观察为300 nm以下片状结构,厚度为(1~2) nm。实验所用材料均为现用现配,合成后的氧化石墨烯溶液分散均匀。甲醛溶液(北京化工厂),胎牛血清(Gibco公司,美国),胰蛋白酶(Gibco公司,美国),L-DMEM培养液(Gibco公司,美国),四氮唑盐(MTT,Amresco公司),二甲基亚砜溶液(DMSO,Sigma,美国),磷酸缓冲盐(PBS;Solario,北京)。
IWCD-175 CO2培养箱(三洋公司,日本),Bio-rad酶标仪(Bio-rad,美国),TDL-60B台式离心机(北京六一仪器厂)
1.2 体内急性毒性实验 1.2.1 动物选择选择清洁级ICR小鼠120只,吉林大学基础动物部提供,已提交伦理审查报告。雌雄各半,体重(18±2) g,饲养3天后,将动物分为两大组,以经口和经尾静脉注射途径进行急性毒性实验。
1.2.2 经口急性毒性实验将60只小鼠分为6组,每组10只,雌雄各半。在无菌条件下将新制备的纳米材料溶于灭菌后的高纯水中(现用现配),因受合成浓度的限制,前期预实验中,最大浓度未发生死亡,故以配置溶液的最大浓度作为最大剂量,后依次等比递减,剂量为3.125 mg/(kg·bw)、6.25 mg/(kg·bw)、12.5 mg/(kg·bw)、25和50 mg/(kg·bw)进行灌胃,对照组灌胃采用高纯水。观察动物的一般状态及病理变化。
1.2.3 经尾静脉注射急性毒性实验将60只小鼠分为6组,每组10只,雌、雄各半,在无菌条件下将新制备的纳米材料溶于灭菌后的高纯水中(现用现配),以剂量1.0 mg/(kg·bw)、2.0 mg/(kg·bw)、4.0 mg/(kg·bw)、8.0 mg/(kg·bw)和16.0 mg/(kg·bw)尾静脉注射,对照组注射高纯水,注射速度为(2~3) s/0.1 mL,观察动物一般状态及死亡情况。
1.2.4 观察指标 1.2.4.1 半数致死剂量采用改良寇氏法[10]进行半数致死剂量计算。
| $ {\rm{lgL}}{{\rm{D}}_{{\rm{50}}}} = {\rm{Xm - i}}\left( {\sum {{\rm{p - 0}}{\rm{.5}}} } \right) $ | (1) |
LD50的95%可信限计算公式为:
| $ {\log ^{{\rm{ - 1}}}}\left( {\log \;{\rm{L}}{{\rm{D}}_{{\rm{50}}}} \pm 1.96 \times {{\rm{S}}_{{\rm{x50}}}}} \right) $ | (2) |
式中:LD50-半数致死剂量,mg/(kg·bw);
i-组距,即相邻两组剂量对数剂量之差,mg/(kg·bw);
Xm-最大剂量的对数,mg/(kg·bw);
∑p-各剂量组的死亡率之和,%;
Sx50-logLD50的标准误,mg/(kg·bw)。
1.2.4.2 组织病理学观察灌胃及尾静脉注射后观察动物一般状态。如死亡,取主要脏器制作病理切片,未死亡鼠观察15天后处死,取心、肝、脾、肺、肾制作病理切片,观察组织病理学变化。
1.3 体外毒性研究选择肺腺癌细胞珠(A549),经复苏后传代培养。选择处于对数生长期的细胞用于实验。调节细胞浓度为3×104/mL,分为8组接种于96孔板,每组设2个复孔,每孔加入细胞悬液200 μL,培养24 h至细胞贴壁[18]。
将氧化石墨烯纳米颗粒在无菌条件下混悬于纯水中,分别以浓度为9.875 μg/mL、18.75 μg/mL、37.5l μg/mL、75 μg/mL、150 μg/mL、300 μg/mL、600 μg/mL的氧化石墨烯(对照组注入培养液)培养A549,继续于CO2培养箱中培养72 h后,各孔加入20 μL的MTT溶液,培养4 h后,离心,弃上清,每孔加入DMSO 150 μL,振荡器震匀后,用酶标仪在490 nm波长下测定各孔吸光度(OD值)。计算细胞存活率。
存活率=(对照组OD值均值-实验组OD值均值)÷对照组OD值均值。
根据存活率,采用改良寇氏法计算A549的半数致死浓度LC50。
1.4 质量控制动物实验中,控制动物饲养温度20℃~24℃,相对湿度50%~70%,饮食饮水保持各组均衡。材料配置及溶解在无菌密闭空间操作。经过多次预实验,灌胃技巧和尾静脉注射技巧娴熟。细胞实验中,药品配置、细胞培养都严格按照无菌操作,按照细胞特点按时进行传代, 防止交叉感染。
2 结果 2.1 氧化石墨表征合成材料的原子力显微镜图片如图 1(a)和(b)所示,为300 nm以下片状结构,厚度为(1~2) nm。
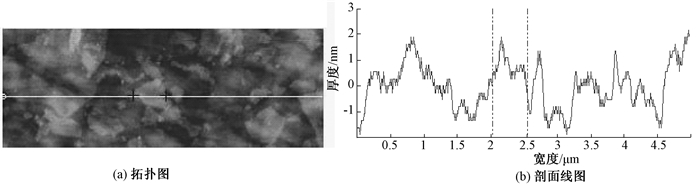
|
| 图 1 GO的表征 |
2.2 体内急性毒性实验 2.2.1 经口急性毒性实验
小鼠灌胃后,一般状态良好,未见行为明显改变,各剂量组15天后均未见死亡。观察15天后,各脏器病理学结果见图 2。显示经灌胃各个器官未发现病理改变,组织血管内未见GO粒子。
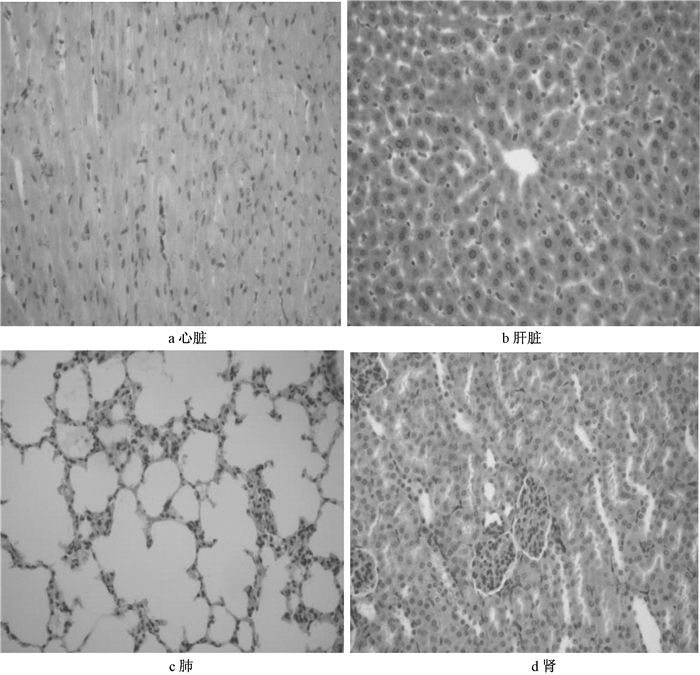
|
| 图 2 小鼠灌胃后主要脏器病理变化(HE 400×) |
2.2.2 尾静脉注射急性毒性实验
不同剂量注射后小鼠的死亡率如表 1所示。尾静脉注射纳米GO后,剂量为16 mg/(kg·bw)组出现全部死亡,8 mg/(kg·bw)组雄性全部死亡,雌性2只死亡,并且小鼠在注射后2 min活动减少,5 min后抽搐继而死亡;注射剂量为4 mg/(kg·bw)小鼠雌、雄各有1只死亡,小鼠在注射后出现活动减少,继而5 min后出现抽搐,并于10 min内出现死亡;注射剂量为2 mg/(kg·bw)组雌性1只死亡,雄性无死亡;注射1 mg/(kg·bw)的小鼠注射后活动减少。寇氏法计算LD50为5.657 mg/(kg·bw),95%可信区间为(3.745~7.569) mg/(kg·bw)。
| 剂量/ (mg/(kg·bw)) |
雌性死亡数 | 雄性死亡数 | 总死亡数 | 死亡率/% |
| 1 | 0 | 0 | 0 | 0 |
| 2 | 1 | 0 | 1 | 10 |
| 4 | 1 | 1 | 2 | 20 |
| 8 | 2 | 5 | 7 | 70 |
| 16 | 5 | 5 | 10 | 100 |
对注射死亡小鼠主要器官病理切片如图 3所示,在注射立即死亡小鼠心、肝、肺、肾的组织血管中均可见有棕褐色颗粒状物质,但未见其他病理改变。尾静脉注射后存活小鼠15 d后主要脏器病理变化如图 4所示,小鼠的心、肝、肺、肾中未见病理改变,也未见棕褐色颗粒状物质。
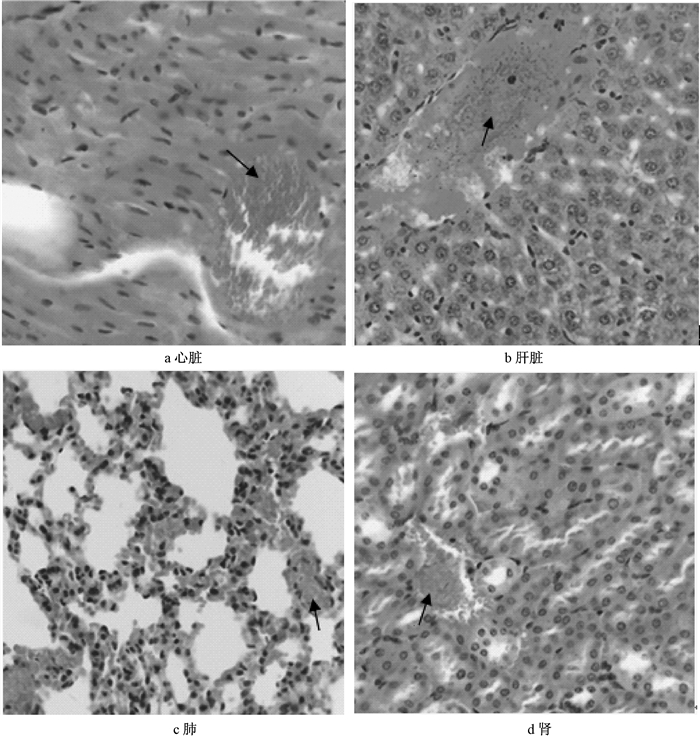
|
| 图 3 小鼠尾静脉注射GO后主要脏器的病理学变化(HE 400×) |
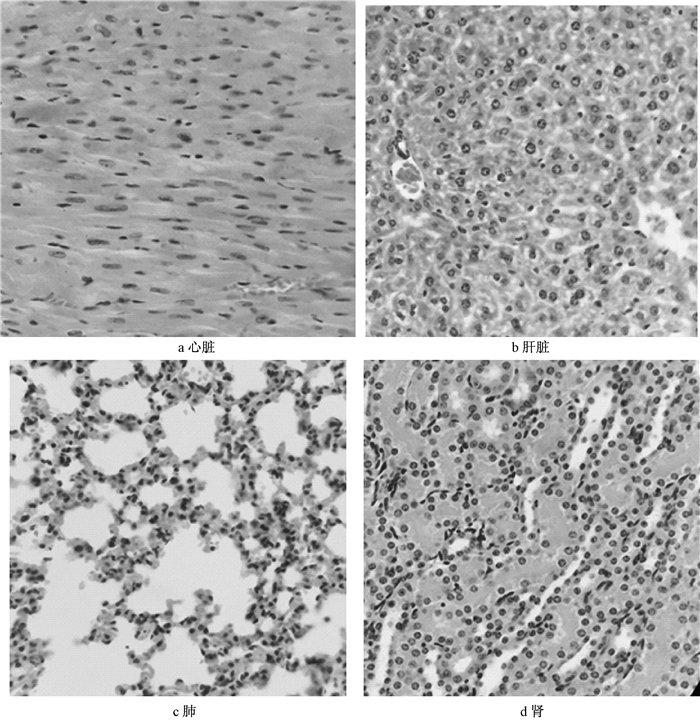
|
| 图 4 小鼠尾静脉注射GO 15 d后主要脏器的病理学变化(HE 400×) |
2.3 体外急性毒性实验
在不同氧化石墨烯纳米溶液浓度下培养的A549细胞存活率见表 2。利用改良寇氏法计算出氧化石墨烯纳米颗粒对A549细胞的LC50为56.885 μg/mL。
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 剂量/(μg/mL) | 600 | 300 | 150 | 75 | 37.5 | 18.75 | 9.875 |
| 存活率/% | 28.13 | 28.33 | 30.25 | 32.34 | 38.39 | 44.99 | 111.74 |
3 讨论
有研究对将氧化石墨烯尾静脉注入(8~12) 周的雄性瑞士鼠体内,注射15 min后处死取肺组织发现可引起小鼠广泛的血栓栓塞[11]。Zhang等[9]将横向尺寸为(10~800) nm的单层氧化石墨烯尾静脉注入昆明鼠体内,剂量为1 mg/(kg·bw)和10 mg/(kg·bw),注射后14天未见低剂量鼠发生病理变化,却在高剂量组鼠体内发现GO沉积肺脏,并且由于清除率慢而引起肺部肉芽肿和肺部炎细胞浸润、纤维化。本实验中,氧化石墨烯纳米颗粒对ICR小鼠的LD50为5.657 mg/(kg·bw),95%可信区间为(3.745~7.569) mg/(kg·bw)。未见对氧化石墨烯灌胃的报道,大多研究采用静脉及腹腔注射的方式。本实验通过对小鼠经口急性染毒氧化石墨烯,并未发现有行为、状态改变,且未引起小鼠器官的病理改变;而经尾静脉注射出现小鼠死亡,且立即死亡小鼠的心、肝、肺组织血管中出现棕褐色颗粒状物质。推测可能是氧化石墨烯难以经过消化道被吸收,因此大剂量灌胃小鼠无行为及病理改变,而尾静脉注射后,小鼠出现死亡可能是由于氧化石墨烯薄片与细胞膜之间产生直接的机械作用,而造成细胞凋亡,有研究发现氧化石墨烯可损伤红细胞的细胞膜而使细胞破裂[12],也可能是由于石墨烯发生团聚现象,在血管内发生凝聚,阻塞血管,进而引起小鼠死亡。有研究发现粒径为9 nm的四氧化三铁球形纳米材料的LD50为160 mg/(kg·bw) [13],可看到氧化石墨烯作为片状材料较球形纳米材料表现出更加明显的生物毒性。Chithrani等[14]也研究74 nm×14 nm的金纳米棒其细胞摄取速率小于球形金纳米颗粒,即金纳米棒的细胞毒性更大。
实验中灌胃以合成的最大剂量,若浓度更大,无法形成稳定均匀的分散系。文献中报道药物负载的最大浓度的氧化石墨烯,以多柔比星为例,多柔比星的临床用药约为每次(30~60) mg[15],则一个正常成人所需用GO量约为(0.1~0.26) mg/(kg·bw),灌胃剂量远大于此剂量。
在体外实验中,采用MTT法检测氧化石墨烯的毒性作用。MTT法又叫四甲基偶氮唑蓝比色法,能够灵敏地反映材料对细胞的损害程度,是一种经济、简便、高效的方法[16]。关淑英等[17]通过将丝素-氧化石墨烯制成的薄膜与成纤维L929细胞的培养,表明细胞毒性在一定范围内与氧化石墨烯浓度呈正相关。本实验中,纳米氧化石墨烯对小鼠的A549细胞的LC50为56.885 μg/mL,显示一定浓度纳米氧化石墨烯对于细胞存在毒性作用。出现细胞毒性可能是由于氧化石墨烯因可聚集细胞膜表面,阻碍细胞呼吸及物质交换,产生毒性;或氧化石墨烯可引起细胞发生氧化应激而产生自由基,进而引起细胞死亡。
综上所述,未经修饰的纳米氧化石墨烯经灌胃对小鼠无明显影响,经尾静脉注射可导致动物死亡,同时,对细胞生长具有一定抑制作用。氧化石墨烯需经修饰或改性等环节减小毒性才能使用于生物体内。
| [1] | 朱宏伟. 石墨烯:单原子层二维碳晶体--2010年诺贝尔物理学奖简介[J]. 自然杂志, 2010, 32(6): 326–331. Zhu HW. Graphene, A two-dimensional Crystal of Single Atom Layer:A Brief Introduction to the Nobel Prize in Physics 2010[J]. Chinese Journal of Nature, 2010, 32(6): 326–331. (in Chinese). |
| [2] | 张文文, 刘秀军, 李同起, 等. 氧化石墨烯/聚合物复合材料的研究进展[J]. 化工新型材料, 2015, 43(1): 12–14. Zhang WW, Liu XJ, Li TQ, et al. Research progress on graphene oxide/polymer composites[J]. New Chemical Materials, 2015, 43(1): 12–14. (in Chinese). |
| [3] | 李忠军, 邓跃飞, 庞家栋, 等. 功能化纳米氧化石墨烯微粒对胶质瘤u251细胞的靶向光热作用[J]. 中华临床医师杂志(电子版), 2013, 7(24): 11503–11506. doi: 10.3877/cma.j.issn.1674-0785.2013.24.097 Li ZJ, Deng YF, Pang JD, et al. Functionalizednano-graphene oxide particles for glioma U251 cells targeted photothermy[J]. Chinese Journal of Clinicians (Electronic Edition), 2013, 7(24): 11503–11506. doi: 10.3877/cma.j.issn.1674-0785.2013.24.097 (in Chinese). |
| [4] | Zhang LM, Xia JG, Zhao QH, et al. Functional graphene oxide as a nanocarrier for controlled loading and targeted delivery of mixed anticaner drugs[J]. Small, 2010, 6(4): 537–544. doi: 10.1002/smll.v6:4 |
| [5] | Lu CH, Yang HH, Zhu CL, et al. A graphene platform for sensing biomolecules[J]. Angew Chem Int Ed, 2009, 48(26): 4785–4787. doi: 10.1002/anie.v48:26 |
| [6] | Yang ST, Chang YL, Wang HF, et al. Folding aggregation of graphene oxide and its application in Cu2+ removal[J]. J Colloid Interface Sci, 2010, 351(1): 122–127. doi: 10.1016/j.jcis.2010.07.042 |
| [7] | 李然, 陈晓波, 葛学军. 氧化石墨烯对于口腔义齿基托材料强度的影响[J]. 山西医科大学学报, 2014, 45(12): 1200–1202. Li R, Chen XB, Ge XJ. Influence of graphene oxide on the strength of oral denture base[J]. Journal of Shanxi Medical University, 2014, 45(12): 1200–1202. (in Chinese). |
| [8] | Wang K, Ruan J, Song H, et al. Biocompatibility of grapheneoxide[J]. Nanoscale Res Lett, 2011, 6(1): 8. |
| [9] | Zhang XJ, Yin JL, Peng C, et al. Distribution and biocompatibility studies of graphene oxide in mice after intravenous administration[J]. Carbon, 2011, 49(3): 986–995. doi: 10.1016/j.carbon.2010.11.005 |
| [10] | 沈建忠. 动物毒理学[M]. 北京: 中国农业出版社, 2002: 131-140. Shen JZ. Animal Toxicology[M]. Beijing: China Agriculture Press, 2002: 131-140 (in Chinese). |
| [11] | Singh SK, Singh MK, Nayak MK, et al. Thrombus inducing property of atomically thin graphene oxide sheets[J]. ACS Nano, 2011, 5(6): 4987–4996. doi: 10.1021/nn201092p |
| [12] | Liao KH, Lin YS, Macosko CW, et al. Cytotoxicity of graphene oxide and graphene in human erythrocytes and skin fibroblasts[J]. ACS Appl Mater Interfaces, 2011, 3(7): 2607–2615. doi: 10.1021/am200428v |
| [13] | 李雪, 陶易, 李景舜, 等. 纳米四氧化三铁对小鼠外周血象的影响[J]. 环境与健康杂志, 2011, 28(1): 33–35. Li X, Tao Y, Li JS, et al. Effect of Nano-Fe3O4 on Hematological System in Mice[J]. J Environ Health, 2011, 28(1): 33–35. (in Chinese). |
| [14] | Chithrani BD, Ghazani AA, Chan WCW. Determining the size and shape dependence of gold nanoparticle uptake into mammaliancells[J]. NanoLett, 2006, 6(4): 662–668. doi: 10.1021/nl052396o |
| [15] | 徐兴英, 程江峰, 单妍, 等. 氧化石墨烯的制备及其对盐酸多柔比星的高效装载和缓释性能[J]. 青岛科技大学学报(自然科学版), 2011, 32(5): 472–477. Xu XY, Cheng JF, Shan Y, et al. Preparation of Graphene Oxide and Its High-efficiency Loading and Sustained-release of Doxorubicin Hydrochloride[J]. Journal of Qingdao University of Science and Technology(Natural ScienceEdition), 2011, 32(5): 472–477. (in Chinese). |
| [16] | Mosmann T. Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assays[J]. J Immunol Methods, 1983, 65(1-2): 55–63. doi: 10.1016/0022-1759(83)90303-4 |
| [17] | 关淑英, 武峰, 赵彬. MTT法检测氧化石墨烯的细胞毒性[J]. 中国现代医生, 2014, 52(17): 18–20, 24. Guan SY, Wu F, Zhao B. MTT assay for cetection of the cytotoxicity of graphene oxide[J]. China Modern Doctor, 2014, 52(17): 18–20, 24. (in Chinese). |



