2. 东莞松山湖实验中学医务室;
3. 南方医科大学2016级研究生
近几十年,抗生素类药物已被广泛应用于药物治疗和畜牧养殖业,由此引发的潜在危害也引起了越来越多的关注[1]。土霉素(oxytetracycline,OTC)又称氧四环素,属于四环素类广谱抗生素,作为抗菌剂和饲料添加剂被广泛地应用于人类和动物的食物中。土霉素进入机体后,少部分经过代谢反应生成无活性的产物,大部分则以原形及活性代谢物排到体外进入环境;尤其是OTC性质稳定,在环境中不易降解,被排泄到环境中仍能稳定存在很长时间,从而造成环境中的药物残留[2]。常规的污水生物处理工艺及自来水厂处理工艺对于抗生素类药物污染难以有效去除[3],已有的研究表明,无论是活性污泥法、生物滤池还是加氯消毒工艺都无法有效去除水中的四环素类抗生素[4]。
光催化氧化技术作为一种新兴的水处理技术在抗生素降解方面有良好的应用前景。超声波降解技术集高级氧化技术、焚烧、超临界氧化等多种水处理技术的特点于一身,降解条件温和、降解速度快、适用范围广,可以单独或与其他水处理技术联合使用,是一种很有发展潜力和应用前景的技术[5-6]。目前,国内仅有少量文献报道光降解技术对土霉素的影响,鲜有超声波技术对土霉素的报道。为此,我们联合利用两种技术对土霉素的降解情况进行初步的探索。
1 材料和方法 1.1 仪器和试剂 1.1.1 仪器高效液相色谱仪(上海玖梧实业有限公司伍丰LC-100);自制的紫外灯超声降解仪(250 W紫外线高压汞灯+昆山市超声仪器有限公司KQ-500DE型)。
1.1.2 试剂磷酸(天津科密欧化学试剂有限公司,色谱纯);乙腈(天津赛孚世纪科技发展有限公司,色谱纯);土霉素(北京百灵威科技有限公司,纯度:97%);土霉素标准品(中国药品生物制品检定所,130305-201420);氢氧化钠(东莞市乔科化学有限公司,分析纯);无水乙醇(江苏强盛功能化学股份有限公司,分析纯);钛酸正丁酯(国药集团化学试剂有限公司,化学纯);甲醇(天津市富宇精细化工有限公司,分析纯);硝酸(西陇化工股份有限公司,分析纯);冰乙酸、硝酸钾、盐酸(分析纯, 均购自天津科密欧化学试剂有限公司)。
1.2 方法 1.2.1 TiO2光催化降解条件下降解OTC吸取20 mL浓度为50 mg/L的OTC溶液于100 mL的烧杯中,利用浓盐酸或氢氧化钠调节pH在4.0左右,加入1 mg催化剂TiO2(此时TiO2的浓度为50 mg/L),于主波峰为365 nm波长的紫外灯下光照降解60 min,降解后利用HPLC测量剩余的OTC的量。
1.2.2 超声降解条件下降解OTC吸取20 mL浓度为50 mg/L的OTC溶液于100 mL的烧杯中,利用浓盐酸或氢氧化钠调节pH在4.0左右,于超声功率为200 W的超声仪中超声降解60 min,降解后利用HPLC测量剩余的OTC的量。
1.2.3 超声协同TiO2光催化条件下降解OTC土霉素初始浓度为50 mg/L,利用盐酸或氢氧化钠调节pH在4.0左右,催化剂TiO2的投加量为50 mg/L,于超声功率为200 W的超声仪中超声60 min,同时进行光照,时间为60 min后,降解后利用HPLC测量剩余的OTC的量。
1.2.4 光照时间对降解水中抗生素的影响实验固定TiO2催化剂的初始浓度为50 mg/L,OTC的初始浓度为50 mg/L,利用盐酸或氢氧化钠调节pH在4.0左右,超声功率为200 W,超声60 min,比较在TiO2光催化降解条件下和超声协同TiO2光催化降解条件下降解OTC的情况。光照时间分别为0 min、15 min、30 min、45 min、60 min、75 min和90 min。
1.2.5 超声时间对OTC降解率的影响实验固定OTC的初始浓度为50 mg/L,光照时间为60 min,超声功率为195 W,催化剂TiO2的投加量为50 mg/L,利用盐酸或氢氧化钠调节溶液起始pH=4.0左右,考察单独超声降解条件下和超声协同TiO2光催化降解条件下超声时间对OTC降解率的影响。超声时间分别为0 min、10 min、20 min、30 min、40 min、50 min、60 min。
1.2.6 超声功率对OTC降解率的影响实验控制OTC的初始浓度为50 mg/L,光照和超声时间均为60 min,利用盐酸或氢氧化钠调节pH在4.0左右,催化剂TiO2的投加量为50 mg/L,考察单独超声降解条件下、单独的TiO2光催化降解条件下和超声协同TiO2光催化三种降解条件下对OTC含量的影响,超声功率分别为200 W、250 W、300 W、350 W、400 W、450 W。
1.2.7 催化剂TiO2含量对OTC降解率的影响实验控制OTC的初始浓度为50 mg/L,光照和超声时间均为60 min,超声功率为200 W,利用盐酸或氢氧化钠调节pH在4.0左右,考察TiO2光催化降解条件下和超声协同TiO2光催化降解条件下催化剂TiO2的投加量对OTC的降解率的影响。OTC投加量分别为1 mg/L、3 mg/L、5 mg/L、7 mg/L和10 mg/L。
1.2.8 pH浓度对OTC降解率的影响实验控制OTC的浓度为50 mg/L,光照和超声时间均为60 min,超声功率为200 W,催化剂TiO2的投加量为50 mg/L,考察单独超声降解条件下、单独的TiO2光催化降解条件下和超声协同TiO2光催化三种降解条件下,溶液起始pH分别为3、5、7、9、10.8时对OTC降解率的影响,
1.2.9 硝酸根浓度对OTC降解率的影响实验控制OTC的初始浓度为50 mg/L,光照和超声时间均为60 min,超声功率为200 W,催化剂TiO2的投加量为50 mg/L,利用盐酸或氢氧化钠调节pH在4.0左右,考察在单独超声降解条件下、单独的TiO2光催化降解条件下和超声协同TiO2光催化三种降解条件下,NO3-浓度分别为0 mg/L、0.2 mg/L、0.5 mg/L、1.0 mg/L、1.5 mg/L、2.0 mg/L时对OTC降解率的影响。
1.3 OTC的测定 1.3.1 测定条件采用上海伍丰高效液相色谱仪进行定量分析,色谱柱为Promosll C18(4.6×250) mm。土霉素的测定条件为:进样量25 μL,流速是1.0 mL/min,流动相水和乙腈的体积比为70:30,检测波长为355 nm。
1.3.2 标准曲线的绘制以50 mg/L土霉素标准溶液为母液,配制浓度梯度为2 mg/L、5 mg/L、10 mg/L、20 mg/L、50 mg/L的标准溶液,HPLC法测量以OTC的浓度为横坐标,HPLC所测结果的峰面积为纵坐标,得到OTC的标准曲线。
1.4 质量控制每次测量,配制标准品溶液上样绘制标准曲线,配制确定浓度上样进行空白加标回收,验证仪器稳定性,每个样品重复测量三次,当三次测定结果相对标准偏差大于时5%,进行第四次测定,若有需要,依次进行,最后剔除偏差大的数据,取平均值。
1.5 统计学分析根据HPLC测得的OTC峰面积,带入标准曲线所得公式中,得到OTC降解后的浓度,由降解率公式:降解率%=(降解前浓度-降解后的浓度)/降解前的浓度×100%求得降解率。所得结果采用Excel 2003软件进行数据录入和分析。
2 结果 2.1 OTC标准曲线应用Excel 2003软件,根据HPLC对OTC的测量结果,以OTC的浓度为横坐标,HPLC所测结果的峰面积为纵坐标,得到OTC的标准曲线。可得OTC的浓度与峰面积的简单线性回归曲线为Y=1 486.7X-1 605.5(Y表示峰面积,X表示OTC的浓度),R2=0.998 49。
2.2 光照时间对降解水中土霉素的影响实验结果如图 1所示。在(0~15) min超声协同光催化降解条件下的降解率达到84.06%,而单一的光催化降解条件下的降解率为27.30%,为30 min、45 min、60 min、75 min、90 min时,其中协同降解条件下的降解率依次为82.26%、84.21%、85.20%、87.90%、83.30%,单一的光降解条件下的降解率依次为26.40%、30.50%、34.10%、32.80%、30.20%。两种降解条件下的最大降解率都是在光照时间为75 min时达到最大,其中协同降解的最大降解率达到87.90%,而单独光催化条件下的降解率最大为34.10%。
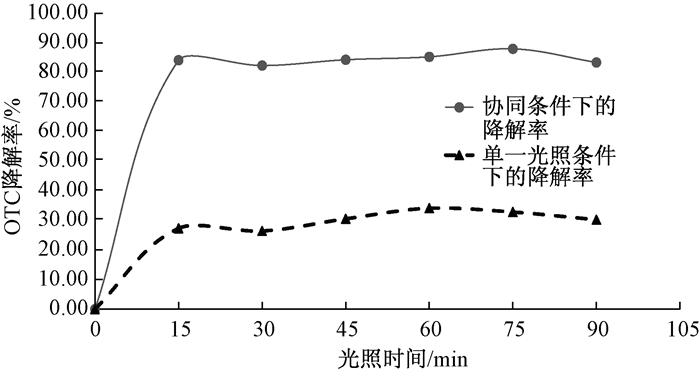
|
| 图 1 光照时间对OTC降解率的影响 |
2.3 超声时间对OTC降解率的影响
实验结果如图 2所示。当超声时间为0 min、10 min、20 min、30 min、40 min、50 min、60 min时,超声协同光催化降解条件下的降解率依次为0%、59.50%、68.20%、73.80%、69.20%、71.50%、68.00%,单独的超声降解条件下的降解率依次为0%、12.80%、11.60%、12.90%、17.40%、21.00%、21.64%。超声协同光催化处理条件下,在超声时间为30 min之前,随着超声时间的延长,OTC的降解率大幅增大,在30 min时达到最大降解率73.80%,之后便有小幅度的降低。而单独的超声降解在时间为60 min时才达到最大值,为21.64%。

|
| 图 2 超声时间对OTC降解率的影响 |
2.4 超声功率对OTC降解率的影响
实验结果如图 3所示。当把超声功率依次设定为200 W、250 W、300 W、350 W、400 W、450 W时,其中超声协同光催化处理条件的降解率依次为97.92%、84.85%、73.60%、38.13%、36.81%、16.66%,单独的超声处理条件下的降解率依次为19.90%、21.80%、19.40%、21.50%、23.40%、22.60%。在协同条件下,随着超声功率的增大,OTC的降解率反而降低,最大值是当超声功率为200 W时,OTC的降解率最大,为97.92%。在单独的超声处理条件下,随着超声功率的增大,OTC的降解率有小幅度的增大,当超声功率为400 W时,达到最大值,为23.40%。
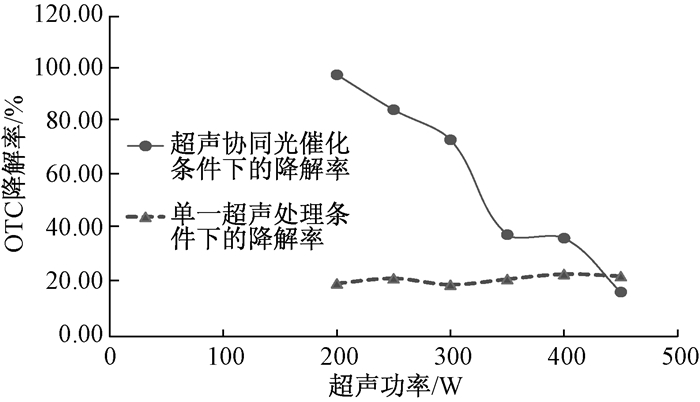
|
| 图 3 不同超声功率对OTC降解率的影响 |
2.5 催化剂TiO2浓度对OTC降解率的影响
实验结果如图 4所示。当催化剂TiO2的浓度为1.0 mg/L、3.0 mg/L、5.0 mg/L、7.0 mg/L、10.0 mg/L时,其中超声协同光催化处理条件下的降解率依次为73.50%、70.30%、68.80%、83.89%、94.80%,单一的光催化处理条件下的降解率依次为25.30%、33.00%、46.40%、48.90%、50.50%。在两种实验条件下,随着催化剂TiO2的投加量的增加,OTC的降解率都在增加,但是从总体的降解率来看,协同处理条件下的降解率大于单一的光催化条件下的降解率,当催化剂的量为10 mg/L时,OTC的降解率可高达94.80%。
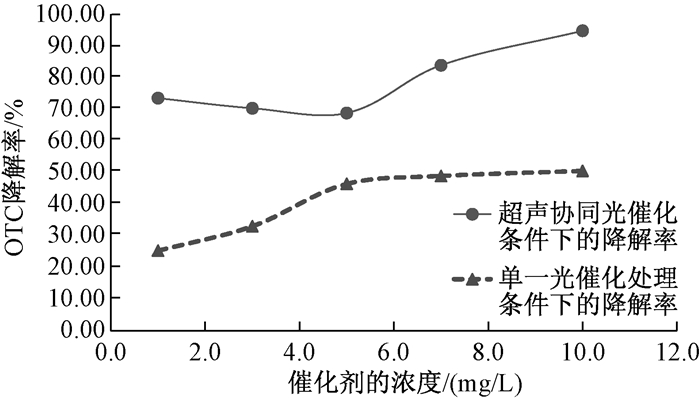
|
| 图 4 不同催化剂的投加量对OTC降解率的影响 |
2.6 pH对OTC降解率的影响
实验结果如图 5所示。当控制溶液的pH为3、5、7、9、10.8时,其中超声协同光催化处理条件下的降解率依次为73.95%、80.34%、85.30%、89.72%、97.43%,单一的超声降解条件下的降解率依次为12.00%、16.50%、51.20%、55.20%、73.50%,单一的光催化降解条件下的降解率依次为20.80%、35.90%、61.00%、85.80%、95.36%。pH的变化对单独的超声降解和光催化降解的影响比较大,而对协同降解的影响相对较小。随着pH的增加,三种降解条件下的OTC降解率都在增加,在实验控制的pH范围内,当pH为10.8时,降解率达到最大。
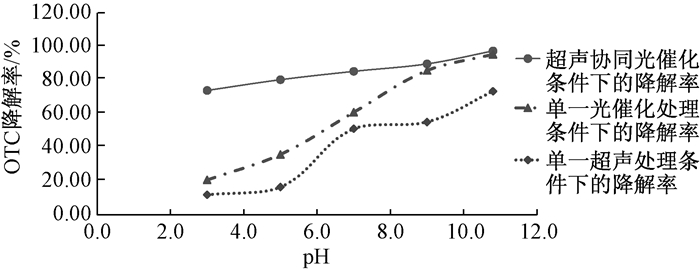
|
| 图 5 不同pH对OTC降解率的影响 |
2.7 不同硝酸根浓度对OTC降解率的影响
实验结果如同图 6所示。当硝酸根的浓度为0 mg/L、0.2 mg/L、0.5 mg/L、1.0 mg/L、1.5 mg/L、2.0 mg/L时,超声协同光催化处理条件下的降解率依次为17.60%、6.60%、9.40%、8.20%、15.40%、25.06%,单一的超声降解条件下的降解率依次为63.68%、12.60%、20.50%、27.36%、17.40%、9.09%,单一的光催化降解条件下的降解率依次为50.70%、12.60%、11.07%、37.90%、26.50%、26.60%。在单一的超声处理条件下,OTC的降解率随着硝酸根的浓度增大,当降解率先大幅度降低,当硝酸根浓度从0增加到0.2是,OTC的降解率从63.68%下降到12.60%,随后OTC的降解率便有小幅度的增加。在单一的光催化处理条件下,亦一样随着硝酸根浓度的增加,OTC的降解率大幅下降,后有小幅增大。在超声协同光催化的条件下,随着硝酸根浓度的增加,OTC的降解率缓慢增大。
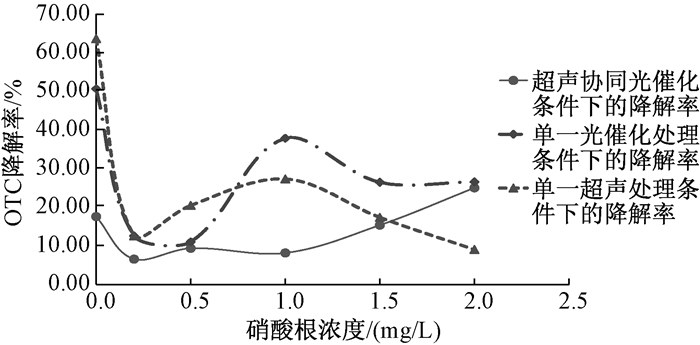
|
| 图 6 不同硝酸根浓度对OTC降解率的影响 |
3 讨论
土霉素作为一种广谱抗生素,广泛地应用于人类和动物疾病防治,禽畜养殖,同时也造成环境的污染。常规水处理方法对土霉素不能有效地去除,故而水环境中的土霉素残留风险很大。作为一种环境友好的高级氧化技术,超声协同光催化技术综合了超声效应和光催化降解过程,实现两者的协同作用。本文研究的实验结果表明超声协同光催化降解水中的土霉素的降解效率要比单独超声降解和单独的光催化降解的降解效率高,最佳条件为光照时间为75 min,超声功率为200 W,超声时间为30 min,OTC初始浓度为0.5 mg/L,催化剂浓度为10 mg/L,pH为10.8,硝酸根浓度为2 mg/L。超声协同光催化法具有高效环保,节能节时,且对自然因素的抗干扰性较好的优点。
超声—光催化氧化复合工艺是基于超声的空化效应、自由基效应以及机械效应对光催化过程的影响[7-8]。超声空化效应产生的高温高压为超声—光催化氧化降解创造了一个极端的物理化学环境。同时高温高压引发的自由基反应,增加了溶液的自由基浓度,促进了有机污染物的破坏降解。引入超声后,其在光催化剂微粒表面产生强烈的微射流,可以解聚和分散光催化剂,使光催化剂活性表面及催化位点更多地暴露出来,提高光催化剂的功能活性。此外,微射流还可以提高水中反应物向光催化剂表面以及反应产物向水相的传质速率,从而达到提高降解效率的目的。
光催化对超声降解OTC具有很好的协同促进作用。这可能是因为在超声协同光催化条件下,也就是光辐射和超声辐射条件下,半导体光敏催化剂二氧化钛被光激发出电子—空穴对,而吸附在半导体表面的水及OTC分子接受光电子对—空穴对,同时超声对光催化剂表面起到活化作用[9],也能直接分解水分子产生羟基自由基,从而与水中的OTC发生氧化还原作用,实现降解或者完全去除OTC。随着超声功率的增大,OTC的降解率反而降低,这可能是因为超声的空化作用加强,产生了过多的自由基,结果过多的羟基自由基相互碰撞,发生泯灭,反而使降解率下降[10]。
协同处理条件下,随着OTC初始浓度的提高,降解率在减小,这可能是由于较高的OTC初始浓度使溶液的黏性增大, 不利于空化效应,进而降低有效声能。随着OTC初始浓度的增加,催化剂的量相对在下降。随着催化剂TiO2的投加量的增加,OTC的降解率在增加,由此可知催化剂的量对于OTC降解率的大小有重要影响,过多的OTC吸附在光催化剂表面, 降低水中反应物向光催化剂表面、反应产物向水相的传质速率, 从而抑制了降解效率[11]。由此可以推测,超声协同光催化技术对于降解水中低浓度的OTC效果更好。
在自然环境中,各种生活污水、工业污水、农业污水、医院废水等废水呈现不同的pH,此次试验探究了pH的变化对超声协同光催化降解OTC的影响,协同处理条件下,随着pH值的增大,OTC降解率在增大。这是因为在不同的pH条件下,OTC呈现不同的状态,酸性条件下为OTC+,中性条件下为OTC, 碱性条件下为OTC-。pH从3变化到11时,OTC在(300~500) mm的紫外可见光的吸收峰逐渐增强,对应着OTC的光降解速率常数也在增加[12]。其中在各pH下,协同条件下的降解率都要大于单一处理条件下的降解率。pH对协同条件下的降解率的影响要小于两种单一处理条件下的降解率,说明pH的变化对超声协同光催化降解水中的土霉素的影响较小。
自然界中,NO3-在水中普遍存在。三种降解方法中,硝酸根浓度对协同降解的影响较小。随着硝酸根的浓度的增大,OTC的降解率变化幅度相对于单独的超声降解和光降解而言要小。在硝酸根浓度为0时,三种降解条件下的OTC降解率都比较高。当硝酸根浓度不为0时,随着硝酸根浓度的增加,协同降解条件下的OTC降解率也在增大,说明硝酸根对OTC的降解起促进作用。原因可能是NO3-和Fe(III)样,都是典型的光化学活性物质, 在光照下均能生成·OH等ROS(活性氧簇),从而可促进土霉素的氧化降解[13]。实验结果表明,超声协同光催化降解水中的OTC的最佳NO3-浓度为2.0 mg/L。
由于实际的水环境中的土霉素的含量较小,一般为微克每升到纳克每升,所以研究时降低土霉素的含量对研究的实际应用更具意义。为了更进一步的了解土霉素的降解机理,可以应用HPLC-MS来检测其降解的中间产物。综述以上可知,超声协同光催化降解水中土霉素其降解效果要比单独的超声和单独光催化效果要好,且具有降解过程易行,降解装置简单,环保节时等优点,可以将其应用至工业化的土霉素污水处理,也可考虑将其应用至其他抗生素或者有机污染物的降解处理。另外,也可考虑将超声协同光催化技术与其他的水处理技术相结合,更进一步提高其降解效率和节能环保的优点。
| [1] | Richardson BJ, Lam PKS, Martin M. Emerging chemicals of concer:pharmaceuticals and personal care products (PPCPS) in Asia, with particular reference to Southern China[J]. Mar Pollut Bull, 2005, 50(9): 913–920. doi: 10.1016/j.marpolbul.2005.06.034 |
| [2] | Hirsch R, Ternes T, Haberer K, et al. Occurrence of antibiotics in the aquatic environment[J]. Sci Total Environ, 1999, 225(1-2): 109–118. doi: 10.1016/S0048-9697(98)00337-4 |
| [3] | Ternes TA, Meisenheimer M, McDowell D, et al. Removal of pharmaceuticals during drinking water treatment[J]. Environ Sci Technol, 2002, 36(17): 3855–3863. doi: 10.1021/es015757k |
| [4] | Watkinson AJ, Murby EJ, Costanzo SD. Removal of antibiotics in conventional and advanced wastewater treatment:Implications for environmental discharge and wastewater recycling[J]. Water Res, 2007, 41(18): 4164–4176. doi: 10.1016/j.watres.2007.04.005 |
| [5] | 郑怀礼, 张占梅. 低频超声协同Fe-Ni-Mn/Al2O3催化降解酸性绿B的研究[J]. 环境工程学报, 2009, 3(2): 193–198. |
| [6] | 刘洪涛, 徐冠华, 朱果逸. 先进水处理技术研究进展[J]. 水处理技术, 2008, 34(4): 1–7. |
| [7] | Peller J, Wiest O, Kamat PV. Synergy of combining sonolysis and photocatalysis in the degradation and mineralization of chlorinated aromatic compounds[J]. Environ Sci Technol, 2003, 37(9): 1926–1932. doi: 10.1021/es0261630 |
| [8] | Hirano K, Nitta H, Sawada K. Effect of sonication on the photo-catalytic mineralization of some chlorinated organic compounds[J]. Ultrason Sonochem, 2005, 12(4): 271–276. doi: 10.1016/j.ultsonch.2004.01.034 |
| [9] | Gianluca Li Puma, Awang Bono. Preparation of titanium dioxide photo catalyst loaded onto activated carbon support using chemical vapor deposition:A review paper[J]. Journal of Hazardous Materials, 2008, 157(2-3): 209–219. doi: 10.1016/j.jhazmat.2008.01.040 |
| [10] | 李蕊, 赵景联, 孙亚萍. 超声协同TiO2光催化降解酸性大红染料的研究[J]. 应用化工, 2006, 35(6): 416–419. Li R, Zhao JL, Sun YP. Study on photodegradation of acid scarlet dyestuff catalyzed by coupling system of titanium dioxide and ultrasonic[J]. Appl Chem Ind, 2006, 35(6): 416–419. (in Chinese). |
| [11] | 王颖, 牛军峰, 张哲, 等. 超声-光催化降解水中有机污染物[J]. 化学进展, 2008, 20(10): 1621–1627. Wang Y, Niu JF, Zhang Z, et al. Sono-photocatalytic degradation of organic pollutants in water[J]. Prog Chem, 2008, 20(10): 1621–1627. (in Chinese). |
| [12] | 黄丽萍, 陈东辉, 黄满红, 等. TiO2光催化降解水中土霉素的动力学研究[J]. 环境工程学报, 2012, 6(1): 57–62. Huang LP, Chen DH, Huang MH, et al. Kinetics study on photocatalytic degradation of oxytetracycline (OTC) in water by Nano titanium suspended system[J]. Chin J Environ Eng, 2012, 6(1): 57–62. (in Chinese). |
| [13] | Jiao S J, Zheng S R, Yin D Q, et al. Aqueous photolysis of tetracycline and toxicity of photolytic products to luminescent bacteria[J]. Chemosphere, 2008, 73: 377–382. doi: 10.1016/j.chemosphere.2008.05.042 |



