2. 中国疾病预防控制中心环境与健康相关产品安全所
近地面层臭氧(O3)增加是当今环境与健康研究的前沿课题之一。臭氧具有强氧化能力,对粘膜具有很强的刺激性,进而引起呼吸系统疾病及心血管系统疾病[1-2]。毒理学证据表明臭氧可以引起肺部炎症[3],增加呼吸道反应[4],甚至导致血液流体动力学的改变等[5]。流行病学研究发现,大气臭氧污染能导致人体产生一系列的不良健康影响,如哮喘[6]、急诊[7]、住院甚至死亡[8]等。
尽管已有大量的流行病学研究证明大气臭氧可以造成健康损害,但多数研究发生于欧美国家[9-12],我国的相关研究较少。Zhang等[13]及Yang等[14]发现上海和苏州的臭氧浓度与日死亡数呈显著相关,然而Wong等 [15]和Tao等[16]在武汉、珠海、佛山的研究并未得出一致结论[17]。本文收集石家庄市的急救、环保、气象数据,采用广义相加时间序列模型,分析臭氧浓度对日呼吸系统疾病急救人次的急性影响。
1 材料与方法 1.1 资料来源急救数据来自石家庄市急救中心,包括2013年1月1日—2014年12月31日石家庄市常住人口的急救医疗数据;按照WHO国际疾病分类(ICD-10)对初步诊断进行疾病分类,逐日统计由于呼吸系统疾病(J00-J98)接受急救服务的人次;收集石家庄市同期的气象数据(每日平均温度、平均相对湿度)和大气污染物资料(O3-8 h,PM2.5,PM10,SO2,NO2)。
1.2 统计学方法本研究采用基于泊松分布的广义相加模型来分析每日大气中的O3-8 h浓度对居民因呼吸系统疾病寻求急救服务的急性影响;运用自然样条平滑函数来控制日急救人次、平均气温及平均相对湿度的长期趋势和季节趋势,并将“星期几效应”和“节假日效应”作为模型哑变量。基本模型表达为:
| $\begin{align} & \text{logE(}{{\text{Y}}_{\text{t}}}\text{)= }\!\!\beta\!\!\text{ }{{\text{Z}}_{\text{t}}}\text{+DOW+ns}\left( \text{time,df} \right)+\text{ns} \\ & \left( \text{temperature,6} \right)\text{+ns}\left( \text{humidity,3} \right)\text{+intercept} \\ \end{align}$ | (1) |
式中:E(Yt)—第t日的期望急救人次;
β—回归系数;
Zt—t日O3-8 h浓度;
DOW(day of week)—星期几效应;
ns—自然样条平滑函数,其中df为自由度;
intercept—截距。
本研究中时间自由度选择7,平均温度和平均相对湿度的自由度分别选择6和3。
由于O3-8 h浓度具有明显的季节差异,因此分冬季(11月—次年4月)、夏季(5月—10月)两个季节进行分层分析,时间自由度设为4。
敏感性分析:第一,由于空气污染物对人群健康的影响具有滞后效应,因此本研究分析了O3-8 h浓度对呼吸系统疾病急救的单独滞后(1 d,2 d,3 d,4 d,5 d,6 d,7 d)和移动平均滞后(0 d~1 d,0 d~2 d,0 d~3 d,0 d~4 d,0 d~5 d,0 d~6 d,0 d~7d)的影响;第二,模型分析了时间自由度为4,5,6,7,8,9和10时O3-8 h浓度对呼吸系统疾病急救人次的影响;第三,引入双污染物模型(PM2.5,PM10,SO2和NO2)来评价模型的稳定性;最后,引入生物学上与空气污 染无关的损伤急救数据进行模型分析[18],评价模型的稳定性。
本研究采用R 3.2.1软件进行分析,分析指标为大气O3-8 h浓度每升高或降低10 μg/m3,人群每日由于呼吸系统疾病急救增加或减少的百分比。P < 0.05为差异有统计学意义。
2 结果 2.1 描述性分析2013年—2014年石家庄市共有8 972人次因呼吸系统疾病急救的记录,平均每天13人次(表 1)。日均温度和日均相对湿度分别为14.5℃和57%,为典型的温带季风气候;O3-8 h的年均值为78.9 μg/m3(表 1),远低于《环境空气质量标准》(GB 3095-2012)[19]二级标准160 μg/m3的限值,研究期内有73 d O3-8 h浓度超过二级标准。
| 因素 | Mean | SD | Min | P25 | P50 | P75 | Max |
| 空气污染物浓度/ (μg/m3) | |||||||
| PM2.5 | 133.8 | 100.1 | 9.8 | 65.2 | 109.6 | 166.6 | 771.3 |
| PM10 | 260.1 | 150.9 | 22.3 | 146.6 | 226.7 | 334.5 | 842.1 |
| SO2 | 82.6 | 69.6 | 5.3 | 31.5 | 56.7 | 118.3 | 319.3 |
| NO2 | 57.7 | 29.3 | 13 | 36.8 | 51.9 | 71.6 | 176.8 |
| O3-8 h | 78.9 | 53.9 | 3.3 | 34.1 | 69.0 | 115.8 | 262.4 |
| 气象因素 | |||||||
| 平均气温/°C | 14.5 | 10.8 | -7.7 | 5.0 | 16.0 | 24.2 | 34.7 |
| 相对湿度/% | 57.0 | 19.6 | 11.5 | 43.0 | 58.4 | 72.3 | 98.0 |
| 急救人次 | |||||||
| 呼吸系统疾病(J00-J98) | 13 | 5 | 1 | 9 | 12 | 15 | 34 |
2.2 大气污染物与气象因素的相关性分析
经shapiro-wilh检验,相关数据均非正态分布,因此采用Spearman相关性分析(表 2)。O3与其他污染物均呈负相关,与气温呈正相关。
| 因素 | SO2 | NO2 | PM2.5 | PM10 | 平均气温 | 相对湿度 |
| O3-8 h | -0.50 | -0.48 | -0.36 | -0.31 | 0.82 | -0.04 |
| SO2 | 0.75 | 0.57 | 0.68 | -0.66 | -0.29 | |
| NO2 | 0.66 | 0.75 | -0.44 | -0.07 | ||
| PM2.5 | 0.88 | -0.39 | 0.33 | |||
| PM10 | -0.33 | 0.14 | ||||
| 平均气温 | 0.12 |
2.3 O3-8 h与呼吸系统疾病急救人次的相关分析
表 3表示时间自由度选择对结果的影响,时间自由度在4 ~ 10变化时,超额危险度及其置信区间没有明显变化,表明模型比较稳定。
| 自由度 | 超额危险度/% | 95% | CI /% |
| 4 | 0.33 | -0.60 | 1.25 |
| 5 | 0.29 | -0.62 | 1.21 |
| 6 | 0.22 | -0.70 | 1.15 |
| 7 | 0.22 | -0.69 | 1.14 |
| 8 | 0.31 | -0.61 | 1.23 |
| 9 | 0.26 | -0.65 | 1.17 |
| 10 | 0.36 | -0.54 | 1.27 |
图 1表示不同滞后日期大气O3-8 h浓度对居民呼吸系统疾病急救人次的影响,滞后1 d(lag1)与2 d累积效应(lag01)的结果具有统计学意义,其中lag1时广义交叉有效性(GCV)值最小,因此后续暴露反应关系曲线分析采用lag1。
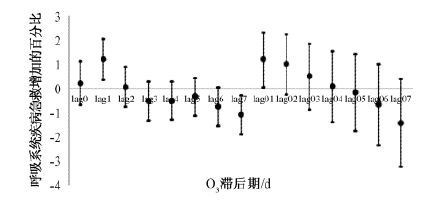
|
| 图 1 石家庄市大气O3-8h浓度每升高10 μg/m3对居民呼吸系统疾病急救人次影响的滞后效应 |
在单污染物模型中,大气O3-8 h(lag1)浓度每增加10 μg/m3,居民因呼吸系统疾病急救的风险增加1.20%(95% CI:0.36% ~ 2.04%);而在多污染物模型中(表 4),当引入SO2、NO2、PM2.5、PM10等污染物时,O3对呼吸系统疾病急救的影响消失。
| 污染物 | 超额危险度/% | 95% CI /% | |
| O3 | 1.20 | 0.36 | 2.04 |
| O3+SO2 | 0.37 | -0.57 | 1.31 |
| O3+NO2 | 0.29 | -0.65 | 1.23 |
| O3+PM2.5 | 0.31 | -0.60 | 1.23 |
| O3+PM10 | 0.32 | 0.32 | 0.32 |
根据文献[18],引入与空气污染没有生物学关联的损伤急救数据,分析结果表明O3-8 h浓度对损伤急救人次没有影响,再次印证了模型具有较好的稳定性。
2.4 暴露—反应关系曲线选择最强效应期(lag1)描述空气O3-8 h浓度与每日呼吸系统疾病急救人次的暴露—反应关系。O3-8 h浓度的升高与居民呼吸系统疾病急救风险增加的暴露—反应关系基本呈线性关系(图 2)。
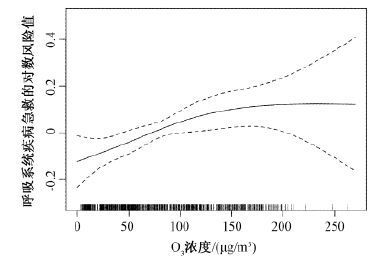
|
| 注:横坐标的短黑线表示O3-8 h浓度的频数分布,图中虚线表示95%置信区间 图 2 大气O3-8 h浓度与每日呼吸系统疾病急救人次的暴露反应关系图 |
2.5 不同季节大气O3-8 h浓度对呼吸系统疾病急救人次的影响
夏季大气O3-8 h浓度每增加10 μg/m3时,居民lag1、lag01、lag02呼吸系统疾病急救的风险分别增加1.57%(95% CI:0.53% ~ 2.61%)、1.72%(95% CI:0.33% ~ 3.11%)和1.90%(95% CI:0.35% ~ 3.44%)。而冬季O3-8 h浓度的升高对居民呼吸系统疾病急救的影响均无统计学意义;季节间存在显著差异(P < 0.05)。
3 讨论本研究通过定量描述石家庄市O3-8 h浓度水平与居民呼吸系统疾病急救人次的关系,评价了O3-8 h浓度升高对人群健康的公共卫生学意义。结果表明,大气O3-8 h浓度每升高10 μg/m3,石家庄市居民因呼吸系统疾病急救人次增加1.20%(95% CI:0.36% ~ 2.04%)。O3的健康危害在夏季最强,累积效应可达1.90%(95% CI:0.35% ~ 3.44%)。
大量流行病学研究表明大气O3浓度过高可以引起呼吸系统症状、提高发病率,而且与人群非意外总死亡率、呼吸系统疾病死亡率及心血管系统疾病死亡率显著相关[6-8-10-12]。然而,大多数研究集中于欧美等发达国家;我国相关研究较少,而且已有的文献均以死亡作为健康结局评价指标率。本研究收集急救数据作为健康结局指标进行O3的健康危害分析,以期能更灵敏的反应O3污染对人群健康的急性效应,为污染的控制提供科学依据。Yan等 [17]通过Meta分析表明,大气O3-8 h浓度每升高10 μg/m3,我国居民因呼吸系统疾病的死亡率增加0.50%(95% CI: 0.22% ~ 0.77%);Li [20]等人分析结果表明O3-8 h对广州市民总死亡率的影响冬季[0.63%(95% CI:0.05% ~ 1.22%)],大于夏季[0.36%(95% CI:-0.10% ~ 0.84%)]。本文研究结果显示,O3-8 h对呼吸系统疾病急救的影响远高于他人的死亡率影响结果;而且石家庄夏季的影响显著高于冬季,与广州相反,原因可能首先在于北方冬季寒冷导致人群室外活动时间减少,暴露减少;其次,供暖产生的大量颗粒污染物也降低了自然源产生的O3;第三,不同研究城市的性别与年龄构成情况可能存在差异,而且居民对O3污染的耐受情况也不同。
时间序列研究是一种应用于大气污染急性暴露健康效应研究的定量评价方法,已在国内外得到广泛应用。本研究采用多种非参数平滑函数的GAM,调整了长期趋势、季节趋势和气象因素等潜在的混杂因素,能更准确的体现污染物与人群健康结局的相关关系。本研究存在的局限性在于,仅收集了2年的数据,模型可能存在一定的稳定性;而且未能分析性别、年龄等因素对健康结局的影响。
综上所述,石家庄市大气O3污染可能增加居民呼吸系统疾病风险,尤其是在炎热的夏季。有必要呼吁民众关注O3污染,开展相关健康教育,减少暴露;同时建议政府部门合理分配卫生资源,降低其对居民健康的危害。
| [1] | 陈仁杰, 陈秉衡, 阚海东. 上海市近地面臭氧污染的健康影响评价[J]. 中国环境科学, 2010, 30 (5): 603–608. |
| Click to display the text | |
| [2] | U.S.EPA.2013 Final report:integrated science assessment of ozone and related photochemical oxidants[R].EPA/600/R-10/076F,Washington,DC:U.S.EPA,2013. |
| Click to display the text | |
| [3] | Bosson J, Pourazar B, Forsberg E, et al. Ozone enhances the airway inflammation initiated by diesel exhaust[J]. Respir Med, 2007, 101(6): 1140–1146. 10.1016/j.rmed.2006.11.010 . |
| Click to display the text | |
| [4] | Chen CY, Bonham AC, Plopper CG, et al. Neuroplasticity in nucleus tractus solitarius neurons after episodic ozone exposure in infant primates[J]. J Appl Physiol, 2003, 94(2): 819–827. 10.1152/japplphysiol.00552.2002 . |
| Click to display the text | |
| [5] | Chuang KJ, Chan CC, Su TC, et al. The effect of urban air pollution on inflammation,oxidative stress,coagulation,and autonomic dysfunction in young adults[J]. Am J Respir Crit Care Med, 2007, 176(4): 370–376. 10.1164/rccm.200611-1627OC . |
| Click to display the text | |
| [6] | Shmool JL, Kinnee E, Sheffield PE, et al. Spatio-temporal ozone variation in a case-crossover analysis of childhood asthma hospital visits in New York City[J]. Environ Res, 2016, 147: 108–114. 10.1016/j.envres.2016.01.020 . |
| Click to display the text | |
| [7] | Malig BJ, Pearson DL, Chang YB, et al. A time-stratified case-crossover study of ambient ozone exposure and emergency department visits for specific respiratory diagnoses in California (2005-2008)[J]. Environ Health Perspect, 2016, 124(6): 745–753. . |
| Click to display the text | |
| [8] | Crouse DL, Peters PA, Hystad P, et al. Ambient PM2.5,O3,and NO2 exposures and associations with mortality over 16 years of follow-up in the Canadian Census Health and Environment Cohort (CanCHEC)[J]. Environ Health Perspect, 2015, 123(11): 1180–1186. . |
| Click to display the text | |
| [9] | Katsouyanni K, Touloumi G, Samoli E, et al. Confounding and effect modification in the short-term effects of ambient particles on total mortality:results from 29 European cities within the APHEA2 project[J]. Epidemiology, 2001, 12(5): 521–531. 10.1097/00001648-200109000-00011 . |
| Click to display the text | |
| [10] | Gryparis A, Forsberg B, Katsouyanni K, et al. Acute effects of ozone on mortality from the "air pollution and health:a European approach" project[J]. Am J Respir Crit Care Med, 2004, 170(10): 1080–1087. 10.1164/rccm.200403-333OC . |
| Click to display the text | |
| [11] | Huang Y, Dominici F, Bell ML. Bayesian hierarchical distributed lag models for summer ozone exposure and cardio-respiratory mortality[J]. Environmetrics, 2005, 16(5): 547–562. 10.1002/(ISSN)1099-095X . |
| Click to display the text | |
| [12] | Bell ML, Dominici F. Effect modification by community characteristics on the short-term effects of ozone exposure and mortality in 98 US communities[J]. Am J Epidemiol, 2008, 167(8): 986–997. 10.1093/aje/kwm396 . |
| Click to display the text | |
| [13] | Zhang YH, Huang W, London SJ, et al. Ozone and daily mortality in Shanghai,China[J]. Environ Health Perspect, 2006, 114(8): 1227–1232. 10.1289/ehp.9014 . |
| Click to display the text | |
| [14] | Yang CX, Yang HB, Guo S, et al. Alternative ozone metrics and daily mortality in Suzhou:the China Air Pollution and Health Effects Study (CAPES)[J]. Sci Total Environ, 2012, 426: 83–89. 10.1016/j.scitotenv.2012.03.036 . |
| Click to display the text | |
| [15] | Wong CM, Vichit-Vadakan N, Kan H, et al. Public health and air pollution in Asia (PAPA):a multicity study of short-term effects of air pollution on mortality[J]. Environ Health Perspect, 2008, 116(9): 1195–1202. 10.1289/ehp.11257 . |
| Click to display the text | |
| [16] | Tao YB, Huang W, Huang XL, et al. Estimated acute effects of ambient ozone and nitrogen dioxide on mortality in the Pearl River Delta of Southern China[J]. Environ Health Perspect, 2011, 120(3): 393–398. 10.1289/ehp.1103715 . |
| Click to display the text | |
| [17] | Yan ML, Liu ZR, Liu XT, et al. Meta-analysis of the Chinese studies of the association between ambient ozone and mortality[J]. Chemosphere, 2013, 93(6): 899–905. 10.1016/j.chemosphere.2013.05.040 . |
| Click to display the text | |
| [18] | Yang CY, Chen AL, Chen RJ, et al. Acute effect of ambient air pollution on heart failure in Guangzhou,China[J]. Int J Cardiol, 2014, 177(2): 436–441. 10.1016/j.ijcard.2014.09.003 . |
| Click to display the text | |
| [19] | 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB 3095-2012环境空气质量标准[S].北京:中国环境科学出版社,2016. |
| Click to display the text | |
| [20] | Li TT, Yan ML, Ma WJ, et al. Short-term effects of multiple ozone metrics on daily mortality in a megacity of China[J]. Environ Sci Pollut Res, 2015, 22(11): 8738–8746. 10.1007/s11356-014-4055-5 . |
| Click to display the text |



