2. 苏州大学儿科临床医学院;
3. 苏州大学医学部;
4. 上海市城市环境气象中心
细颗粒物(PM2.5)由于粒径较小,易富集空气中有毒重金属、酸性氧化物、有机污染物、细菌和病毒等,能较长时间停留在空气中,直接进入肺泡并沉积,通过肺泡进入血液,进而随血液循环进入全身。因此细颗粒物对环境和健康的影响较一般颗粒物严重,其污染及健康危害受到普遍关注。
国内外很多研究证实,大气中的PM2.5浓度升高与呼吸系统疾病导致的死亡率升高密切相关,如著名的伦敦烟雾事件期间空气中尘粒浓度达4.46 mg/m3,4天内死亡人数比常年同期多4 000多人,在此之后两个月内,又有近8 000人因为烟雾事件而死于呼吸系统疾病[1]。有研究发现,大气PM2.5浓度每增加10 μg/m3,我国居民每日死亡率上升0.31%,呼吸系统疾病每日死亡率上升1.00%[2]。2013年初以来,我国发生大范围持续雾霾天气,给人们生产生活造成了严重影响,雾霾天气具有天数多、覆盖范围广、强度大及影响程度重的特点[3]。雾霾天气一般持续数日,PM2.5浓度可在短时间内激增,所以研究PM2.5对呼吸系统的急性危害特征以及损伤机制,有助于防治其导致的急性损伤。尽管国内外有关PM2.5健康危害的研究较多,但由于不同地区、不同季节PM2.5的来源不同,其组成成分也存在较大差异,对呼吸系统损伤特征和机制也不尽相同[4]。苏州市工业企业众多、交通拥挤、人口密集,雾霾频发,大气主要污染物为PM2.5。目前尚无苏州市大气PM2.5来源、成分或健康危害的研究报道。本研究采集了苏州市独墅湖高教区某校区大气PM2.5,急性染毒大鼠3 d,研究本地区大气细颗粒物对呼吸系统的急性损伤特征,并探讨可能的损伤机制。
1 材料与方法 1.1 实验动物及分组采用上海斯莱克实验动物有限责任公司(许可证号码 SCXK(沪)2012-0002)提供的6周龄健康雄性Wistar大鼠24只,体重166 g~205 g(合格证编号:2007000549868)。大鼠适应性饲养1周后,随机分为4组。
1.2 主要实验仪器TH-150 C型智能中流量空气总悬浮微粒采样器,配PM10-PM5-PM2.5组合式多功能切割器(武汉市天虹仪表有限责任公司),SB25-12D超声波振荡器(宁波新芝生物科技股份有限公司),LABCONCO冷冻干燥机(美国),DM750病理显微镜(Leica),FC500流式细胞仪(美国Beckman Coulter)。
1.3 主要试剂TNF-ɑ,IL-4,IL-8,IL-10以及LDH,ACP,AKP试剂盒(上海易利生物科技有限公司);磷酸盐缓冲液(PBS,pH为7.2~7.4);红细胞裂解液(pH为7.2~7.4),4℃保存备用。
1.4 PM2.5的采集与制备样品采自苏州市独墅湖高教区某校区,采样时间为2013年3月28日—5月5日,雨天不采样,实际采样30 d,每天连续采样10 h,采样期间PM2.5日平均质量浓度为151 μg/m3,达中度污染水平。
PM2.5悬液的制备:将载有颗粒物的滤膜裁剪成1 cm ×3 cm大小,浸入50 mL双蒸水中。超声处理30 min×3次,洗脱颗粒物,6层纱布过滤。滤液于4℃,12 000 r/min离心30 min。收集下层悬液,分装于小玻瓶中,于-80℃过夜。次日取出样品,进行真空冷冻干燥,实验时用生理盐水配制成相应质量浓度的PM2.5悬液(表 1)。
| 剂量组 | 浓度/(mg/mL) | PM2.5重量/mg | 生理盐水体积/mL |
| 对照组 | 0 | 0 | 5 |
| 低剂量组 | 2.5 | 12.5 | 5 |
| 中剂量组 | 5.0 | 25.0 | 5 |
| 高剂量组 | 10.0 | 50.0 | 5 |
1.5 动物处理 1.5.1 动物染毒
染尘方式采用非暴露式气管滴注染毒法。实验动物乙醚麻醉后固定于染尘架上,将气管导管通过声门裂,注入预热的PM2.5悬液,10 s后将动物侧卧位放置于保温饲养笼内。每天气管滴注1次,滴注量为1 mL/kg体重,连续染毒3 d,每次间隔24 h。
1.5.2 支气管肺泡灌洗液(BALF)的制备最后一次染毒结束24 h后,用10%水合氯醛麻醉大鼠。打开腹腔,腹主动脉放血处死,将肺灌洗针头插入分离出的气管,结扎固定,并以止血钳夹闭左主支气管,用冷PBS灌洗肺部,得到支气管肺泡灌洗液(BALF),经4℃,1 200 r/min 离心10 min,分装上清,-80℃保存待测。
1.5.3 肺单细胞悬液的制备大鼠处死后,剪取部分未经灌洗的左肺,在平皿中轻刮组织块,并以PBS冲洗;用吸管吸取组织匀浆,用200目筛网过滤到试管内,滤液经800 r/min离心5 min后弃上清,加入红细胞裂解液2 mL孵育10 min,离心去上清;再用PBS漂洗3次,加2 mL PBS得到大鼠肺单细胞悬液。
1.6 肺灌洗液中部分酶、细胞因子的测定采用标准比色法测定支气管肺泡灌洗液中乳酸脱氢酶(LDH)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)含量;ELISA法测定灌洗液中促炎因子TNF-ɑ、IL-8,抗炎因子IL-4、IL-10水平。
1.7 肺组织病理学检查取部分左肺,用10%的中性甲醛固定,制成石蜡切片,苏木素/伊红染色,观察肺组织病理学改变。
1.8 肺单细胞各项指标的检测分析以流式细胞仪检测肺细胞线粒体膜电位(MMP)、钙离子浓度(Ca2+)、活性氧(ROS) 含量。
1.9 数据处理和统计方法实验数据均以均数±标准差(x±s)表示。用SAS 9.0软件包,采用单因素方差分析对实验数据进行分析,P<0.05时表示差异具有统计学意义。
2 结果 2.1 PM2.5染毒后大鼠肺组织病理学改变PM2.5对大鼠肺组织的影响见图 1,与对照组相比,染毒组部分肺泡及支气管内可见异物颗粒,肺间质增宽;肺泡腔及肺间质内红细胞增多,高剂量组伴水肿,周围肺泡代偿性气肿;可见局灶性炎症细胞侵入;部分肺泡内可见少量水肿液;支气管周围淋巴结都未见明显异常。染毒组病变程度随剂量的增加而加重。
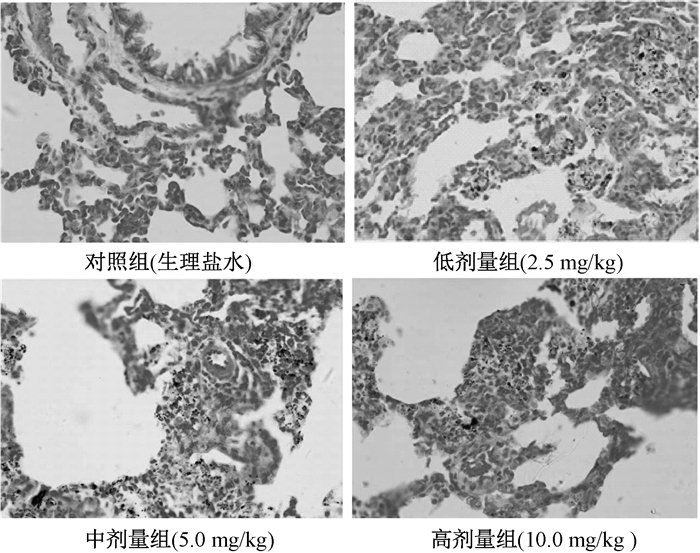
|
| 图 1 PM2.5染毒后大鼠肺组织病理学改变(HE, ×40) |
2.2 PM2.5染毒后大鼠肺泡灌洗液中部分酶、细胞因子水平的变化 2.2.1 肺灌洗液中ACP,AKP和LDH含量的变化
5.0 mg/kg和10.0 mg/kg PM2.5染毒后大鼠肺泡灌洗液中AKP显著低于对照组,各剂量组ACP,LDH含量与对照组比较差异均无统计学意义(表 2)。
| 染毒剂量/(mg/kg) | ACP/(IU/L) | AKP/(IU/L) | LDH/(IU/L) |
| 0 | 3.229±0.613 | 74.816±10.870 | 421.791±26.844 |
| 2.5 | 3.375±0.572 | 73.754±10.156 | 410.674±25.082 |
| 5.0 | 3.636±0.593 | 55.612±10.524* | 435.250±25.991 |
| 10.0 | 3.053±0.573 | 61.016±10.170* | 441.003±25.116 |
| 注:*与对照组比较P<0.05 | |||
2.2.2 肺泡灌洗液中细胞因子含量的变化
PM2.5染毒后大鼠肺泡灌洗液中TNF-α,IL-4,IL-8和IL-10含量均无显著变化(表 3)。
| 染毒剂量/(mg/kg) | TNF-α/(ng/L) | IL-4/(pg/mL) | IL-8/(ng/L) | IL-10/(ng/L) |
| 0 | 316.883±14.857 | 83.335±7.388 | 448.050±21.511 | 83.212±5.828 |
| 2.5 | 316.159±13.882 | 81.338±6.903 | 441.978±20.099 | 81.522±5.446 |
| 5.0 | 303.952±14.385 | 81.997±7.154 | 444.793±20.827 | 81.970±5.643 |
| 10.0 | 300.444±13.901 | 83.230±6.913 | 449.800±20.126 | 83.093±5.453 |
2.3 PM2.5染毒后大鼠肺细胞Ca2+,ROS和MMP的变化
PM2.5染毒后各剂量组肺细胞Ca2+浓度均显著高于对照组,且随着PM2.5浓度的增大Ca2+浓度逐渐升高,呈现出剂量依赖趋势;各剂量组ROS含量与对照组比较均呈升高趋势,但仅5.0 mg/kg组差异有统计学意义;各染毒组MMP与对照组比较均显著下降(表 4)。
| 染毒剂量/(mg/kg) | Ca2+/(荧光值) | ROS/(荧光值) | MMP/(FL2/FL1) |
| 0 | 9.912±2.868 | 2.091±0.808 | 1.378±0.174 |
| 2.5 | 16.074±2.680* | 3.426±0.755 | 1.053±0.162* |
| 5.0 | 19.532±2.777* | 3.902±0.783* | 1.085±0.168* |
| 10.0 | 23.795±2.683* | 3.420±0.756 | 1.017±0.163* |
| 注:*与对照组比较P<0.05 | |||
3 讨论
近年来,大气PM2.5污染及其对健康的危害受到广泛的关注。有研究认为,氧化应激损伤和炎症因子介导是PM2.5毒性作用的可能作用途径[5]。本实验以采自苏州市独墅湖高教区某校区的大气PM2.5配制较高浓度的PM2.5悬液,采用非暴露式气管滴注方法对大鼠进行急性染毒,从氧化应激和炎症反应两个方面来探讨大气细颗粒物对大鼠呼吸系统的损伤特征及其可能机制。
有研究发现PM2.5染毒大鼠后肺组织中性粒细胞、单核细胞浸润,肺间质增厚,肺毛细血管出血,肺泡腔增宽并有分泌物,且炎性病变随剂量增加而加重[6]。本实验肺组织病理学检查结果也发现部分动物肺组织出现炎症反应,肺间质增宽,肺泡腔内分泌物增多,并随着染毒剂量的增加,病变程度有加重的趋势,表明PM2.5可引起机体肺实质损伤,产生炎症性病变,且PM2.5浓度越高,对肺组织损伤越大。
PM2.5染毒后大鼠支气管肺泡灌洗液中部分酶及促炎和抗炎类细胞因子水平的变化,可以反映细颗粒物引起大鼠急性呼吸系统损伤的特点及机制。本实验大鼠肺泡灌洗液中酶ACP、LDH以及细胞因子TNF-α,IL-4,IL-8和IL-10水平均无明显变化;仅5.0 mg/kg和10.0 mg/kg PM2.5染毒组大鼠肺泡灌洗液中AKP显著低于对照组。本研究发现5.0 mg/kg和10.0 mg/kg PM2.5染毒后大鼠肺泡灌洗液中AKP显著低于对照组。AKP主要由肺泡Ⅱ型细胞产生,部分由中性粒细胞产生,其活性提示了肺泡Ⅱ型细胞受损程度和中性粒细胞浸润程度,AKP是分子量约为160 000的二聚体,二价金属离子(Mg2+,Zn2+) 是 AKP的激活剂,AKP的每一个亚基含2个锌原子,其中1个锌原子与亚基紧密结合,形成酶的稳定结构,另1个锌原子和亚基结合较松,参与催化作用。AKP降低可能与金属离子的缺乏有关,也可能与肺泡Ⅱ型细胞的增生作用有关,这与其他研究结果不同,具体原因还需进一步进行研究探讨。不同地区的PM2.5可致上述指标的不同变化,有研究表明,同种研究条件下,广州、东莞、深圳PM2.5对上述效应指标的影响强于肇庆[7],其原因可能是由于各地区PM2.5成分不同所致。本实验中动物可能在滴注了PM2.5后机体的抗氧化水平逐渐增强,各种酶和细胞因子的释放量减少,使机体恢复正常;也有可能是测定方法的灵敏度不同或染毒剂量还不够高,未达到实验动物的毒性效应水平。
氧化应激是机体有氧代谢过程产生的细胞损伤。Ca2+作为第二信使,在细胞活动中起着重要作用,在自由基介导的氧化应激反应中也起到了非常重要的作用。某些刺激作用,导致内质网释放其储存的Ca2+,然后线粒体摄取Ca2+,线粒体钙超载导致线粒体损伤;此外,细胞质内钙离子的升高可以激活其它一些酶,如一氧化氮合成酶(NOS),从而增加氧自由基的产生,而ROS也可以间接地产生更多的氧化物而促进钙离子水平的升高[8]。活性氧生成过多会引起细胞损伤,各种刺激诱导细胞产生内源性ROS可作为传播促进炎症或生长刺激的第二信使,与氧化应激和慢性炎症有关[9]。维持正常的线粒体膜电位是细胞线粒体进行氧化磷酸化产生ATP的前提,是保持线粒体功能所必需的条件。线粒体在受到各种刺激而膜电位降低,线粒体基质中释放出致凋亡活性物质,这些物质进入胞质,可激活Caspase级联反应,最终导致细胞凋亡[10]。钙离子与线粒体、ROS之间有着错综复杂的关系,线粒体是ROS的主要来源和促凋亡作用靶点,线粒体也是胞内钙库之一,细胞内ROS、Ca2+、线粒体膜电位相互联系、相互影响,三者共同作用于机体。摄入体内的PM2.5到达肺组织后具有产生活性氧的能力,自身还具有自由基活性,可作用于肺上皮细胞和巨噬细胞,使其释放活性氧和活性氮,自由基相互作用而损伤细胞本身及邻近的细胞。为了解PM2.5染毒大鼠后,对肺组织的氧化性损伤作用,本实验以肺细胞为实验对象,检测MMP,Ca2+和ROS含量的变化,以测定PM2.5染毒后对肺部细胞的急性氧化应激情况。结果显示,PM2.5染毒后,Ca2+浓度呈上升趋势,与对照组的差异均有显著性意义;ROS含量与对照组相比均升高,仅中剂量组与对照组有统计学差异;MMP均显著低于对照组,呈下降趋势。结果表明,PM2.5致肺急性损伤过程可能与细胞内Ca2+动态失衡和生物膜遭到破坏有关,PM2.5染毒处理破坏肺细胞的抗氧化机制的平衡,使细胞产生氧化应激反应。实验证明了PM2.5染毒能增加肺细胞的氧化应激水平,导致细胞损伤以及生物膜通透性改变,从而说明了氧化应激损伤可能是PM2.5对肺细胞功能造成损害的方式之一,PM2.5具有急性肺损伤作用。
PM2.5对肺组织损伤的可能原因是:来自颗粒物上吸附的有害成分,如有害金属、细菌等,诱导肺细胞内产生大量的ROS,降低细胞抗氧化能力从而使细胞膜脂质过氧化,导致细胞膜破坏,增加质膜透性和膜脂流动性,从而导致机体炎症效应或造成细胞内Ca2+浓度升高。同时,炎症细胞和Ca2+浓度上升又会导致细胞功能紊乱或结构损伤,造成细胞产生更多的ROS、线粒体膜电位崩溃,膜通透性改变,引起通过线粒体途径的凋亡。各种途径的相互促进可导致PM2.5对机体的损伤效应进一步放大。
| [1] | Bell ML, Davis DL, Fletcher T. A retrospective assessment of mortality from the London smog episode of 1952:the role of influenza and pollution[J]. Environ Health Perspect,2004, 112 (1) : 6 –8. |
| Click to display the text | |
| [2] | 王德庆, 王宝庆, 白志鹏. PM2.5污染与居民每日死亡率关系的Meta分析[J]. 环境与健康杂志,2012, 29 (06) : 529 –532. |
| Click to display the text | |
| [3] | 张建忠, 孙瑾, 缪宇鹏. 雾霾天气成因分析及应对思考[J]. 中国应急管理,2014 (1) : 16 –21. |
| Click to display the text | |
| [4] | 刘洁岭, 蒋文举. PM2.5的研究现状及防控对策[J]. 广州化工,2012, 40 (23) : 22 –24. |
| Click to display the text | |
| [5] | Riva DR, Magalh[AKa~D]es CB, Lopes AA, et al. Low dose of fine particulate matter(PM2.5) can induce acute oxidative stress,inflammation and pulmonary impairment in healthy mice[J]. Inhal Toxicol,2011, 23 (5) : 257 –267. |
| Click to display the text | |
| [6] | 曲红梅, 牛静萍, 魁发瑞, 等. 大气中PM2.5致大鼠呼吸道急性损伤作用[J]. 中国公共卫生,2006, 22 (5) : 598 –599. |
| Click to display the text | |
| [7] | 闫庆倩, 赵学彬, 杨莉, 等. 不同地区大气PM2.5致大鼠肺损伤的比较实验研究[J]. 环境与健康杂志,2012, 29 (1) : 7 –11. |
| Click to display the text | |
| [8] | 郭静, 蒲咏梅, 张东才. 钙离子信号与细胞凋亡[J]. 生物物理学报,2005, 21 (1) : 1 –18. |
| Click to display the text | |
| [9] | Hensley K, Robinson KA, Gabbita SP, et al. Reactive oxygen species,cell signaling,and cell injury[J]. Free Rad Biol Med,2000, 28 (10) : 1456 –1462. |
| Click to display the text | |
| [10] | Ly JD, Grubb DR, Lawen A. The mitochondrial membrane potential (Δψm)in apoptosis:an update[J]. Apoptosis,2003, 8 (2) : 115 –128. |
| Click to display the text |



