2. 中国环境科学研究院, 环境基准与风险评估国家重点实验室
机动车为人类的生活带来了方便与快捷,也带来了大气污染,尤其是对一些人口密集城市,如北京[1]、东京[2]、米兰[3]的大气环境影响更为严重。2010—2012年我国机动车保有量由1.9亿万辆增加到2.2亿辆,年均增长8.5%[4]。随着机动车保有量的增长,机动车排放PM2.5成为我国许多地区大气污染的主要来源[5]。Kong等[6]总结了国内外采用受体模型计算的机动车尾气对大气PM2.5和PM10的贡献率,分别为3.3% ~ 82.2%和20% ~ 34%。一些研究也表明机动车排放PM2.5是引起城市灰霾的主要因素[1, 7-8]之一。
流行病学研究表明大气污染对人体心肺疾病和呼吸系统疾病的发生率及死亡率存在影响[9-10]。毒理学研究表明大气污染中的颗粒物对心血管系统、血液系统、免疫系统和生殖系统等存在危害作用,尤其对于血液系统,颗粒物可能诱发血栓形成和凝血异常[11]。机动车排放PM2.5因其排放高度处于人的呼吸带及粒径细微的特点,对人体健康造成的危害更为严重。2008年Liu[12]的动物研究显示,暴露于机动车尾气颗粒物会引起T细胞辅助因子一系列基因甲基化的改变,并且这一改变可能是哮喘的发病机制。2013年Brunst[13]的研究表明暴露于机动车尾气会引起叉头蛋白(3FOXP3) 的高甲基化,并且3FOXP3甲基化的改变可能是儿童患哮喘的一个危险因素。目前已有流行病学研究表明暴露于机动车排放PM2.5会增加心血管疾病的发生率[10, 14]。同时毒理学研究也表明暴露于机动车排放PM2.5会导致血管功能改变[15-16]。2009年Baccarelli[17]的研究显示暴露于交通颗粒物后会引起长散在重复序列(LINE)-1甲基化降低。
目前国内外研究多集中在汽车尾气排放颗粒物对细胞增殖毒性与细胞凋亡毒性的研究,机动车排放PM2.5对血管内皮细胞DNA甲基化损伤性的研究尚不清楚。本次研究以机动车排放PM2.5为研究对象,以人脐静脉内皮细胞EA.hy926为受试对象,采用MTS法测定细胞活力;采用甲基化定量检测试剂盒(比色法)测定细胞甲基化率(5-mC%);采用FITC-AnnexinV/PI染色法测定细胞凋亡情况。通过细胞增殖毒性、DNA甲基化率和细胞凋亡共同比较机动车排放PM2.5对血管内皮细胞的毒性影响,从不同角度探索机动车排放PM2.5对血管内皮细胞的影响机制。
1 材料与方法 1.1 材料 1.1.1 试验细胞人脐静脉血管内皮细胞株EA.hy926,由美国ATCC细胞库提供,增值周期约为31 h。
1.1.2 仪器D-1型自动蒸汽灭菌锅(北京发恩科贸有限公司);生物安全柜(美国Thermo Forma公司);CO2恒温培养箱(美国Thermo Forma公司);0.22 μm滤器(美国PALL公司);流式细胞仪(美国BD公司);TH4-200倒置显微镜(日本OLYMPUS公司);PM2.5撞击式中流量颗粒物采样器(78 L/min);METTLER TOLEDO AL104-IC分析天平(美国梅特勒-托利多仪器公司);舒美KQ500DB超声震荡仪(江苏昆山市超声仪器公司);LGJ-18真空冷冻干燥机(北京亚泰科隆公司);Model 680型酶标仪(美国Bio-Rad公司);恒温水浴锅(江苏金坛荣华仪器公司);核算蛋白分析仪(北京凯奥科技发展有限公司)。
1.1.3 试剂胰蛋白酶、二甲基亚砜(美国Sigma公司);双抗青霉素—链霉素(华北制药公司);DMEM培养液、胎牛血清FBS、磷酸盐缓冲液PBS(美国HyClone公司);石英纤维采样滤膜(美国PALL公司);MTS试剂盒(美国Promega公司);AnnexinV-FITC/PI试剂盒(美国BD公司);DNA提取试剂盒(北京艾德科技有限公司);DNA甲基化定量检测试剂盒—比色法(美国Epigentek)。
1.2 方法 1.2.1 机动车排放PM2.5的收集将已恒重的石英纤维滤膜(直径为90 mm)用小镊子取出,“毛”面向上,平放在膜托上,并和膜托盒盖上标记好的编号对应记录,将装好膜的膜托置于采样器内,拧紧采样夹。采样器在实验前,用孔口流量器进行流量校准;在中流量撞击式采样器中放入膜托,安装好采样器,检验流量并确定密封性,记录每个采样器的流量(78 L/min)。启动柴油车,开采样器泵,对柴油机动车排放的颗粒物进行固定源稀释通道采集[18],采集20 min。熄灭柴油车,约20 min柴油机冷却后再启动,循环采样10次。采样前要在马弗炉中将石英纤维滤膜600℃灼烧2 h,恒温干燥24 h后迅速称重,在膜袋上记下滤膜的编号和重量,将其平展地放在光滑洁净的膜袋内,然后贮存于盒内备用。采样后小心取下石英纤维滤膜,以样品采样膜中线且“毛”面朝内对叠后,在平衡室内平衡24 h,迅速称重记录后,用铝箔纸包装好并放回滤袋内。将滤袋置于-20℃冰柜保存。
1.2.2 机动车排放PM2.5样品的提取采用超声振荡取法提取颗粒物。取装有50 mL去离子水的烧杯,把样品采样膜“毛”面朝下放在烧杯中,超声震荡(功率500 W)2次,每次30 min洗脱颗粒物。为除掉样品采样膜碎片,提取液用8层纱布过滤。过滤后的提取液分装到小瓶中(已消毒,5 mL/瓶),在冷冻柜放置8 h后,再真空冷冻干燥72 h使其成干粉,将其干粉称重并做好记录,取一定量的干粉和磷酸盐缓冲液(phosphate buffered saline,PBS;已灭菌)配制成不同浓度染毒母液,质量浓度分别为100、250、500、1 000、2 000 μg/mL。置于-20℃避光保存。
1.2.3 细胞的培养EA.hy926采用常规传代培养,培养液为DMEM培养液(含1%双抗、10%胎牛血清),在37℃、5%CO2培养箱中培养至对数生长期。
1.2.4 细胞染毒和实验将PBS(已灭菌)及已配置的母液超声震荡15 min,用DMEM培养液(含0.5%胎牛血清)将不同质量浓度机动车排放PM2.5染毒母液稀释10倍,使机动车排放PM2.5染毒终质量浓度分别为0(PBS溶剂对照)、10、25、50、100、200 μg/mL。
1.2.4.1 MTS毒性检测[19]选用处于对数生长期的良好细胞,用DMEM培养液(含1%双抗、10%胎牛血清)制成密度为3×105 mL单细胞悬液,以100 μL/孔接种于96孔板,在37℃、5%CO2培养箱中培养24 h。弃去培养板中原培养液,以100 μL/孔加入配置好的0(PBS溶剂对照)、10、25、50、100、200 μg/mL染毒液,每个浓度组设置平行样6个。在37℃、5%CO2培养箱中培养24 h。在细胞染毒结束前1 h加入MTS(20 μL/孔),继续在细胞培养箱内避光培养1 h。用酶联免疫检测仪检测样品吸光度OD值(检测波长490 nm,参考波长630 nm)。实验重复2次,按细胞存活率(%)=(实验组OD)/(对照组OD)×100%,求得细胞存活率。
1.2.4.2 细胞DNA甲基化实验[20]选用处于对数生长期的良好细胞,用DMEM培养液(含1%双抗、10%胎牛血清)制成密度为3×105 mL单细胞悬液,接种于6孔板(2 mL/孔),在37℃、5%CO2培养箱中培养24 h。弃去培养板中原培养液,以1 mL/孔加入配置好的0(PBS溶剂对照)、10、50、200 μg/mL染毒液,每个浓度组设置平行样6个。在37℃、5%CO2培养箱中培养24 h。依照DNA提取试剂盒步骤提取DNA。全基因组甲基化率用DNA甲基化定量检测试剂盒—比色法试剂盒测定DNA甲基化率,计算5-mC%。
1.2.4.3 细胞凋亡检测选用处于对数生长期的良好细胞,用DMEM培养液(含1%双抗、10%胎牛血清)制成密度为3×105 mL单细胞悬液。接种于6孔板(2 mL/孔),在37℃、5%CO2培养箱中培养24 h。弃去培养板中原培养液,以1 mL/孔加入配置好的0(PBS溶剂对照)、10、50、200 μg/mL染毒液,建立空白和补偿对照组。染毒结束后,在37℃、5%CO2培养箱中培养24 h。收集细胞,按照AnnexinV-FITC/PI试剂盒说明书步骤操作,流式细胞仪检测细胞凋亡情况。
1.3 统计学分析数据整理后用SPSS 17.0统计软件进行数据分析,以“均数±标准差(x±s)”表示最终的实验结果。采用单因素方差分析的LSD法(方差齐时)和Tamhane’s T2法(方差不齐时)进行多个样本均数比较,当P<0.05时为差异有统计学意义。
2 结果 2.1 细胞毒性检验EA.hy926细胞被机动车排放PM2.5染毒24 h后,细胞活力在100% ~ 84.8%范围,从数值上看细胞活力随着染毒浓度的增加而下降;不同剂量之间比较有差异(FOD=12.528,POD<0.05, F存活率=16.095,P存活率<0.05)。两两比较可得最高剂量组(200 μg/mL)和空白组(PBS对照组)差异具有统计学意义(P OD=0.007,P存活率=0.013;表 1)。
| 剂量/(μg/mL) | 吸光度OD值 | 细胞存活率/% |
| 0 | 1.285 ± 0.040 | 100.000 |
| 10 | 1.293 ± 0.052 | 100.689 ± 4.656 |
| 25 | 1.274 ± 0.028 | 99.202 ± 2.985 |
| 50 | 1.264 ± 0.033 | 98.452 ± 1.545 |
| 100 | 1.144 ± 0.100 | 88.989 ± 6.326 |
| 200 | 1.090 ± 0.072▲ | 84.853 ± 5.269▲ |
| 注:▲和0(PBS对照)相比,P<0.05 | ||
2.2 细胞甲基化结果
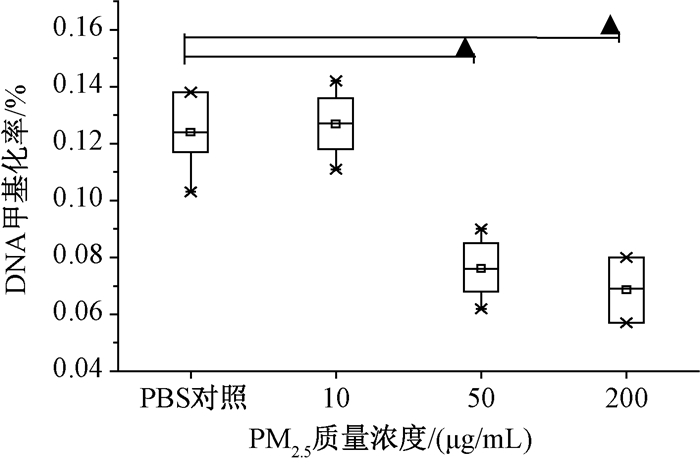
机动车排放PM2.5悬液作用于EA.hy926细胞24 h后,从数值上看随着剂量的增加细胞甲基化率(5-mC%)下降。不同剂量之间比较有差异(F=43.261,P<0.05)。两两比较可得中剂量组(50μg/mL)、高剂量组(200μg/mL)都与空白组(PBS对照组)差异有统计学意义(P50<0.05,P100<0.05;图 1)。
|
| 注:▲和PBS对照相比,P<0.05 图 1 机动车排放PM2.5对细胞甲基化作用的的比较 |
2.3 细胞凋亡结果
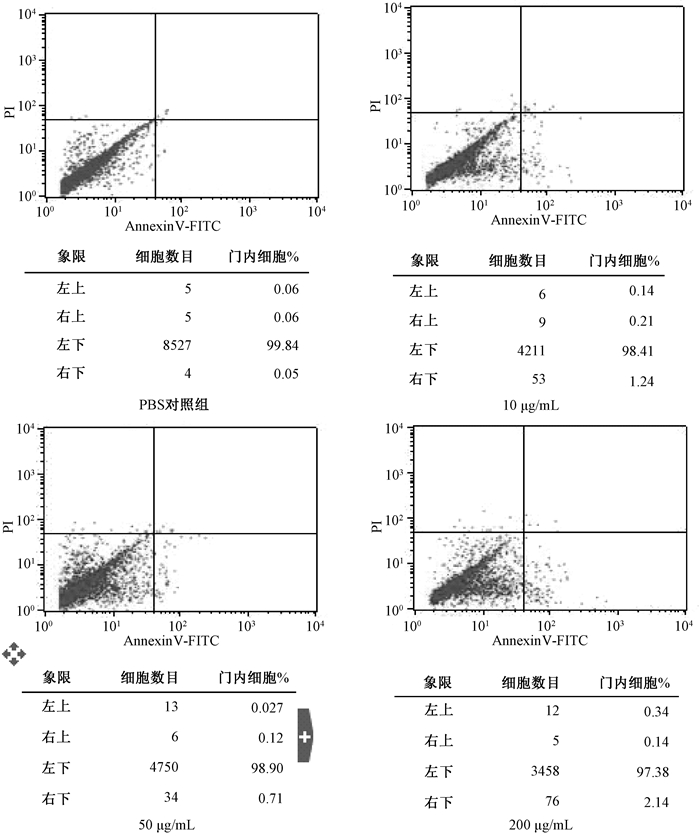
流式细胞术检测凋亡结果见图 2。机动车排放PM2.5悬液作用于EA.hy926细胞24 h后,随着剂量的增加细胞凋亡率上升。
|
| 图 2 不同质量浓度PM2.5引起细胞凋亡结果 |
3 讨论
目前大多数机动车排放PM2.5的毒性研究均采用细胞MTS实验,与传统的MTT实验相比,MTS实验检测细胞毒性更加简便快速,检测结果也更加稳定和精确。本研究采用MTS实验观察机动车排放PM2.5对EA.hy926细胞活性的影响。结果显示机动车排放PM2.5染毒24 h可抑制细胞增殖功能,随着染毒质量浓度的升高,细胞活力逐渐下降,在染毒质量浓度为200 μg/mL时与PBS对照组比较差异有统计学意义(P<0.05)。其它研究也显示了与本研究相一致的毒性趋势。董洁[21]的实验结果表明,一定浓度范围的交通相关颗粒物(PM2.5)染毒细胞时,6T-CEM细胞增殖功能受到抑制,并且在染毒质量浓度高于320μg/mL时,增殖指数低于80%。机动车排放PM2.5对健康的影响与其理化性质密切相关,尤其是颗粒物的粒径与成分,易于滞留在终末细支气管和肺泡,某些较细的组分还可以穿透肺泡进入血液,因而对心血管系统的损害更为严重。2012年范兰兰[22]对MTT和LDH结果进行A549和HUVECs2种细胞间的数据统计分析,发现HUVECs比A549对颗粒物的刺激作用略微敏感。
人类癌症的发展中,DNA甲基化已成为一种主要的表观遗传机制[23]。研究显示DNA甲基化的改变可以激活致癌基因并使抑癌基因沉默,从而导致基因组不稳定及癌症的发生[24]。机动车排放PM2.5对DNA的甲基化造成改变,一方面激活DNA的甲基化,另一方面促使DNA去甲基化。这种变化常常发生在疾病的早期阶段,与氧化应激、免疫缺陷和慢性炎症具有密切联系。在Brunst[13]研究的机动车排放颗粒物与儿童哮喘的关系中显示,foxp3基因的高甲基化促使儿童哮喘更加严重化。在Liu[12]研究中指出机动车尾气颗粒物会引起CpG岛上IFN-γ的高甲基化和IL-4启动子的低甲基化。本研究采用DNA甲基化定量检测试剂盒—比色法检测机动车排放PM2.5染毒24 h对细胞DNA甲基化产生的影响,随着染毒质量浓度的增加,细胞DNA甲基化率(5-mC%)下降,在染毒质量浓度为50 μg/mL和200 μg/mL时与对照组比较差异有统计学意义(P<0.05)。Baccarelli[17]研究中显示人体暴露于交通颗粒物后,全基因组甲基化率会降低。Miousse IR[25]对鼠巨噬细胞暴露于PM10后发现,不同浓度的染毒都对全基因组甲基化率产生影响。由于人类基因的复杂性及其时空差异性,机动车排放PM2.5对定点基因甲基化的影响需继续探究。
细胞凋亡是保证多细胞生物个体正常发育成熟和维持正常生理过程所必须的。经AnnexinV-FITC/PI染色流式细胞仪测定暴露于机动车排放的PM2.5对细胞诱导凋亡作用随染毒浓度升高细胞凋亡率逐渐升高,说明机动车排放PM2.5对EA.hy926细胞有诱导凋亡作用。董洁[21]用一定浓度范围的交通相关颗粒物染毒细胞24 h后,发现交通相关颗粒物可以诱导细胞凋亡作用。细胞凋亡过程失调不仅使生物个体失去机体的稳定性,还是人类许多严重疾病的根源。
综上所述,机动车排放PM2.5可以抑制EA.hy926细胞的增殖功,改变EA.hy926细胞的DNA甲基化率,对EA.hy926细胞可以产生诱导凋亡作用。一些体内体外研究表明异常的DNA甲基化可能会引起细胞周期停滞、细胞异常增殖和细胞凋亡,所有这些变化都被认为是致癌作用、肿瘤新血管形成、血管生成和转移的风险因素[26-28]。本研究的DNA甲基化改变在染毒质量浓度为50 μg/mL时与PBS对照比较差异有统计学意义,相对于其他检测指标出现更早,因而DNA甲基化可能是细胞增殖和凋亡的机制之一,定点基因的甲基化变化仍需要进一步研究。
| [1] | 张楫泽, 刘憬然, 孔漪宝. 北京雾霾现象与机动车尾气排放关系分析[J]. 北方环境, 2013, 25(11): 115–117. |
| [2] | Yorifuji T, Kawachi I, Kaneda M, et al. Diesel vehicle emission and death rates in Tokyo, Japan:a natural experiment[J]. Sci Total Environ, 2011, 409(19): 3620–3627. doi: 10.1016/j.scitotenv.2011.06.002 |
| [3] | Marcazzan GM, Ceriani M, Valli G, et al. Source apportionment of PM10 and PM2.5 in Milan (Italy) using receptor modelling[J]. Sci Total Environ, 2003, 317(1-3): 137–147. doi: 10.1016/S0048-9697(03)00368-1 |
| [4] | 王若素, 肖寒, 白涛, 等. 全国机动车保有量-《2013年中国机动车污染防治年报》(第Ⅰ部分)[J]. 环境与可持续发展, 2014, 39(01): 88–90. doi: 10.3969/j.issn.1673-288X.2014.01.028 |
| [5] | Fu L, Hao J, He D, et al. Assessment of vehicular pollution in China[J]. J Air Waste Manag Assoc, 2001, 51(5): 658–668. doi: 10.1080/10473289.2001.10464300 |
| [6] | Kong S, Han B, Bai Z, et al. Receptor modeling of PM2.5, PM10 and TSP in different seasons and long-range transport analysis at a coastal site of Tianjin, China[J]. Sci Total Environ, 2010, 408(20): 4681–4694. doi: 10.1016/j.scitotenv.2010.06.005 |
| [7] | Song Y, Xie S, Zhang Y, et al. Source apportionment of PM2.5 in Beijing using principal component analysis/absolute principal component scores and UNMIX[J]. Sci Total Environ, 2006, 372(1): 278–286. doi: 10.1016/j.scitotenv.2006.08.041 |
| [8] | Feng J, Chan CK, Fang M, et al. Characteristics of organic matter in PM2.5 in Shanghai[J]. Chemosphere, 2006, 64(8): 1393–1400. doi: 10.1016/j.chemosphere.2005.12.026 |
| [9] | Pope CA, Burnett RT, Thun MJ, et al. Lung cancer, cardiopulmonary mortality, and long-term exposure to fine particulate air pollution[J]. JAMA, 2002, 287(9): 1132–1141. doi: 10.1001/jama.287.9.1132 |
| [10] | Pope CA, Burnett RT, Thurston GD, et al. Cardiovascular mortality and long-term exposure to particul ate air pollution:epidemiological evidence of general pathophysiological pathways of disease[J]. Circulation, 2004, 109(1): 71–77. |
| [11] | 孙志豪, 崔燕平. PM2.5对人体健康影响研究概述[J]. 环境科技, 2013, 26(04): 75–78. doi: 10.3969/j.issn.1674-4829.2013.04.019 |
| [12] | Liu J, Ballaney M, Al-Alem U, et al. Combined inhaled diesel exhaust particles and allergen exposure alter methylation of T helper genes and IgE production in vivo[J]. Toxicol Sci, 2008, 102(1): 76–81. doi: 10.1093/toxsci/kfm290 |
| [13] | Brunst KJ, Leung YK, Ryan PH, et al. Forkhead box protein 3 (FOXP3) hypermethylation is associated with diesel exhaust exposure and risk for childhood asthma[J]. J Allergy Clin Immunol, 2013, 131(2): 592–594. doi: 10.1016/j.jaci.2012.10.042 |
| [14] | 陈伯宁, 宋宏, 温干京, 等. 机动车尾气暴露对广州某社区中老年人心血管系统影响的panel研究[J]. 环境与健康杂志, 2009, 26(09): 758–762. |
| [15] | Campen M, Robertson S, Lund A, et al. Engine exhaust particulate and gas phase contributions to vascular toxicity[J]. Inhal Toxicol, 2014, 26(6): 353–360. doi: 10.3109/08958378.2014.897776 |
| [16] | Kodavanti UP, Thomas RF, Ledbetter AD, et al. Diesel exhaust induced pulmonary and cardiovascular impairment:the role of hypertension intervention[J]. Toxicol Appl Pharmacol, 2013, 268(2): 232–240. doi: 10.1016/j.taap.2013.02.002 |
| [17] | Baccarelli A, Wright RO, Bollati V, et al. Rapid DNA methylation changes after exposure to traffic particles[J]. Am J Respir Crit Care Med, 2009, 179(7): 572–578. doi: 10.1164/rccm.200807-1097OC |
| [18] | 刘晓宇. 典型固定燃烧源颗粒物排放特征研究[D]. 中国环境科学研究院, 2007. http://cdmd.cnki.com.cn/Article/CDMD-82405-2007128599.htm |
| [19] | Ramachandran V, Arumugam T, Wang H, et al. Anterior gradient 2 is expressed and secreted during the development of pancreatic cancer and promotes cancer cell survival[J]. Cancer Res, 2008, 68(19): 7811–7818. doi: 10.1158/0008-5472.CAN-08-1320 |
| [20] | Fernandez-Roig S, Lai SC, Murphy MM, et al. Vitamin B12 deficiency in the brain leads to DNA hypomethylation in the TCblR/CD320 knockout mouse[J]. Nutr Metab (Lond), 2012, 9: 41. doi: 10.1186/1743-7075-9-41 |
| [21] | 董洁, 张志红, 郭丽丽, 等. 交通相关的细颗粒物(PM2.5)对6T-CEM细胞凋亡的影响[J]. 毒理学杂志, 2011, 25(04): 249–251. |
| [22] | 范兰兰, 尚羽, 张玲. 大气颗粒物对A549和HUVECs细胞的毒性作用[J]. 环境科学研究, 2012, 25(10): 1166–1172. |
| [23] | Jones PA, Baylin SB. The fundamental role of epigenetic events in cancer[J]. Nat Rev Genet, 2002, 3(6): 415–428. |
| [24] | Howard G, Eiges R, Gaudet F, et al. Activation and transposition of endogenous retroviral elements in hypomethylation induced tumors in mice[J]. Oncogene, 2008, 27(3): 404–408. doi: 10.1038/sj.onc.1210631 |
| [25] | Miousse IR, Chalbot MC, Aykin-Burns N, et al. Epigenetic alterations induced by ambient particulate matter in mouse macrophages[J]. Environ Mol Mutagen, 2014, 55(5): 428–435. doi: 10.1002/em.v55.5 |
| [26] | Valavanidis A, Vlachogianni T, Fiotakis K, et al. Pulmonary oxidative stress, inflammation and cancer:respirable particulate matter, fibrous dusts and ozone as major causes of lung carcinogenesis through reactive oxygen species mechanisms[J]. Int J Environ Res Public Health, 2013, 10(9): 3886–3907. doi: 10.3390/ijerph10093886 |
| [27] | Lou J, Wang Y, Yao C, et al. Role of DNA methylation in cell cycle arrest induced by Cr (Ⅵ) in two cell lines[J]. PLoS One, 2013, 8(8): e71031. doi: 10.1371/journal.pone.0071031 |
| [28] | Ghio AJ, Carraway MS, Madden MC. Composition of air pollution particles and oxidative stress in cells, tissues, and living systems[J]. J Toxicol Environ Health B Crit Rev, 2012, 15(1): 1–21. doi: 10.1080/10937404.2012.632359 |



