2. 贵州医科大学基础医学院药理学教研室;
3. 贵州医科大学基础医学院生理学教研室
氟是安全阈极窄、化学性质极活泼的元素,在常温下能与许多元素特别是金属元素发生作用。氟过量会导致全身性中毒,高氟是影响儿童智力发育的重要因素之一[1]。铝是自然界中最丰富的金属元素,也是慢性神经毒性物质,可导致学习记忆障碍[2-3]。在使用高岭土拌煤的燃煤型地氟病区、应用铝盐除氟的饮水型地氟病区、采用冰晶石—氧化铝熔盐电解法生产金属铝的工业废气污染区等环境都有可能有氟、铝共存,并经各种环境介质进入人体。氟与铝形成氟化铝后更容易通过脑屏障使其在脑中的含量和活性增加[4],氟铝自幼持续暴露一年对大鼠学习记忆产生不良影响[5]。出生前后是中枢神经系统发育最快也最易受损的时期,但孕哺期及成年前氟、铝联合暴露对子代学习记忆行为的影响及其机制尚不明了。氨基酸类神经递质与学习记忆等关系密切[6-8]。本研究采用3×3析因设计,于亲代孕哺期及子代成年前,进行氟、铝不同水平单独及联合暴露后,观察仔鼠学习记忆行为和测定海马氨基酸类神经递质谷氨酸 (Glu)、天冬氨酸 (Asp)、甘氨酸 (Gly)、䨿-氨基丁酸 (GABA) 含量,探讨氟、铝对子代学习记忆的影响的机制及联合作用类型,为氟铝联合对学习记忆损害的防治提供依据。
1 材料与方法 1.1 主要仪器与试剂PF-1-01雷磁氟离子电极、232雷磁参比电极 (上海右一仪器有限公司),PHS-3C pH计 (上海嘉鹏科技有限公司),ETHOS A微波消解仪 (上海新仪微波化学科技有限公司),VISTA-MPS SPECTROME电感耦合等离子体发射光谱仪 (美国Perkin Elmer公司),5415R小型高速冷冻离心机 (德国Eppendorf公司),AB104-N电子分析天平 (瑞士梅特勒-托利多公司),Milli-Q超纯水仪 (美国Millipore公司),L-8900型全自动氨基酸分析仪 (日本日立高新技术公司)。
氟化钠 (NaF,分析纯,天津市科密欧化学试剂有限公司);氯化铝 (AlCl3,分析纯,天津市致远化学试剂有限公司);苯基硫脲 (分析纯,美国Sigma公司);5-磺基水杨酸 (分析纯,天津市科密欧化学试剂有限公司);0.1 μmol/L氨基酸混合标准溶液 (日本和光纯药工业株式会社);大鼠天冬氨酸 (Asp)、γ-氨基丁酸 (GABA) ELISA试剂盒 (美国RD公司)。
1.2 实验动物分组与染毒方法选择健康成年清洁级SD大鼠54只 (雌鼠38只,雄鼠16只),体重约200 g,由贵阳医学院实验动物中心提供,实验设施合格证编号为SYXK (黔)2012—0001,动物合格证编号为SCXK (黔)2012—0001。实验经贵阳医学院伦理委员会批准实施,编号为:1305020。
实验期间,大鼠自由摄食及饮水,于实验中心饲养。饲养条件:室温26.5℃,相对湿度60%,工作照度278 lx,昼夜交替12 h。剂量分组见表 1,根据3×3析因设计,在各组饮水中添加NaF和AlCl3溶液,均临用现配。
| mg/L | ||
| 组别 | NaF | AlCl3 |
| 对照 | 0 | 0 |
| 低氟 | 100 | 0 |
| 高氟 | 200 | 0 |
| 低铝 | 0 | 500 |
| 高铝 | 0 | 1 000 |
| 低氟低铝 | 100 | 500 |
| 低氟高铝 | 100 | 1 000 |
| 高氟低铝 | 200 | 500 |
| 高氟高铝 | 200 | 1 000 |
染毒方式为经饮水染毒。适应性喂养一周后,按体重随机分为9组,每组6只 (雌:雄=2:1),每天观察阴栓,查到阴栓之日视为受孕第0天,将孕鼠单笼饲养。染毒时间:母鼠受孕第0天至仔鼠出生第21天 (postnatal day 21,PND 21);从每窝随机选取的12只仔鼠自PND 22(断乳后)~PND 60(成年) 期间,延续同组母鼠染毒剂量和方式染毒。
1.3 指标及其检测方法 1.3.1 仔鼠学习记忆能力的测试于PND 60,采用Morris水迷宫测试仔鼠的学习记忆能力。定位航行试验:测试前,让仔鼠自由游泳2 d,以熟悉环境。测试时平台固定置于某一象限,将仔鼠面向池壁分别从4个象限入水,记录仔鼠找到平台所用的时间 (逃避潜伏期)。找到平台后,让其在平台站立20 s后,休息4 min再行下一次测试。超过60 s未找到平台,潜伏期记为60 s。连续进行4 d,4次/d,上午、下午各2次。空间探索试验:第5天撤除平台,让仔鼠在无平台情况下寻找记忆中的平台,游泳60 s,记录仔鼠的游泳路线和跨平台象限游泳次数。测试过程中,水池周围参照物和实验者位置保持不变[9]。
1.3.2 尿液样品收集及氟、铝浓度的测定仔鼠处死前用代谢笼收集12 h尿,按照《尿中氟的离子选择电极测定方法》(WS/T 30-1996)[10]测定尿中氟离子的浓度,电感耦合等离子体发射光谱法 (ICP-AES) 测定尿液中铝离子浓度。
1.3.3 脑组织病理形态学观察,氟、铝和氨基酸神经递质的含量测定染毒结束,乙醚麻醉、脱臼法处死大鼠,断头迅速取出脑组织并称重,低温生理盐水漂洗后,并沿大脑纵裂垂直切为左右两个半球,游离并取出左侧海马组织,称重,分装袋分装,储存于-80℃冰箱;右侧脑半球用10%福尔马林溶液固定,待用。
右侧脑半球用10%福尔马林溶液固定,标号,石蜡包埋,切片,HE染色,封片,在光学显微镜下观察,并对海马区CA3区拍照,观察脑组织的病理形态。
每份脑组织样品各取0.3 g脑皮质,分别用氟离子选择电极法和ICP-AES测定氟、铝含量。
制备10%海马组织匀浆:彻底分离大鼠脑海马组织,并放在冰冷的PBS磷酸盐缓冲剂中漂洗,滤纸拭干,准确称取,按重量 (g):体积 (mL)=1:9的比例加入PBS磷酸盐缓冲剂,冰水浴条件下机械研磨成匀浆,置于低温离心机2 500 r/min离心10 min,取上清液即10%的匀浆液,存于4℃冰箱,按照ELISA试剂盒说明书测定GABA、Asp。
磺基水杨酸法制备海马匀浆:彻底分离大鼠脑海马组织,并放在4 ℃预冷的PBS磷酸盐缓冲剂中漂洗,滤纸拭干,准确称取50 mg,加入1 mL 10%磺基水杨酸,冰浴条件下充分匀浆,10 000 r/min、4℃离心20 min,留取上清液,存于-80℃冰箱,采用氨基酸自动分析仪检测Glu和Gly。
1.4 数据统计与分析利用SPSS 17.0软件包进行统计分析,数据以误差条图或均数±标准差表示。仔鼠体重和逃避潜伏期采用重复测量方差分析 (repeated measures),其余指标采用单因素方差分析 (one-way-ANOVA)。组间比较,方差齐性时采用SNK (student-newman-keuls) 法;方差不齐时,采用games-howell检验。采用析因设计方差分析判断是否存在交互作用,并分析二者交互作用的类型,当|(氟化钠+氯化铝组指标—对照组指标)| > |(氟化钠组指标—对照组指标)|+|(氯化铝组指标—对照组指标)|时,可判定交互作用的类型为协同;当|(氟化钠+氯化铝组指标—对照组指标)| < |(氟化钠组指标—对照组指标)|+|(氯化铝组指标—对照组指标)|时,可判定交互作用的类型为拮抗[11]。P < 0.05表示差异有统计学意义。
2 结果 2.1 仔鼠的尿氟、尿铝质量浓度与对照组比较,单独氟和氟铝联合暴露各组仔鼠尿氟浓度升高 (P < 0.05);单独铝和氟铝联合暴露各组仔鼠尿铝浓度升高 (P < 0.05);低氟与低氟+低铝、低氟+高铝组相比;高氟与高氟+低铝、高氟+高铝组相比,仔鼠的尿氟质量浓度值随着染铝质量浓度增加而逐渐升高 (表 2)。氟铝联合对仔鼠尿铝的影响未见交互作用 (F=0.768,P > 0.05),对仔鼠尿氟的影响存在协同型交互作用 (F=3.554,P < 0.05)。
| 组别 | 尿氟/(mg/L) | 尿铝/(μg/L) |
| 对照 | 2.89±0.81 | 0.60±0.07 |
| 低氟 | 13.31±1.05a | 0.65±0.06 |
| 高氟 | 19.77±0.88ab | 0.67±0.11 |
| 低铝 | 4.16±0.48 | 8.12±0.02a |
| 高铝 | 3.05±0.23 | 14.16±0.17ac |
| 低氟低铝 | 17.22±1.79a | 8.13±0.04a |
| 低氟高铝 | 19.26±0.74a | 13.94±0.05a |
| 高氟低铝 | 23.99±1.95a | 8.18±0.11a |
| 高氟高铝 | 25.00±2.98a | 14.08±0.34ad |
| 注:a与对照组比较,P < 0.05;b与低氟组比较,P < 0.05;c与低铝组比较,P < 0.05;d与低氟+低铝组比较,P < 0.05;n=12 | ||
2.2 仔鼠脑重系数及脑氟、铝情况
与对照组比较,染毒组仔鼠脑重系数差异无统计意义;单独染氟组和氟铝联合组仔鼠脑氟含量升高 (P < 0.05);单独染铝组和氟铝联合组仔鼠脑铝含量增加 (P < 0.05)。染氟剂量相同的不同组仔鼠脑氟质量浓度值随着染铝剂量的增加而逐渐减少 (P < 0.05)。氟铝联合对仔鼠脑氟、脑铝的毒效应为略低于氟、铝单独的毒效应之和,表现为拮抗型交互作用 (F值分别为:2.692,3.535,P < 0.05;表 3)。
| 组别 | 脑重系数/ (×10-3 g/100 g·BW) |
脑氟/ (μg/g) |
脑铝/ (μg/g) |
| 对照 | 6.35±0.30 | 1.30±0.38 | 8.24±0.53 |
| 低氟 | 6.11±0.62 | 7.46±2.89a | 9.62±1.29 |
| 高氟 | 5.77±0.87 | 13.44±2.26ab | 9.91±1.17 |
| 低铝 | 5.68±0.67 | 1.39±0.22 | 10.48±0.43a |
| 高铝 | 5.62±0.35 | 2.29±0.64 | 15.36±0.40ac |
| 低氟低铝 | 5.81±0.56 | 4.43±0.54a | 10.43±0.59a |
| 低氟高铝 | 5.82±0.66 | 5.20±0.77a | 14.55±0.92a |
| 高氟低铝 | 5.89±0.42 | 11.89±3.08a | 10.55±0.92a |
| 高氟高铝 | 6.25±2.16 | 11.48±1.82ad | 15.95±0.39ad |
| 注:a与对照组比较,P < 0.05;b与低氟组比较,P < 0.05;c与低铝组比较,P < 0.05;d与低氟+低铝组比较,P < 0.05;n=12 | |||
2.3 仔鼠海马HE染色结果
对照组神经元体积正常、排列均匀。各染毒组仔鼠海马CA3区神经元出现不同程度损伤,表现为细胞排列紊乱、体积增大,胞质疏松淡染及细胞水肿,细胞出现空泡样变性。随染毒浓度的增加,以上现象加重,并出现神经元结构模糊、细胞核及核仁消失等现象 (图 1)。由此可知,随着氟、铝染毒浓度的增加,仔鼠海马CA3区病理损伤逐渐加重。
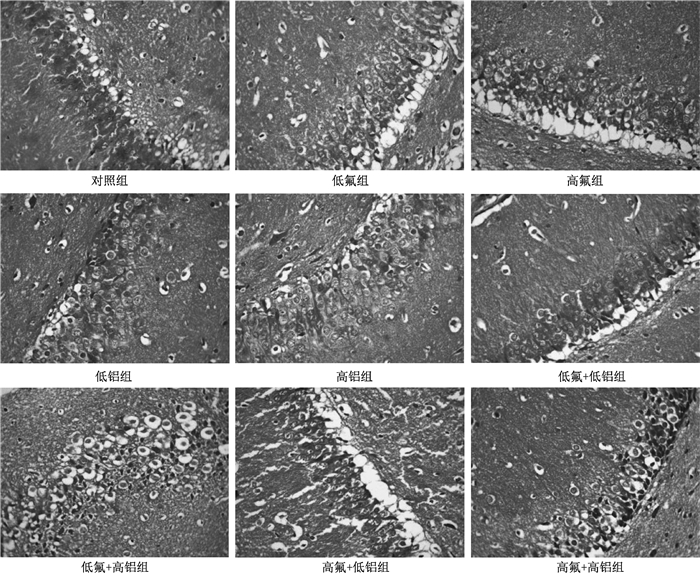
|
| 图 1 各实验组仔鼠海马CA3区病理结果 (HE×400) |
2.4 Morris水迷宫实验结果 2.4.1 仔鼠定位航行实验结果
与对照组比较,第1、2和3天,除低氟组、低铝组及低氟低铝组外,其余各染毒组仔鼠的逃避潜伏期均延长 (P < 0.05);第4天,各染毒组仔鼠的逃避潜伏期均延长 (P < 0.05)。训练次数越少及氟、铝染毒质量浓度越高,仔鼠的逃避潜伏呈延长的趋势。氟铝联合对仔鼠逃避潜伏期的毒效应略低于氟、铝单独的毒效应之和,表现为拮抗型交互作用 (F=7.521,P < 0.05;图 2)。

|
| 注:a与对照组比较,P < 0.05 图 2 氟铝联合对仔鼠逃避潜伏期的影响 |
2.4.2 仔鼠空间探索实验结果
与对照组比较,除低氟组、低氟+低铝组外,其余各染毒组仔鼠的首次达平台时间均延长,差异均有统计学意义 (P < 0.05);各染毒组仔鼠的穿越平台次数均减少,差异均有统计学意义 (P < 0.05)。且随着氟、铝染毒质量浓度的升高,仔鼠的首次达台时间呈延长的趋势,穿越平台次数呈减少的趋势。
氟和铝联合染毒对仔鼠首次达平台时间的影响未见交互作用 (P > 0.05);氟铝联合对仔鼠穿越平台次数的毒效应略低于氟、铝单独染毒的毒效应之和,表现为拮抗型交互作用 (F=4.961,P < 0.05;表 4)。
| 组别 | 首次达台时间/s | 穿越平台次数/次 |
| 对照 | 5.83±2.27 | 4.50±1.95 |
| 低氟 | 11.35±2.89 | 2.71±0.76a |
| 高氟 | 22.89±8.73a | 1.88±0.84a |
| 低铝 | 13.65±9.46a | 2.44±1.01a |
| 高铝 | 27.90±5.01a | 1.38±0.74a |
| 低氟低铝 | 10.05±1.52 | 2.83±0.41a |
| 低氟高铝 | 23.63±5.13a | 1.25±0.46a |
| 高氟低铝 | 27.57±5.93a | 1.38±0.74a |
| 高氟高铝 | 34.41±6.19a | 0.56±0.53a |
| 注:a与对照组比较,P < 0.05 | ||
2.5 仔鼠海马氨基酸类神经递质的水平
与对照组比较,各染毒组仔鼠海马区Glu、Asp浓度降低 (P < 0.05);除低氟+低铝、低氟+高铝组外,各染毒组GABA浓度上升 (P < 0.05);各染毒组Gly浓度差异无统计学意义。组间比较,低氟+低铝组较低氟组Glu浓度升高 (P < 0.05);低氟+低铝、低氟+高铝组海马的GABA浓度较低氟组降低 (P < 0.05)。氟铝联合对仔鼠海马区Gly、Asp浓度的影响未见交互作用 (P < 0.05);氟铝联合对仔鼠海马区Glu、GABA毒效应略低于氟、铝单独染毒的毒效应之和,表现为拮抗型交互作用 (F分别为18.996,36.274,P < 0.05;图 3)。

|
| 注:a与对照组比较,P < 0.05;b与低氟组比较,P < 0.05;c与低铝组比较,P < 0.05;d与低氟+低铝组比较,P < 0.05;n=12 图 3 氟铝联合对仔鼠海马氨基酸类神经递质浓度的影响 |
3 讨论
出生前后是中枢神经系统发育的关键时期。海马是认知功能相关的重要脑区,是学习记忆的高级中枢。神经递质与相关受体结合完成神经元间的突触联接,构成脑内复杂的传递网络,完成包括学习和记忆在内的复杂生理功能[12]。氨基酸类神经递质包括兴奋性氨基酸和抑制性氨基酸,二者保持平衡,才能维持正常的学习记忆能力。前者主要包括Glu和Asp,通过与G蛋白介导的谷氨酸受体及NDMN受体选择性结合,引起Ca2+通道开放,使突触后膜Ca2+内流增加,从而参与LTP的产生和维持;后者主要包括Gly和GABA,其中GABA是最主要的抑制性神经递质。GABA在体内由谷氨酰胺 (Gln) 在谷氨酸脱羧酶 (GAD) 作用下合成,通过GABA转运体从突触中释放,由GABA受体接受,引发神经元超极化,产生抑制性效应[13]。在LTP诱导阶段可以通过GABA自身磷酸化作用降低对NMDA受体的抑制作用,从而促进NMDA受体的活化促进大量Ca2+内流,触发LTP的产生。GABA的抑制作用与Glu的兴奋作用达到平衡,有利于突触可塑性的维持[8]。
与对照组比较,随着氟、铝染毒质量浓度的增加,仔鼠海马CA3区病理损伤加重;单独氟和氟铝联合暴露各组仔鼠尿氟质量浓度明显升高,单独铝和氟铝联合暴露各组仔鼠尿铝质量浓度明显升高;氟铝联合暴露组仔鼠逃避潜伏期延长及穿越平台次数明显减少;各染毒组仔鼠海马区Glu、Asp含量明显降低;除低氟+低铝、低氟+高铝组外,GABA含量明显上升。氟铝联合对仔鼠尿氟的影响存在协同型交互作用,对逃避潜伏期延长及穿越平台次数,脑皮质氟、铝,海马Glu、GABA含量的影响均表现为拮抗型交互作用,但差值较小。提示出生前后氟、铝单独及联合染毒,经胎盘、乳汁途径导致染毒组仔鼠体内毒物负荷增加[14],学习记忆的重要脑区海马CA3区出现病理损伤;对空间位置感和方向感 (空间定位) 的学习记忆能力下降;兴奋性神经递质Glu、Asp含量降低,抑制性氨基酸神经递质GABA升高,可能引起神经元突触稳定性和可塑性失衡,导致LTP的产生和维持受影响[8],是氟铝联合损害仔鼠空间学习记忆的机制之一。
既往研究表明,铝可促进体内氟的排泄[15],与本研究中氟铝联合对仔鼠尿氟的影响存在协同型交互作用一致。此外,一定量的氟可提高机体吸收铝的比率[16],本研究中氟铝联合后对部分学习记忆指标显示出轻微拮抗作用,但未见尿铝排泄明显升高。本研究剂量设定较为单一,染毒时间仅包括胚胎期、哺乳期和成年前,仔鼠经饮水直接染毒时间较短,结果仅初步反映氟铝联合对仔鼠样品作用情况。鉴于铝是公认的神经毒物,长期毒性为渐进性大脑损伤甚至死亡,故延长染毒时间和不同剂量比例的氟铝联合对神经系统毒作用类型和氟铝联合染毒后毒物在体内的分布、排泄及脑损伤敏感指标的变化及机制有待深入研究。
| [1] | Poureslami HR, Horri A, Khoramian S, et al. Intelligence quotient of 7 to 9 year-old children from an area with high fluoride in drinking water[J]. J of Dentistry and Oral Hyg, 2011, 3(4): 61–63. |
| [2] | 潘宝龙, 牛侨, 张玲. 慢性铝暴露对大鼠学习记忆及脑源神经生长因子的影响[J]. 中华劳动卫生职业病杂志, 2013, 3(10): 740–743. doi: 10.3760/cma.j.issn.1001-9391.2013.10.005 |
| [3] | 牛侨. 铝的神经毒性[C]. 第十次全国劳动卫生与职业病学术会议论文集, 杭州: 中华预防医学会, 2009, 26-28. |
| [4] | 王大宁. 氟中毒脑损伤机制研究进展[J]. 国外医学卫生学分册, 2006, 33(3): 135–139. |
| [5] | 白静, 刘庆斌. 砖茶型氟铝联合中毒大鼠学习记忆障碍及脑组织生长抑素的变化[J]. 中国地方病防治学杂志, 2010, 25(3): 161–163. |
| [6] | Guzmán-Ramos K, Osorio-Gómez D, Moreno-Castilla P, et al. Post-acquisition release of glutamate and norepinephrine in the amygdala is involved in taste-aversion memory consolidation[J]. Learning & Memory, 2012, 19(6): 231–238. |
| [7] | Rahn KA, Slusher BS, Kaplin AI. Glutamate in CNS neurodegeneration and cognition and its regulation by GCPII inhibition[J]. Current Medicinal Chemistry, 2012, 19(9): 1335–1345. doi: 10.2174/092986712799462649 |
| [8] | 程淑群, 王应雄, 夏茵茵, 等. 苯并[a]芘对大鼠学习记忆能力及氨基酸类神经递质的影响[J]. 现代预防医学, 2012, 39(003): 670–671. |
| [9] | 张婷, 张占伟, 董克, 等. 淫羊藿甙对P8系快速老化小鼠记忆障碍的改善作用[J]. 中国老年学杂志, 2013, 33(4): 870–871. |
| [10] | 原中华人民共和国卫生部. WS/T 30-1996尿中氟的离子选择电极测定方法[S]. 北京: 中国标准出版社, 1996. |
| [11] | 李奕. 长期饮用F、Al高浓度茶水对SD大鼠海马结构和功能的影响[D]. 中南大学2006届学位硕士论文. |
| [12] | 孙成峰. 微波辐射致大鼠海马组织差异表达的microRNA与学习记忆关系的研究[D]. 安徽医科大学硕士学位论文, 2013. |
| [13] | 欧超燕, 黄明立, 姜岳明, 等. 对氨基水杨酸钠对染锰大鼠基底核氨基酸类神经递质含量的影响[J]. 中华预防医学杂志, 2011, 45(5): 422–425. |
| [14] | 王鸿, 原福胜, 高俊宏, 等. 甲醛和甲苯联合染毒致小鼠脑细胞DNA损伤的研究[J]. 环境与健康杂志, 2012, 29(12): 1085–1087. |
| [15] | Rao T, Kumari P, Yadav A, et al. Aluminium uptake by some foods from the aluminium cookware during cooking and effect of fluoride on the uptake[J]. Der Pharma Chemica, 2014, 6(3): 1–5. |
| [16] | 裴俊瑞, 李丙云, 高彦辉, 等. 铝对氟中毒小鼠斑状脱毛的保护作用[J]. 中华地方病学杂志, 2013, 32(2): 136–139. |



