2. 北京建工环境修复股份有限公司, 污染场地安全修复国家工程实验室, 北京 100015
2. National Engineering Laboratory for Site Remediation Technologies, Beijing Construction Engineering Group Environmental Remediation Co., Ltd, Beijing 100015
中国是世界铬化工第一生产大国, 在电镀、印染、医药、氧化剂、合成橡胶等工业生产中, 铬盐是重要的原料.但因历史原因, 铬盐生产过程中大量铬渣以简单堆放的方式处置, 防雨防渗设施不到位造成周边地区土壤及地下水污染(王兴润等, 2020).研究表明, 中国耕地土壤中铬含量为0.05~3353.60 mg · kg-1, 平均铬含量为78.94 mg · kg-1, 明显高于其背景值(57.30 mg · kg-1), 说明人类活动已将其引入土壤环境(Zhang et al., 2016).首次全国土壤污染状况调查结果显示, 铬的点位超标率为1.1%.污染土壤中铬的主要存在形式为Cr(Ⅲ)和Cr(Ⅵ), 其中, Cr(Ⅵ)通常以含氧阴离子(如HCrO4-和CrO42-等)形式存在, 土壤对其吸附能力较弱, 很容易迁移到土壤和地下水中(Shahid et al., 2017).研究表明, Cr(Ⅵ)的毒性是Cr(Ⅲ)的100倍(Su et al., 2016), 且Cr(Ⅵ)易被人体吸收, 长期接触可能致癌, 美国环境保护局将Cr(Ⅵ)列为A类致癌物质.相较而言, Cr(Ⅲ)则倾向于在弱酸性和碱性环境中吸附在土壤表面或以Cr(OH)3的形式沉淀, 迁移性较弱.
基于将高毒性、迁移性强的Cr(Ⅵ)转化成低毒性、迁移性弱的Cr(Ⅲ)和直接将铬从土壤中去除两种思路, 科研人员提出了化学还原技术(Palma et al., 2015)、化学淋洗技术(李明等, 2018)、电动力学修复技术(李敏等, 2020)、生物修复技术(Tariq et al., 2019)等多种铬污染场地修复技术.其中, 化学还原技术因成本低、效率高等优势是目前技术最成熟、体系最完善、工程应用最广泛的铬污染土壤修复方法.国内铬污染场地修复大部分采用化学还原技术, 常见的还原剂有铁系还原剂(如Fe0、亚铁类还原剂)、硫系还原剂(如H2S、FeSx、硫代硫酸盐和多硫化合物等)和一些还原性有机物(如富里酸和腐殖质) (郑建中等, 2015;刘馥雯等, 2019).在铁系还原剂中, 硫酸亚铁因其还原效率较高和廉价易得等优点应用较多, Fe(Ⅱ)除可将Cr(Ⅵ)还原为Cr(Ⅲ)外, 氧化还原反应产物Fe(Ⅲ)还可与土壤中的氢氧根离子形成Fe(OH)3胶体, 对土壤中的Cr(Ⅵ)进行吸附(尹贞等, 2016), 从而降低土壤中铬的毒性和迁移性.黄莹等(2015)使用硫酸亚铁对某化工企业遗留铬渣堆存场中的表层高Cr(Ⅵ)浓度的渣土混合物进行化学还原, 还原率达到99%以上, 还原效果显著.但大量研究表明, 硫酸亚铁的投加量普遍高于理论值Fe(Ⅱ)/Cr(Ⅵ)=3:1(物质的量比), 在还原Cr(Ⅵ)的同时可能会改变土壤理化性质, 过量投加容易造成二次污染.
化学还原技术常常与稳定化技术结合使用, 通过还原与稳定化药剂复配或化学还原与微生物稳定化技术联用等方式修复铬污染土壤(郑家传等, 2014;张辉等, 2017), 以达到减少化学药剂投加量、减轻还原剂对土壤的影响等绿色修复的目的.沼渣是厌氧发酵的残余物, 其中含有大量有机质、腐殖酸、还原性物质及微生物(Insam et al., 2015).有研究报道, 使用沼渣可以有效降低铬污染土壤中的重金属可利用性, 同时提高土壤的养分水平和微生物多样性, 具有成本效益的潜力(Insam et al., 2015), 但其单独应用时Cr(Ⅵ)的还原能力十分有限.目前, 已有研究将餐厨垃圾和污泥等多种有机废物复合使用用于铬污染土壤修复(金春姬等, 2011;刘帅霞等, 2017).研究表明, 有机废物可加速六价铬的化学还原效率, 提高六价铬的修复效果.然而, 有关沼渣协同硫酸亚铁对Cr(Ⅵ)污染土壤的修复效果尚未见相关报道.
基于此, 本文通过室内模拟实验, 研究沼渣协同硫酸亚铁对Cr(Ⅵ)污染土壤的修复效果, 利用Design-expert软件中响应面分析法对影响Cr(Ⅵ)修复效率的主要因素进行优化并获取Cr(Ⅵ)最佳修复参数, 通过连续提取实验和仪器分析来揭示沼渣+硫酸亚铁修复过程中铬的价态变化和形态变化, 进一步通过小白菜毒性实验来评价土壤修复前后潜在的植物毒性, 通过高通量分析土壤中细菌群落的变化特征.
2 材料与方法(Materials and methods) 2.1 实验土壤实验所用土壤为未受污染的农田土壤, 经自然风干, 将大颗粒土壤进行研磨, 过10目筛备用, 土壤含水率为5.7%, pH值为8.71, 电导率为312 μS · cm-1, Cr(Ⅵ)含量为1.01 mg · kg-1, 有机质为2.5%.实验所用含Cr(Ⅵ)土壤为模拟土, 使用重铬酸钾溶液配制Cr(Ⅵ)含量约为1000 mg · kg-1的土壤, 搅拌均匀后自然风干1周, 研磨并过10目筛备用.实验所用沼渣取自青岛十方生物科技有限公司, 沼渣含水率为54%, pH值为8.85, 电导率为3.69 mS · cm-1, Cr(Ⅵ)含量为0.28 mg · kg-1, 有机质为26.9%.
2.2 稳定化实验稳定化实验设4个实验组, 第1组为对照组, 不添加任何修复材料, 加入去离子水调节土壤含水率为30%;第2组为硫酸亚铁处理组, 按Fe(Ⅱ)与Cr(Ⅵ)物质的量比3:1(即n(Fe(Ⅱ)) :n(Cr(Ⅵ))= 3:1)投加硫酸亚铁, 调节土壤含水率为30%;第3组为沼渣处理组, 按质量比为5%(干基)添加沼渣, 调节土壤含水率为30%;第4组为沼渣+硫酸亚铁处理组, 按n(Fe(Ⅱ)) :n(Cr(Ⅵ))=3:1投加硫酸亚铁, 同时投加5%的沼渣(干基), 调节相同的含水率.土壤样品搅拌均匀后装入塑料密封盒中, 置于培养箱30 ℃恒温培养, 分别在2 h、4 h、8 h、24 h、2 d、3 d、4 d、6 d、8 d、10 d、15 d、20 d取样, 测定土壤Cr(Ⅵ)含量并计算Cr(Ⅵ)稳定化效率.此外, 考察了含水率、Fe(Ⅱ)/Cr(Ⅵ)物质的量比和沼渣添加量对Cr(Ⅵ)稳定化效果的影响, 设置不同参数水平进行稳定化实验.分别调节含水率为25%、30%、35%、40%和45%(其中n(Fe(Ⅱ)) :n(Cr(Ⅵ))=3:1, 沼渣(干基)投加量为4%), Fe(Ⅱ)/Cr(Ⅵ)物质的量比分别为2:1、2.5:1、3:1、3.5:1和4:1(其中含水率为35%, 沼渣(干基)投加量为4%), 以及沼渣投加量分别为1%、2%、4%、6%和8%(其中含水率为35%, n(Fe(Ⅱ)) :n(Cr(Ⅵ))=3:1), 置于30 ℃恒温培养, 分别在2、12和60 d取样, 测定土壤Cr(Ⅵ)含量并计算Cr(Ⅵ)稳定化效率.
2.3 形态分析基于BCR四步连续提取法, 可将土壤中铬分为酸溶态、可还原态、可氧化态和残渣态.对不同稳定化处理样品, 冷冻干燥后研磨过100目筛, 待用.形态分析时, 取0.50 g土壤样品于离心管, 按以下操作进行分步提取:①F1酸溶态:加入0.11 mol · L-1 HAc溶液20 mL, 室温下连续振荡16 h, 取上清液分析;②F2可还原态(Fe-Mn氧化态):加入0.5 mol · L-1 NH2OH · HCl溶液20 mL(pH=2), 在室温下连续振荡16 h, 取上清液分析;③F3可氧化态(有机结合态):加入30% H2O2溶液5 mL(pH=2~3), 85 ℃水浴消解1 h, 间隔振荡, 再加入30% H2O2溶液5 mL(pH=2~3), 85 ℃水浴消解1 h, 间隔振荡, 冷却后加入1 mol · L-1 NH4OAc溶液25 mL, 在室温下连续振荡16 h, 取上清液分析;④F4残渣态:微波消解2 h, 取上清液分析.
2.4 风险评估由Perin等(1985)提出的风险评价编码法(RAC)是一种常用的基于重金属形态进行风险评估的手段.RAC以F1形态存在的重金属百分比评估重金属的风险等级, 因为这部分重金属具有较高的生物可利用性, 计算公式见式(1).
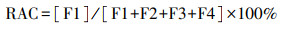
|
(1) |
风险评价(RAC)分为以下5个等级: 无风险(RAC < 1%)、低风险(1% < RAC < 10%)、中风险(11% < RAC < 30%)、高风险(31% < RAC < 50%)、非常高风险(RAC>50%)(宋宜等, 2020).
2.5 XPS分析将土壤样品在X射线光电子能谱仪上进行测定, 对土壤中C、O、Fe和Cr进行分析.X射线激发源为单色Al Kα, X射线束斑400 μm, 能量分析器透过能为30 eV.采用CasaXPS软件拟合XPS光谱.
2.6 植物毒性取不同处理下稳定化处理的土壤样品, 经自然风干后, 研磨过10目筛, 取5 g土壤样品于干燥的50 mL锥形瓶中, 加入25 mL去离子水, 振荡1~2 min, 静置5~10 min后取上清液过0.45 μm滤膜, 得到土壤浸出液, 进行种子发芽实验.每处理25粒小白菜种子, 重复3次, 取各处理土壤浸出液5 mL加入培养皿, 另加一组去离子水做对照, 放置于25 ℃培养箱内, 恒温培养56 h后, 观察种子的生长状况, 分别计量种子的发芽数, 测量种子根长, 并根据所测得数据计算种子发芽率(SG)、种子相对根长(RRG)和种子发芽指数(GI), 计算公式见式(2)~(4).
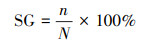
|
(2) |

|
(3) |
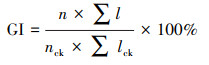
|
(4) |
式中, n为处理组正常发芽粒数, nck为对照组正常发芽粒数, N为供试种子数;l为处理组种子根长, lck为对照组种子根长.
2.7 细菌群落特征对不同处理下的土壤进行DNA提取, DNA提取使用MoBio PowerSoil® DNA分离试剂盒(MoBio, Carlsbad, CA, USA), 提取后检测DNA样品的浓度和纯度, 对细菌16S rDNA基因V3~V4区域进行PCR扩增.扩增所用引物:341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTA CHVGGGTATCTAATCC-3′).扩增过程:94 ℃预变性3 min;94 ℃变性30 s, 45 ℃退火20 s, 65 ℃延长30 s, 5个周期;94 ℃变性20 s, 55 ℃退火20 s, 72 ℃延长30 s, 20个周期.
对基因测序所得序列按97%相似性归于各操作分类单元(OTU), 通过稀释性曲线、Shannon、Coverage、Chao1等指数进行土壤细菌群落的物种丰度及多样性分析.
2.8 分析方法土壤中总Cr测定参照标准HJ 491—2009;Cr(Ⅵ)测定参照标准HJ 1082—2019及GB/T 15555.4—1995;土壤pH值测定参照标准NY/T 1377—2007;土壤含水率测定参照标准HJ 613—2011;土壤电导率测定参照标准HJ 802—2016;土壤有机质测定参照标准HJ 761—2015.
3 结果与讨论(Results and discussion) 3.1 稳定化效率不同处理组中Cr(Ⅵ)的稳定化效率随时间的变化如图 1所示.在实验过程中, 对照组Cr(Ⅵ)的稳定化效率基本维持在10%左右, 且在整个实验过程中保持稳定.投加硫酸亚铁时, 2 h内土壤中Cr(Ⅵ)的稳定化效率达到92.27%, 随后基本保持不变, 可见硫酸亚铁对Cr(Ⅵ)的还原作用主要发生在短期内, 其没有持续的还原能力.投加沼渣时, Cr(Ⅵ)的稳定化效率随着反应时间的延长而显著增加, 但其本身对Cr(Ⅵ)的稳定化效率十分有限, 反应20 d时Cr(Ⅵ)的稳定化效率仅为43.88%.相比而言, 沼渣和硫酸亚铁复合使用时, 能够较两者单独使用时提高Cr(Ⅵ)的稳定化效率, 且表现出持续还原能力, 当稳定化反应20 d后Cr(Ⅵ)的稳定化效率为97.62%, 此时, Cr(Ⅵ)的残余含量仅为22.38 mg · kg-1.通过稳定化实验可以看出, 硫酸亚铁和沼渣复合投加修复铬污染土壤时, 沼渣可以加速Cr(Ⅵ)的还原速率, 提高Cr(Ⅵ)的稳定化效率, 这可能是因为沼渣中含有还原性物质及可为微生物还原Cr(Ⅵ)提供电子和碳源的有机物, 且加入沼渣后, 土壤氧化还原电位降低, 利于Cr(Ⅵ)的还原(Song et al., 2019).
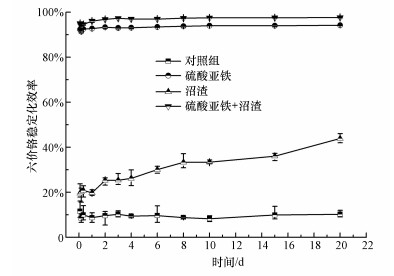 |
| 图 1 不同处理时土壤中Cr(Ⅵ)的稳定化效率 Fig. 1 The stabilization efficiency of Cr(Ⅵ) in soil with different treatments |
不同含水率、Fe(Ⅱ)/Cr(Ⅵ)物质的量比和沼渣添加量对Cr(Ⅵ)稳定化效果的影响如表 1所示.在n(Fe(Ⅱ))/n(Cr(Ⅵ))=3:1, 沼渣添加量为4%条件下, 随着含水率的增加, Cr(Ⅵ)稳定化效率提升.含水率为40%和45%时, 12 d后土壤中Cr(Ⅵ)含量仅分别为5.3 mg · kg-1和3.7 mg · kg-1, 低于《土壤环境质量建设用地土壤污染风险管控标准》(GB36600—2018)中第二类用地筛选值5.7 mg · kg-1;60 d后土壤中Cr(Ⅵ)含量分别降至2.2 mg · kg-1和1.2 mg · kg-1, 仍满足修复要求.在含水率为35%, 沼渣添加量为4%条件下, n(Fe(Ⅱ))/n(Cr(Ⅵ))由2:1增加到2.5:1, Cr(Ⅵ)稳定化效率提高较为明显;n(Fe(Ⅱ))/n(Cr(Ⅵ))高于2.5:1时, Cr(Ⅵ)稳定化效率变化不大, 12 d后土壤中Cr(Ⅵ)含量均低于第二类用地筛选值.在n(Fe(Ⅱ))/n(Cr(Ⅵ))=3:1, 含水率为35%条件下, 随着沼渣添加量的增加, Cr(Ⅵ)稳定化效率有所提高.沼渣添加量不少于2%时, 12 d后土壤中Cr(Ⅵ)含量均低于第二类用地筛选值, 其中沼渣添加量达到8%时, 土壤中Cr(Ⅵ)含量已低于第一类用地筛选值.
| 表 1 不同因素条件下Cr(Ⅵ)残余量和稳定化效率 Table 1 The residual Cr(Ⅵ) content and stabilization efficiency with different conditions |
使用Design-expert 12统计学软件对不同参数水平下的Cr(Ⅵ)稳定化效率进行响应面分析, 探讨各因素之间的交互作用关系.图 2a为在反应12 d后, 沼渣添加量为4%(干基)时, Fe/Cr物质的量比(以下简称“Fe/Cr比”)与含水率变化对稳定化效率影响的响应图.由图可知, 当含水率一定时, 随着Fe/Cr比的增加, 响应值先增大后趋于平缓且有下降趋势, 而Fe/Cr比一定时, 含水率增加, 响应值逐渐增大.图 2b所示为Fe/Cr比为3:1时, 含水率与沼渣添加量变化对稳定化效率影响的响应图.可知当含水率或沼渣添加量一定时, 另一参数值增加, 响应值均逐渐增大.图 2c为含水率35%时, Fe/Cr比和沼渣添加量变化对稳定化效率影响的响应图. 由图可知, 当沼渣添加量一定时, Fe/Cr比增加, 响应值先增大后趋于平缓且有下降趋势, 而Fe/Cr比一定时, 沼渣添加量增加, 响应值逐渐增大.由图 2a、2b和2c下方的等高线图可知, 含水率与Fe/Cr比、含水率与沼渣添加量、Fe/Cr比与沼渣添加量之间均存在交互作用.此外, 通过响应面分析得出最佳的修复条件为:Fe/Cr比=3:1, 含水率为35%, 沼渣投加量为4.5%.在此条件下, Cr(Ⅵ)稳定化效率为99.85%, 残余六价铬含量为1.49 mg · kg-1, 符合第二类用地筛选值要求, 修复效果良好.
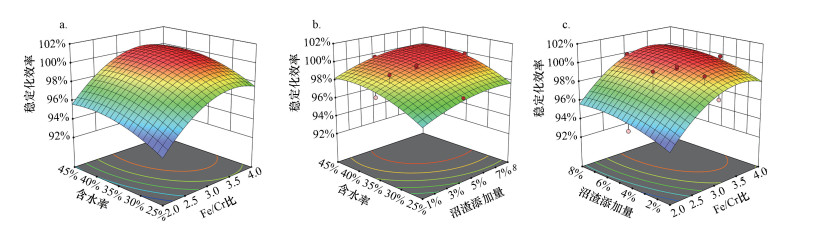 |
| 图 2 Fe/Cr比与含水率(a)、含水率与沼渣添加量(b)、Fe/Cr比与沼渣添加量(c) 对稳定化效率影响的响应曲面图 Fig. 2 RSM contour plot of effects of Fe/Cr ratio and water content(a), water content and biogas residue(b), Fe/Cr ratio and biogas residue(c) on the removal efficiency |
采用X射线光电子能谱技术高分辨率光谱对稳定化过程中Fe和Cr的价态进行分析表征, 利用Casa XPS软件对不同价态元素进行分峰拟合, 分析不同价态元素的相对含量, 结果如图 3所示.经硫酸亚铁处理后, 土壤中Cr(Ⅵ)和Cr(Ⅲ)的相对含量分别为91.49%和8.51%, 而Fe(Ⅲ)和Fe(Ⅱ)的相对含量分别为83.97%和16.03%, 说明大部分Fe(Ⅱ)参与Cr(Ⅵ)的还原反应, 被氧化为Fe(Ⅲ).沼渣处理后, 土壤中Cr(Ⅵ)和Cr(Ⅲ)的相对含量分别为60.92%和39.08%, 也就意味着仅有少部分Cr(Ⅵ)被沼渣还原.相比而言, 沼渣和硫酸亚铁协同处理时, Cr完全以Cr(Ⅲ)形式存在.这些结果表明, 沼渣和硫酸亚铁协同处理时能够加速Cr(Ⅵ)的还原, 进而提高Cr的稳定性.
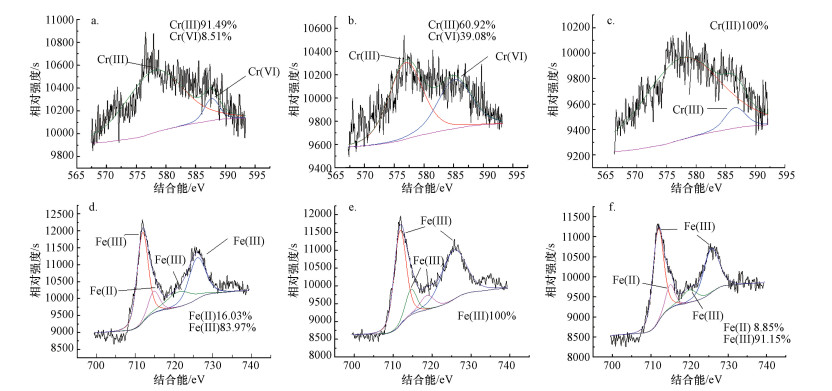 |
| 图 3 硫酸亚铁(a, d)、沼渣(b, e)、硫酸亚铁+沼渣(c, f) 处理组的Cr 2p (a~c)和Fe 2p (d~f) 的窄轨道谱图 Fig. 3 XPS narrow spectrum of Cr 2p (a~c) and Fe 2p (d~f) for FeSO4 treatment (a, d), biogas residue treatment (b, e) and FeSO4+ biogas residue treatment (c, f) |
不同处理下土壤中铬的结合形态如图 4所示.对照组处理2 d和20 d时酸溶态铬含量占比最高, 分别为82.19%和83.86%, 其次是残渣态(7.93%和11.30%)及可还原态(3.38%和4.16%)和可氧化态(3.13%和4.05%).经沼渣稳定化处理后, 酸溶态铬含量有所降低, 但其比例仍超过60%.经硫酸亚铁稳定化处理2 d和20 d后, 酸溶态含量分别降至3.48%和3.75%, 可还原态含量增至54.20%和60.30%, 可氧化态含量增至11.76%和11.81%, 残渣态含量增至24.13%和30.56%, 对Cr(Ⅵ)的稳定化起到关键作用.对于沼渣和硫酸亚铁复合处理2 d和20 d时, 酸溶态含量分别降至3.26%和3.65%, 同时残渣态含量增至19.57%和24.76%, 较单独硫酸亚铁处理有所增加, 这也就意味着沼渣和硫酸亚铁协同处理时, 能够增强Cr(Ⅵ)的稳定性.此外, 酸溶态Cr向更稳定的残渣态转变可能是因为Cr(Ⅵ)被还原为Cr(Ⅲ)后, Cr(Ⅲ)与Fe(Ⅲ)离子半径相似, 容易被吸附在Fe(OH)3表面, 而沼渣存在的情况下三价铬与沼渣中的S2-或有机质发生螯合作用, 使Cr趋向更稳定的形态转化.
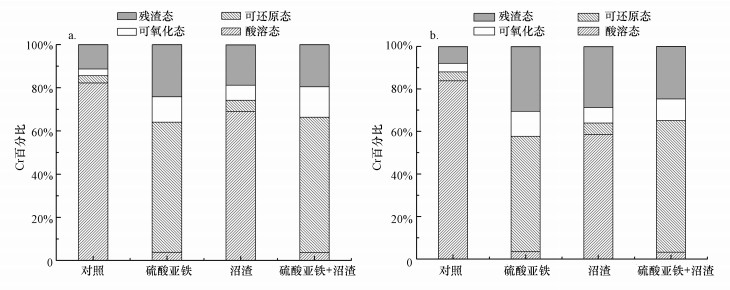 |
| 图 4 土壤中Cr的结合形态(a.2 d, b. 20 d) Fig. 4 The binding form of Cr in soil(a.2 d, b. 20 d) |
基于风险指数RAC数值的变化可表征污染土壤中铬的环境风险.由图 5可以看出, 反应2 d时, 对照组RAC值为82.19%, 处于高风险状态.反应时间延长至20 d时为83.86%, 未发生显著变化, 说明土壤高含量的六价铬对环境构成的风险非常高.经沼渣处理后RAC数值有所降低, 反应2 d和20 d时RAC数值分别为68.97%和58.60%, 仍处于非常高风险.经沼渣和硫酸亚铁复合处理后, 反应2 d和20 d时RAC数值分别降至3.65%和3.26%, 处于低风险.相比而言, 其数值均低于单独硫酸亚铁处理, 说明沼渣和硫酸亚铁协同处理时能够加速Cr(Ⅵ)的还原效率, 进一步降低土壤中Cr(Ⅵ)的环境风险.研究表明, 重金属的RAC变化与其赋存形态和价态变化密切相关.对比稳定化前后土壤中铬的赋存形态和风险指数变化, 沼渣和硫酸亚铁协同处理可快速还原Cr(Ⅵ)为Cr(Ⅲ), 显著提高铬的稳定性, 降低铬的环境风险.此外, 铬的结合形态由不稳定的酸溶态向更稳定的可还原态、可氧化态和残渣态转变, 形成更稳定的铁-铬复合氧化物(如CrxFe1-x(OH)3和CrxFe1-xOOH)或Cr(OH)3沉淀(Pan et al., 2014), 从而提高铬的稳定性和降低铬的环境风险指数.
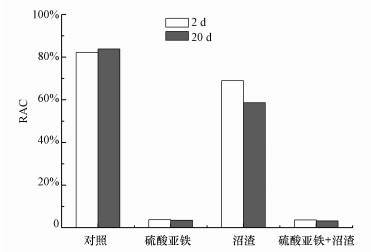 |
| 图 5 不同处理样品的RAC值变化 Fig. 5 The change of RAC with different treatments |
通过植物毒性实验观察不同处理后土壤样品对小白菜生长情况的影响.由图 6a可知, 4组稳定化处理土壤样品对小白菜种子的发芽率影响不大, 可见小白菜种子的发芽情况不受土壤中六价铬含量影响, 可能因为种子萌发阶段需要的养分可从胚内获取, 外界环境中的有毒有害物质对种子发芽的影响较小(宋玉芳等, 2002).由图 6b和6c可知, 不同处理时小白菜的相对根长和种子发芽指数存在显著差异, 对照组的小白菜相对根长和发芽指数数值均处于较低状态, 分别为8.98%和8.74%, 说明其受土壤中六价铬影响比较显著.相比种子萌发, 小白菜根部直接暴露在外界环境中, 毒性作用明显.投加硫酸亚铁和沼渣后, RRG和GI数值均显著提高, 分别为82.98%和79.60%.实验结果表明, 土壤中Cr(Ⅵ)含量较高时, 小白菜的植物毒性较为明显, 其对小白菜的生长有很强的抑制作用.相比而言, 硫酸亚铁+沼渣复合处理后, 高毒的六价铬已转化为低毒的三价铬, 减轻了其对小白菜生长的抑制作用.根据Baragaño等(2020)的研究, GI数值<50%处于高毒性, 50%~80%处于中等毒性, >80%为无毒.从这些研究结果可知, 经沼渣和硫酸亚铁复合处理后GI值为79.60%, 接近80%, 基本处于没有植物毒性状态.
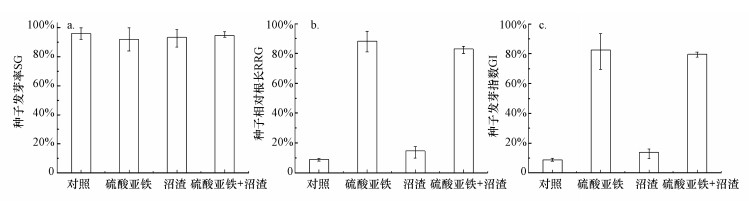 |
| 图 6 不同处理时小白菜种子发芽率(a)、种子相对根长(b) 及种子发芽指数(c) 变化 Fig. 6 Variations of seed germination rate (a), relative root length (b) and seed germination index (c) of Chinese cabbage under different treatments |
对不同处理组稳定化土壤样品进行高通量测序, 共得到241735条有效序列, 序列长度在353~475 bp之间, 按97%相似性归于各操作分类单元(OTU), 4组土壤样品所得OUT数目为107~201(表 2).通过对不同样品进行Alpha多样性分析可以反映细菌群落的丰度和多样性, 即Shannon、Chao1、Ace、Simpson和Coverage指数.不同处理组样品的覆盖率为1.0, 说明从土壤中得到的基因序列基本全部被检出, 测序结果能代表土壤中细菌群落的真实情况.经沼渣+硫酸亚铁复合处理的土壤样品的Shannon指数高于对照组, 而Simpson指数则低于对照组, 说明其稳定化处理后土壤细菌群落多样性显著提高.此外, Chao1和Ace指数是可用来估计群落中OUT数目的指数, 沼渣+硫酸亚铁复合处理组的Chao1和Ace指数均高于对照组, 说明物种数目增加.
| 表 2 不同处理时细菌α多样性指数变化 Table 2 The changes of alpha diversity index with different treatments |
不同处理土壤样品中细菌群落包括21个门、42个纲、69个目、144个科、249个属, 其中优势菌门(相对丰度>1%)和优势菌属(相对丰度>1%)的物种组成变化如图 7所示.由图 7a可知, 门水平上主要优势菌为变形菌门(Proteobacteria), 相对丰度为94.12%, 其次为厚壁菌门(Firmicutes)(2.41%)及拟杆菌门(Bacteroidetes)(1.63%).经稳定化处理后, 各组土壤样品中的细菌群落物种组成基本相似, 但变形菌门丰度有所降低, 其中, 沼渣和硫酸亚铁协同处理后其丰度降至87.22%, 这可能是因为其对Cr(Ⅵ)的耐性较高, 在较高的Cr(Ⅵ)浓度下得到了富集;此外, 厚壁菌门和拟杆菌门丰度略有增加.有研究表明, 土壤中变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)的丰度与铬浓度显著相关(于皓等, 2021).
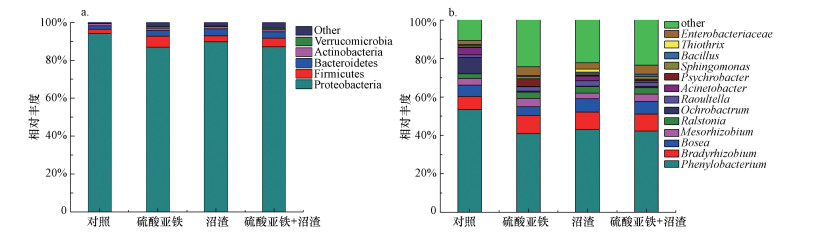 |
| 图 7 不同处理土壤中细菌群落在门(a)和属(b) 水平上的物种组成 Fig. 7 Composition of bacterial community on phylum(a) and genus(b) levels in soil |
由图 7b可知, 在属水平上, 对照组优势菌属主要为苯基杆菌属(Phenylobacterium)、大豆根瘤菌属(Bradyrhizobium)、Bosea菌属、中慢生根瘤菌属(Mesorhizobium)、拉乌尔菌属(Raoultella)、苍白杆菌属(Ochrobactrum)、青枯菌属(Ralstonia)、不动杆菌属(Acinetobacter)、嗜冷杆菌属(Psychrobacter)、鞘脂单胞菌属(Sphingomonas)、芽孢杆菌属(Bacillus)、丝硫细菌属(Thiothrix)等.与对照组相比, 沼渣和硫酸亚铁协同处理时苯基杆菌属和苍白杆菌属丰度明显降低, 分别为42.24%和0.57%, 可能是因为这两种菌属在铬污染土壤中得到富集.与之相反的是, 大豆根瘤菌属和拉乌尔菌属丰度略有增加, 分别为8.81%和3.34%, 这可能是因为这些细菌不能抵抗较高浓度的Cr(Ⅵ), 土壤中Cr(Ⅵ)含量较高时会抑制细菌的酶活性.有相关文献报道, 变形菌门中的鞘脂单胞菌属(Sphingomonas)、厚壁菌门中的芽孢杆菌属(Bacillus)(于皓等, 2021)、不动杆菌菌株Acinetobacter AB1有较强的耐铬能力(Essahale et al., 2012), 同时能够还原Cr(Ⅵ).
4 结论(Conclusions)1) 沼渣协同硫酸亚铁对土壤中Cr(Ⅵ)有良好的稳定化效果.通过响应面分析得出最佳修复条件为:Fe/Cr物质的量比为3:1, 含水率为35%, 沼渣投加量为4.5%.在此条件下, Cr(Ⅵ)稳定化效率为99.85%, 残余六价铬含量为1.49 mg · kg-1, 满足《土壤环境质量建设用地土壤污染风险管控标准》(GB 36600—2018)第二类用地筛选值5.7 mg · kg-1的限值要求.
2) 沼渣协同硫酸亚铁修复Cr(Ⅵ)污染土壤后, 酸溶态铬含量显著降低, 而可还原态、可氧化态和残渣态铬含量增加, 说明沼渣+硫酸亚铁复合使用能够有效提高土壤中铬的稳定性, 土壤铬的环境风险等级也由非常高风险降至低风险.
3) 沼渣与硫酸亚铁复合使用后小白菜的种子发芽指数由8.74%升高至79.60%, 其能够有效降低土壤的植物毒性, 减缓铬对植物生长的毒害作用.
4) 微生物多样性和群落结构分析可知, 沼渣+硫酸亚铁稳定化处理后土壤中Shannon和Chao1指数均显著增加, 细菌群落的丰度和多样性均增大.变形菌门丰度有所降低, 厚壁菌门和拟杆菌门丰度略有增加, 苯基杆菌属和苍白杆菌属丰度明显降低, 大豆根瘤菌属和拉乌尔菌属丰度略有增加.
Baragano D, Alonso J, Gallego J R, et al. 2020. Zero valent iron and goethite nanoparticles as new promising remediation techniques for As-polluted soils[J]. Chemosphere, 238(1): 124624. |
Comba S, Sethi R. 2009. Stabilization of highly concentrated suspensions of iron nanoparticles using shear-thinning gels of xanthan gum[J]. Water Research, 43(15): 3717-3726. |
Essahale A, Malki M, I Marín, et al. 2012. Hexavalent chromium reduction and accumulation by Acinetobacter AB1 isolated from fez tanneries in Morocco[J]. Indian Journal of Microbiology, 52(1): 48-53. |
Gheju M. 2011. Hexavalent chromium reduction with zero-valent iron (ZⅥ) in aquatic systems[J]. Water Air & Soil Pollution, 222(1/4): 103-148. |
黄莹, 徐民民, 李书鹏, 等. 2015. 还原稳定化法修复六价铬污染土壤的中试研究[J]. 环境工程学报, 9(2): 951-958. |
Insam H, Gómez-Brandón M, Ascher J. 2015. Manure-based biogas fermentation residues-Friend or foe of soil fertility?[J]. Soil Biology and Biochemistry, 84: 1-14. |
金春姬, 任娟, 田国宾, 等. 2011. 餐厨垃圾与铬污染土壤混合堆肥中铬形态的转化[J]. 环境工程学报, 5(1): 225-230. |
李敏, 孙照明, 马聪, 等. 2020. 以牺牲阳极强化的电化学联用方法修复铬污染土壤[J]. 环境工程, 38(9): 224-230. |
李明, 程寒飞, 安忠义, 等. 2018. 化学淋洗与生物质炭稳定化联合修复镉污染土壤[J]. 环境工程学报, 12(3): 904-913. |
刘馥雯, 罗启仕, 王漫莉, 等. 2019. 铬污染土壤稳定化处理对蚯蚓的毒性效应[J]. 环境科学学报, 39(3): 952-957. |
刘帅霞, 孙哲, 曹瑞雪. 2017. 秸秆-复合菌-污泥联合修复铬污染土壤技术[J]. 环境工程学报, 11(10): 5696-5702. |
Palma L D, Gueye M T, Petrucci E. 2015. Hexavalent chromium reduction in contaminated soil: A comparison between ferrous sulphate and nanoscale zero-valent iron[J]. Journal of Hazardous Materials, 281(1): 70-76. |
Pan J J, Jiang J, Xu R K. 2014. Removal of Cr(Ⅵ) from aqueous solutions by Na2SO3/FeSO4 combined with peanut straw biochar[J]. Chemosphere, 101(4): 71-76. |
Perin G, Craboledda L, Lucchese M, et al. 1985. Heavy metal speciation in the sediments of northern Adriatic Sea.A new approach for environmental toxicity determination[J]. Heavy Metals in the Environment, 2(1): 454-456. |
Shahid M, Shamshad S, Rafiq M, et al. 2017. Chromium speciation, bioavailability, uptake, toxicity and detoxification in soil-plant system: A review[J]. Chemosphere, 178(7): 513-533. |
宋宜, 王华伟, 吴雅静, 等. 2020. 三价铁促进生物氧化锰稳定土壤砷的效果和机制[J]. 环境科学学报, 40(4): 1460-1466. |
宋玉芳, 许华夏, 任丽萍, 等. 2002. 土壤重金属对白菜种子发芽与根伸长抑制的生态毒性效应[J]. 环境科学, 23(1): 103-107. |
Song Z L, Fang L C, Wang J, et al. 2019. Use of biogas solid residue from anaerobic digestion as an effective amendment to remediate Cr(Ⅵ)-contaminated soils[J]. Environmental Science and Pollution Research, 26(13): 13041-13053. |
Su H, Fang Z, Tsang P E, et al. 2016. Remediation of hexavalent chromium contaminated soil by biochar-supported zero-valent iron nanoparticles[J]. Journal of Hazardous Materials, 318: 533-540. |
Tariq M, Waseem M, Rasool M H, et al. 2019. Isolation and molecular characterization of the indigenous Staphylococcus aureus strain K1 with the ability to reduce hexavalent chromium for its application in bioremediation of metal-contaminated sites[J]. Peer J. DOI:10.7717/peerj.7726 |
王兴润, 李磊, 颜湘华, 等. 2020. 铬污染场地修复技术进展[J]. 环境工程, 38(6): 1-8+23. |
尹贞, 廖书林, 马强, 等. 2016. 几种稳定化药剂修复铬污染土壤的研究[J]. 环境工程, 34(5): 166-169. |
于皓, 安益君, 金德才, 等. 2021. 铬污染对土壤细菌群落结构及其构建机制的影响[J]. 环境科学, 42(3): 1197-1204. |
张辉, 付融冰, 郭小品, 等. 2017. 铬污染土壤的还原稳定化修复[J]. 环境工程学报, 11(11): 6163-6168. |
Zhang X Y, Zhong T Y, Liu L, et al. 2016. Chromium occurrences in arable soil and its influence on food production in China[J]. Environmental Earth Sciences, 75(3): 257. |
郑家传, 张建荣, 刘希雯, 等. 2014. 污染场地六价铬的还原和微生物稳定化研究[J]. 环境科学, 35(10): 3882-3887. |
郑建中, 石美, 李娟, 等. 2015. 化学还原固定化土壤地下水中六价铬的研究进展[J]. 环境工程学报, 9(7): 3077-3085. |
 2021, Vol. 41
2021, Vol. 41


