2. 中国农业科学院农业经济与发展研究所, 北京 100081
2. Institute of Agricultural Economics and Development, Chinese Academy of Agricultural Sciences, Beijing 100081
土壤作为农田生态系统的生存基质, 通过物理、化学和生物反应相互交织共同构成了复杂的元素循环体系(Amundson et al., 2015).土壤微生物被认为是影响元素循环的一个重要因素(Soong et al., 2018; Schleuss et al., 2019), 其中, 细菌是农田生态系统的一类重要微生物, 作为数量最多的微生物, 参与土壤有机质的合成与分解, 在土壤元素循环过程中发挥着重要作用(Liu et al., 2019).近年来, 围绕土壤细菌的研究已有一些报道, 诸如固氮细菌等自养型细菌对N的固定作用和对氨气等无机化合物的氨化作用(Kastl et al., 2015), 光合细菌对大气中CO2的吸收(Ge et al., 2013; Jian et al., 2016), 异养微生物以NO3-、SO42-为电子受体进行厌氧呼吸等(Tian et al., 2014).但以往大多数研究集中在单一土地利用类型生态系统, 对于轮作模式下其不同轮作期土壤微生物群落特征演变及其生态影响的比较研究较少.
碳(C)、氮(N)循环过程及其平衡关系是农田生态系统研究的关键科学问题, C、N既是农田土壤最基本的元素, 也是土壤质量评价和农田可持续利用的重要表征指标(马莉等, 2012), 如土壤有机碳含量是影响农田土壤肥力和作物产量高低的决定性因子, C/N可以表征土壤有机质的分解程度和土壤肥力状况(Chen et al., 2012).同时, C、N也是较为活跃的土壤组分, 影响着土壤与大气之间的元素平衡.温室气体CH4和N2O排放是当前研究的热点, 其中, 农田生态系统排放的CH4、N2O等温室气体约占人类活动排放总量的1/5, 在调节气候变化中发挥着重要作用(Lin et al., 2015; Weller et al., 2016).但在不同的轮作模式下, 诸如旱-旱和水-旱轮作模式下农田土壤TC、TN含量特征与温室气体排放的微生物调节作用仍鲜见报道.
合理的轮作方式是保证作物高产优质及农田土壤健康可持续的关键措施.有研究表明, 轮作模式能够促进土壤有机质积累, 进而提高土壤中微生物群落的多样性(Liu et al., 2015).尤其水-旱轮作在积累土壤有机质和提高土壤微生物活性方面特别显著, 相比于传统旱-旱轮作, 水-旱轮作土壤环境为好氧和厌氧条件交替, 土壤中C、N循环进程加速(Kong et al., 2005), 但不同轮作模式下轮作期的差异对土壤微生物群落及碳氮循环过程的影响及其耦合研究尚鲜见报道.
基于此, 本文通过研究传统旱-旱轮作及水-旱轮作下不同轮作期农田土壤细菌群落特征及其对土壤C、N含量和温室气体释放潜力的影响, 以期为农田轮作方式的选择及农业绿色发展提供科学指导.
2 研究区与研究方法(Study area and methods) 2.1 研究区与采样点研究区位于安徽省铜陵市, 属北亚热带湿润季风气候, 降水集中于6—8月.铜陵市全年日照充足, 无霜期长, 水资源丰富(冯长春等, 2014), 主要土壤类型为马干土和红壤, 是水稻、蔬菜和白姜的主要产区.依托铜陵市旱-旱轮作与水-旱轮作分布面积较广的典型区域为研究区, 其中, 姜-菜轮作模式(JC)采样点位于安徽省铜陵市郊区大通镇大院村(117°50′18″E, 30°53′0″N, JC采样点, 图 1), 该采样点为白姜和蔬菜轮作, 本研究分别选取该采样点姜季和菜季作为研究对象, 一般姜季和菜季轮作时间为2~3年.姜-菜轮作模式下菜季(JC-C)种植秋葵, 施肥措施为复合肥1500 kg·hm-2(N: P: K=18:18:18)、有机肥3750 kg·hm-2;姜-菜轮作模式下姜季(JC-J)施肥措施为复合肥2250 kg·hm-2(N: P: K比例为18:18:18)、有机肥5625 kg·hm-2.姜-稻轮作模式(JD)采样点位于安徽省铜陵市义安区西联镇山东村(117°50′24″E, 30°59′16″N, JD采样点, 图 1), 该采样点为白姜和水稻轮作, 本研究分别选取该采样点姜季和稻季作为研究对象, 一般姜季和稻季轮作时间为2~3年.姜-稻轮作模式下稻季(JD-D)施肥措施为复合肥750 kg·hm-2(N: P: K为16:16:16);姜-稻轮作模式下姜季(JD-J)施肥措施为复合肥450 kg·hm-2(N: P: K=16:16:16)、有机肥4875 kg·hm-2.该区域为探究旱-旱和水-旱轮作模式下不同轮作期土壤细菌群落多样性、碳氮含量及CH4、N2O排放潜力提供了理想的试验地.
 |
| 图 1 采样点示意图 Fig. 1 Location of sampling area |
于2020年8月采用空间代替时间法(侯栋梁等, 2016; 李小飞等, 2019), 采集轮作模式不同作物生长期土壤样品.具体为:在安徽省铜陵市郊区大通镇大院村采集姜-菜轮作模式下菜季和姜季的土壤样品, 在安徽省铜陵市义安区西联镇山东村采集姜-稻轮作模式下稻季和姜季的土壤样品.在8月采样时间, 姜季处于旺盛生长期, 蔬菜处于采收期, 水稻处于蜡熟期.按照S型采样法, 用长30 cm、直径5 cm的采土器采集表层0~20 cm深的土壤样品(耕层土壤), 每种处理采集3个重复, 装入自封袋, 用便携式冷藏箱带回实验室, 挑出植物残体后分成3份, 其中一份自然风干, 过100目筛后储存, 用于测定土壤TC、TN含量;另外两份分别存于4 ℃条件下用于土壤培养测定温室气体释放潜力和-20 ℃条件下用于土壤细菌的高通量测序.
2.3 土壤理化指标测定土壤容重采用环刀法测定(鲁如坤, 2000), 土壤含水量采用烘干法测定, 土壤pH采用pH计测定(Starter 300, USA), 水土质量比为2.5:1, 先振荡30 min后测定, 土壤电导率采用电导仪测定(2265FS, USA), 土壤全碳(TC)、全氮(TN)采用CN元素分析仪(Elementar Vario MAX CN, Germany)测定.
2.4 土壤CH4和N2O释放潜力测定本研究采用恒温鲜土培养, 分别称取4种处理鲜土各30 g, 水分条件模拟各处理原位鲜土, 不作外部水分调整, 置于120 mL培养瓶中, 将培养瓶密封后放于生化培养箱中20 ℃连续培养3 d, 培养期间每隔1 d抽取培养瓶上部空间气体5 mL进行浓度测定(仝川等, 2011; 汪旭明等, 2015).CH4和N2O浓度测定采用日本岛津气相色谱仪(日本岛津, GC-2010).释放潜力采用式(1)计算(Wassmann et al., 1998).
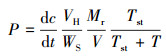
|
(1) |
式中, P为CH4和N2O释放潜力(μg·g-1·d-1), dc/dt为培养瓶内气相CH4和N2O浓度单位时间的变化(μg·g-1·d-1), VH为培养瓶内上部空间体积(L), WS为干土质量(g), Mr为CH4和N2O的相对分子质量(g), V为标准状态下1 mol气体的体积(L), Tst为标准温度(K), T为培养温度(K).
2.5 土壤细菌多样性及结构分析-高通量测序技术 2.5.1 DNA抽提和PCR扩增土壤细菌测定为3个重复, 根据E.Z.N.A.Ⓡ soil DNA kit (Omega Bio-tek, Norcross, GA, U.S.)说明书进行微生物群落总DNA抽提, 使用1%的琼脂糖凝胶电泳检测DNA的提取质量, 使用NanoDrop2000测定DNA浓度和纯度;使用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因V3~V4可变区进行PCR扩增, 扩增程序如下:95 ℃预变性3 min, 27个循环(95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s), 然后72 ℃稳定延伸10 min, 最后在4 ℃进行保存(PCR仪:ABI GeneAmpⓇ 9700型).PCR反应体系为:5×TransStart FastPfu缓冲液4 μL, 2.5 mmol·L-1 dNTPs 2 μL, 上游引物(5 μmol·L-1) 0.8 μL, 下游引物(5 μmol·L-1)0.8 μL, TransStart FastPfu DNA聚合酶0.4 μL, 模板DNA 10 ng, ddH2O补足至20 μL.
2.5.2 Illumina Miseq测序将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物, 利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City, CA, USA)进行回收产物纯化, 2%琼脂糖凝胶电泳检测, 并用QuantusTM Fluorometer (Promega, USA)对回收产物进行检测定量.使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific, 美国)进行建库:①接头链接;②使用磁珠筛选去除接头自连片段;③利用PCR扩增进行文库模板的富集;④磁珠回收PCR产物得到最终的文库.利用Illumina公司的Miseq PE300/NovaSeq PE250平台进行测序(上海美吉生物医药科技有限公司).
2.6 数据处理运用Excel 2016、Origin 2019、SPSS 20.0统计分析软件对测定数据进行整理和绘图.其中, 原始数据的平均值及标准误差的计算采用Microsoft Excel 2016分析, 土壤碳氮比(C/N)采用质量比.不同轮作模式下土壤TC、TN含量、CH4、N2O释放潜力和土壤细菌多样性指数差异采用SPSS 20.0中单因素方差分析(One-Way ANOVA).环境因子对土壤细菌群落结构的影响, 采用Canoco5.0软件中RDA分析, 环境因子对土壤细菌菌属的影响及细菌群落特征对TC、TN含量和CH4、N2O释放潜力的影响采用SPSS 20.0中Spearman相关性分析.微生物数据分析在交互式微生物多样性云分析平台完成(www.majorbio.com, 上海美吉生物科技有限公司).利用生物云平台的PICRUSt2软件预测不同轮作模式下土壤的细菌功能.
3 结果与分析(Results and analysis) 3.1 轮作模式下土壤TC、TN含量与C/N特征不同轮作模式对土壤TC、TN含量产生了不同的影响, 由图 2a可知, 在旱-旱轮作模式下, JC-C和JC-J土壤TC含量分别为(1.30±0.04)和(1.03±0.06) g·kg-1;在水-旱轮作模式下, JD-D和JD-J土壤TC含量分别为(1.24±0.10)和(1.01±0.04) g·kg-1, 两种轮作模式TC含量都表现为姜季<其他轮作(p < 0.05).图 2b显示, 在旱-旱轮作模式下, JC-C和JC-J土壤TN含量分别为(0.18±0.01)和(0.15±0.01) g·kg-1.在水-旱轮作模式下, JD-D和JD-J土壤TN含量分别为(0.18±0.01)和(0.18±0.01) g·kg-1.图 2c显示, 在旱-旱轮作模式下, JC-C和JC-J土壤C/N分别为7.13±0.05和6.94±0.17, 在水-旱轮作模式下, JD-D和JD-J土壤C/N分别为6.80±0.67和5.70±0.36.总体来看, 两种轮作模式下姜季相比于其他作物季TC、TN含量和C/N均表现为降低.其中, JC-J模式TC含量显著低于JC-C模式, JD-J模式TC含量显著低于JD-D模式(p < 0.05), JC-J模式TN含量显著低于JC-C模式(p < 0.05).
 |
| 图 2 不同轮作模式下土壤TC、TN含量及其计量比特征 Fig. 2 Soil C and N contents and their stoichiometric characteristics under different rotation patterns |
不同轮作模式对土壤CH4和N2O释放潜力产生了不同的影响, 由图 3可知, 在旱-旱和水-旱轮作模式下, 土壤CH4释放潜力表现为JD-D>JC-J>JC-C>JD-J, 且JC-D模式CH4释放潜力显著高于其他处理(p < 0.05).土壤N2O释放潜力表现为JC-C>JD-J>JD-D>JC-J, 不过4种处理N2O释放潜力差异不明显.
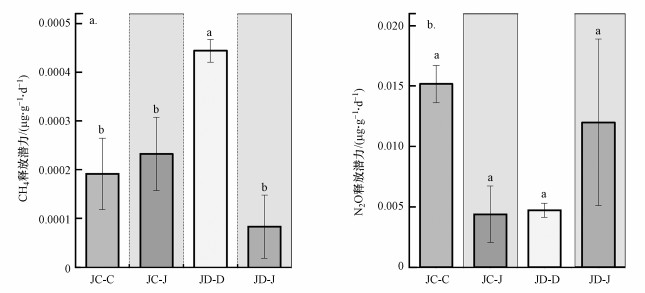 |
| 图 3 不同轮作模式下土壤CH4(a)和N2O(b)释放潜力 Fig. 3 Soil CH4(a) and N2O(b) release potential under different rotation patterns |
Alpha多样性表示一个特定区域或者某一生态系统的微生物多样性.不同轮作模式下土壤细菌群落α多样性指数特征如表 1所示, 各个土壤样品的文库覆盖率(Coverage)为99%, 表示土壤样品中基因序列被检测出来的概率极高, 本次的检测实验能够很好地表示土壤中细菌群落的真实情况.在旱-旱轮作模式中, JC-J模式Shannon、Ace和Chao指数均低于JC-C模式, 表示在旱-旱轮作模式下姜季降低了土壤细菌群落的多样性.在水-旱轮作模式中, JD-J模式Shannon、Ace和Chao指数均低于JD-D模式, 表明在水-旱轮作模式下姜季降低了土壤细菌群落的多样性.此外, JD-J模式Shannon、Ace和Chao指数均高于JC-J模式, 表明水-旱轮作模式下姜季土壤细菌多样性高于旱-旱轮作模式下姜季, 从多样性的视角来看, 水-旱轮作更有利于细菌多样性的维持.
| 表 1 不同轮作模式土壤细菌的多样性指数 Table 1 Diversity index of soil bacteria in different rotation patterns |
Beta多样性分析是指通过对不同处理的微生物群落之间进行组间比较分析, 来探讨不同处理土壤群落组成的相似性或者差异性.为了更为直观地分析不同轮作模式下土壤细菌群落结构, 绘制了主成分分析图(PCA)(图 4).如图 4所示, 共提取了两个主成分(PC1和PC2), 累计的方差贡献率为42.12%, 表明这两个主成分是造成不同轮作模式下土壤细菌群落差异的主要因素.图中不同的点代表不同的处理, 点的距离越近代表细菌群落结构越相似.由图 4可知, JC-C和JC-J模式在PC1轴上分布呈一致性, 且在PC2轴上分布距离较近, 表明JC-C和JC-J模式土壤细菌群落结构相似.JD-D和JD-J模式在PC1轴上分布呈一致性, 表明JD-D和JD-J模式土壤细菌群落结构相似.
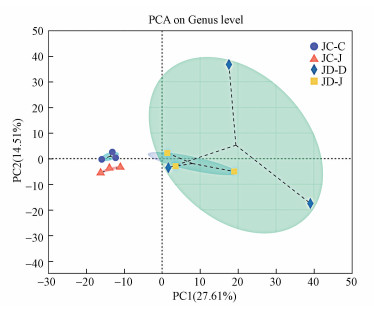 |
| 图 4 不同轮作模式下土壤细菌群落结构PCA分析 Fig. 4 PCA analysis of soil bacterial community structure under different rotation patterns |
NMDS分析, 即非度量多维尺度分析(Non-metric multidimensional scaling), 用来比较不同处理之间相似的程度.如图 5所示, JC-C分布在坐标轴NMDS1的负端及坐标轴NMDS2的两端, JC-J分布在坐标轴NMDS1的负端及坐标轴NMDS2的两端, 表明JC-C和JC-J模式土壤细菌群落结构相似度较高.JD-D分布于坐标轴NMDS1的正端及坐标轴NMDS2的负端, JD-J分布于坐标轴NMDS1的正端及坐标轴NMDS2的两端, 表明JD-D和JD-J模式土壤细菌群落结构存在一定的相似性.
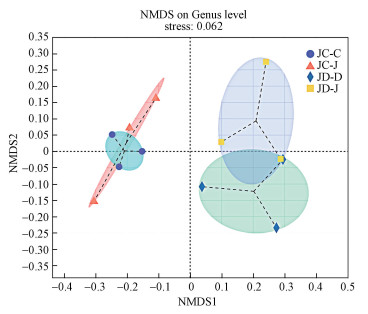 |
| 图 5 不同轮作模式下属水平NMDS分析 Fig. 5 NMDS analysis of different rotation patterns |
① 土壤细菌OTU分布.韦恩图可用于统计多组或者多个样本中所共有和独特有的物种数目(如OTU数目), 可以比较直观地表现出不同处理样本的群落组成相似性及重叠情况.分析时采用相似水平为97%的OTUs或者其他分类学水平的样本表.由图 6可知, JC-C、JC-J和JD-D、JD-J模式特有的OTUs分别为304、268和1092、725个.JC-C和JC-J模式共有的OTUs为366个, JD-D和JD-J模式共有的OTUs为1563个.结果表明, 在不同的轮作模式下, 姜季和其他种植季节土壤细菌群落均发生了较大改变.
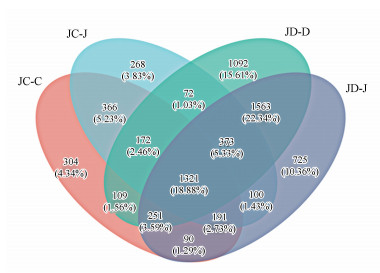 |
| 图 6 不同轮作模式下土壤OTUs韦恩分布图 Fig. 6 Distribution of OTUs Wayne in soil under different rotation patterns |
② 土壤细菌群落组成结构特征.不同轮作模式下土壤细菌门水平的群落组成如图 7a所示, 在旱-旱和水-旱轮作模式下, 相对丰度较高的前10种菌门分别为放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)、厚壁菌门(Firmicutes)、Gemmatimonadota、粘菌门(Myxococcota)、蓝菌门(Cyanobacteria)、髌骨细菌门(Patescibacteria)和Bacteroidota.其中, 旱-旱轮作模式中, JC-J模式相比JC-C模式放线菌门和变形菌门相对丰度减少, 酸杆菌门和厚壁菌门相对丰度有所增加.在水-旱轮作模式中, JD-J模式相比JD-D模式变形菌门和粘菌门相对丰度有所减少.旱-旱轮作模式与水-旱轮作模式对比来看, JD-J模式相比JC-J模式放线菌门、变形菌门和厚壁菌门相对丰度有所减少, 绿弯菌门和酸杆菌门相对丰度有所增加.
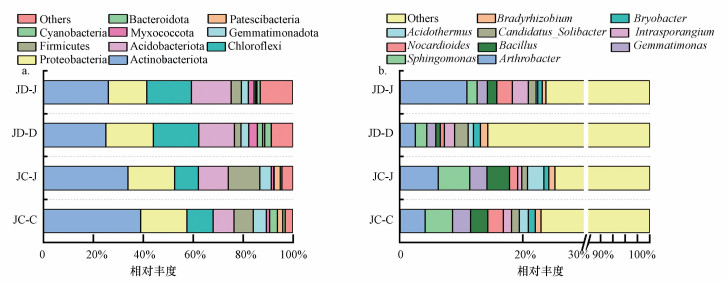 |
| 图 7 不同轮作模式下细菌门(a)及属(b)水平相对丰度 Fig. 7 Relative abundance of phylum (a) and genus (b) under different rotation patterns |
不同轮作模式下土壤细菌属水平的群落组成如图 7b所示, 在旱-旱和水-旱轮作模式下, 提取了相对丰度较高的前10种菌属, 分别为节杆菌属(Arthrobacter)、鞘氨醇单胞菌属(Sphingomonas)、芽单胞菌属(Gemmatimonas)、芽胞杆菌属(Bacillus)、诺卡氏菌属(Nocardioides)、间孢囊菌属(Intrasporangium)、(Candidatus_Soilbacter)、嗜酸栖热菌属(Acidothermus)、(Bryobacter)和(Bradyrhizobium).其中, 旱-旱轮作模式中, JC-J模式相比JC-C模式节杆菌属、鞘氨醇单胞菌属和芽胞杆菌属相对丰度有所增加, 类诺卡氏菌属、间孢囊菌属相对丰度有所降低.在水-旱轮作模式中, JD-J模式相比JD-D模式节杆菌属相对丰度增加.旱-旱轮作模式与水-旱轮作模式对比来看, JD-J模式相比JC-J模式节杆菌属相对丰度增加, 鞘氨醇单胞菌属和芽胞杆菌属相对丰度降低.
③ 土壤细菌属差异特征.如图 8所示, 在旱-旱和水-旱轮作模式下, 4种作物模式的土壤细菌属水平相对丰度呈现出了较大的差异.其中, 芽胞杆菌属(Bacillus)、Gaiella、Paenibacillus、Blastococcus等菌属在不同轮作模式下呈现出显著差异(p < 0.05).
 |
| 图 8 不同轮作模式下土壤细菌属差异特征 Fig. 8 Characteristics of soil bacteria under different rotation patterns |
不同轮作方式对农田土壤细菌群落结构的影响会进一步影响细菌功能组成(图 9).在相对丰度较高的前24位的细菌功能中, 轮作模式对土壤细菌的功能影响较为显著.在前19个功能方面, JD-J轮作模式相比于JC-J均增强, 两者差异功能大多集中于核苷酸合成、氨基酸合成、蛋白质周转等方面, 水-旱轮作显著影响了细菌的功能, 增强了高丰度功能, 减弱了低丰度功能.
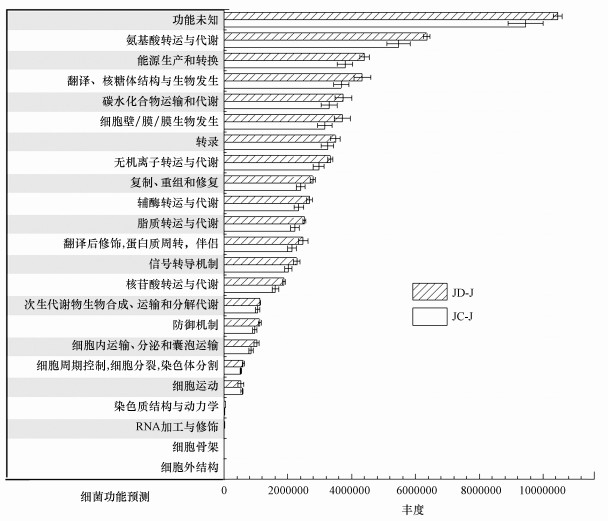 |
| 图 9 不同轮作模式下细菌功能预测 Fig. 9 Prediction of bacterial function under different rotation patterns |
土壤细菌群落结构与土壤pH、含水量、电导率和容重等存在相关性(图 10).为了进一步探究细菌群落结构之间与环境因子之间的关系, 对相对丰度前30位的细菌菌属与环境因子进行Spearman相关性分析(图 11).其中, Haliangium与土壤pH和容重呈显著正相关(p < 0.05), Anaeromyxobacter与土壤pH、含水量和容重呈显著正相关(p < 0.05), Gaiella与土壤含水量和容重呈显著正相关(p < 0.05).Blastococcus、Bacillus、Phenylobacterium和Paenibacillus与土壤含水量和容重呈显著负相关(p < 0.05).
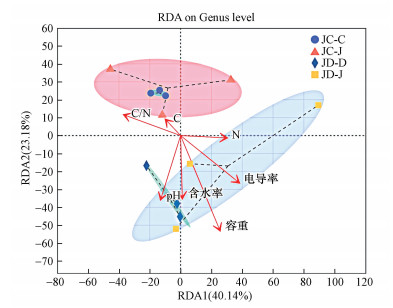 |
| 图 10 土壤细菌群落结构与环境因子RDA分析 Fig. 10 RDA analysis of soil bacterial community structure and environmental factors |
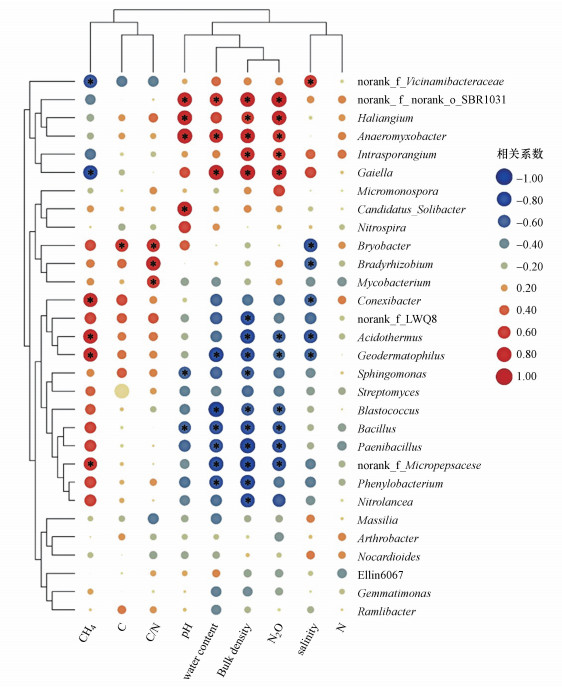 |
| 图 11 土壤细菌群落结构与环境因子相关性分析 Fig. 11 Correlation analysis of soil bacterial community structure and environmental factors |
环境因子与土壤碳氮动态和温室气体释放潜力的相关性如图 12所示.其中, 土壤TC含量与TN含量呈显著正相关(p < 0.05), 土壤电导率与土壤TC含量呈显著负相关(p < 0.05), 土壤电导率与CH4释放潜力呈显著负相关(p < 0.05), 土壤容重与N2O释放潜力呈显著正相关(p < 0.01), CH4释放潜力和N2O释放潜力呈显著负相关(p < 0.05).
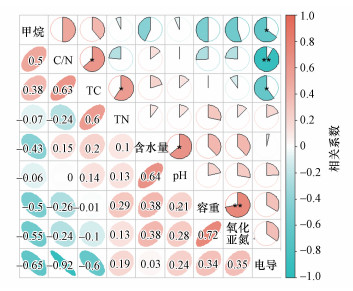 |
| 图 12 土壤碳氮动态、温室气体释放潜力与环境因子相关性分析 Fig. 12 Correlation analysis of soil carbon and nitrogen dynamics, greenhouse gas emission potential and environmental factors |
细菌群落结构和丰度的变化会对土壤碳氮动态与温室气体释放潜力产生影响(图 11), Bryobacter菌属对土壤TC含量具有显著正效应(p < 0.05).Bryobacter、Bradyrhizobium和Mycobacterium对土壤C/N有显著正效应(p < 0.05).Intrasporangium、Haliangium、Gaiella菌属显著影响土壤N2O释放潜力, 与土壤N2O的释放呈显著正相关(p < 0.05), Acidothermus、Geodermatophilus、Blastococcus、Bacillus、Paenibacillus菌属对土壤N2O释放有显著负效应(p < 0.05).Conexibacter、Acidothermus和Geodermatophilus菌属对土壤CH4释放具有显著正效应(p < 0.05).
4 讨论(Discussion) 4.1 不同轮作模式下土壤TC、TN含量及温室气体释放潜力特征土壤C、N含量是评价土地可持续利用的重要指标, 其含量能够影响土壤的肥力与作物的生长状况(Wu et al., 2015).有研究表明, 土壤有机碳含量与氮含量之间存在密切关系, 有机碳含量的增高有利于提高土壤氮素的利用率(Spargo et al., 2011).另一方面, 土壤C/N可以表征土壤有机质的分解程度及养分利用状况.在本研究中, 旱-旱和水-旱轮作模式下, 土壤TC、TN含量表现为JC-C>JC-J、JD-D>JD-J, 表明在姜季生长过程中能够较多地消耗C、N元素, 这是因为白姜作为一种根茎类经济作物, 其在生长至成熟期的过程中对土壤营养元素的消耗能力较高(王辉等, 2019).水-旱轮作相比旱-旱轮作C/N显著降低, 表明水-旱轮作土壤有机质分解程度较高, 作物生长较少受到N素的限制, 具有较高的养分利用效率.另外, 在农田生态系统中, 环境条件如气候条件、耕作方式及土壤特性等是影响农田土壤CH4和N2O释放的重要因素(Smith et al., 2008).在本研究中, 水-旱轮作显著降低了土壤CH4释放潜力(p < 0.05), 对N2O释放潜力影响不显著, 主要是由于旱-旱轮作相比于水-旱轮作, 有更多的外源有机物质投入, 为CH4氧化细菌提供了充足的碳源, 同时增加了土壤的碳释放(Paustian et al., 1997).可见, 水-旱轮作是一种生态、高效的种植模式.
4.2 不同轮作模式对土壤细菌群落结构及多样性影响土壤细菌不仅能够影响营养元素的分解与转化, 控制农田作物对养分的利用效率, 而且土壤细菌群落结构的变化还能够反映土壤的生态健康状况(Bardgett et al., 2014).同时, 土壤细菌的群落结构和多样性受到土壤理化性质、化学因子和耕作模式等多种因素的影响, 如含水量可以通过影响土壤营养元素运输、细菌底物利用效率来改变细菌的群落组成和活性.经典微生物生态理论认为, 多样性较高的土壤细菌群落将提供更多的功能特性, 进而有助于土壤生态系统的可持续发展(Cardinale et al., 2006; Pennekamp et al., 2018).本研究表明, 多样性指数表现为水-旱轮作姜季模式>旱-旱轮作姜季模式, 这是因为在水-旱轮作模式下农田土壤pH、含水量、容重等环境因子相比旱-旱轮作模式明显升高, 通过环境扰动调节生态位格局, 优化环境过滤作用对菌种的选择性筛选, 造成水-旱轮作细菌多样性升高(Feng et al., 2018).另一方面, 在JD轮作稻季, 土壤由于长期处于淹水的环境下, 厌氧的条件限制了土壤有机质的分解, 使土壤肥力得以积累, 而土壤养分的增加能够增加微生物群落的多样性(Galicia et al., 2004).也有研究指出, 在旱-旱生态系统中, 单一的种植方式及特定的施肥方式导致土壤微生物的环境过滤作用增强, 使得只有特定的一部分菌种群落得以生存, 因此, 具备较高的同质性选择作用(Stegen et al., 2012).异质性选择过程从旱-旱轮作到水-旱轮作呈现增加趋势, 最终旱地和湿地的环境差异性可以使得大量的菌种得以适应(Feng et al., 2017).通过对比两种轮作模式发现, 水-旱轮作相比于旱-旱轮作节杆菌属(Arthrobacter)相对丰度增加, 鞘氨醇单胞菌属(Sphingomonas)和芽胞杆菌属(Bacillus)相对丰度降低.芽胞杆菌属是一类好氧或兼性厌氧细菌, 在农业上有着较高的价值, 多数为腐生菌(Patel et al., 2015), 可以产生多种有用代谢产物, 进而促进作物生长与固碳(Ueda et al., 1994; Wang et al., 2015).同时, 本研究也发现芽胞杆菌属和鞘氨醇单胞菌属丰度与土壤含水量和容重呈显著负相关, JD轮作模式相比于JC轮作模式含水量和容重有所升高, 研究结果也从侧面验证了旱-旱和水-旱轮作可以通过改变土壤理化因子来影响土壤微生物群落结构.
4.3 细菌群落特征对碳氮动态与温室气体释放潜力的影响目前微生物被认为是土壤元素循环的一个重要引擎, 土壤中不同来源的C、N等元素经过微生物的分解矿化作用进而进入土壤生物地球化学循环(Schleuss et al., 2019).在农田土壤中, 结构性元素C及限制性元素N的含量及循环过程受到外部环境和土壤微生物的制约(Munda et al., 2018).从细菌门水平来看, 本研究发现蓝菌门(Cyanobacteria)和变形菌门(Proteobacteria)在姜季生长期相对丰度有所降低, 蓝菌门在土壤中多具有固氮功能, 变形菌门中含有大量的能与植物根系共生的固氮细菌(Dedysh et al., 2004; Lv et al., 2014), 进而在姜季生长期相关菌门丰度的减少会造成土壤N素流失.从属水平来看, 相对丰度前30位菌属中芽胞杆菌属(Bacillus)被认为是一种具有固碳功能的菌属, 苯基杆菌属(Phenylobacterium)被认为是固氮菌的一种(Vilain et al., 2006; Sun et al., 2020).同时, 通过Spearman相关性分析发现, Bacillus和Phenylobacterium丰度与土壤含水量、容重呈显著负相关, 在姜季土壤含水量、容重和pH有所降低, 进而造成旱-旱和水-旱轮作模式下姜季土壤C、N含量均降低.从细菌功能来看, 土壤的代谢功能极为重要, 碳水化合物代谢与土壤固氮、养分利用效率密切相关(Polónia et al., 2014; Landesman et al., 2014), 氨基酸代谢可以帮助土壤细菌吸收氨基酸, 有利于细菌的存活(Rahman et al., 2014);另一方面, 部分细菌可以通过代谢功能产生抑菌蛋白和抗生素, 抑制病原菌的生长(Bromke et al., 2013).因此, JD-J轮作模式相比于JC-J模式, 代谢功能增强, 表明水-旱轮作有助于抑制土壤病原菌并且促进作物对土壤养分的利用效率.同时, 农田温室气体气体排放受到土壤类型、上覆植被以及施肥量等多方面的影响.有研究表明, 土壤在水分非饱和的情况下可作为CH4吸收的碳汇以及大气N2O的排放源.其原因在于在好氧条件下, 甲烷氧化菌能够将土壤中产生的CH4氧化成CO2释放到大气中.同时, 自养型氨氧化菌可将NH4+-N氧化为NO2--N, 然后异构亚硝酸盐还原酶可以利用NO2-作为电子受体产生N2O, 同时, 异养硝化细菌可通过羟氨氧化酶的催化作用, 将氨氧化过程中的产物转化为亚硝酸盐和N2O(Schnell et al., 1994; Schmidt et al., 2007).在本研究中, 水-旱轮作模式下稻季增加了土壤CH4释放潜力(p < 0.05), 其他轮作对CH4和N2O影响不明显.这是因为在稻季, 土壤长期处于淹水状态, 甲烷氧化菌和氨氧化菌活性降低, 甲烷产生菌活性增强, 进而造成CH4释放潜力升高(Yang et al., 1998), 同时抑制了N2O的排放.总的来讲, 轮作方式的差异会导致土壤理化性质及物理结构等发生改变, 土壤微生物群落的改变又会驱动土壤营养元素含量及气体排放特征发生改变(图 13).因此, 可以通过探究农田的不同轮作方式及土地的不同利用方式来调控土壤微生物群落结构, 从而使农田土壤可持续健康发展.
 |
| 图 13 不同轮作模式下细菌群落与环境因子特征概念模型图 Fig. 13 Conceptual model of bacterial community and environmental factors under different rotation patterns |
1) 旱-旱和水-旱轮作模式下姜季均降低了土壤TC、TN含量, 水-旱轮作模式下稻季增加了土壤CH4释放潜力(p < 0.05), 其他轮作模式对CH4和N2O影响不明显.
2) 不同轮作模式对土壤细菌群落多样性影响不同, 细菌多样性指数表现为水-旱轮作模式>旱-旱轮作模式(p < 0.05).其中, 水-旱轮作相比于旱-旱轮作节杆菌属(Arthrobacter)相对丰度增加, 鞘氨醇单胞菌属(Sphingomonas)和芽胞杆菌属(Bacillus)相对丰度降低.芽胞杆菌属(Bacillus)、Gaiella、Paenibacillus、Blastococcus等菌属在不同轮作模式下呈现出显著差异(p < 0.05).
3) Blastococcus、Bacillus、Phenylobacterium和Paenibacillus与土壤含水量和容重呈显著负相关(p < 0.05).旱-旱轮作模式下, 土壤细菌群落受环境因子影响较小.水-旱轮作模式下, 土壤细菌群落受土壤pH、含水量和容重影响较大, 细菌的多样性指数增高, 代谢功能增强, 增加了土壤养分的利用效率.
4) Bryobacter、Bradyrhizobium和Mycobacterium对土壤C/N有显著正效应(p < 0.05).Acidothermus、Geodermatophilus、Blastococcus、Bacillus、Paenibacillus菌属对土壤N2O释放有显著负效应(p < 0.05).Conexibacter、Acidothermus和Geodermatophilus菌属对土壤CH4释放具有显著正效应(p < 0.05).
致谢: 本研究在野外采样和室内分析过程中得到了安徽省铜陵市农业农村局崔光庆、姚继贵, 以及福建师范大学金强、刘旭阳、黑杰等的帮助, 在此一并表示由衷的感谢!
Amundson R, Berhe A A, Hopmans J W, et al. 2015. Soil and human security in the 21st century[J]. Science, 348: 1261071. DOI:10.1126/science.1261071 |
Bardgett R D, van der Putten W H. 2014. Belowground biodiversity and ecosystem functioning[J]. Nature, 515: 505-511. DOI:10.1038/nature13855 |
Bromke M. 2013. Amino acid biosynthesis pathways in Diatoms[J]. Metabolites, 3: 294-311. DOI:10.3390/metabo3020294 |
Cardinale B J, Srivastava D S, Emmett Duffy J, et al. 2006. Effects of biodiversity on the functioning of trophic groups and ecosystems[J]. Nature, 443: 989-992. DOI:10.1038/nature05202 |
Chen F S, Feng X, Liang C. 2012. Endogenous versus exogenous nutrient affects C, N, and P dynamics in decomposing litters in mid-subtropical forests of China[J]. Ecological Research, 27: 923-932. DOI:10.1007/s11284-012-0970-4 |
Dedysh S, Ricke P, Liesack W. 2004. NifH and NifD phylogenies: An evolutionary basis for understanding nitrogen fixation capabilities of methanotrophic bacteria[J]. Microbiology(Reading, England), 150: 1301-1313. |
冯长春, 曹敏政, 谢婷婷. 2014. 不同生态保育尺度下铜陵市土地利用结构优化[J]. 地理研究, 33(12): 2217-2227. |
Feng Y, Chen R, Stegen J C, et al. 2018. Two key features influencing community assembly processes at regional scale: Initial state and degree of change in environmental conditions[J]. Molecular Ecology, 27: 5238-5251. DOI:10.1111/mec.14914 |
Feng Y, Guo Z, Zhong L, et al. 2017. Balanced fertilization decreases environmental filtering on soil bacterial community assemblage in North China[J]. Frontiers in Microbiology, 8: 2376. DOI:10.3389/fmicb.2017.02376 |
Galicia L, Garcia Oliva F. 2004. The effects of C, N and P additions on soil microbial activity under two remnant tree species in a tropical seasonal pasture[J]. Applied Soil Ecology, 26: 31-39. DOI:10.1016/j.apsoil.2003.10.006 |
Ge T, Wu X, Chen X, et al. 2013. Microbial phototrophic fixation of atmospheric CO2 in China subtropical upland and paddy soils[J]. Geochimica et Cosmochimica Acta, 113: 70-78. DOI:10.1016/j.gca.2013.03.020 |
侯栋梁, 何东进, 严锦钰, 等. 2016. 互花米草入侵对闽东滨海湿地土壤有机碳的影响[J]. 海洋湖沼通报, (1): 68-76. |
Jian Y, Zhu Z, Xiao M, et al. 2016. Microbial assimilation of atmospheric CO2 into soil organic matter revealed by the incubation of paddy soils under 14C-CO2 atmosphere[J]. Archives of Agronomy and Soil Science, 62: 1678-1685. DOI:10.1080/03650340.2016.1171850 |
Kastl E M, Schloter Hai B, Buegger F, et al. 2015. Impact of fertilization on the abundance of nitrifiers and denitrifiers at the root-soil interface of plants with different uptake strategies for nitrogen[J]. Biology and Fertility of Soils, 51: 57-64. DOI:10.1007/s00374-014-0948-1 |
Kong A Y Y, Six J, Bryant D C, et al. 2005. The relationship between carbon input, aggregation, and soil organic carbon stabilization in sustainable cropping systems[J]. Soil Science Society of America Journal, 69: 1078-1085. DOI:10.2136/sssaj2004.0215 |
Landesman W, Nelson D, Fitzpatrick M. 2014. Soil properties and tree species drive ß-diversity of soil bacterial communities[J]. Soil Biology and Biochemistry, 76: 201-209. DOI:10.1016/j.soilbio.2014.05.025 |
Lin B, Fei R. 2015. Regional differences of CO2 emissions performance in China's agricultural sector: A Malmquist index approach[J]. European Journal of Agronomy, 70: 33-40. DOI:10.1016/j.eja.2015.06.009 |
Liu D, Ishikawa H, Nishida M, et al. 2015. Effect of paddy-upland rotation on methanogenic archaeal community structure in paddy field soil[J]. Microbial Ecology, 69: 160-168. DOI:10.1007/s00248-014-0477-3 |
Liu Y, Dong Y, Ge T, et al. 2019. Impact of prolonged rice cultivation on coupling relationship among C, Fe, and Fe-reducing bacteria over a 1000-year paddy soil chronosequence[J]. Biology and Fertility of Soils, 55: 589-602. DOI:10.1007/s00374-019-01370-x |
李小飞, 侯立军, 刘敏. 2019. 崇明东滩湿地土壤硝酸盐异化还原成铵过程及其影响因素[J]. 环境科学学报, 39(4): 1284-1294. |
鲁如坤. 2000. 土壤化学农业分析方法[M]. 北京: 中国农业科技出版社.
|
Lv X, Yu J, Fu Y, et al. 2014. A meta-analysis of the bacterial and archaeal diversity observed in wetland soils[J]. The Scientific World Journal, 2014: 437684. |
马莉, 吕宁, 冶军, 等. 2012. 生物炭对灰漠土有机碳及其组分的影响[J]. 中国生态农业学报, 20(8): 976-981. |
Munda S, Bhaduri D, Mohanty S, et al. 2018. Dynamics of soil organic carbon mineralization and C fractions in paddy soil on application of rice husk biochar[J]. Biomass and Bioenergy, 115: 1-9. DOI:10.1016/j.biombioe.2018.04.002 |
Patel S K S, Kumar P, Singh M, et al. 2015. Integrative approach to produce hydrogen and polyhydroxybutyrate from biowaste using defined bacterial cultures[J]. Bioresource Technology, 176: 136-141. DOI:10.1016/j.biortech.2014.11.029 |
Paustian K, Andrén O, Janzen H, et al. 1997. Agricultural soils as a sink to mitigate CO2 emissions[J]. Soil Use and Management, 13: 230-244. DOI:10.1111/j.1475-2743.1997.tb00594.x |
Pennekamp F, Pontarp M, Tabi A, et al. 2018. Biodiversity increases and decreases ecosystem stability[J]. Nature, 563: 109-112. DOI:10.1038/s41586-018-0627-8 |
Polónia A R M, Cleary D F R, Duarte L N, et al. 2014. Composition of archaea in seawater, sediment, and sponges in the kepulauan seribu reef system, Indonesia[J]. Microbial Ecology, 67: 553-567. DOI:10.1007/s00248-013-0365-2 |
Rahman M, Quadir Q, Rahman A, et al. 2014. Screening and characterization of phosphorus solubilizing bacteria and their effect on rice seedlings[J]. Research in Agriculture Livestock and Fisheries, 1: 27-35. |
Schleuss P M, Widdig M, Heintz Buschart A, et al. 2019. Stoichiometric controls of soil carbon and nitrogen cycling after long-term nitrogen and phosphorus addition in a mesic grassland in South Africa[J]. Soil Biology and Biochemistry, 135: 294-303. DOI:10.1016/j.soilbio.2019.05.018 |
Schmidt C, Hultman K, Robinson D, et al. 2007. PCR profiling of ammonia-oxidizer communities in acidic soils subjected to nitrogen and sulphur deposition[J]. FEMS Microbiology Ecology, 61: 305-316. DOI:10.1111/j.1574-6941.2007.00335.x |
Schnell S, King G. 1994. Mechanistic analysis of ammonium inhibition of atmospheric methane consumption in forest soils[J]. Applied and Environmental Microbiology, 60: 3514-3521. DOI:10.1128/aem.60.10.3514-3521.1994 |
Smith P, Martino D, Cai Z, et al. 2008. Greenhouse gas mitigation in agriculture philosophical transactions of the Royal Society of London[J]. Series B, Biological Sciences, 363: 789-813. DOI:10.1098/rstb.2007.2184 |
Soong J L, Marañon Jimenez S, Cotrufo M F, et al. 2018. Soil microbial CNP and respiration responses to organic matter and nutrient additions: Evidence from a tropical soil incubation[J]. Soil Biology and Biochemistry, 122: 141-149. DOI:10.1016/j.soilbio.2018.04.011 |
Spargo J T, Cavigelli M A, Mirsky S B, et al. 2011. Mineralizable soil nitrogen and labile soil organic matter in diverse long-term cropping systems[J]. Nutrient Cycling in Agroecosystems, 90: 253-266. DOI:10.1007/s10705-011-9426-4 |
Stegen J C, Lin X, Konopka A E, et al. 2012. Stochastic and deterministic assembly processes in subsurface microbial communities[J]. The ISME Journal, 6: 1653-1664. DOI:10.1038/ismej.2012.22 |
Sun B, Gu L, Bao L, et al. 2020. Application of biofertilizer containing bacillus subtilis reduced the nitrogen loss in agricultural soil[J]. Soil Biology and Biochemistry, 148: 107911. DOI:10.1016/j.soilbio.2020.107911 |
Tian X F, Hu H W, Ding Q, et al. 2014. Influence of nitrogen fertilization on soil ammonia oxidizer and denitrifier abundance, microbial biomass, and enzyme activities in an alpine meadow[J]. Biology and Fertility of Soils, 50: 703-713. DOI:10.1007/s00374-013-0889-0 |
仝川, 鄂焱, 廖稷, 等. 2011. 闽江河口潮汐沼泽湿地CO2排放通量特征[J]. 环境科学学报, 31(12): 2830-2840. |
Ueda S, Kuwabara Y, Agata N, Konuma H, et al. 1994. Survival of bacillus thuringiensis in farmland soil and their distribution in soils in Japan[J]. Japanese Journal of Food Microbiology, 11: 43-50. DOI:10.5803/jsfm.11.43 |
Vilain S, Luo Y, Hildreth M, et al. 2006. Analysis of the life cycle of the soil saprophyte bacillus cereus in liquid soil extract and in soil[J]. Applied and Environmental Microbiology, 72: 4970-4977. DOI:10.1128/AEM.03076-05 |
王辉, 杜慧, 何正兴, 等. 2019. 不同氮磷钾配比对生姜脱毒苗生长和根茎鲜重的影响[J]. 中国土壤与肥料, (2): 159-164. |
Wang J, Chapman S J, Yao H. 2015. The effect of storage on microbial activity and bacterial community structure of drained and flooded paddy soil[J]. Journal of Soils and Sediments, 15: 880-889. DOI:10.1007/s11368-014-1053-7 |
汪旭明, 曾冬萍, 闵庆文, 等. 2015. 福州茉莉花种植园土壤化学计量比及其对碳释放潜力的影响[J]. 中国水土保持科学, 13(1): 118-126. DOI:10.3969/j.issn.1672-3007.2015.01.019 |
Wassmann R, Neue H U, Bueno C, et al. 1998. Methane production capacities of different rice soils derived from inherent and exogenous substrates[J]. Plant and Soil, 203: 227-237. DOI:10.1023/A:1004357411814 |
Weller S, Janz B, Jörg L, et al. 2016. Greenhouse gas emissions and global warming potential of traditional and diversified tropical rice rotation systems[J]. Global Change Biology, 22: 432-448. DOI:10.1111/gcb.13099 |
Wu W, Xu Z, Zhan C, et al. 2015. A new framework to evaluate ecosystem health: A case study in the Wei River basin, China[J]. Environmental Monitoring and Assessment, 187: 460. DOI:10.1007/s10661-015-4596-1 |
Yang S S, Chang H L. 1998. Effect of environmental conditions on methane production and emission from paddy soil[J]. Agriculture, Ecosystems & Environment, 69: 69-80. |
 2021, Vol. 41
2021, Vol. 41


