2. 华南应用微生物国家重点实验室, 广州 510070;
3. 广东省菌种保藏与应用重点实验室, 广州 510070
2. State Key Laboratory of Applied Microbiology Southern China, Guangzhou 510070;
3. Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application, Guangzhou 510070
壬基酚(4-nonylphenol, NP)是烷基酚的最终降解产物聚乙氧基化物, 广泛用于制备润滑油添加剂、树脂、增塑剂、表面活性剂、洗涤剂、油漆、化妆品和其他配制产品(Lu et al., 2014).壬基酚是一类典型的环境内分泌干扰物, 具有毒性、难降解性、生物蓄积性, 其广泛应用引起的环境污染问题越发严重(Soares et al., 2008:Li et al., 2019).研究发现我国市政污水中壬基酚最高检测浓度为63 μg·L-1, 城市富营养化湖泊壬基酚最高检测浓度达32.8 μg·L-1, 河水中壬基酚的浓度为0.7 ng·L-1~15 μg·L-1(Wu et al., 2007; Soares et al, 2008).此外, 研究发现壬基酚广泛存在于食品中, 其浓度范围为0.1~19.4 μg·kg-1, 而成人每日壬基酚摄入量约为7.5 μg (Guenther et al., 2002).NP具有亲脂性, 导致其在动物组织中积累.壬基酚具有类似雌激素的活性, 可通过模仿雌激素干扰正常激素信号传导, 从而引发各种生殖、内分泌系统疾病, 以及促进肿瘤发生发展, 对人类健康产生了巨大威胁(Shanle et al., 2011).
近年来, 壬基酚暴露已被证明能够扰乱机体免疫系统, 导致疾病风险增加(Kim et al., 2010).巨噬细胞是一类重要的免疫细胞, 是机体免疫系统极其重要的组成部分, 在调控免疫和炎症反应、维持组织稳态过程发挥着重要作用(Shapouri-Moghaddam et al., 2018).在不同的环境中, 巨噬细胞可发生不同性质的极化成为具有不同分子表型和功能特征的亚型(Murray, 2017).依据不同的极化方式, 巨噬细胞通常被分为经典活化型(classically activated, M1)和替代活化型(alternatively activated, M2)两大类型.M1型巨噬细胞, 通常由脂多糖(LPS)或干扰素γ(IFN-γ)诱导产生, 其特征为分泌促炎因子如IL-12、TNF-α等, 具有杀灭病原体及抗肿瘤功能.M2型巨噬细胞通常由IL-4诱导活化, 其高表达甘露糖受体CD206和清道夫受体CD163, 分泌抗炎因子IL-10, 发挥抗炎、促进组织修复以及促肿瘤功能(Yunna et al., 2020).先前的研究表明壬基酚可以调节小鼠巨噬细胞活化(You et al., 2002; Bennasroune et al., 2012), 然而关于壬基酚对人巨噬细胞极化和功能的作用尚未见报道.本研究拟采用人THP-1巨噬细胞模型, 体外考察壬基酚暴露对人巨噬细胞表型极化的影响.
2 材料与方法(Materials and methods) 2.1 材料壬基酚购自sigma公司, 溶解于二甲基亚砜(DMSO)中制备成10 mmol·L-1的储存液, -20 ℃保存;胎牛血清、DMEM培养基、胰蛋白酶购自Gibco公司;CD68、CD163、CD206抗体购自Abcam公司;ERK、p-ERK抗体购自CST公司;GAPDH抗体购自Santa Cruz公司;HRP标记山羊抗鼠IgG、山羊抗兔IgG购自北京鼎国生物技术有限公司;Quick Start Bradford蛋白定量试剂购自Bio-Rad公司;ECL化学发光底物试剂盒购自Pierce公司;反转录试剂盒、RT-PCR试剂盒购自TaKaRa公司;PCR引物由上海生工公司合成;BRDU试剂盒购自;PMA购自sigma公司;其余试剂均为国产分析纯.
2.2 细胞培养人单核细胞株THP-1购自中科院上海细胞库.采用含10%胎牛血清(Fetal Bovine Serum, FBS)的DMEM培养液, 于37 ℃、5% CO2的培养箱内饱和湿度培养.
2.3 BrdU检测壬基酚对THP-1细胞增殖的影响接种THP-1细胞(1×104个·孔-1)至96孔板, 待细胞贴壁后, 饥饿处理细胞12 h, 换成完全培养基.分别采用不同浓度的壬基酚(0、10、100 ng·mL-1)处理细胞48 h, 每组设5个复孔.加入BrdU试剂至培养细胞, 标记2 h, 丢弃细胞培养上清;每孔加入100 μL细胞固定液, 室温固定30 min, 洗涤液清洗细胞3次;每孔加入100 μL BrdU检测抗体, 室温孵育1 h, 洗涤液清洗细胞3次;加入二抗室温孵育30 min, 洗涤液清洗细胞3次;每孔加入100 μL底物室温孵育30 min, 加入100 μL终止液, 450 nm检测各孔绝对吸光值, 计算细胞增殖能力.
2.4 Transwell细胞迁移实验将Transwell小室放入培养板中, 在上室加入300 μL预温的无血清培养基, 室温下静置15~30 min, 使基质胶再水化.消化细胞, 用PBS洗2遍, 用无血清培养基重悬.调整细胞密度至2×105个·mL-1.取细胞悬液200 μL加入24孔板Transwell小室.24孔板下室加入500 μL含FBS的培养基.对接种在24孔板Transwell小室的细胞进行不同浓度壬基酚(0、100 ng·mL-1)处理.继续培养48 h后, 对下室细胞进行苏木素染色, 每组随机取5个视野进行计数, 并做柱状图分析壬基酚对细胞侵袭能力的影响.
2.5 Real-time RT-PCR按照Trizol(Invitrogen)说明书方法提取细胞总RNA, 按Primescript RT reagent Kit反转录试剂盒(TaKaRa)说明书将RNA逆转录为cDNA.引物由上海生工生物工程有限公司设计并合成, 引物序列如下:IL-10上游引物:5′- ACCTGCCTAACATGCTT CGAG-3′, 下游引物:5′-CTGGGTCTTGGTTCTCAGC TT-3′;IL-12上游引物:5′-TCATTTTGGGCCGAGCT GGAG-3′, 下游引物:5′-TACATCAGCTTCTCGGTGAC ACG-3′;iNOS上游引物:5′-AGCTGAACTTGAGCGA GGAG-3′, 下游引物:5′-GGAAAAGACTGCACCGA AGA-3′;Arg1上游引物:5′-CAGATATGCAGGGA GTCACC-3′, 下游引物:5′-CAGAAGAATGGAAGAG TCAG-3′;TGF-b上游引物:5′-GGCCAGATCCTG TCCAAGC-3′, 下游引物:5′-GTGGGTTTCCACCATT AGCAC-3′;GAPDH上游引物:5′-GCACCGTCAAGG CTGAGAAC-3′, 下游引物:5′-TGGTGAAGACGCC AGTGGA-3′.Real-time PCR反应体系及条件参照SYBR Premix Ex TapTM试剂盒(TaKaRa), 2-ΔΔCT法计算mRNA的相对表达量, 以GAPDH作为内参.每个实验组重复3次.
2.6 蛋白提取和Western Blot分析收集细胞, 经PBS洗涤后用三去污裂解液(50 mmol·L-1 Tris-Cl、150 mmol·L-1 NaCl、0.2 g·L-1叠氮钠、100 mg·L-1 Aprotin、100 mg·L-1 PMSF、1 g·L-1 SDS、10 g·L-1 NP-40、5 g·L-1去氧胆酸钠)裂解, 离心后收集上清, 用Bradford法测定蛋白浓度;等量蛋白样品经10%的SDS-PAGE电泳分离后, 转印至PVDF膜上, 5%脱脂奶粉室温封闭2 h, p-ERK、ERK、GAPDH一抗均以1:1000比例稀释, 4 ℃孵育过夜.经PBST洗涤后, 加入HRP标记的特异性二抗以1:5000比例稀释, 室温下孵育2 h, 最后用ECL化学发光试剂对X光片显影, 扫描图片.
2.7 流式细胞术检测巨噬细胞的表型细胞培养结束后, 用含5 mmol·L-1 EDTA的PBS溶液消化不同处理的THP-1细胞, 4000 r·min-1, 1 min离心收集细胞, 用PBS洗2次, 同时计数.按照1×105/100 mL的浓度用PBS(含1%BSA)重悬细胞;参考抗体说明书直接加入荧光素偶联的抗体(anti-CD68、anti-CD163、anti-CD206)进行荧光染色, 室温避光孵育30 min, 染色完毕后用500 mL PBS(含1%BSA)重悬细胞;使用流式细胞仪检测标志物的表达, 每个样品至少收集l×104以上的细胞.采用流式分析软件Flowjo 7.6.1分析结果.
2.8 统计学方法各组实验均重复3次, 应用软件GraphPad Prism 5.0进行统计学分析, 两组间差异用未配对样本t检验分析, 多组间比较用One-way analysis of variance(单因素方差分析), p < 0.05表示有统计学差异.
3 结果(Results) 3.1 PMA诱导人THP-1单核细胞分化成巨噬细胞人单核细胞系THP-1细胞是一个广泛应用于研究巨噬细胞的的体外模型.本研究采用30 ng·mL-1 PMA刺激THP-1细胞48 h后, 光镜下观察大部分细胞表现出巨噬细胞特有的生长特征, 即细胞贴壁较紧, 形态不规则, 有细胞伸出伪足, 提示细胞的运动能力增强(图 1a).CD68作为人巨噬细胞特异性标记物, 用以检测单核巨噬细胞的分化效率.在PMA刺激48 h后, 采用qRT-PCR检测CD68的表达, 结果发现CD68的表达显著升高(图 1b).流式细胞检测结果显示, PMA处理显著促进CD68的蛋白表达(图 1c, 1d).以上结果表明, 本研究成功建立了THP-1巨噬细胞模型.
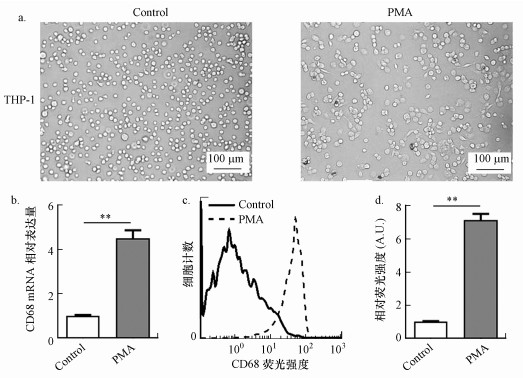 |
| 图 1 PMA诱导人THP-1单核细胞分化成巨噬细胞 (a. THP-1巨噬细胞形态图;b. 实时荧光定量PCR检测PMA对THP-1细胞CD68表达的影响;c. 流式细胞技术检测PMA对THP-1细胞CD68表达的影响;d. CD68相对荧光强度统计分析**p < 0.01) Fig. 1 Effects of BPA on differentiation of THP-1 cells to macrophages. (a. Morphology of THP-1 macrophages; b. THP-1 cells were treated with PMA for 48 h, the mRNA levels of CD68 were measured by qRT-PCR; c. THP-1 cells were treated with PMA for 48 h, the expression of CD68 were measured by FACS using specific mAbs; d. Relative fluorescence intensity statistical analysis **p < 0.01) |
首先采用Brdu实验检测壬基酚对THP-1巨噬细胞增殖的影响.分别以0、10、100 ng·mL-1壬基酚处理THP-1巨噬细胞48 h, Brdu实验结果显示, 壬基酚对THP-1巨噬细胞的增殖无明显的影响(图 2a).采用壬基酚(100 ng·mL-1)处理THP-1巨噬细胞24 h, Transwell实验检测显示, 壬基酚处理组穿过Matrigel及Transwell小室滤膜到达滤膜下层的THP-1巨噬细胞数(279+15)显著多于对照组(73+12)(图 2b, 2c).结果说明壬基酚处理能够增加THP-1巨噬细胞的迁移能力.
 |
| 图 2 壬基酚对THP-1巨噬细胞增殖和迁移的影响 (a. 采用不同浓度壬基酚处理THP-1细胞48 h, Brdu实验检测壬基酚对THP-1巨噬细胞增殖的影响;b. Transwell实验检测壬基酚对THP-1巨噬细胞迁移的影响;c.迁移细胞数统计分析**p < 0.01) Fig. 2 Effects of NP on cell proliferation and migration of THP-1 macrophages. (a. THP-1 macrophages were treated with NP for 48 h, cell proliferation were measured by BrdU assay; b. THP-1 macrophages were treated with NP (100 ng·mL-1) for 24 h, cell migration were measured by Transwell assay; c. Number of migration cells **p < 0.01) |
采用壬基酚(100 ng·mL-1)处理THP-1巨噬细胞, 48 h后, 收集细胞, 检测细胞分子标记的表达变化.流式结果显示, 壬基酚处理后, M2型巨噬细胞标志物CD163和CD206的表达显著上调(图 3a).进一步采用qRT-PCR检测壬基酚处理后巨噬细胞中IL-10、IL-12、Arg1、TGF-b和iNOS等分子的mRNA水平, 结果显示:加入壬基酚后, IL-12、iNOS的表达水平均明显降低.与之相反, IL-10、Arg1、TGF-b的表达水平则显著升高(图 3b).结果表明, 壬基酚能够诱导巨噬细胞向M2型转化.
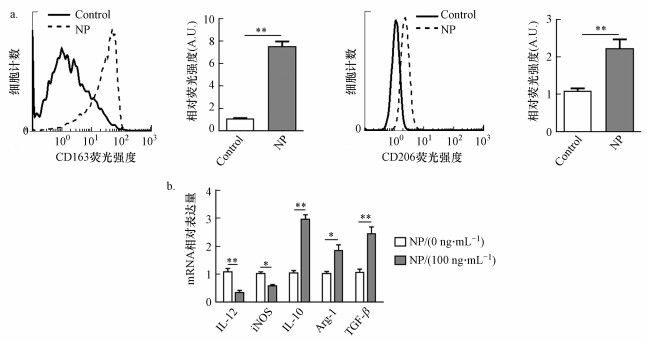 |
| 图 3 壬基酚诱导THP-1巨噬细胞向M2型转化 (a. 采用100 ng·mL-1壬基酚处理THP-1巨噬细胞48 h, 流式细胞技术检测M2型巨噬细胞标志物CD163和CD206表达情况;b. 实时荧光定量PCR检测壬基酚对巨噬细胞分泌因子的影响*p < 0.05, **p < 0.01) Fig. 3 The effect of NP on M2 polarization of THP-1 macrophages. (a. THP-1 macrophages were treated with NP (100 ng·mL-1) for 48 h, the expression of CD163 and CD206 were measured by FACS using specific mAbs; b. THP-1 macrophages were treated with NP (100 ng·mL-1) for 48 h, the mRNA levels of IL-12, iNOS, IL-10, Arg1 and TGF-b were measured by qRT-PCR *p < 0.05, **p < 0.01) |
由于壬基酚可以通过雌激素受体信号(Estrogen Receptor, ER)作为炎症诱导物, 本研究检测了ER是否参与了壬基酚对巨噬细胞表型转化的调节.壬基酚(100 ng·mL-1)处理THP-1巨噬细胞48 h后, 提取细胞总蛋白, Western Blot检测发现壬基酚处理能显著促进ER信号下游ERK1/2的磷酸化, 而加入ER拮抗剂ICI182780则能够逆转壬基酚的作用(图 4a).流式结果显示, ICI182780能够抑制壬基酚诱导的CD163和CD206的表达(图 4b).进一步采用qRT-PCR分析发现ICI182780能够下调IL-10、Arg1和TGF-b的表达(图 4c).以上结果表明, 壬基酚通过激活ER-ERK信号促进THP-1巨噬细胞M2型转化.
 |
| 图 4 壬基酚激活雌激素受体信号促进THP-1巨噬细胞M2型转化 (a. 分别采用壬基酚(100 ng·mL-1)、ER抑制剂ICI182780(20 nmol·L-1)、壬基酚联合ICI182780处理THP-1巨噬细胞, Western blot检测ERK1/2的磷酸化水平;b. 流式细胞技术检测CD163和CD206表达水平;c. 实时荧光定量PCR检测巨噬细胞分泌因子的水平*p < 0.05, **p < 0.01) Fig. 4 The effect of ER inhibitor ICI182780 on NP-induced M2 polarization of THP-1 macrophages. (a. THP-1 macrophages were treated with NP (100 ng·ml-1), ICI182780 (20 nmol·L-1), or NP plus ICI182780, the phosphorylation level of ERK1/2 was measured by Western blot; b. the expression of CD163 and CD206 were measured by FACS using specific mAbs; c. the mRNA levels of IL-12, iNOS, IL-10, Arg1 and TGF-b were measured by qRT-PCR *p < 0.05, **p < 0.01) |
近年来, 内分泌干扰素壬基酚对人体健康的有害影响备受关注.研究表明, 壬基酚暴露可以增强过敏反应(Suen et al., 2012)、诱发新陈代谢综合症(Wada et al., 2007)、影响男性的生育能力(Lagos-Cabre et al., 2012)、影响激素依赖性乳腺癌的发生(Recchia et al., 2004)等.此外, 研究发现壬基酚暴露通过调节免疫细胞的功能扰乱机体免疫系统, 导致疾病风险增加(Kim et al, 2010).巨噬细胞是天然免疫系统中的一个重要成员, 在机体的免疫反应中起着重要作用.本研究发现壬基酚暴露能够影响巨噬细胞的功能, 从而影响人体免疫稳态.
研究表明壬基酚通过调控细胞因子的表达来调节免疫细胞的功能(Bechi et al., 2010; Hung et al., 2010).You等研究发现壬基酚能够抑制脂多糖(LPS)激活的鼠巨噬细胞中一氧化氮(NO)和TNF-α等促炎细胞因子的产生(You et al., 2002).在本研究中, 发现壬基酚处理不仅能够抑制THP-1巨噬细胞IL-12、iNOS等促炎因子的表达, 而且能够促进IL-10、Arg1、TGF-b等抗炎因子的表达.重要的是, 壬基酚处理显著上调M2型巨噬细胞标志物CD163和CD206的表达.以上研究结果表明, 壬基酚能够抑制巨噬细胞向M1型极化, 并促进巨噬细胞向M2型极化.
巨噬细胞极化是一个多因子相互作用的复杂过程, 受到多种信号分子及其通路的调控.研究发现激活ERK信号能够促进M2型巨噬细胞极化(Veremeyko et al., 2018; Pang et al., 2021), ERK通过促进STAT3的磷酸化, 从而调控M2型巨噬细胞标志物的表达(Mu et al., 2018).本研究结果表明, 壬基酚处理会导致ERK1/2的磷酸化激活.壬基酚化学结构与雌二醇(E2)相似, 可与雌激素受体ER结合, 启动雌激素依赖性细胞信号传导途径.本课题组发现ER拮抗剂ICI182, 780能够逆转壬基酚诱导的ERK1/2的磷酸化, M2型巨噬细胞标志物的表达, 以及IL-10、Arg1、TGF-b等细胞因子的表达, 提示壬基酚通过激活ER/ERK信号促进巨噬细胞向M2型极化.
5 结论(Conclusions)本研究首次发现壬基酚能够促进人THP-1巨噬细胞向M2型巨噬细胞极化, 提示壬基酚能够影响巨噬细胞的功能干扰机体免疫系统, 然而壬基酚诱导巨噬细胞极化的机制还需进一步深入探讨, 以期为壬基酚的健康毒理评价提供实验依据.
Bechi N, Ietta F, Romagnoli R, et al. 2010. Environmental levels of para-nonylphenol are able to affect cytokine secretion in human placenta[J]. Environmental Health Perspectives, 118: 427-431. DOI:10.1289/ehp.0900882 |
Bennasroune A, Rojas L, Foucaud L, et al. 2012. Effects of 4-Nonylphenol and/or Diisononylphthalate on Thp-1 Cells: Impact of Endocrine Disruptors on Human Immune System Parameters[J]. International Journal of Immunopathology and Pharmacology, 25: 365-376. DOI:10.1177/039463201202500206 |
Guenther K, Heinke V, Thiele B, et al. 2002. Endocrine disrupting nonylphenols are ubiquitous in food[J]. Environmental Science & Technology, 36: 1676-1680. |
Hung C H, Yang S N, Kuo P L, et al. 2010. Modulation of cytokine expression in human myeloid dendritic cells by environmental endocrine-disrupting chemicals involves epigenetic regulation[J]. Environmental Health Perspectives, 118: 67-72. DOI:10.1289/ehp.0901011 |
Kim C, Cadet P. 2010. Environmental toxin 4-nonylphenol and autoimmune diseases: using DNA microarray to examine genetic markers of cytokine expression[J]. Archives of Medical Science, 6: 321-327. |
Lagos-Cabre R, Moreno RD. 2012. Contribution of environmental pollutants to male infertily: A working model of germ cell apoptosis induced by plasticizers[J]. Biological Research, 45: 5-14. DOI:10.4067/S0716-97602012000100001 |
Li X, Huo J, Liu Z, et al. 2019. An updated weight of evidence approach for deriving a health-based guidance value for 4-nonylphenol[J]. Journal of Applied Toxicology, 39: 87-100. DOI:10.1002/jat.3661 |
Lu Z, Gan J. 2014. Analysis, toxicity, occurrence and biodegradation of nonylphenol isomers: a review[J]. Environment International, 73: 334-345. DOI:10.1016/j.envint.2014.08.017 |
Mu X, Shi W, Xu Y, et al. 2018. Tumor-derived lactate induces M2 macrophage polarization via the activation of the ERK/STAT3 signaling pathway in breast cancer[J]. Cell Cycle, 17: 428-438. DOI:10.1080/15384101.2018.1444305 |
Murray PJ. 2017. Macrophage Polarization[J]. Annual Review of Physiology, 79: 541-566. DOI:10.1146/annurev-physiol-022516-034339 |
Pang X, Wang S S, Zhang M, et al. 2021. OSCC cell-secreted exosomal CMTM6 induced M2-like macrophages polarization via ERK1/2 signaling pathway[J]. Cancer Immunology Immunotherapy, 70: 1015-1029. DOI:10.1007/s00262-020-02741-2 |
Recchia A G, Vivacqua A, Gabriele S, et al. 2004. Xenoestrogens and the induction of proliferative effects in breast cancer cells via direct activation of oestrogen receptor alpha[J]. Food Additives and Contaminants, 21: 134-144. DOI:10.1080/02652030310001641177 |
Shanle E K, Xu W. 2011. Endocrine disrupting chemicals targeting estrogen receptor signaling: identification and mechanisms of action[J]. Chemical Research in Toxicology, 24: 6-19. DOI:10.1021/tx100231n |
Shapouri-Moghaddam A, Mohammadian S, Vazini H, et al. 2018. Macrophage plasticity, polarization, and function in health and disease[J]. Journal of Cellular Physiology, 233: 6425-6440. |
Soares A, Guieysse B, Jefferson B, et al. 2008. Nonylphenol in the environment: a critical review on occurrence, fate, toxicity and treatment in wastewaters[J]. Environment International, 34: 1033-1049. DOI:10.1016/j.envint.2008.01.004 |
Suen J L, Hung C H, Yu H S, et al. 2012. Alkylphenols-potential modulators of the allergic response[J]. Kaohsiung Journal of Medical Sciences, 28: S43-S48. DOI:10.1016/j.kjms.2012.05.009 |
Veremeyko T, Yung AWY, Dukhinova M, et al. 2018. Cyclic AMP Pathway Suppress Autoimmune Neuroinflammation by Inhibiting Functions of Encephalitogenic CD4 T Cells and Enhancing M2 Macrophage Polarization at the Site of Inflammation[J]. Frontiers in Immunology, 9: 50. DOI:10.3389/fimmu.2018.00050 |
Wada K, Sakamoto H, Nishikawa K, et al. 2007. Life style-related diseases of the digestive system: endocrine disruptors stimulate lipid accumulation in target cells related to metabolic syndrome[J]. Journal of Pharmacological Sciences, 105: 133-137. DOI:10.1254/jphs.FM0070034 |
Wu Z B, Zhang Z, Chen S P, et al. 2007. Nonylphenol and octylphenol in urban eutrophic lakes of the subtropical China[J]. Fresenius Environmental Bulletin, 16: 227-234. |
You H J, Choi C Y, Jeon Y J, et al. 2002. Suppression of inducible nitric oxide synthase and tumor necrosis factor-alpha expression by 4-nonylphenol in macrophages[J]. Biochemical and Biophysical Research Communications, 294: 753-759. DOI:10.1016/S0006-291X(02)00550-8 |
Yunna C, Mengru H, Lei W, et al. 2020. Macrophage M1/M2 polarization[J]. European Journal of Pharmacology, 877: 173090. DOI:10.1016/j.ejphar.2020.173090 |
 2021, Vol. 41
2021, Vol. 41


