酸性矿区废水(Acid Mine Drainage, AMD)主要来自黄铁矿等硫化矿物的氧化风化, 其中含有大量的铁、硫酸根及多种其他重金属(Chen et al., 2015; Jin et al., 2020; Xie et al., 2018).Cd、Pb是AMD中常见的高浓度重金属, 研究表明, Cd具有很强的生物毒性, 能通过食物链危害动、植物生长和人体健康, 且Cd超标会损害人体泌尿功能甚至致癌(Riederer et al., 2013); Pb作为第一类污染物, 可导致动、植物生长发育受到抑制甚至死亡, 还会导致人体肾脏疾病及儿童痴呆等(Fu et al., 2013; Turner, 2019)
施氏矿物(Fe8O8(OH)8-2x(SO4)x)是酸性矿区环境中一种典型的次生矿物, 在低pH、高硫酸盐和铁浓度条件下极易形成(Bigham et al., 1990; Fan et al., 2019).施氏矿物因具有较大的比表面积、丰富的铁羟基官能团及大量吸附态和结构态的硫酸根, 使其对许多重金属都具有较好的吸附作用, 因而成为酸性矿区环境中重要的重金属沉积库, 其吸附机制主要为表面络合及硫酸根的离子交换作用(Antelo et al., 2012; Gan et al., 2015; Sun et al., 2019).
小分子有机酸是土壤、水体、沉积物中常见的自然有机质, 其中, 柠檬酸是最具代表性的一种小分子有机酸.研究发现, 柠檬酸主要来自细菌的代谢活动、植物的根际分泌等, 在土壤中的背景含量约为0.01~1 mmol·kg-1(Sun et al., 2001).柠檬酸含有3个羧基官能团, 能与许多矿物进行表面络合, 形成矿物-有机质复合体(Owen et al., 2001; Lindegren et al., 2009b).结合在矿物上的有机质会影响矿物与重金属的相互作用, 并且受到环境条件, 如pH、有机质与重金属浓度、共存离子等的影响, 从而表现出不同的吸附行为(Otero-Fariña et al., 2017; Du et al., 2018; Xue et al., 2019). Otero-Fariña等(2017)研究表明, 水铁矿和针铁矿与腐殖质形成的有机质矿物复合体能提高对Cu的吸附效果, 并且碳含量越高, 促进吸附效果越好, 腐殖质中的羧基在吸附Cu过程中起到了一定作用, 但主要还是矿物本身进行吸附.Zhu等(2010)研究发现, 酒石酸和草酸与水铁矿共沉淀形成的有机质矿物复合体, 可降低单位质量矿物对Cu、Cr和Pb的吸附量.Xue等(2019)则研究发现, 腐殖质水铁矿复合体对As(Ⅲ)和As(Ⅴ)的吸附能力均下降, 并且腐殖质抑制了As(Ⅲ)在水铁矿表面的氧化(Xue et al., 2019).因此, 有必要进一步开展有机体-矿物复合体对重金属环境行为的影响研究.
基于此, 本文选取多金属矿区典型次生矿物—施氏矿物作为代表, 探究柠檬酸结合在施氏矿物上形成复合体后对矿物吸附Cd、pb的影响; 同时鉴于酸性矿区环境中存在大量的SO42-, 本文以SO42-作为共存离子探究其对吸附行为的影响, 以期为更好地理解和预测酸性矿区环境中重金属Cd、Pb的迁移转化规律提供理论依据.
2 材料与方法(Materials and methods) 2.1 复合体制备与表征施氏矿物的合成采用H2O2氧化亚铁的化学合成法(姜梦戈等, 2020).柠檬酸-施氏矿物复合体采用吸附法制备, 将0.5 g合成的施氏矿物加入到500 mL含不同浓度柠檬酸溶液中(0.2、0.5、1.0 mmol·L-1, 并以0.01 mol·L-1的NaCl作为背景电解质), 搅拌反应1 h, 得到的混合液作为不同柠檬酸浓度下的复合体.分别称取0.2 g冷冻干燥后的施氏矿物和不同柠檬酸浓度的复合体, 加入10 mL 6 mol·L-1的盐酸在室温下消解24 h, 取适量稀释后的溶液测定Fe、SO42-和TOC含量.总铁含量采用盐酸羟胺还原法联合邻菲罗啉显色法测定, SO42-采用离子色谱法测定, TOC采用TOC仪测定, 矿物上的柠檬酸含量通过测得的TOC用质量分数进行换算.同时对纯施氏矿物和1.0 mmol·L-1柠檬酸体系下制备的复合体进行XRD、FTIR、SEM表征.
2.2 吸附实验设置所有吸附实验的矿物浓度均为1 g·L-1, 以10 mmol·L-1的NaCl作为背景电解质控制离子强度, 重金属浓度梯度为10、20、50、100 mg·L-1, pH值梯度为3.0、4.0、5.0、6.0(鉴于对大宝山矿区河流理化性质及重金属的研究, 选取该pH范围, 并以pH=5.0作为典型值进行金属浓度实验和SO42-影响实验).吸附实验均在25 ℃、180 r·min-1的恒温摇床中进行, 反应24 h.所有实验均进行3个平行.为了简化描述, 后续结果与讨论中纯施氏矿物简称为Sch, 施氏矿物与不同柠檬酸浓度(0.2、0.5、1.0 mmol·L-1)下制备的施氏矿物-柠檬酸复合体分别用0.2-Sch、0.5-Sch、1.0-Sch表示, 统称为CA-Sch(Citric Acid-Schwertmannite Complex).
2.2.1 重金属浓度实验取20 mL复合体悬浊液(实验空白以同体积去离子水代替)加入到离心管中, 加入1 mL不同浓度的Cd或Pb储备液达到目标金属浓度, 调节pH到5.0, 放入摇床中振荡反应, 并定时监测和调节pH值.反应结束后离心, 取上清液过0.22 μm微孔滤膜, 测定金属浓度.将100 mg·L-1浓度下Sch和1.0-Sch反应后固体样品冷冻干燥用于后续FTIR表征.
2.2.2 pH实验控制金属浓度为100 mg·L-1, 控制pH在目标值, 其余步骤与2.2.1节一致.将Sch和1.0-Sch批次实验反应后的悬浮液离心, 取固体冷冻干燥进行XRD表征.
2.2.3 SO42-影响实验在制备的复合体溶液中加入SO42-储备液达到体系目标浓度(0.5或1.0 mmol·L-1), 金属浓度设置为100 mg·L-1, pH固定为5.0, 其余步骤与2.2.1节一致.同时, 为了更直观地观察到有机酸对复合体吸附重金属造成的影响, 定义复合体上的有机酸效应E, 具体见式(1).
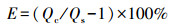
|
(1) |
式中, Qc为柠檬酸-施氏矿物复合体对金属M的吸附量, Qs为施氏矿物对金属M的吸附量.E为正值时表明柠檬酸促进了复合体对金属M的吸附, 负值表示抑制了复合体对金属M的吸附.
2.3 分析方法与仪器本研究采用火焰原子吸收法(Optima 5300DV Perkin-Elmer, San Diego, USA)测定Cd2+、Pb2+浓度;吸附量为反应前后溶液中金属浓度的差值与矿物质量浓度的比值(mg·g-1).
采用傅里叶红外光谱仪(FTIR, VERTEX33, Bruker)对矿物表面官能团特征进行分析;采用扫描电镜(SEM, Carl Zeiss Microscopy, Germany)观察矿物形貌;采用X射线衍射光谱仪(XRD, D8 ADVANCE, Bruker)结合Jade软件鉴定矿物矿相组成.
3 结果和讨论(Results and discussion) 3.1 矿物的合成和鉴定合成的Sch及几种CA-Sch的元素组成如表 1所示, 几种复合体的柠檬酸含量随制备的柠檬酸溶液浓度升高逐渐上升, 并且随着柠檬酸含量升高, CA-Sch的SO42-含量下降.这表明柠檬酸吸附在施氏矿物上时会在一定程度上导致矿物释放SO42-.铁含量升高可能是因为SO42-质量占比下降所致.
| 表 1 Sch和CA-Sch的元素组成 Table 1 Elemental composition of synthesized Sch and CA-sch |
本实验合成的Sch及1.0-Sch的XRD谱图如图 1所示.由图可知, 合成的Sch特征峰峰强较弱, 仅在2θ=35°处有一明显的特征峰, 表明合成的施氏矿物晶型较差.1.0-Sch的谱图基本与Sch一致, 表明虽然Sch在吸附柠檬酸时会释放部分SO42-, 但在本研究最高浓度1.0 mmol·L-1柠檬酸体系下制备的复合体, 依旧保持着施氏矿物的特征峰, 矿相没有发生明显变化, 释放的SO42-可能主要来自于矿物上外圈络合的SO42-.Kumpulainen等(2008)在100 mg·L-1的腐殖酸溶液中制备施氏矿物, 发现腐殖酸的存在并不影响Fe的水解成矿及施氏矿物的基本晶型结构.
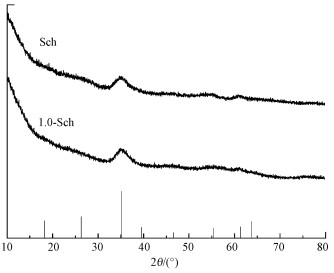 |
| 图 1 Sch与1.0-Sch的XRD谱图 (底部黑竖线为施氏矿物标准峰位, PDF 47-1775) Fig. 1 XRD Spectrum of origin synthetic Sch and 1.0-Sch (black vertical lines at the bottom is the standard peaks of schwertmannite(PDF 47-1775)) |
Sch和1.0-Sch的SEM图及EDS元素质量分数如图 2所示.采用H2O2氧化法合成的Sch为直径300~800 nm左右的不规则球体.相比生物合成法的海胆状形貌(Sun et al., 2019), 本实验合成的Sch表面较为光滑, 毛刺结构不明显.这可能也与H2O2一次性投加有关, Zhang等通过减缓H2O2的滴加速率, 使得化学合成的施氏矿物表面针刺状更加明显, 同时相比于一次性投加H2O2, 其比较面积从169.31 m2·g-1提升到228.75 m2·g-1 (Zhang et al., 2019).1.0-Sch依旧保持相同的海胆状形貌, 与Sch相比没有明显变化, 同时在EDS中也可以检测到矿物上存在一定质量的碳元素, 证明施氏矿物上结合了柠檬酸并形成有机质-矿物复合体.
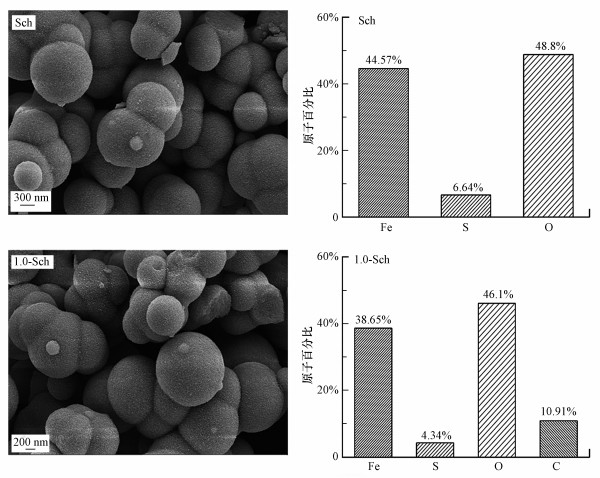 |
| 图 2 Sch与1.0-Sch的SEM图像和相应分布SEM-EDS图 Fig. 2 SEM images and SEM-EDS elemental mass fraction of synthesized Sch and 1.0-Sch complex |
图 3a为Sch及CA-Sch在pH=5.0下对不同浓度Cd的吸附情况.由图可知, 随着Cd浓度增大, 几种矿物对Cd的吸附量均逐渐升高, 0.5-Sch和1.0-Sch均提高了矿物在不同浓度下对Cd的吸附量.与Sch相比,0.2-Sch在10~50 mg·L-1范围内对Cd的吸附量下降, 在50 mg·L-1时柠檬酸带来的抑制效应为-46.90%, 而在100 mg·L-1时对Cd的吸附量在几种矿物中达到最大值11.09 mg·g-1, 0.5-Sch和1.0-Sch对Cd的吸附量则随柠檬酸浓度的升高略有降低.由此可见, 在pH=5.0下, 相比Sch, 0.5-Sch和1.0-Sch在各个Cd浓度下对Cd的吸附量均上升, 而0.2-Sch对10~50 mg·L-1 Cd的吸附却受到抑制, 直到Cd浓度提高到100 mg·L-1才起到促进作用, 并且在此Cd浓度下柠檬酸浓度升高还会略微减小其在CA-Sch上的吸附量.
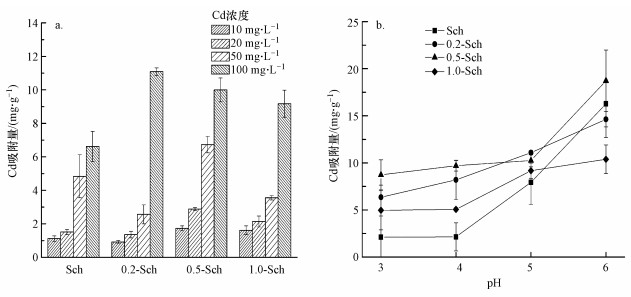 |
| 图 3 Sch和CA-Sch对Cd的吸附效果 (a.不同Cd浓度下的吸附量, b.不同pH下的吸附量) Fig. 3 Adsorption of Cd on Sch and CA-Sch (a.Adsorption capability at different Cd concentration, b.Adsorption capability at different pH) |
图 3b为复合体在不同pH下对100 mg·L-1 Cd的吸附情况.由图可知, 复合体对Cd的吸附量随pH的升高而显著提高, 在pH=3~5范围内, 柠檬酸均促进CA-Sch对Cd的吸附, 在pH=3.0和4.0时柠檬酸对0.5-Sch吸附Cd的促进效果最明显, 促进效率分别为313.32%和351.29%, 而在pH=5.0下则是对0.2-Sch的促进效果最好.1.0-Sch在几个目标pH下对Cd的吸附效果均不如0.2-Sch和0.5-Sch, 甚至在pH=6.0下, 与Sch相比吸附量下降明显, 与0.2-Sch的吸附量相似, 不同于0.5-Sch在此pH下对Cd的吸附量依旧显著高于Sch, 达到18.71 mg·g-1.与本研究类似, Stietiya等(2014)研究发现, Al2O3在0.25、0.5、1.0 mmol·L-1的柠檬酸溶液中吸附柠檬酸后, 在pH=6.5下后续吸附Cd时0.25和1.0 mmol·L-1体系的吸附量均不如0.5 mmol·L-1体系高.Lackovic等(2004b)则研究发现, 在pH=3~4左右, 当溶液中共存有50、100 μmol·L-1和1 mmol·L-1的柠檬酸时, 高岭石和蒙脱石对Cd的吸附能力会有所提高, 但1.0 mmol·L-1的柠檬酸体系在pH=5.0往后则会逐渐降低两种矿物对Cd的吸附效果, 50和100 μmol·L-1的柠檬酸体系则随着pH升高逐渐出现抑制作用.管宇立等(2018)探究了水铁矿与腐殖质共沉物对Cd的吸附, 结果表明, 结合了腐殖质的水铁矿提高了对Cd的吸附能力, 并且不受pH值变化的影响.
3.3 Pb吸附实验Sch及CA-Sch在pH=5.0下对不同浓度Pb的吸附量如图 4a所示.由图可知, Sch对Pb的吸附量明显比Cd高, 且随Pb浓度的增加, 其在几种矿物上的吸附量也逐渐升高.相比Sch, CA-Sch对Pb的吸附量明显下降, 0.2-Sch在100 mg·L-1下的吸附量较Sch下降了46.71%, 并且柠檬酸浓度越高, 下降比例越大, 0.5-Sch和1.0-Sch分别下降了58.11%和76.10%.由此可见, 柠檬酸对复合体吸附Pb有很明显的抑制作用, 并且随着CA-Sch上柠檬酸浓度的升高, 抑制作用越明显.与本实验结果类似, Wu等(2003)探究了柠檬酸共存体系下针铁矿对Pb的吸附, 发现pH=6.0下, 随着体系中柠檬酸浓度的升高, 针铁矿对Pb的吸附能力逐渐下降, 柠檬酸对针铁矿吸附Pb也具有一定的抑制作用.
 |
| 图 4 Sch和CA-Sch对Pb的吸附效果 (a.不同Pb浓度下的吸附量, b.不同pH下的吸附量) Fig. 4 Adsorption of Pb on Sch and CA-Sch (a.Adsorption capability at different Pb concentration, b. Adsorption capability at different pH) |
图 4b为复合体在不同pH值下对100 mg·L-1 Pb的吸附情况.由图可知, Pb在几种矿物上的吸附受pH影响十分明显, pH=3.0下难以吸附到矿物上, 而随着pH升高, 吸附量明显上升, 在pH=6.0下Sch对Pb的吸附量可以达到102.55 mg·g-1.由于柠檬酸带来的抑制作用, 在pH=3.0~6.0内CA-Sch对Pb的吸附量均有所下降, 并且柠檬酸浓度越高下降程度越大, 相比pH=6.0下Sch的吸附量, 1.0-Sch对Pb的吸附量仅为32.86 mg·g-1, 降低了67.96%.对比吸附Cd的实验可以发现, 柠檬酸对CA-Sch吸附Pb在各个pH值及重金属浓度下, 都仅会产生明显的抑制作用.与本实验结果不同, Huang等(2003)在柠檬酸溶液中采用共沉淀法合成柠檬酸-矿物复合体, 并进行其对Pb的动力学吸附实验, 发现高浓度柠檬酸下生成的铁氧化物由于结晶度更差, 使得比表面积更大, 暴露更多的Fe—OH位点, 因此, 相比针铁矿、赤铁矿和纤铁矿混合物, 复合体对Pb的吸附速率更快, 吸附量更大. Zhu等(2010)研究也发现, 以单位质量吸附量进行对比, 酒石酸/草酸-水铁矿复合体对Pb的吸附能力相比水铁矿有所下降, 可能是由于有机质引起的团聚作用使得有效吸附面积减少所致.因此对于本实验的结果推测, 柠檬酸竞争了复合体上的表面络合位点, 使得复合体对Pb的吸附量明显下降.
| 表 2 柠檬酸对CA-Sch吸附Cd、Pb产生的有机酸效应E Table 2 The citric acid efficiency of adsorption of Cd, Pb on different CA-Sch compared to Sch |
SO42-作为一种含氧阴离子, 可与许多金属阳离子产生配位作用, 进而影响金属阳离子在铁氧化物上的赋存形式与吸附量(Swedlund et al., 2009).从图 5a可以看出, 对于纯Sch, 0.5 mmol·L-1 SO42-共存体系对Cd的吸附量略微减小, 1.0 mmol·L-1 SO42-共存体下则对Cd吸附量没有明显影响.而对于CA-Sch, SO42-的存在都使得Cd吸附量明显下降.Swedlund等(2009)研究发现, 共存的SO42-通过形成三元络合物促进针铁矿对Cd的吸附, 而Lackovic等(2004a)发现柠檬酸也能通过形成三元络合物促进针铁矿对Cd的吸附.对于本研究体系而言, 存在两种不同的配位阴离子, 而它们对Cd具有不同的配位结合方式和能力, 可能是由于络合常数的差异使得Cd更倾向于与体系中的SO42-在液相中结合, 从而导致复合体对Cd的吸附能力下降.不同于Cd, 无论是Sch还是几种复合体, SO42-的存在均促进对Pb的吸附, 并且SO42-浓度越高对Pb的促进吸附效果越明显.Elzinga等(2001)利用原位红外结合EXAFS探究了SO42-共存下针铁矿与Pb的结合形式, 分析发现, 在pH=5.0下SO42-能够以内圈络合的形式结合到针铁矿上, 使得矿物更容易与Pb进行配位络合形成三元络合物.因此推测在本实验中, 虽然复合体上结合的柠檬酸对吸附Pb具有一定的抑制作用, 但由于溶液中存在的SO42-影响了矿物对Pb的配位结合, 进而一定程度上提高了矿物对Pb的吸附量.
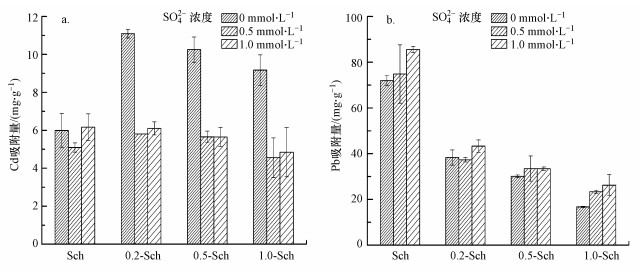 |
| 图 5 共存SO42-下Sch和CA-Sch对Cd (a)和Pb (b) 的吸附 Fig. 5 Adsorption of Cd(a) or Pb(b) on Sch and CA-Sch under co-existing sulfate |
图 6为Sch、1.0-Sch及其吸附Cd、Pb后的红外光谱图.由图可知, 合成的Sch在428和703 cm-1处为Fe—O吸收峰;611 cm-1处v4(SO4)为矿物结构态的硫酸根振动峰, 979 cm-1处v1(SO4)是硫酸根分子内对称收缩振动的吸收峰, 被认为是施氏矿物外层络合的硫酸根;1123 cm-1处是硫酸根分子的三重简并反对称伸缩振动的吸收峰v3(SO4), 同时伴随1180和1056 cm-1处两个肩峰的存在, v1(SO4)和v3(SO4)都被认为是外圈络合态的SO42- (Boily et al., 2010; 范聪, 2019);位于1630 cm-1处的吸收峰由H—O—H的伸缩振动产生.
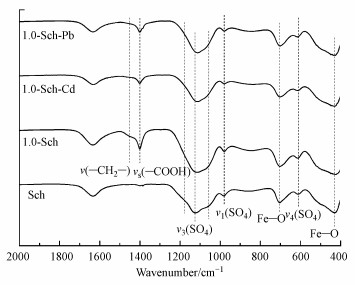 |
| 图 6 Sch和1.0-Sch及其吸附Cd、Pb后的FTIR图 Fig. 6 The FTIR of Sch and 1.0-Sch as well as the corresponding spectrum after adsorption of Cd and Pb |
1.0-Sch的特征峰与Sch基本一致, 1400 cm-1处出现的是柠檬酸羧基的对称伸缩振动峰, 1436 cm-1处较宽的肩峰代表柠檬酸分子上—CH2—的弯曲振动(Hidber et al., 2005; Lindegren et al., 2009a).受到H—O—H峰的掩盖, 在1613 cm-1处羧基的反对称伸缩峰vas(—COOH)并不明显(Hidber et al., 2005), 同时, 相比Sch在428 cm-1处的Fe—O峰, 1.0-Sch的Fe—O峰强略微减弱, 并且偏移到436 cm-1处, 表明柠檬酸与Sch表面的Fe—OH发生了配位络合形成内圈络合物(Zhu et al., 2010; 陈红凤, 2018; 谢莹莹, 2018), v3(SO4)的峰宽变窄, 并且分裂减弱, 推测可能是柠檬酸的配位络合在一定程度上影响了外层硫酸根在矿物表面的配位结构(Boily et al., 2010).而在1722 cm-1处观察不到v(C O)的特征峰, 这可能是由于配位结合到Sch上的柠檬酸的羧基全部去质子化所致(Mudunkotuwa et al., 2010).在吸附Cd和Pb后, 1.0-Sch的vs(COOH)峰强减弱, v(—CH2—)特征峰消失, 推测可能是Sch上结合的柠檬酸参与了对Cd和Pb的吸附过程.对比复合体对Cd和Pb的吸附差异, 推测复合体上柠檬酸可能以暴露的羧基与Cd进行配位形成三元络合物, 从而使得1.0-Sch相较Sch对Cd的吸附量上升;而对于Pb, 柠檬酸可能仅与相邻结合在矿物上的Pb发生羧基键合或者氢键键合, 而不能与Pb形成三元络合物来提高对Pb的吸附作用, 从而导致不同的CA-Sch对Pb的吸附量均低于Sch(Ha et al., 2009; Simanova et al., 2011; Flynn et al., 2017).
3.6 反应后固体的XRD分析施氏矿物在高pH下较不稳定, 存在矿相转变的可能(Jönsson et al., 2005; Knorr et al., 2007), 因此, 有必要对反应后的样品进行XRD分析以确定矿相是否发生变化.Sch和1.0-Sch吸附Cd和Pb后的XRD谱图如图 7所示.由图可知, Sch在pH=3~5范围内吸附Cd后矿相基本不变, 但在pH=6下2θ=35°处的主峰峰强下降, 这可能是由高pH下矿物中SO42-的释放导致晶体结构变差所致(Jönsson et al., 2005), 1.0-Sch在pH=3~6的反应过程中保持施氏矿物的基本矿相不变.对于吸附Pb实验, 1.0-Sch在各个pH下反应后没有新的特征峰出现, 而Sch在pH=6下反应后在2θ=20°~30°间出现较宽的特征峰, 这可能是PbSO4沉淀带来的特征峰.因此推测, Sch相比几种CA-Sch对Pb的吸附量更大, 可能是由于Sch在反应过程中Pb能与矿物上的SO42-结合在矿物表面形成PbSO4沉淀, 从而一定程度上提高了Sch对Pb的吸附量; 而1.0-Sch由于体系中仍存在一定量的柠檬酸, 会与Pb形成水溶性络合物, 从而抑制了Pb与SO42-沉淀的产生(Marcussen et al., 2009), 这也一定程度上解释了共存的SO42-可能通过形成表面沉淀物的形式来促进Sch和CA-Sch对Pb的吸附.
 |
| 图 7 Sch和1.0-Sch在不同pH下吸附Cd、Pb后的XRD图 (底部黑色竖线为施氏矿物标准峰(PDF 47-1775), 黑色虚线为硫酸铅标准峰位(PDF 45-0839)) Fig. 7 XRD spectrum of Sch and 1.0-Sch after adsorption of Cd and Pb at different pH (The peak positions for Schwertmannite (PDF 47-1775) are given as black vertical lines, and that for PbSO4 (PDF 45-0839) are given as black dash line) |
有机质对矿物吸附重金属的影响, 既可能产生促进效应, 也可能产生抑制效应.促进效应主要有: ①有机质改变了矿物表面电荷从而影响了矿物对金属离子的静电作用;②吸附的有机质与重金属结合在矿物表面形成阴离子桥型三元络合物;③游离的有机质与金属离子在矿物表面形成沉淀物.抑制效应主要有: ①有机质占据或掩盖矿物上金属离子吸附的相同位点;②使矿物发生团聚而降低比表面积及孔隙度, 进而降低有效吸附位点(Collins et al., 1999; Qu et al., 2019).
在本研究中, 相较于Sch, CA-Sch在吸附Cd、Pb时均表现出不同的趋势.整体上, 柠檬酸促进了CA-Sch对Cd的吸附, 而对Pb的吸附产生抑制作用.铁氧化物对金属阳离子的吸附主要通过表面铁羟基位点进行结合, 研究表明, 铁羟基位点对Pb的络合常数要比Cd大(Serrano et al., 2009), 并且水解常数也更高, 更容易在溶液中形成水合离子从而在矿物上发生吸附, 这也一定程度上解释了本研究中Sch对Pb的吸附量显著高于Cd.对于CA-Sch, 推测由于体系中仍存在一定的游离态柠檬酸, 其与Cd、Pb均能形成游离态的络合物, 并且柠檬酸与Pb形成络合物的络合常数更大(Lackovic et al., 2004a), 游离态的络合物会在一定程度上降低矿物对Pb的吸附亲和性并且抑制了在矿物上形成表面沉淀物(Borda et al., 2007), 从而降低了CA-Sch对Pb的吸附量.Du等(2018)在研究腐殖质-水铁矿复合体时, 以干燥矿物的形式进行实验, 在一定程度上避免了游离态有机质带来的影响, 从而使得有机质的引入整体上没有改变矿物对Pb的吸附量; Liu等(2003)通过共沉淀的形式制备了柠檬酸-铁氧化物复合体, 发现共沉淀的制备方法会使得矿物更加无序, 结晶度降低, 从而暴露更多的有效吸附位点, 从而对Pb的吸附量上升.本研究采用吸附法制备复合体会导致矿物上许多有效位点被柠檬酸占据, 这在一定程度上竞争了Pb在矿物上的特异性吸附位点;而柠檬酸在矿物上的吸附位点可能与Cd不同, 因而对Cd产生的竞争吸附作用较弱, 并且柠檬酸结合到矿物上后其暴露的羧基更容易与Cd形成三元络合物, 从而对Cd的吸附起到一定的促进作用.对于柠檬酸影响下施氏矿物对Cd和Pb的配位形式差异, 后续需进行进一步的深入研究.
4 结论(Conclusions)1) 本文探究了施氏矿物与不同浓度柠檬酸形成的有机质矿物复合体对Cd、Pb吸附的差异.结果表明, 复合体对两种重金属表现出明显不同的吸附行为: 复合体对Cd的吸附量总体上随着Cd浓度的升高和pH的降低而上升, 0.5-Sch在pH=4.0和100 mg·L-1条件下具有最大的促进效应(351.29%);而复合体对Pb的吸附在不同pH和金属浓度下均比施氏矿物要低, 在pH=3.0下对Pb几乎不吸附, 且复合体中柠檬酸含量越高, Pb吸附量下降越大.
2) 在pH=5.0下, 共存SO42-会抑制复合体对Cd的吸附;而对于Pb, SO42-可能以促进形成PbSO4沉淀的形式提高其在Sch和CA-Sch上的吸附量, 且SO42-浓度越高吸附量越大.
3) 红外分析证明了柠檬酸与施氏矿物的结合, 并且可能与Cd和Pb发生了不同形式的配位结合, 这为后续针对有机质介导下施氏矿物与重金属间相互作用研究提供了一定的参考意义.天然有机质对施氏矿物吸附不同重金属产生了不同的影响, 这导致实际AMD环境中重金属的迁移和归趋不仅受矿物作用的影响, 还受到有机质的影响从而可能提高或降低其迁移性及带来的环境风险.因此, 本研究可为实际AMD环境中Cd和Pb的环境行为及相应的污染控制提供一定的理论依据.
Antelo J, Fiol S, Gondar D, et al. 2012. Comparison of arsenate, chromate and molybdate binding on schwertmannite: surface adsorption vs anion-exchange[J]. Journal of Colloid and Interface Science, 386: 338-343. DOI:10.1016/j.jcis.2012.07.008 |
Bigham J M, Schwertmann U, Carlson L, et al. 1990. A poorly crystallized oxyhydroxysulfate of iron formed by bacterial oxidation of Fe(Ⅱ) in acid mine waters[J]. Geochimica et Cosmochimica Acta, 54: 2743-2758. DOI:10.1016/0016-7037(90)90009-A |
Boily J F O, Gassman P L, Peretyazhko T, et al. 2010. FTIR spectral components of schwertmannite[J]. Environmental Science & Technology, 44: 1185-1190. |
Borda M, Sparks D. 2007. Kinetics and Mechanisms of Sorption-Desorption in soils: A Multiscale Assessment[M]. John Wiley & Sons, Inc..
|
陈红凤. 2018. 土壤腐殖酸在多组分矿物上的选择吸附特性及作用机制量化[D]. 武汉: 华中农业大学
|
Chen M, Lu G, Guo C, et al. 2015. Sulfate migration in a river affected by acid mine drainage from the Dabaoshan mining area, South China[J]. Chemosphere, 119: 734-743. DOI:10.1016/j.chemosphere.2014.07.094 |
Collins C R, Ragnarsdottir K V, Sherman D M. 1999. Effect of inorganic and organic ligands on the mechanism of cadmium sorption to goethite[J]. Geochimica et Cosmochimica Acta, 63: 2989-3002. DOI:10.1016/S0016-7037(99)00226-4 |
Du H, Huang Q, Lei M, et al. 2018. Sorption of Pb(Ⅱ) by nanosized ferrihydrite organo-mineral composites formed by adsorption versus coprecipitation[J]. ACS Earth and Space Chemistry, 2: 556-564. DOI:10.1021/acsearthspacechem.8b00005 |
Elzinga E J, Peak D, Sparks D L. 2001. Spectroscopic studies of Pb(Ⅱ)-sulfate interactions at the goethite-water interface[J]. Geochimica et Cosmochimica Acta, 65: 2219-2230. DOI:10.1016/S0016-7037(01)00595-6 |
Fan C, Guo C, Chen M, et al. 2019. Transformation of cadmium-associated schwertmannite and subsequent element repartitioning behaviors[J]. Environmental Science and Pollution Research, 26: 617-627. DOI:10.1007/s11356-018-3441-9 |
范聪. 2019. 施氏矿物还原-重结晶过程中重金属的再分配机制研究[D]. 广州: 华南理工大学
|
Flynn E D, Catalano J G. 2017. Competitive and cooperative effects during nickel adsorption to iron oxides in the presence of oxalate[J]. Environmental Science & Technology, 51: 9792-9799. |
Fu J, Zhang A, Wang T, et al. 2013. Influence of E-Waste dismantling and its regulations: Temporal trend, spatial distribution of heavy metals in rice grains, and its potential health risk[J]. Environmental Science & Technology, 47: 7437-7445. |
Gan M, Sun S, Zheng Z, et al. 2015. Adsorption of Cr(Ⅵ) and Cu(Ⅱ) by AlPO4 modified biosynthetic Schwertmannite[J]. Applied Surface Science, 356: 986-997. DOI:10.1016/j.apsusc.2015.08.200 |
管宇立. 2018. 水铁矿及其与腐植酸共沉物对水溶液中镉的吸附作用研究[D]. 兰州: 兰州大学
|
Ha J, Trainor, T P, Farges F, et al. 2009. Interaction of Zn(Ⅱ) with hematite nanoparticles and microparticles: Part 2.ATR-FTIR and EXAFS study of the aqueous Zn(Ⅱ)/oxalate/hematite ternary system[J]. Langmuir, 25: 5586-5593. DOI:10.1021/la802895a |
Hidber P, Graule T, Gauckler L. 2005. Citric acid-a dispersant for aqueous alumina suspension[J]. Journal of the American Ceramic Society, 79: 1857-1867. |
姜梦戈, 赖伟斌, 曾宇飞, 等. 2020. Citrobacter sp.EBS8对施氏矿物和黄钾铁矾的还原溶解及相转化行为的影响[J]. 环境科学学报, 40(11): 3858-3867. |
Jin D, Wang X, Liu L, et al. 2020. A novel approach for treating acid mine drainage through forming schwertmannite driven by a mixed culture of Acidiphilium multivorum and Acidithiobacillus ferrooxidans prior to lime neutralization[J]. Journal of Hazardous Materials, 400: 123108. DOI:10.1016/j.jhazmat.2020.123108 |
Jönsson J, Persson P, Sjöberg S, et al. 2005. Schwertmannite precipitated from acid mine drainage: phase transformation, sulphate release and surface properties[J]. Applied Geochemistry, 20: 179-191. DOI:10.1016/j.apgeochem.2004.04.008 |
Knorr K, Blodau C. 2007. Controls on schwertmannite transformation rates and products[J]. Applied Geochemistry, 22: 2006-2015. DOI:10.1016/j.apgeochem.2007.04.017 |
Kumpulainen S, von der Kammer F, Hofmann T. 2008. Humic acid adsorption and surface charge effects on schwertmannite and goethite in acid sulphate waters[J]. Water Research, 42: 2051-2060. DOI:10.1016/j.watres.2007.12.015 |
Lackovic K, Angove M J, Wells J D, et al. 2004a. Modeling the adsorption of Cd(Ⅱ) onto goethite in the presence of citric acid[J]. Journal of Colloid and Interface Science, 269: 37-45. DOI:10.1016/j.jcis.2003.08.041 |
Lackovic K, Wells J D, Johnson B B, et al. 2004b. Modeling the adsorption of Cd(Ⅱ) onto kaolinite and Muloorina illite in the presence of citric acid[J]. Journal of Colloid and Interface Science, 270: 86-93. DOI:10.1016/j.jcis.2003.09.009 |
Lindegren M, Loring J S, Persson P. 2009a. Molecular structures of citrate and tricarballylate adsorbed on α-FeOOH particles in aqueous suspensions[J]. Langmuir, 25: 10639-10647. DOI:10.1021/la900852p |
Lindegren M, Loring J S, Persson P. 2009b. Molecular structures of citrate and tricarballylate adsorbed on Alpha-FeOOH particles in aqueous suspensions[J]. Langmuir, 25: 10639-10647. DOI:10.1021/la900852p |
Liu C, Huang P M. 2003. Kinetics of lead adsorption by iron oxides formed under the influence of citrate[J]. Geochimica et Cosmochimica Acta, 67: 1045-1054. DOI:10.1016/S0016-7037(02)01036-0 |
Marcussen H, Holm P E, Strobel B W, et al. 2009. Nickel sorption to goethite and montmorillonite in presence of citrate[J]. Environmental Science & Technology, 43: 1122-1127. |
Mudunkotuwa I A, Grassian V H. 2010. Citric acid adsorption on TiO2 nanoparticles in aqueous suspensions at acidic and circumneutral pH: Surface coverage, surface speciation, and its impact on nanoparticle-nanoparticle interactions[J]. Journal of the American Chemical Society, 132: 14986-14994. DOI:10.1021/ja106091q |
Otero-Fariña A, Peacock C, Fiol S, et al. 2017. A universal adsorption behaviour for Cu uptake by iron (hydr)oxide organo-mineral composites[J]. Chemical Geology, 479: 22-35. |
Owen D, Scot M. 2001. Surface complexation and dissolution of hematite by C1-C6 dicarboxylic acids at pH = 5.0[J]. Geochimica et Cosmochimica Acta, 65: 4289-4301. DOI:10.1016/S0016-7037(01)00696-2 |
Qu C, Chen W, Hu X, et al. 2019. Heavy metal behaviour at mineral-organo interfaces: Mechanisms, modelling and influence factors[J]. Environment International, 131: 104995. DOI:10.1016/j.envint.2019.104995 |
Riederer A M, Belova A, George B J, et al. 2013. Urinary Cadmium in the 1999-2008 U.S.National Health and Nutrition Examination Survey (NHANES)[J]. Environmental Science & Technology, 47: 1137-1147. |
Serrano S, O'Day P A, Vlassopoulos D, et al. 2009. A surface complexation and ion exchange model of Pb and Cd competitive sorption on natural soils[J]. Geochimica et Cosmochimica Acta, 73: 543-558. DOI:10.1016/j.gca.2008.11.018 |
Simanova A A, Loring J S, Persson P. 2011. Formation of ternary metal-oxalate surface complexes on α-FeOOH particles[J]. The Journal of Physical Chemistry C, 115: 21191-21198. DOI:10.1021/jp2058707 |
Stietiya M H, Wang J J. 2014. Zinc and cadmium adsorption to aluminum oxide nanoparticles affected by naturally occurring ligands[J]. Journal of Environmental Quality, 43: 498-506. DOI:10.2134/jeq2013.07.0263 |
Sun R C, Sun X F. 2001. Identification and quantitation of lipophilic extractives from wheat straw[J]. Industrial Crops and Products, 14: 51-64. DOI:10.1016/S0926-6690(00)00088-1 |
Sun S, Zhu J, Zheng Z, et al. 2019. Biosynthesis of β-cyclodextrin modified Schwertmannite and the application in heavy metals adsorption[J]. Powder Technology, 342: 181-192. DOI:10.1016/j.powtec.2018.09.072 |
Swedlund P J, Webster J G, Miskelly G M. 2009. Goethite adsorption of Cu(Ⅱ), Pb(Ⅱ), Cd(Ⅱ), and Zn(Ⅱ) in the presence of sulfate: Properties of the ternary complex[J]. Geochimica et Cosmochimica Acta, 73: 1548-1562. DOI:10.1016/j.gca.2008.12.007 |
Turner A. 2019. Heavy metals in the glass and enamels of consumer container bottles[J]. Environmental Science & Technology, 53: 8398-8404. |
Wu Z, Gu Z, Wang X, et al. 2003. Effects of organic acids on adsorption of lead onto montmorillonite, goethite and humic acid[J]. Environmental Pollution, 121: 469-475. DOI:10.1016/S0269-7491(02)00272-5 |
Xie Y, Lu G, Yang C, et al. 2018. Mineralogical characteristics of sediments and heavy metal mobilization along a river watershed affected by acid mine drainage[J]. Plos One, 13: e0190010. DOI:10.1371/journal.pone.0190010 |
谢莹莹. 2018. 溶解性有机质介导下酸性矿山废水中施氏矿物的转化机制及对重金属环境行为的影响[D]. 广州: 华南理工大学
|
Xue Q, Ran Y, Tan Y, et al. 2019. Arsenite and arsenate binding to ferrihydrite organo-mineral coprecipitate: Implications for arsenic mobility and fate in natural environments[J]. Chemosphere, 224: 103-110. DOI:10.1016/j.chemosphere.2019.02.118 |
Zhang Z, Guo G, Li X, et al. 2019. Effects of hydrogen-peroxide supply rate on schwertmannite microstructure and chromium(Ⅵ) adsorption performance[J]. Journal of Hazardous Materials, 367: 520-528. DOI:10.1016/j.jhazmat.2018.12.116 |
Zhu J, Pigna M, Cozzolino V, et al. 2010. Competitive sorption of copper(Ⅱ), chromium(Ⅲ) and lead(Ⅱ) on ferrihydrite and two organomineral complexes[J]. Geoderma, 159: 409-416. DOI:10.1016/j.geoderma.2010.09.006 |
 2021, Vol. 41
2021, Vol. 41


