硫化氢(Hydrogen sulfide, H2S)是继一氧化碳(CO)和一氧化氮(NO)之后的第3种气体信号分子, 在植物、动物和微生物体内均具有一定的生理功能(Wang, 2002).已有研究证明, 在哺乳动物中, H2S可舒张血管、降压, 并具有抗炎、抗氧化和抗凋亡等功能(Abe et al., 1996);当H2S代谢异常时, 可增加高血压、糖尿病、肝脏疾病等多种疾病发生的风险, 甚至引发癌症(徐文静, 2020;Zheng et al., 2021).在植物中, H2S参与了植物生长、发育、成熟和衰老整个生理过程(Jin et al., 2015;裴雁曦, 2016), 同时还可提高植物对环境胁迫的耐受性(Jin et al., 2015;Zhou et al., 2018;贾红磊等, 2020).在微生物中, Shen等(2012)发现表达拟南芥合成H2S酶编码基因的大肠杆菌, 对镉毒性的耐受性明显提高.
砷是一种存在于自然界且具有毒性的环境污染物, 可抑制植物幼苗根和茎的生长, 并改变植物学形态(de Freitas-Silva et al., 2016;Shamim et al., 2017);同时会导致肾、肺、肝脏等动物组织器官的损伤(Hu et al., 2018; Zhao et al., 2019;李秀娟等, 2019;Sosa et al., 2020).本课题组前期研究发现, 气体信号分子NO参与调控亚砷酸钠引起的细胞死亡(吴丽华等, 2012), 但H2S是否影响酵母细胞对砷的耐受性尚不清楚.因此, 本实验以模式生物酿酒酵母为研究材料, 分析亚砷酸钠对酵母细胞H2S代谢的影响, 以探讨H2S在酵母细胞应对砷胁迫中的作用, 以期为解释砷毒性机理及砷中毒防治方面提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验材料供试菌株酿酒酵母(BY4741), 保存于本实验室.
2.2 酵母细胞培养取酵母单菌落于YPD液体培养基后, 28 ℃、180 r·min-1条件下恒温培养至对数生长期, 然后进行砷胁迫处理.
2.3 亚砷酸钠对H2S产量的影响 2.3.1 醋酸铅试纸法将一定量对数期细胞接种于含0~2 mmol·L-1亚砷酸钠的YPD液体培养基中, 使各处理组培养液初始OD600相等且小于0.1, 同时在瓶口处放置醋酸铅纸条, 用橡胶塞塞住, 28 ℃、180 r·min-1条件下恒温振荡培养12或24 h后, 取下试纸条, 量取试纸条上黑色部分的长度, 同时测定培养液OD600.将试纸条上硫化铅黑色部分长度(cm)与培养液OD600的比值记为H2S相对含量(高雪洁等, 2018), 处理组OD600与对照组OD600的比值记为相对生长率.
2.3.2 BIGGY法参照马捷等(2013)的方法, 将对数期细胞(OD600约为1.8左右)用无菌水洗涤后, 各取5 μL点样至含不同浓度(0、0.5、1、1.5和2 mmol·L-1)亚砷酸钠的BIGGY培养基上, 28 ℃恒温培养48 h后, 观察记录, 并根据菌斑的颜色来判断H2S产量变化.
2.4 外源H2S对细胞相对存活率和砷耐受性的影响 2.4.1 细胞相对存活率检测将一定量对数期细胞用无菌水稀释到相同浓度后涂布至含不同浓度(0、1、1.5、2、2.5和5 mmol·L-1)NaHS的YPD固体培养基上, 使每个平板上含细胞数约300个左右, 28 ℃恒温倒置培养48 h后计数, 处理组菌落数除以对照组菌落数即为细胞相对存活率.
2.4.2 砷耐受性检测将相同数量的对数期细胞经不同浓度(0、0.05、0.1、0.15和0.2 mmol·L-1)NaHS预处理6 h后, 10倍梯度稀释, 并按一定顺序点样到含有0或1 mmol·L-1亚砷酸钠的YPD固体培养基中, 常规方法培养后观察, 拍照记录.
2.5 qRT-PCR检测参照本实验室已建立的方法(吴丽华等, 2019)提取RNA, 反转录并qRT-PCR, 然后计算基因的相对表达量.其中, ACT 1为本实验所选用的内参基因, 引物序列见表 1.
| 表 1 qRT-PCR引物 Table 1 Primers for qRT-PCR |
采用SPSS 16.0软件对实验结果进行Duncan检验, 分析所测指标在处理组与对照组间的差异显著性(*p < 0.05, * *p < 0.01), 然后用Graphpad Prism 7软件作图.
3 结果(Results) 3.1 酿酒酵母在不同生长时间段H2S产量变化H2S可与醋酸铅反应生成黑色的硫化铅沉淀, 因此, 试纸条颜色可间接反映酵母细胞H2S的产量.由图 1可知, 不同生长阶段的酵母, 产生H2S的量有所不同.在培养前10 h中, H2S产量很低, 在试纸条上几乎看不到沉淀颜色;培养10~14 h后, 试纸条下端可看到较深的颜色, 说明H2S释放量明显增多(图 1a);在12~24 h之间, H2S累积量明显多于前12 h(图 1b), 但在胁迫12 h和24 h均可以明显看到H2S的累积.因此, 在后续实验中选择12 h和24 h作为本实验的胁迫时间.
 |
| 图 1 酿酒酵母在不同生长时间段H2S产量变化 Fig. 1 Changes in H2S production of S. cerevisiae during different growth periods |
醋酸铅试纸条法和BIGGY法检测结果显示, 酵母细胞H2S产量随砷浓度升高呈现先升后降的趋势, 当亚砷酸钠浓度为1 mmol·L-1时, H2S产量最高(图 2a、2b和2e).在2 mmol·L-1处理组中, 试纸条上黑色部分长度短于对照组, 且BIGGY平板中几乎完全看不到H2S的累积(图 2c和2e), 但H2S相对含量却显著高于对照组(图 2d).这可能是因为高浓度砷虽然可增加相同数量细胞中H2S产生的量, 但由于细胞数量相对较少, 从而导致H2S相对总含量减少.
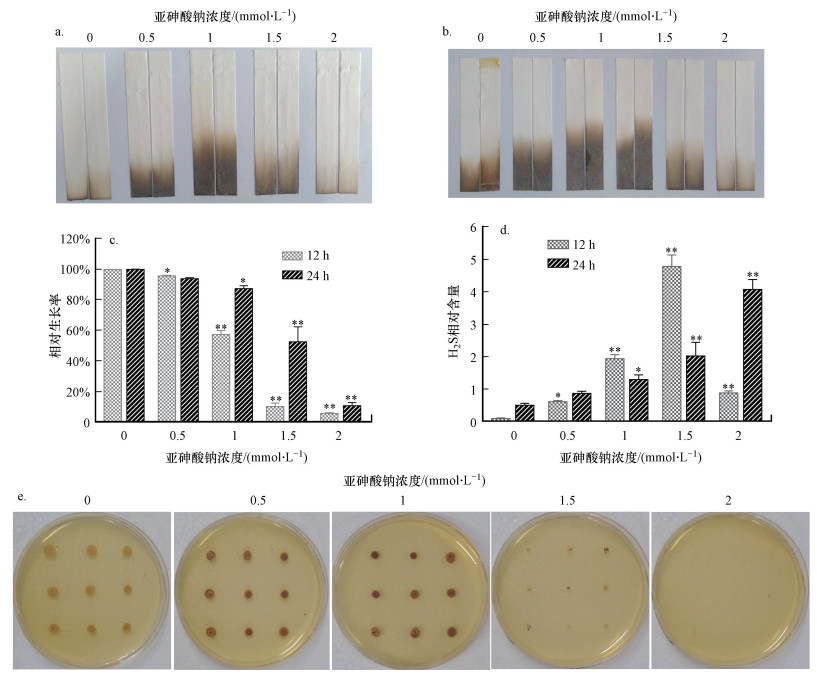 |
| 图 2 亚砷酸钠对酵母细胞H2S产量的影响(a.醋酸铅试纸法(12 h), b.醋酸铅试纸法(24 h);c.细胞生长情况;d.H2S相对含量;e.BIGGY法) Fig. 2 Effect of sodium arsenite on H2S production in yeast cells |
由图 3可知, 酵母细胞经0.5 mmol·L-1亚砷酸钠处理12 h后, 产H2S相关基因的相对表达量均与对照组间无显著差异;2 mmol·L-1处理组中, 产H2S相关基因的相对表达量均显著高于对照组.其中, MET5基因相对表达量在酵母细胞经亚砷酸钠胁迫12 h后呈先升后降的趋势, 在1.5 mmol·L-1处理组中相对表达量达到最高;胁迫24 h后, 其相对表达量随砷浓度的升高逐渐上升, 此结果与H2S相对含量结果一致(图 2d).结果表明, 亚砷酸钠可影响产H2S酶编码基因表达, 进而调节H2S产量.
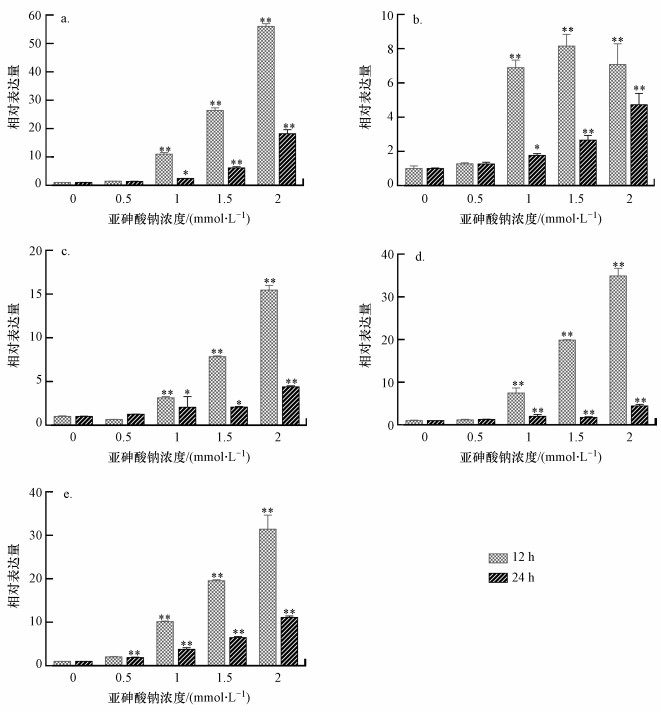 |
| 图 3 亚砷酸钠对酵母细胞产H2S相关基因表达的影响(a. MET3; b. MET5; c. MET10; d. MET14; e. MET16) Fig. 3 Effects of sodium arsenite on the relative gene expression of biosynthesis H2S related genes in yeast cells |
由图 4可知, NaHS可影响酵母细胞的活性.酵母细胞经NaHS胁迫后, 细胞相对存活率随着NaHS浓度的升高而逐渐降低;在高浓度处理组(1.5~5.0 mmol·L-1)中, 细胞相对存活率显著低于对照组(图 4a).酵母细胞经低浓度(0.05~0.2 mmol·L-1)NaHS预处理后, 细胞在含有1 mmol·L-1亚砷酸钠的平板中生长情况均明显优于砷单独处理组(未经NaHS预处理);经0.05 mmol·L-1NaHS预处理后, 在稀释倍数为105处, 仍长出一定数量的菌落, 而砷单独处理组中几乎看不到菌落(图 4b).结果说明, 高浓度NaHS可诱导细胞死亡, 低浓度NaHS可提高酵母细胞对砷的耐受性, 即H2S作为信号分子可在一定程度上调控酵母细胞的存活.
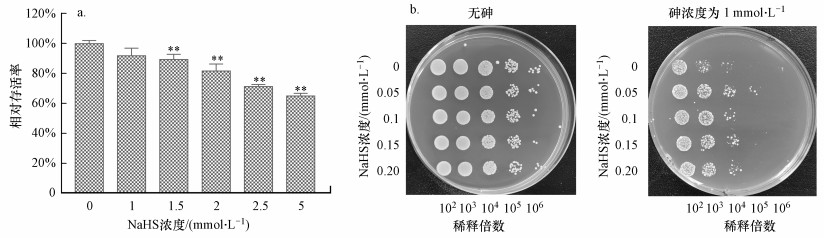 |
| 图 4 外源H2S对酵母细胞相对存活率(a)和砷耐受性(b)的影响 Fig. 4 Effects of exogenous H2S on relative survival rate(a) and arsenic tolerance(b) in yeast cells |
H2S作为一种内源性小分子, 其在生物体内的含量受各种外界胁迫的影响.已有大量研究证明, Cd胁迫可激活植物内源H2S的产生, 并上调H2S酶编码基因的表达(Cui et al., 2014;Shi et al., 2014;Zhang et al., 2015).吴帼秀等(2020)在黄瓜幼苗中发现, 低温胁迫亦可诱导植物体内H2S的迅速产生.本实验中, 亚砷酸钠可激活酵母细胞内源H2S的产生, H2S相对含量随着砷浓度的升高而逐渐升高.醋酸铅试纸条法和BIGGY法检测结果显示, 内源H2S含量随着砷胁迫浓度的升高呈现先升后降的趋势, 这可能是因为高浓度亚砷酸钠可完全抑制酵母细胞的生长, 使细胞总量减少, 导致H2S总释放量减少.本实验中采用的酿酒酵母为本课题组长期使用的一种实验材料, 具有生长周期短、培养条件简单、遗传背景清楚等优点, 且前期研究结果与多数学者在植物和动物研究中的结果一致(Wu et al., 2013; Wu et al., 2016; 吴丽华等, 2019).因此, 本实验结果可为探讨亚砷酸钠对高等生物硫代谢的影响提供实验依据.
在酵母细胞中, H2S的产生与含硫氨基酸的代谢和有机含硫化合物的合成有关, 是硫酸盐代谢过程中的产物之一(Beinrt et al., 1997).硫酸盐进入细胞后, 可依次在ATP硫酸化酶(MET3)、5-磷酸硫酸腺苷激酶(MET14)、3-磷酸腺苷硫酸盐还原酶(MET16)和亚硫酸还原酶(MET5和MET10)的作用下生成H2S(Marzluf, 1994).因此, 这些基因表达的高低会在一定程度上影响酵母内源H2S的生成.本研究发现, 亚砷酸钠可上调产H2S酶编码基因MET3、MET10、MET14及MET16的表达, 且随着砷浓度的升高而逐渐上调.MET5基因的表达量在胁迫24 h后也呈现相同趋势, 而在胁迫12 h后, 呈先升高后降低的趋势, 其表达变化趋势与H2S相对含量具有一致性, 说明MET5在砷胁迫下调控内源H2S产生的过程中起重要作用.
砷作为一种毒性较强的重金属, 可通过添加外源H2S(NaHS)缓解其对豌豆幼苗的毒性(Singh et al., 2015).潘际刚等(2020)在SH-SY5Y细胞中也证明了NaHS对砷毒性具有同样的干预效果.陈志刚(2018)用MET5突变株研究时发现, H2S的释放量在一定程度上会影响酵母对金属铜和锌的耐受性.本研究结果显示, 高浓度NaHS可诱导酵母细胞死亡, 而0.05~0.2 mmol·L-1的NaHS可以缓解重金属对酵母细胞的毒性作用.以上结果说明, 亚砷酸钠可以通过改变H2S酶编码基因的表达而影响酵母细胞H2S产生的量, 而H2S含量在一定程度上可干预亚砷酸钠对酵母细胞的毒性.
5 结论(Conclusions)亚砷酸钠可激活酵母细胞内源H2S的产生, 诱导产H2S酶编码基因的表达上调.低浓度NaHS可提高酵母细胞对砷的耐受性, 而高浓度NaHS可诱导酵母细胞死亡, 推测H2S参与调控酿酒酵母对砷化物的耐受性.该研究可为砷毒性的干预及NaHS的安全使用提供实验依据.
Abe K, Kimura H. 1996. The possible role of hydrogen sulfide as an endogenous neuromodulator[J]. The Journal of neuroscience: the official journal of the Society for Neuroscience, 16(3): 1066-1071. DOI:10.1523/JNEUROSCI.16-03-01066.1996 |
Beinrt H, HolmR H, Münck E. 1997. Iron-sulfur clusters: nature's modular, multipurpose structures[J]. Science, 277(5326): 653-659. DOI:10.1126/science.277.5326.653 |
Cui W T, Chen H P, Zhu K K, et al. 2014. Cadmium-induced hydrogen sulfide synthesis is involved in cadmium tolerance in medicago sativa by reestablishment of reduced (homo) glutathione and reactive oxygen species homeostases[J]. PLoS One, 9(10): 109669. DOI:10.1371/journal.pone.0109669 |
陈志刚. 2018. 酿酒酵母中硫代谢的研究[D]. 济南: 山东大学. 52
|
de Freitas-Silva L, de Araújo T O, da Silva L C, et al. 2016. Arsenic accumulation in Brassicaceae seedlings and its effects on growth and plant anatomy[J]. Ecotoxicology and Environmental Safety, 124: 1-9. DOI:10.1016/j.ecoenv.2015.09.028 |
高雪洁, 刘冰花, 吕舟, 等. 2018. SCH9基因对酿酒酵母中H2S代谢的影响[J]. 四川大学学报(自然科学版), 55(2): 381-386. DOI:10.3969/j.issn.0490-6756.2018.02.030 |
Hu Y, Yu C, Yao M, et al. 2018. The PKCδ-Nrf2-ARE signaling pathway may be involved in oxidative stress in arsenic-induced liver damage in rats[J]. Environmental Toxicology and Pharmacology, 62: 79-87. DOI:10.1016/j.etap.2018.05.012 |
贾红磊, 刘华欣, 马佩云, 等. 2020. 硫氢化钠在缓解菘蓝幼苗镉胁迫中的作用[J]. 陕西科技大学学报, 38(1): 32-37. DOI:10.3969/j.issn.1000-5811.2020.01.006 |
Jin Z P, Pei Y X. 2015. Physiological implications of hydrogen sulfide in plants: Pleasant exploration behind its unpleasant odour[J]. Oxidative Medicine and Cellular Longevity, 2015: 397502. |
马捷, 王磊, 刘延琳. 2013. 葡萄酒酵母筛选过程中菌株产硫化氢特性的评价[J]. 西北农业学报, 22(3): 168-172. |
李秀娟, 仪慧兰, 曾群. 2019. 砷暴露诱导小鼠空肠结构损伤和免疫紊乱[J]. 环境科学学报, 39(4): 1348-1354. |
Marzluf G A. 1994. Genetics and molecular genetics of sulfur assimilation in the fungi[J]. Advanced Genetics, 31: 187-206. |
潘际刚, 吴昌学, 齐晓岚, 等. 2020. 亚砷酸钠诱导SH-SY5Y细胞凋亡及硫化氢的干预作用[J]. 贵州医科大学学报, 45(11): 1255-1259. |
裴雁曦. 2016. 植物中的气体信号分子硫化氢: 无香而立, 其臭如兰[J]. 中国生物化学与分子生物学报, 32(7): 721-733. |
Shamim M Z, Pandey A. 2017. Effects of arsenic toxicity on morphological characters in blackgram (Vigna mungo L.) during early growth stage[J]. Cellular and Molecular Biology (Noisy-le-grand), 63(6): 38-43. DOI:10.14715/cmb/2017.63.6.8 |
Shen J J, Qiao Z J, Xing T J, et al. 2012. Cadmium toxicity is alleviated by AtLCD and AtDCD in Escherichia coli[J]. Journal of Applied Microbiology, 113(5): 1130-1138. DOI:10.1111/j.1365-2672.2012.05408.x |
Shi H, Ye T, Chan Z. 2014. Nitric oxide-activated hydrogen sulfide is essential for cadmium stress response in bermudagrass (Cynodon dactylon (L).Pers.)[J]. Plant Physiology and Biochemistry, 74: 99-107. DOI:10.1016/j.plaphy.2013.11.001 |
Singh V P, Singh S, Kumar J, et al. 2015. Hydrogen sulfide alleviates toxic effects of arsenate in pea seedlings through up-regulation of the ascorbate-glutathione cycle: Possible involvement of nitric oxide[J]. Journal of Plant Physiology, 181: 20-29. DOI:10.1016/j.jplph.2015.03.015 |
Sosa C, Guillén N, Lucea S, et al. 2020. Effects of oral exposure to arsenite on arsenic metabolism and transport in rat kidney[J]. Toxicology Letters, 333: 4-12. DOI:10.1016/j.toxlet.2020.07.029 |
Wang R. 2002. Two's company, three's a crowd: can H2S be the third endogenous gaseous transmitter[J]. FASEB Journal, 16(13): 1792-1798. DOI:10.1096/fj.02-0211hyp |
吴帼秀, 李胜利, 李阳, 等. 2020. H2S和NO及其互作对低温胁迫下黄瓜幼苗光合作用的影响[J]. 植物生理学报, 56(10): 2221-2232. |
吴丽华, 陈燕飞, 仪慧兰, 等. 2019. 氧化胁迫参与硫酸锌诱导的酵母细胞死亡[J]. 环境科学学报, 39(9): 3188-3194. |
Wu L H, Chen Y F, Gao H X, et al. 2016. Cadmium-induced cell killing in Sacharomyces cerevisiae involves increases in intracellular NO levels[J]. FEMS Microbiology Letters, 363: 57-63. |
吴丽华, 仪慧兰, 张虎芳. 2012. NO参与亚砷酸钠诱导酵母细胞死亡的调控[J]. 环境科学学报, 32(10): 2612-2616. |
Wu L H, Yi H L, Zhang H F. 2013. Reactive oxygen species and Ca2+ are involved in sodium arsenite-induced cell killing in yeast cells[J]. FEMS Microbiology Letters, 343: 57-63. DOI:10.1111/1574-6968.12131 |
徐文静. 2020. 肝脏内源性硫化氢代谢和功能[J]. 生命的化学, 40(8): 1289-1297. |
Zhang L P, Pei Y X, Wang H J, et al. 2015. Hydrogen sulfide alleviates cadmium-induced cell death through restraining ROS accumulation in roots of Brassica rapa L.ssp.Pekinensis[J]. Oxidative Medicine and Cellular Longevity, 2015: 804603. |
Zhao Y, Su X, Gao Y, et al. 2019. Exposure of low-concentration arsenic-initiated inflammation and autophagy in rat lungs[J]. Journal of Biochemical and Molecular Toxicology, 33(7): e22334. |
Zheng H L, Ma M X, Shi Y S, et al. 2021. Tumor microenvironment-triggered MoS2@GA-Fe nanoreactor: A self-rolling enhanced chemodynamic therapy and hydrogen sulfide treatment for hepatocellular carcinoma[J]. Chemical Engineering Journal, 406: 126888. DOI:10.1016/j.cej.2020.126888 |
Zhou Z H, Wang Y, Ye X Y, et al. 2018. Signaling molecule hydrogen sulfide improves seed germination and seedling growth of maize (Zea mays L.) under high temperature by inducing antioxidant system and osmolyte biosynthesis[J]. Frontiers in Plant Science, 9: 1288. DOI:10.3389/fpls.2018.01288 |
 2021, Vol. 41
2021, Vol. 41


