2. 山西大学资源与环境学院, 太原 030006;
3. 山西省黄河实验室, 太原 030006
2. College of Environment and Resources, Shanxi University, Taiyuan 030006;
3. Shanxi Laboratory for Yellow River, Taiyuan 030006
抗生素在人类防治细菌感染和保障畜牧业发展方面发挥了重大作用.然而, 随着抗生素的长期大量使用甚至滥用, 抗生素耐药细菌(ARBs)和抗性基因(ARGs)问题已成为全球最严重的公共卫生问题之一.我国是世界上最大的抗生素生产和消费国, 2013年我国抗生素使用情况调查表明, 抗生素总产量为248000 t, 总用量约为162000 t, 人用抗生素占48%, 其余为兽用(Ying et al., 2017).我国抗生素的广泛使用已经导致抗生素及其抗性基因在土壤等多种环境介质中普遍被检出, 对人体健康和生态环境安全构成潜在威胁(Ying et al., 2017; Ben et al., 2019).
土壤是抗生素及其抗性基因重要的“汇”之一(Zeng et al., 2019).抗生素残留是诱导环境中抗性基因形成的关键因素(Ben et al., 2019).畜禽粪便及其堆肥产品施用和再生水灌溉等人类活动是抗生素进入农田土壤系统的重要途径(赵方凯等, 2018).抗生素污染源周边农田土壤中抗生素的残留浓度甚至达到mg·kg-1水平(Qiao et al., 2018).因此, 十分有必要采取有效措施促进我国土壤环境中抗生素的消减, 以降低其生态环境风险.
生物质炭是生物质在缺氧条件下热解得到的富含碳的固体材料.近20多年来, 学者们对开发生物质炭功能的兴趣越来越浓厚, 并且在生物质炭减缓气候变化、改良土壤、废物管理、去除/固定污染物等方面取得了诸多成果(黄敏等, 2019;Xiang et al., 2020).在有机污染土壤修复方面, 生物质炭能够通过吸附-固定作用降低有机污染物的生态环境风险, 或者通过调控土壤微生物群落结构, 促进有机污染物的微生物降解(Qin et al., 2013; Ali et al., 2019)抗生素在土壤中的消减既存在吸附、水解和氧化等非生物消减, 也存在微生物降解的生物消减(Pan et al., 2016).一直以来, 利用生物质炭消减环境介质中的抗生素也备受学者们的关注(Dai et al., 2019).生物质炭对不同分子结构类型抗生素的吸附能力差异较大, 进而影响抗生素的水解、氧化和微生物降解等环境行为(Ngigi et al., 2019).因此, 十分有必要进一步深入研究生物质炭对土壤中不同分子结构类型抗生素的非生物和生物消减影响机制.
本研究针对当前土壤抗生素复合污染的现状, 研究生物质炭对土壤中四环素类、磺胺类和喹诺酮类抗生素的非生物和生物消减影响机制, 评估生物质炭对土壤中抗生素潜在生态环境风险的影响.本研究结果将为利用生物质炭修复抗生素污染农田土壤提供理论依据和数据支撑.
2 材料与方法(Materials and methods) 2.1 试剂和提取剂抗生素标准品购于德国Dr. Ehrenstorfer公司.四环素类(TCs):四环素(97.7%)、土霉素(96.5%)、金霉素(99.5%)、强力霉素(98.7%);磺胺类(SAs):磺胺嘧啶(99.2%)、磺胺甲恶唑(99.4%)、磺胺二甲嘧啶(99.0%)、磺胺间甲氧嘧啶(95%)、磺胺喹恶啉(99.0%)、磺胺二甲氧嗪(99.5%)、磺胺对甲氧嘧啶(98.0%)、磺胺氯吡嗪(99.0%);喹诺酮类(QLs):诺氟沙星(99.1%)、氧氟沙星(99.3%)、环丙沙星(94.0%)、恩诺沙星(98.5%).回收率指示物:地美环素(99.0%)、磺胺甲恶唑-D4(98.2%)、环丙沙星-D8(CFC-D8, 94.0%).内标物:四环素-D6(80%)、磺胺地托辛-D6(99.8%)、恩诺沙星-D5、(EFC-D5, 99.0%).色谱纯甲醇和乙腈购于Dikma公司.所用无机试剂均为优级纯.实验用水均为超纯水(电阻率为18.25 MΩ·cm).
EDTA-SPB:将10.56 g NaH2PO4·2H2O溶解于1 L水中, 用稀H3PO4将pH调节至4, 加入80.0 g Na2EDTA·2H2O超声溶解(40 min)后混合均匀.50%Mg(NO3)2-2.5%NH3·H2O:将50 g Mg(NO3)2·6H2O溶解于100 mL水中得50%的Mg(NO3)2, 将质量分数为25%的NH3·H2O稀释10倍后得2.5%的NH3·H2O, 50%的Mg(NO3)2和2.5%的NH3·H2O按体积比96∶ 4(V/V)混合均匀.使用前将EDTA-SPB、Mg(NO3)2-NH3·H2O与乙腈以体积比1∶ 1.5∶ 1.5混合, 用玻璃棒搅拌均匀后, 加入少量的H3PO4调节pH=3.以上溶液的配制均需现用现配.
2.2 材料土壤样品采集和理化性质分析:土壤样品采自山西省榆次市荣村某农田表层土壤(0~20 cm).该农田及其周边农田中的农作物均为玉米.采样时间为夏季.土壤去除大颗粒杂物后, 于阴凉处风干, 研磨, 过2 mm筛子.土壤粒径组成为2.35%的黏粒、11.26%的粉粒和86.39%的沙粒.土壤pH(7.68±0.02)采用pH计测定(土∶水=1∶ 2.5, W/V).土壤有机碳(TOC, (47.81±1.54) g·kg-1)采用外加热法测定.阳离子交换量(CEC, (30.51±0.93) cmol·kg-1)采用醋酸铵交换法测定.土壤中所研究抗生素低于检出限.
生物质炭制备和表征:玉米轴(CC)、玉米秸秆(CS)和核桃壳(WS)分别于250、400和600 ℃缺氧热解4 h, 根据制备原料和热解温度将生物质炭标记为CC2、CC4、CC6、CS2、CS4、CS6、WS2、WS4、WS6(数字2、4和6分别表示制备温度250、400和600 ℃).得到的生物质炭经研磨后过0.15 mm筛.生物质炭pH测定方法是将生物质炭与水的悬浊液(1∶ 20, W/V)振荡2 h后, 离心测上清液的pH(Liu et al., 2018).用稀HCl或NaOH将生物质炭的pH调至中性(6.71~7.66), 80 ℃烘干12 h.生物质炭的电导率采用水浸提法测定(生物质炭∶水= 1∶ 20, W/V).生物质炭的灰分含量是原生物质炭质量减去生物质炭于750 ℃高温灼烧4 h后质量的差值.生物质炭中C、H和N元素的百分含量用Vario EI型元素分析仪测定, O含量通过质量平衡方法来计算.比表面积用ASAP-2020型N2-BET比表面积分析仪测定.
鸡粪来源有机肥:本研究中的鸡粪来源有机肥是商品化有机肥, 购自江苏省徐州市一家有机肥公司.将有机肥样品于阴凉处风干, 研磨后过0.15 mm筛.有机肥样品的pH(9.33±0.03)和有机质含量((247.4±5.67) g·kg-1) 测定方法与土壤测定方法一致.鸡粪来源有机肥样品中主要含有金霉素((1449± 40.16) μg·kg-1)、强力霉素((2019±20.94) μg·kg-1)、诺氟沙星((947±15.71) μg·kg-1)、氧氟沙星((2396±40.16) μg·kg-1)、环丙沙星((2736±32.25) μg·kg-1)和恩诺沙星((420±17.45) μg·kg-1), 磺胺类抗生素未检出.
2.3 实验设计灭菌组:8 kg土壤样品和100 g鸡粪堆肥样品分别采用高压蒸汽灭菌锅连续灭菌3 d(120 ℃, 30 min).取50 g灭菌的鸡粪堆肥样品, 加标10 mL含有16种抗生素的混合标液(溶剂为甲醇, 浓度为500 mg·L-1).加标后的鸡粪堆肥样品于阴凉处风干以去除甲醇溶剂.将50 g已风干的抗生素加标鸡粪堆肥样品施加到4.95 kg灭菌土壤中, 充分混合均匀, 于避光条件下老化7 d.将老化后的抗生素污染土壤冷冻干燥, 干燥后再次搅拌均匀, 测定土壤中抗生素含量, 将其作为土壤培养实验的初始浓度.称取160 g老化后的抗生素污染土壤, 添加到垫有滤纸的灭菌塑料花盆中(上口直径10 cm、高度8.5 cm), 按照每个处理组3个平行, 共计30个盛有抗生素污染土壤的花盆.将各生物质炭以1%的施加量(W/W)添加到盛有土壤的花盆中, 充分混合均匀.未施加生物质炭样品的处理组作为对照.所有花盆均于25 ℃恒温培养箱在黑暗条件培养, 每2 d采用称重法补充灭菌的去离子水, 将土壤水分保持于70%的持水量.30 d后取出土壤样品进行冷冻干燥处理, 再次搅拌均匀, 研磨过0.15 mm筛, 自封袋密封并保存于-15 ℃冰箱待用.
未灭菌组:与灭菌组不同之处在于, 土壤样品未进行灭菌操作, 以考察微生物对抗生素消减的作用.其余方面的操作与灭菌组完全一致.
2.4 抗生素的提取和测定抗生素提取、测定和质量控制与保证方法的详细步骤见我们以往的研究(Zhang et al., 2020).这里简要概述如下:将100 μL浓度为1 mg·L-1回收率指示物加标到1 g土壤中, 加标水平为100 μg·kg-1.用20 mL提取液(Mg(NO3)2-NH3·H2O∶ EDTA-SPB∶乙腈=1∶ 1.5∶ 1.5, V/V/V)反复提取3次, 再用10 mL缓冲液清洗残渣, 振荡10 min.合并所有上清液并稀释至550 mL, 通过强阴离子萃取柱(SAX)-亲水亲脂平衡萃取柱(HLB)串联的固相萃取装置对提取液中的抗生素进行萃取富集.上样前, 用10 mL甲醇、10 mL超纯水依次活化SAX-HLB串联萃取柱.将提取液以5 mL·min-1的流速过萃取柱富集.用含0.2%甲酸的10 mL甲醇溶液洗脱, 洗脱液在40 ℃水浴条件下氮吹至0.5 mL左右.将浓缩液全部转移至进样瓶, 并用含0.2%甲酸的1 mL甲醇溶液清洗, 将清洗液转移至进样瓶, 氮吹至0.5 mL.如此清洗2次, 并将最后一次清洗液超声1 min, 氮吹至近干后, 立即用甲醇-水(V/V=3∶ 7, 含0.2%甲酸)定容至1 mL, 漩涡混匀后超声1 min促溶.
高效液相色谱条件:高效液相色谱仪为Agilent 1200, Inertsil ODS-3色谱柱(250 mm × 4.6 mm, 5 μm, Dikma Company, Japan).流动相为0.1%甲酸/水(V/V)(A)和0.1%(V/V)甲酸/乙腈(B), 流速0.8 mL·min-1, 柱温40 ℃, 进样量10 μL.梯度林夕程序为:0~5 min:90%A, 10%B; 5~10min:75%~63%A, 25%~37%B; 10~16min:63%~5%A, 37%~95%B; 16~19min:5%A, 95%B; 19~22min:5%~90%A, 95%~10%B; 90%A和10%B保持4 min.
质谱条件:三重四级杆质谱(API 3200, AB-Sciex, Framingham, MA)用于检测和识别目标抗生素.电喷雾离子源, 正离子扫描模式(ESI+), 喷雾电压为5000 V, 离子源温度为650 ℃, 脱溶剂气的流速为65 L·min-1, 气帘气的流速为30 L·min-1, 碰撞气的流速为10 L·min-1, 采用分时间段多反应监测模式(MRM)检测, 以每种化合物的保留时间为中心, 监测窗口80 s, 扫描时间0.6 s.优化的MRM离子对、保留时间、锥孔电压、碰撞池入口电压、碰撞能、碰撞池出口电压及离子丰度比等信息见我们以往的研究(Zhang et al., 2020).
土壤中抗生素的分级提取:为了计算土壤中抗生素的表观分配系数(Kapp), 将土壤采用H2O(水溶态), 0.01 mol·L-1 CaCl2(可交换态)和EDTA-Mcllvaine(轻结合态)进行分级提取.其余步骤同上.紧密结合态为总量减去上述3种形态.
质量控制与保证:仪器空白, 溶剂空白, 全程序空白都低于检出限. 分别采用3倍和10倍信噪比计算仪器检出限(LOD)和仪器定量限(LOQ).以浓度为50 μg·L-1的标准样品, 在相同条件下每隔24 h连续进样6次, 峰面积的相对标准偏差小于20%, 否则对仪器进行调谐, 确保峰宽(0.6~0.8 s)和质量偏移(±0.1 Da)在正常范围, 以保证仪器精密度.每个样品在分析前都加入100 μg·kg-1的回收率指示物储备液, 通过测定回收率指示物的回收率情况监控准确度.本研究中四环素类、磺胺类和喹诺酮类抗生素的方法回收率分别为46.27%~72.09%、44.43%~75.98%和40.45%~61.92%.本研究的回收率范围与以往关于土壤中抗生素的回收率范围相当(丁炎强等, 2013)
2.5 数据分析使用IBM SPSS Statistics 22.0对数据进行统计分析, 通过单因素方差分析(ANOVA)确定差异的统计显著性, 再进行Tukey事后检验, 设置95%的置信区间计算最小显著性差异, 显著性水平设为p < 0.05.采用OriginPro 9.1绘制柱状图.使用R 3.5.1的pheatmap包对不同处理组和消减率、表观分配系数进行层次聚类分析.
3 结果与讨论(Results and discussion) 3.1 生物质炭表征及其对土壤理化性质的影响生物质炭的表征结果与以往的研究结果一致(表 1):除pH外, 随着热解温度的升高, 生物质炭中碳含量增多, 而氢和氧含量减少;H/C和(O+N)/C原子比降低;比表面积增大(Chen et al., 2008; Zheng et al., 2013).生物质炭对土壤pH、总有机碳和阳离子交换量的影响见表 2.生物质炭对灭菌和未灭菌土壤的pH影响不大(p>0.05, 除了WS6处理未灭菌土壤).研究发现:在生物质炭施加量较低的情况下, 生物质炭对弱碱性土壤的pH影响较小(Al-Wabel et al., 2015).CC4、CS6、WS4和WS6显著增加了灭菌土壤中的有机碳含量(p < 0.05).生物质炭是富含碳的碳质材料, 能够有效提高土壤, 特别是低肥力土壤中的有机碳含量(罗梅等, 2018).生物质炭对灭菌和未灭菌土壤的阳离子交换量影响不大(p>0.05).这与大多数以往研究中生物质炭显著提高土壤阳离子交换量的结果不一致(El-Naggar et al., 2019).本研究土壤中存在少量鸡粪堆肥产品, 而鸡粪堆肥产品通常具有较高的阳离子交换量, 导致生物质炭对土壤的阳离子交换量影响不大(Zhang et al., 2020).
| 表 1 调节pH后的生物质炭的性质 Table 1 The properties of biochars after adjusting pH |
| 表 2 灭菌和未灭菌土壤理化性质1) Table 2 The properties of the sterilized and unsterilized soil |
如图 1所示, 四环素类、磺胺类和喹诺酮类抗生素的初始浓度分别为503~1472、265~515和874~1742 μg·kg-1.尽管所有抗生素加标浓度一致, 但经过7 d老化作用后, 所测得的土壤中抗生素初始浓度具有较大差异.一方面是因为不同抗生素在土壤颗粒上的吸附能力有显著差异, 导致不同抗生素的方法回收率有一定的差异(丁炎强等, 2013).如鸡粪来源有机肥中未检出磺胺类抗生素, 但磺胺类抗生素之间的浓度仍然具有一定的差异, 主要是回收率差异所致.另一方面是因为金霉素、强力霉素和4种喹诺酮类抗生素在鸡粪来源有机肥中具有较高的浓度水平, 其总体浓度水平显著高于其他抗生素的浓度水平.因此, 本研究中的初始浓度并非以加标浓度为依据, 而是以经过7 d老化作用后的实际检测浓度为依据.
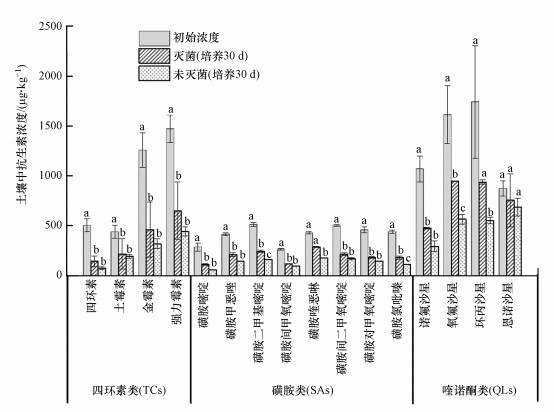 |
| 图 1 土壤中抗生素初始浓度和培养30 d后的残留浓度(不同小写字母表示不同处理间差异显著, p < 0.05) Fig. 1 The initial and residual concentrations of antibiotics in soil after incubation for 30 days (The different lowercase letter means significant difference between different treatments) |
经过30 d的土壤培养实验, 灭菌土壤中四环素类、磺胺类和喹诺酮类抗生素的残留浓度分别降低到142~651、113~288和476~949 μg·kg-1(p < 0.05), 未灭菌土壤中四环素类、磺胺类和喹诺酮类抗生素的残留浓度分别降低到74~441、61~177和294~686 μg·kg-1(p < 0.05)(图 1).未灭菌土壤中磺胺二甲基嘧啶、磺胺喹恶啉、磺胺氯吡秦、氧氟沙星和环丙沙星的浓度水平显著低于其在灭菌土壤中的浓度水平(p < 0.05).这是因为灭菌土壤中抗生素主要发生吸附和水解等非生物消减作用, 而未灭菌土壤除了非生物消减作用还存在微生物降解作用(Zhang et al., 2017;邓雅文, 2020).除上述抗生素以外, 其余抗生素在灭菌和未灭菌土壤中残留浓度的差异不显著(p>0.05).这可能是因为这些抗生素在土壤颗粒上的吸附能力较强导致其生物可利用性较低所致(Zhang et al., 2017).本研究的所有土壤培养实验是在黑暗条件下进行, 因此, 未灭菌和灭菌土壤中抗生素发生光解作用的可能性都很小.
为了比较不同类型抗生素的消减规律, 本研究重点对抗生素的消减百分比(消减率)进行探讨, 以消除不同抗生素初始浓度和回收率差异的影响.灭菌土壤中四环素类、磺胺类和喹诺酮类抗生素的消减率分别为50%~72%、33%~61%和14%~56%;未灭菌土壤中其消减率分别为56%~85%、58%~78%和21%~72%(图 2).通常, 未灭菌土壤中抗生素的消减率略高于灭菌土壤, 这与两种土壤中抗生素残留浓度的结果一致.从分子结构和性质角度分析, ①四环素类.灭菌和未灭菌土壤中土霉素消减率最低(p < 0.05), 其余四环素类抗生素消减率之间无显著差异(p > 0.05).以往的研究已证实辛醇-水分配系数(logKow)与疏水性有机物在吸附剂颗粒上的吸附能力呈正相关(Wang et al., 2016).土霉素的logKow值较四环素高(Zhang et al., 2020), 在土壤颗粒上吸附能力高于四环素(Conde-Cid et al., 2019), 但土霉素的非生物和生物消减率却低于四环素, 这表明吸附作用并非是导致土霉素非生物和生物消减率最低的关键因素.四环素类抗生素的酸离解常数(pKa1、pKa2和pKa3)相近(Zhang et al., 2020), 因此, 酸离解常数并非导致土霉素非生物和生物消减率最低的关键因素(Fernández-Calviño et al., 2015).导致土霉素消减率低的主要原因可能是土霉素在实际土壤环境中较难发生水解等非生物转化(Sanderson et al., 2005).②磺胺类.灭菌土壤中磺胺喹恶啉消减率最低(p < 0.05), 其余磺胺类抗生素之间非生物消减率无显著差异(p>0.05).磺胺喹恶啉的logKow值和pKa2值均高于其他磺胺类抗生素.logKow值高使磺胺喹恶啉具有较强的疏水性, pKa2值高使磺胺喹恶啉在本研究土壤pH范围内以两性离子形态存在, 这都将有利于磺胺喹恶啉在土壤颗粒上的吸附(Zheng et al., 2013).因此, 单吸附作用不足以解释磺胺喹恶啉非生物消减率最低的原因.磺胺喹恶啉在本研究土壤pH条件下的化学稳定性可能是导致其非生物消减率最低的关键因素(Białk-Bielinska et al., 2012).但在未灭菌土壤中, 磺胺喹恶啉的消减率与除了磺胺嘧啶和磺胺氯吡秦以外的磺胺类抗生素之间无显著差异, 这表明磺胺喹恶啉较易于被微生物降解.③喹诺酮类.灭菌土壤中喹诺酮类抗生素的非生物消减变化趋势为诺氟沙星>氧氟沙星~环丙沙星>恩诺沙星(p < 0.05), 这一变化趋势与其logKow值的变化趋势基本一致.虽然环丙沙星的logKow值高于氧氟沙星, 但两者的消减率无显著差异, 这主要是因为氧氟沙星分子中较环丙沙星多一个含氧官能团, 使氧氟沙星更易于与土壤颗粒形成氢键作用.可见, 吸附作用是控制喹诺酮类抗生素非生物消减的关键因素.在未灭菌土壤中, 恩诺沙星消减率最低(p < 0.05), 表明恩诺沙星较其它喹诺酮类抗生素更难被微生物降解(Alexandrino et al., 2017).与灭菌土壤不同, 未灭菌土壤中氧氟沙星和环丙沙星的消减率与诺氟沙星的消减率之间的差异不显著(p>0.05), 表明氧氟沙星和环丙沙星比诺氟沙星更易于被微生物降解(Dorival-García et al., 2013).
 |
| 图 2 土壤培养30 d后的抗生素消减率(不同小写字母表示同一处理组不同抗生素之间的差异显著, p < 0.05) Fig. 2 The dissipation rates of antibiotics in soil after incubation for 30 days (The different lowercase letter means significant difference between different antibiotics in the same treatment) |
为了消除抗生素初始浓度差异的影响, 明确生物质炭影响抗生素非生物和生物消减的机制, 本研究对灭菌和未灭菌土壤中抗生素的消减率进行了聚类分析(图 3).生物质炭处理的灭菌土壤中四环素类、磺胺类和喹诺酮类抗生素的消减率分别为32%~80%、21%~81%和7%~71%, 而未灭菌土壤中三类抗生素的消减率分别为56%~92%、43%~83%和16%~82%.与对照组消减率相比, 生物质炭处理土壤的消减率根据生物质炭的种类不同而具有差异.
 |
| 图 3 灭菌和未灭菌土壤中抗生素消减率的聚类分析 Fig. 3 Clustering analysis of the dissipation of antibiotics in the sterilized and unsterilized soil |
灭菌土壤不同处理组的聚类结果为:对照组抗生素的消减率与CS2、CS6、CC2和CC6处理组的消减率聚类(SI组), 表明这些生物质炭对灭菌土壤中抗生素消减的影响较小.CC4、CS4、WS4和WS6处理组抗生素的消减率聚类(SII组), 未与对照组聚类, 表明这些生物质炭对灭菌土壤中抗生素消减影响较大.WS2处理组单独聚类(SIII组), WS2对灭菌土壤中抗生素消减的影响最大, WS2通常促进了三类抗生素的非生物消减.与其他生物质炭相比, WS2的H/C和(O+N)/C原子比数值最高, 表明WS的炭化程度较低且具有较多的极性官能团(Chen et al., 2008).生物质炭表面的极性官能团可以成为水结合中心, 促进水团簇的形成(Wang et al., 2006).生物质炭表面的水团簇将有利于生物质炭表面及其周围抗生素的水解作用(Zhang et al., 2017).SII组与SI组的主要不同点在于, SII组的喹诺酮类抗生素(除了恩诺沙星)的非生物消减率高于SI组, 而四环素类的非生物消减率低于SI组.SI组和SII组对磺胺类抗生素的非生物消减影响的差异不大.这表明灭菌土壤中三类抗生素之间的竞争吸附主要发生在四环素类与喹诺酮类抗生素之间(Luo et al., 2018).四环素类和喹诺酮类(除了恩诺沙星)抗生素的logKow值比较接近(分别为-1.3~-0.02和-1.08~0.28), 而与磺胺类抗生素的logKow值(-0.09~1.68)显著不同(Zhang et al., 2020).生物质炭等吸附剂对疏水性有机物的吸附能力与logKow值具有强烈的正相关性, 表明疏水吸附作用机制的发生(Sun et al., 2012).因此, 四环素类与喹诺酮类抗生素具有相近的logKow值, 导致两类抗生素对生物质炭上疏水性吸附位点的竞争作用更为强烈.通常, 不可逆吸附作用的增强将提高抗生素的非生物消减效率(轩盼盼等, 2017).
未灭菌土壤不同处理组的聚类结果为:对照组抗生素的消减率与CC2、CC4、WS4和WS6处理组的消减率聚类(NI组), 表明这些生物质炭对抗生素的微生物降解率影响不大.CS2、WS2、CC6和CS4处理组抗生素的消减率聚类(NII组), 该组生物质炭通常提高了未灭菌土壤中抗生素的消减率.未灭菌土壤中的抗生素同时存在非生物消减和生物消减作用.土壤中抗生素的生物消减作用中, 微生物降解起到关键作用(Zhang et al., 2017).有研究报道:生物质炭由于对有机物具有较强的吸附能力而显著降低其生物可利用性(Ali et al., 2019).然而, 本研究结果表明:生物质炭(除了CS6)并未显著抑制抗生素的微生物降解, 甚至具有一定的促进作用.这是因为生物质炭调控微生物群落结构, 刺激了土壤中降解抗生素的微生物生长(Song et al., 2017;Li et al., 2019).另外, 有研究报道发现, 被生物质炭新吸附的有机物由于未经老化作用, 仍可被微生物降解(Marchal et al., 2013).CS6处理组单独聚类(NIII组), 表明CS6对未灭菌土壤中抗生素生物消减的影响最大, CS6明显降低了磺胺类抗生素的生物消减率.我们最近的研究发现:这一现象与CS6显著降低了土壤中放线菌门和变形菌门中特定的细菌属有关(Zhang et al., 2021).
3.4 生物质炭对灭菌土壤和未灭菌土壤中抗生素潜在风险的影响本研究采用表观分配系数(Kapp, 式(1))评估生物质炭对抗生素在灭菌和未灭菌土壤中潜在生态环境风险的影响(Rosendahl et al., 2011).
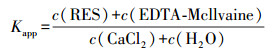
|
(1) |
式中, c(RES)、c(EDTA-Mcllvaine)、c(CaCl2)和c(H2O)分别为紧密结合态、轻结合态、交换态和水溶态抗生素浓度(μg·kg-1), 通过对土壤中抗生素进行分级提取测得.
Kapp值增大说明土壤对有机污染物的吸附固定作用增强(Föster et al., 2009).图 4给出了灭菌和未灭菌土壤中抗生素Kapp值的聚类分析, 结果表明:具有相似结构和性质的抗生素分子聚类, 表明抗生素分子本身的理化性质是决定其环境行为和归宿的关键因素之一.灭菌和未灭菌土壤中抗生素Kapp值变化趋势均是喹诺酮类>四环素类>磺胺类, 表明喹诺酮类易于被生物质炭和土壤颗粒吸附固定, 四环素类次之, 而磺胺类抗生素不容易被生物质炭和土壤颗粒吸附固定.有研究报道:磺胺类抗生素因在土壤颗粒上的吸附能力较弱, 导致其在环境中具有高的迁移性(Tolls, 2001).本研究不同处理组土壤的pH值(表 3)通常大于磺胺类抗生素pKa2值, 因此, 磺胺类抗生素以阴离子形态为主导, 导致磺胺类抗生素与生物质炭、土壤颗粒之间存在静电斥力作用(Zheng et al., 2013), 不利于磺胺类抗生素的吸附固定作用.对于Kapp值, 磺胺类中磺胺嘧啶和磺胺氯吡嗪最大, 而磺胺喹恶啉最小;四环素类中四环素最大, 而土霉素通常最小;喹诺酮类中, 诺氟沙星最大, 恩诺沙星最小.各类抗生素中, Kapp值最大的抗生素通常具有最小的logKow值, 而Kapp值最小的抗生素通常具有最大的logKow值(抗生素的logKow值见Zhang et al., 2020).logKow值小不利于疏水性有机物与土壤等吸附剂之间发生疏水吸附作用(Wang et al., 2016).
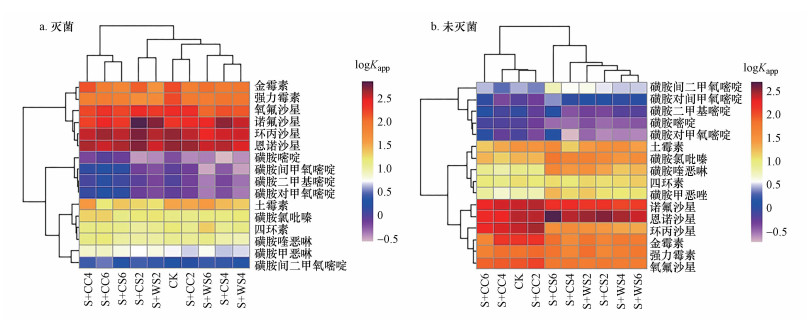 |
| 图 4 灭菌和未灭菌土壤中抗生素表观分配系数(Kapp)的聚类分析 Fig. 4 Clustering analysis of the apparent distribution coeffificients (Kapp) of antibiotics in the sterilized and unsterilized soil |
在土壤和生物质炭颗粒上吸附能力较弱的抗生素是以交换态和水溶态为主要存在形态.与紧密结合态和轻结合态相比, 交换态和水溶态抗生素更易于发生非生物和生物转化, 使得Kapp公式中分母减小, 进而使得Kapp值增大.多数生物质炭主要降低了灭菌和未灭菌土壤中四环素类和喹诺酮类的Kapp值, 对磺胺类的Kapp值影响相对较小.另外, 与灭菌土壤相比, 未灭菌土壤中抗生素的Kapp值通常较低, 这表明微生物的某些分泌物能够促进抗生素从轻结合态甚至紧密结合态向着交换态或者水溶态转变(陶晓庆等, 2015).这一变化将增大抗生素迁移性和传播抗性基因的风险.
4 结论(Conclusions)生物质炭对本研究农田土壤中抗生素消减影响的结果表明:未灭菌土壤中抗生素的消减率通常高于灭菌土壤.250 ℃制备的核桃壳生物质炭通常促进了灭菌和未灭菌土壤中抗生素的消减.生物质炭对本研究农田土壤中抗生素生态环境风险影响的结果表明:多数生物质炭降低了灭菌和未灭菌农田土壤中四环素类和喹诺酮类的Kapp值.Kapp值降低意味着交换态或者水溶态抗生素增多, 这将增大抗生素的迁移性和传播抗性基因的风险.因此, 在利用生物质炭修复抗生素污染农田土壤时, 需综合考虑生物质炭的修复效果和可能的生态环境风险.
Alexandrino D A M, Mucha A P, Almeida C M, et al. 2017. Biodegradation of the veterinary antibiotics enrofloxacin and ceftiofur and associated microbial community dynamics[J]. Science of the Total Environment, 581-582: 359-368. DOI:10.1016/j.scitotenv.2016.12.141 |
Ali N, Khan S, Li Y Y, et al. 2019. Influence of biochars on the accessibility of organochlorine pesticides and microbial community in contaminated soils[J]. Science of the Total Environment, 647: 551-560. DOI:10.1016/j.scitotenv.2018.07.425 |
Al-Wabel M, Usman A R A, El-Naggar A H, et al. 2015. Conocarpus biochar as a soil amendment for reducing heavy metal availability and uptake by maize plants[J]. Saudi Journal of Biological Sciences, 22: 503-511. DOI:10.1016/j.sjbs.2014.12.003 |
Ben Y J, Fu C X, Hu M, et al. 2019. Human health risk assessment of antibiotic resistance associated with antibiotic residues in the environment: A review[J]. Environmental Research, 169: 483-493. DOI:10.1016/j.envres.2018.11.040 |
Białk-Bielinska A, Stolte S, Matzke M, et al. 2012. Hydrolysis of sulphonamides in aqueous solutions[J]. Journal of Hazardous Materials, 221: 264-274. |
Chen B L, Zhou D D, Zhu L Z. 2008. Transitional adsorption and partition of nonpolar and polar aromatic contaminants by biochars of pine needles with different pyrolytic temperatures[J]. Environmental Science and Technology, 42: 5137-5143. DOI:10.1021/es8002684 |
Conde-Cid M, Ferreira-Coelho G, Núñez-Delgado A, et al. 2019. Competitive adsorption of tetracycline, oxytetracycline and chlortetracycline on soils with different pH value and organic matter content[J]. Environmental Research, 178: 108669. DOI:10.1016/j.envres.2019.108669 |
Dai Y J, Zhang N X, Xing C M, et al. 2019. The adsorption, regeneration and engineering applications of biochar for removal organic pollutants: A review[J]. Chemosphere, 223: 12-27. DOI:10.1016/j.chemosphere.2019.01.161 |
邓雅文, 晏彩霞, 聂明华, 等. 2020. 生物质炭对抗生素的吸附/解吸研究进展[J]. 环境污染与防治, 42(3): 376-384. |
丁炎强, 李杰, 李林林, 等. 2013. 土壤抗生素测定中回收率的变异[J]. 环境与健康杂志, 30(8): 740-742. |
Dorival-García N, Zafra-Gómez A, Navalón A, et al. 2013. Removal of quinolone antibiotics from wastewaters by sorption and biological degradation in laboratory-scale membrane bioreactors[J]. Science of the Total Environment, 442: 317-328. DOI:10.1016/j.scitotenv.2012.10.026 |
El-Naggar A, Lee S S, Rinklebe J, et al. 2019. Biochar application to low fertility soils: A review of current status, and future prospects[J]. Geoderma, 337: 536-554. DOI:10.1016/j.geoderma.2018.09.034 |
Fernández-Calviño D, Bermúdez-Couso A, Arias-Estévez M, et al. 2015. Competitive adsorption/desorption of tetracycline and chlortetracycline on two acid soils: stirred flow chamber experiments[J]. Chemosphere, 134: 361-366. DOI:10.1016/j.chemosphere.2015.04.098 |
F ster M, Laabs V, Lamsh ft M, et al. 2009. Sequestration of manure-applied sulfadiazine residues in soils[J]. Environmental Science and Technology, 43: 1842-1830. |
He Y, Liu C, Tang X Y, et al. 2019. Biochar impacts on sorption-desorption of oxytetracycline and flflorfenicol in an alkaline farmland soil as affected by fifield ageing[J]. Science of the Total Environmental, 671: 928-936. DOI:10.1016/j.scitotenv.2019.03.414 |
黄敏, 刘茜, 朱楚仪, 等. 2019. 施用生物质炭对土壤Cd、Pb有效性影响的整合分析[J]. 环境科学学报, 39(2): 560-569. |
Li X J, Li Y, Zhang X L, et al. 2019. Long-term effect of biochar amendment on the biodegradation of petroleum hydrocarbons in soil microbial fuel cells[J]. Science of the Total Environment, 651: 796-806. DOI:10.1016/j.scitotenv.2018.09.098 |
Liu H K, Xu F, Xie Y L, et al. 2018. Effect of modifified coconut shell biochar on availability of heavy metals and biochemical characteristics of soil in multiple heavy metals contaminated soil[J]. Science of the Total Environment, 645: 702-709. DOI:10.1016/j.scitotenv.2018.07.115 |
Luo J W, Li X, Ge C J, et al. 2018. Sorption of norfloxacin, sulfamerazine and oxytetracycline by KOH-modified biochar under single and ternary systems[J]. Bioresource Technology, 263: 385-392. DOI:10.1016/j.biortech.2018.05.022 |
罗梅, 田冬, 高明, 等. 2018. 紫色土壤有机碳活性组分对生物质炭使用量的响应[J]. 环境科学, 39(9): 4327-4337. |
Marchal G, Smith K E C, Rein A, et al. 2013. Comparing the desorption and biodegradation of low concentrations of phenanthrene sorbed to activated carbon, biochar and compost[J]. Chemosphere, 90: 1767-1778. DOI:10.1016/j.chemosphere.2012.07.048 |
Ngigi A N, Ok Y S, Thiele-Bruhn S. 2019. Biochar-mediated sorption of antibiotics in pig manure[J]. Journal of Hazardous Materials, 364: 663-670. DOI:10.1016/j.jhazmat.2018.10.045 |
Pan M, Chu L M. 2016. Adsorption and degradation of fifive selected antibiotics in agricultural soil[J]. Science of the Total Environment, 545: 48-56. |
Qiao M, Ying G G, Singer A C, et al. 2018. Review of antibiotic resistance in China and its environment[J]. Environment International, 110: 160-172. DOI:10.1016/j.envint.2017.10.016 |
Qin G, Gong D, Fan M Y. 2013. Bioremediation of petroleum-contaminated soil by biostimulation amended with biochar[J]. International Biodeterioration and Biodegradation, 85: 150-155. DOI:10.1016/j.ibiod.2013.07.004 |
Rosendahl I, Siemens J, Groeneweg J, et al. 2011. Dissipation and sequestration of the veterinary antibiotic sulfadiazine and its metabolites under fifield conditions[J]. Environmental Science and Technology, 45: 5216-5222. DOI:10.1021/es200326t |
Sanderson H, Ingerslev F, Brain R A, et al. 2005. Dissipation of oxytetracycline, chlortetracycline, tetracycline and doxycycline using HPLC-UV and LC/MS/MS under aquatic semi-field microcosm conditions[J]. Chemosphere, 60: 619-629. DOI:10.1016/j.chemosphere.2005.01.035 |
Song Y, Bian Y R, Wang F, et al. 2017. Effects of biochar on dechlorination of hexachlorobenzene and the bacterial community in paddy soil[J]. Chemosphere, 186: 116-123. DOI:10.1016/j.chemosphere.2017.07.139 |
Sun K, Jin J, Keiluweit M, et al. 2012. Polar and aliphatic domains regulate sorption of phthalic acid esters (PAEs) to biochars[J]. Bioresource Technology, 118: 120-127. DOI:10.1016/j.biortech.2012.05.008 |
陶晓庆. 2015. 土壤中磺胺甲恶唑的形态转化及降解规律研究[D]. 杭州: 浙江工商大学
|
Tolls J. 2001. Sorption of veterinary pharmaceuticals in soils: A review[J]. Environmental Science and Technology, 35: 3397-3406. DOI:10.1021/es0003021 |
Wang X L, Sato T, Xing B S. 2006. Competitive sorption of pyrene on wood chars[J]. Environmental Science and Technology, 40: 3267-3272. DOI:10.1021/es0521977 |
Wang Z Y, Han L F, Sun K, et al. 2016. Sorption of four hydrophobic organic contaminants by biochars derived from maize straw, wood dust and swine manure at different pyrolytic temperatures[J]. Chemosphere, 144: 285-291. DOI:10.1016/j.chemosphere.2015.08.042 |
Xiang W, Zhang X Y, Chen J J, et al. 2020. Biochar technology in wastewater treatment: A critical review[J]. Chemosphere, 252: 126539. DOI:10.1016/j.chemosphere.2020.126539 |
轩盼盼, 唐翔宇, 鲜青松, 等. 2017. 生物质炭对紫色土中氟喹诺酮类吸附-解吸的影响[J]. 中国环境科学, 37(6): 2222-2231. DOI:10.3969/j.issn.1000-6923.2017.06.029 |
Ying G G, He L Y, Ying A J, et al. 2017. China must reduce its antibiotic use[J]. Environmental Science and Technology, 51(3): 1072. DOI:10.1021/acs.est.6b06424 |
Zeng Q T, Sun J T, Zhu L Z. 2019. Occurrence and distribution of antibiotics and resistance genes in greenhouse and open-field agricultural soils in China[J]. Chemosphere, 224: 900-909. DOI:10.1016/j.chemosphere.2019.02.167 |
赵方凯, 杨磊, 李守娟, 等. 2018. 长三角典型城郊土壤抗生素空间分布的影响因素研究[J]. 环境科学学报, 38(3): 1163-1171. |
Zhang G X, Zhao Z H, Zhu Y E. 2020. Changes in abiotic dissipation rates and bound fractions of antibiotics in biochar-amended soil[J]. Journal of Cleaner Production, 256: 120314. DOI:10.1016/j.jclepro.2020.120314 |
Zhang G X, Zhao Z H, Yin X A, et al. 2021. Impacts of biochars on bacterial community shifts and antibiotic biodegradation in an agricultural soil during short-term incubation study[J]. Science of the Total Environment, 771: 144751. DOI:10.1016/j.scitotenv.2020.144751 |
Zheng H, Wang Z Y, Zhao J, et al. 2013. Sorption of antibiotic sulfamethoxazole varies with biochars produced at different temperatures[J]. Environmental Pollution, 181: 60-67. DOI:10.1016/j.envpol.2013.05.056 |
 2021, Vol. 41
2021, Vol. 41


