2. 北京化工大学化学工程学院, 北京 100029
2. College of Chemical Engineering, Beijing University of Chemical Technology, Beijing 100029
硝酸盐氮污染会导致水体富营养化, 且会对公共健康构成威胁.目前降低水中硝酸盐浓度的方法主要有离子交换法(Bergquist et al., 2016)、生物反硝化法(Zhao et al., 2011)及催化还原法(Park et al., 2019)等, 其中, 离子交换法等物理法只是对硝酸盐进行简单的浓缩, 后期需要更进一步的处理, 生物反硝化法处理时间长且会产生大量的污泥等, 而电化学方法因具有环保、操作方便、去除率高等优点被广泛用于硝酸盐的转化和去除.
近年来, 电化学处理硝酸盐技术发展迅速, 电极材料的种类在电还原过程中具有举足轻重的作用(Li et al., 2009).其中以一种金属为基体, 在其上负载一种或者几种金属的多金属材料因既可提高硝酸盐的去除率也能降低副产物的产量而受到广大学者的青睐.例如, 王思(2018)以钛为基体, 制备了Cu/GO/Ti、Ag/GO/Ti及Sn/Pd-GO/Ti 3种电极并用于硝酸盐的去除.但钛的稳定性较差, 活性层易脱落, 而TiO2-NT具有化学稳定性较高、成本低、环境安全性良好的特点(Marien et al., 2016).王龙等(2014)以钛网为基体制备的Bi-PbO2电极在电解120 min后对氨氮的去除率达100%;Kim等(2019)采用TiO2-NT阵列电极来还原硝酸盐;段小月等(2016)以TiO2-NT为基体制备的PbO2/TiO2-NT/Ti电极对p-硝基苯酚的降解率达到97.8%;毛雨路等(2018)利用脉冲电沉积的方法将Pr掺杂的PbO2修饰到TiO2-NT阵列中, 制备出的新型电极材料对亚甲基蓝的去除率高达99.8%;Wang等(2017)利用电沉积技术制备的Ti/TiO2NTs/NiO/Ce-PbO2电极对苯酚降解180 min后的去除率达到100.0%.但目前以TiO2-NT为基体负载金属元素的研究鲜有报道.
基于此, 本研究在钛板上制备TiO2-NT, 并以此为基体负载金属Bi制成Bi-TNA电极.通过对比不同电极的脱氮性能后对性能较好的Bi-TNA电极进行表征, 再探究各操作参数对硝酸盐氮去除效果的影响及进行动力学分析, 最后测试电极的重复使用稳定性.
2 电化学技术去除硝酸盐氮的原理(The principle of electrochemical technology to remove nitrate nitrogen)电化学还原硝酸盐氮技术是指在电场的作用下, 利用阴极极板对硝酸盐氮的吸附和还原作用, 使得硝酸根离子被还原为N2, 从而达到去除硝酸盐氮的目的.目前, 电化学还原硝酸盐主要有直接还原和间接还原两种途径.其中, 直接还原过程如式(1)~(5)所示.

|
(1) |

|
(2) |

|
(3) |

|
(4) |
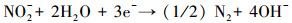
|
(5) |
间接还原过程:在阴极极板处的H+被还原为H2, 之后硝酸盐被H2还原为N2的过程.当水中的污染物只有硝酸盐, 电解液为硫酸钠时, 阳极的反应主要是氧气析出.为了降低出水中的氨氮或者亚硝氮, 通常在溶液中加入电解质NaCl, 此时阳极发生的反应为Cl-被氧化为ClO-, 而阴极产生的氨氮或者亚硝氮则会移动至阳极被ClO-氧化, 反应式如下所示:

|
(6) |

|
(7) |

|
(8) |
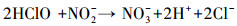
|
(9) |
本实验选用间歇式电化学反应装置, 由反应器、磁力搅拌器、电极及磁力搅拌器等部分构成.该还原硝酸盐的装置为圆柱体, 反应容积为300 mL.实验中以制备的电极为阴极, 不锈钢为阳极, 两电极平行放于反应器内, 电极板大小为4.5 cm×4 cm, 电极间距为2 cm, 将阴、阳极与直流稳压电源的负、正极相连.在电还原过程中, 选择合适的电流与电压, 并用此加以控制.实验装置整体的示意图如图 1所示.
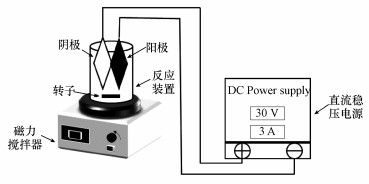 |
| 图 1 NO3--N电还原反应装置 Fig. 1 Device of electroreduction NO3--N |
电极的制备过程主要包括以下几个部分:①钛板的预处理:首先分别用3000目和5000目的砂纸将钛板打磨至表面光亮, 并用去离子水清洗;然后把钛板放入配置的HF: HNO3=1:3(体积比)混合物中40 s, 去除杂质和氧化物层, 清洗后把钛板放入丙酮溶液中超声清洗20 min, 再放入无水乙醇溶液中超声15 min, 最后在纯水中超声处理10 min.
② TiO2纳米管的制备:首先配置含有0.25% NH4F、10%去离子水的乙二醇溶液250 mL, 之后以钛片为阳极, 不锈钢为阴极, 采用25 V的恒电位对钛板进行氧化, 电极间距为1.5 cm, 氧化时间为3 h, 反应结束后用蒸馏水冲洗电极, 待阳极自然晾干后放入马弗炉中在500 ℃下煅烧3 h.
③ 金属的电沉积:采用不溶性电极RuO2-Ti为阳极, 阴极为TiO2纳米管, 电极间距为2 cm;铋(Bi)电沉积液包含5 g·L-1 Bi(NO3)3·5H2O、1 g·L-1 NaCl、5.044 g·L-1 EDTA-2Na, pH=8, 采用恒电流沉积, 在10 mA·cm-2的电流密度下沉积8 min.
3.2.2 硝态氮的去除水样的配制:通过称取一定量的硝酸钠配置不同浓度的硝酸盐氮溶液, 用1 mol·L-1 HCl和1 mol·L-1 NaOH两种酸碱液来调节实验所需要的pH值, 电解质NaCl的浓度设定为1.25 g·L-1.
在每次实验前, 先对制备的电极进行还原预处理.在实验前设定所需要的恒定电流, 在常温下进行2 h的电解反应, 反应进行中每隔20 min抽取10 mL水样.
3.2.3 电极的稳定性以Bi-TNA电极为阴极, RuO2-Ti为阳极, 循环重复进行10次NO3--N的2 h电解实验, 在每次反应过程中及循环结束后测定溶液中NO3--N的量并计算其去除率, 同时结合电极材料在10次反应结束后表面形态及物质的组成变化来讨论Bi-TNA电极的稳定性.
3.3 电极的表征用场发射扫描电子显微镜(SEM)来观察Bi-TNA电极表面的微观形貌, 用X射线衍射仪(XRD)分析Bi-TNA电极表面的元素组成.本实验对电极进行物理表征用到的分析方法如表 1所示.
| 表 1 阴极极板物理表征分析方法 Table 1 Analytical methods of cathode physical characterization |
本研究以硝态氮(NO3--N)去除率、亚硝态氮(NO2--N)及氨氮(NH4+-N)转换率、氮气(N2)选择性和总氮(TN)去除率为衡量标准.其中, NO3--N去除率RNO3-、NO2--N及NH4+-N的转化率SNO2-、SNH4+和N2选择性SN2, 以及TN去除率RTN的计算式如下所示:

|
(10) |
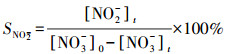
|
(11) |

|
(12) |

|
(13) |

|
(14) |
式中, [NO3-]0为系统中NO3--N的初始浓度(mg·L-1);[NO3-]t、[NO2-]t、[NH4+]t为反应t时刻时NO3--N、NO2--N、NH4+-N的浓度(mg·L-1).文中硝酸根离子、铵根离子、亚硝酸根离子的浓度均以离子中的含氮量来表示.
4 结果与讨论(Results and discussion) 4.1 不同电极材料脱氮性能的对比图 2所示为铜、钛、不锈钢、Ti-RuO2及Bi-TNA 5种阴极的脱氮情况.由图可知, 在处理2 h后, 这5种阴极对NO3--N去除率的大小顺序为Bi-TNA电极(93.52%)>钛板(36.20%)>不锈钢(29.66%)>铜板(24.93%)>Ti-RuO(15.36%), TN的去除率分别为93.40%、33.18%、28.71%、20.55%、13.44%.Bi-TNA作为阴极时对NO3--N的去除率是钛板的3倍左右, 这是由于Bi-TNA电极以TiO2纳米管为基底, 具有较大的比表面积.并且具有电子空轨道的金属元素可吸附具有孤对电子的氧原子(Wei et al., 2018), 而Bi元素具有电子空轨道, 可以吸附NO3--N中的氧原子, 从而加快了此电极对NO3--N的吸附速率, 提高了去除效率.另外, 用Bi-TNA作为阴极时TN的去除率得到大幅提高, 可能是由于Bi元素的加入为NO3--N还原产生的中间物质的降解提供了活性位点.通过观察NO3--N在5种不同阴极下NO2--N的转换率发现, 当反应进行到40 min时, 用Bi-TNA作为阴极时NO2--N的转换率最小, 接近于零, 其它4种阴极的最大转换率分别为1.63%、2.33%、3.06%、5.08%, 更加证实了Bi元素的加入有利于提高N2的选择性.
 |
| 图 2 不同阴极材质对NO3--N、TN去除率及NO2--N转换的影响 Fig. 2 Effect of different cathode materials on removal of NO3--N, TN and conversion of NO2--N |
对优化后的Bi-TNA电极的表面形貌进行表征, 其中, 纳米管的煅烧温度为500 ℃, 电沉积时间为8 min.图 3为Bi-TNA电极在放大倍数为10万倍和1.5万倍下的表面形貌.可以看出, Bi颗粒成团、不规则地分布在二氧化钛纳米管表面;Bi颗粒团与团之间存在空隙, 且在纳米管表面约有1/2被Bi完全覆盖.
 |
| 图 3 Bi-TNA电极的SEM图 (a.10万倍, b.1.5万倍) Fig. 3 SEM image of Bi-TNA electrode |
优化的Bi-TNA电极的表面元素组成如图 4所示, TiO2纳米管的图谱显示只存在Ti和TiO2两种物质.对比看来, Bi-TNA电极中在2θ=27.6°处出现了新的物相Bi单质, 可知溶液中的Bi2O3已成功地被还原为Bi单质并负载到TiO2纳米管上.
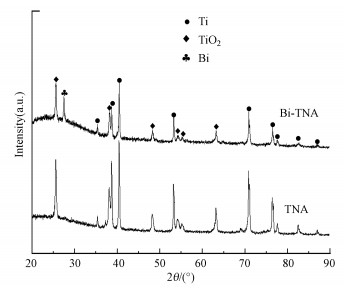 |
| 图 4 Bi-TNA电极的XRD图谱 Fig. 4 The XRD pattern of Bi-TNA electrode |
在pH=7、NO3--N浓度为100 mg·L-1的溶液中不同电流密度(C.D.)对NO3--N去除效果的影响如图 5所示.随着电流密度的增大, NO3--N去除率上升的幅度较明显.这是因为电流密度增大会使NO3-扩散速率增加, 在阴极表面的吸附量上升, 因而去除效果好;但电流密度过高会使得阴极附近析氢反应增加(吕佳奇, 2019), 导致NO3--N的去除和H2的还原产生竞争, 故NO3--N不会随着电流密度的再升高而得到明显的去除.在低电流密度(15、20、25 mA·cm-2)下, 反应20 min后, NO2--N转化率分别为2.19%、1.83%、1.01%, 而在高电流密度(30、35 mA·cm-2)下, 溶液中的NO2--N含量很小, 这可能是因为高电压使得NO2--N转化为N2.随着电流密度的增大, NH4+-N的转换率随之减小, 较高的电流密度对NH4+-N的去除有利, 这与杨胜翔(2017)的研究结论相同.TN去除率与NO3--N去除率随电流密度变化的情况相同, 在35 mA·cm-2时TN去除率达到最大(83.25%).在30 mA·cm-2下反应时间为20、60、100、120 min时, N2的选择性分别为97.16%、98.53%、99.71%、99.84%, 而在35 mA·cm-2的处理条件下, 整个反应过程N2的选择性都在99%以上.
 |
| 图 5 电流密度对NO3--N去除率、NO2--N和NH4+-N转换率、TN去除率及N2选择性的影响 Fig. 5 Effect of C.D. on the NO3--N removal rate, NO2--N and NH4+-N conversion rate, TN removal rate and N2 selectivity |
通过对5种不同电流密度下NO3--N去除情况、TN去除情况、N2选择性的分析及能耗因素的考虑, 本文选择30 mA·cm-2为最佳电流密度.
4.3.2 溶液初始pH的影响溶液未参与反应时的酸碱性大小是电还原硝酸盐氮的一个重要参数(Kumar et al., 2015; Chauhan et al., 2016).在电流密度为30 mA·cm-2条件下不同初始pH对硝态氮(100 mg·L-1)还原的影响见图 6.当pH小于7时, 随着pH的上升, NO3--N的去除效果明显下降;而当初始pH值升高时, NO3--N的还原率随之上升, 这与Li等(2010)的研究结果相似.这是因为H+浓度较高时, 电极表面吸附较多的H+会阻碍NO3--N与电极表面接触, 导致去除效果变差.在pH>7的条件下, 发生反应时OH-将占据电极表面较多的活性位点, 与NO3--N的吸附形成竞争, 故pH上升至10时NO3--N的去除率反而下降.初始溶液的pH对NO2--N占比的影响很小, 但对NH4+-N的产生一定的影响.在溶液初始pH值为3.0时, NH4+-N转换率在40 min时达到最大(4.54%), 之后会被HClO还原.而随着初始溶液酸性的减弱, 溶液中H+与N键结合形成N—H键, NH4+-N含量下降, 其转换率不断下降.TN随pH的变化情况与NO3--N随pH的变化情况相同.因为在不同初始pH下NO2--N和NH4+-N的量都很少, 二者含量的改变只占总氮去除的小部分, 故不能改变TN去除率的变化趋势.由N2选择性可以看出, 在120 min时5种pH值下的N2选择性都高于98%.
 |
| 图 6 pH对NO3--N去除率、NO2--N和NH4+-N转换率、TN去除率及N2选择性的影响 Fig. 6 Effect of pH on NO3--N removal rate, NO2--N and NH4+-N conversion rate, TN removal rate and N2 selectivity |
通过分析可知, 在溶液初始pH值为8.5时, 溶液中NO3--N含量最小, TN去除率最大, 整个反应过程中N2的选择性都在98%以上.
4.3.3 初始浓度的影响图 7为pH=8.50、30 mA·cm-2的电流密度下不同初始浓度对硝态氮去除效果的影响.由图可知, Bi-TNA电极对NO3--N还原能力随着其初始浓度的升高而降低, 这与Li等(2020)的研究结论相同.这是由于增加硝酸盐的浓度将增加电极表面上吸附位点的使用数量, 而电极表面的催化活性位点数量是一定的, 在相同的电流密度下低浓度的NO3--N能够在Bi-TNA表面进行更有效的还原.NO2--N和NH4+-N两者的转换率都随着NO3--N初始浓度的增大而上升.随着反应时间的增加, NO2--N和NH4+-N的转换率都先增大后减小, 这是因为NO2--N是可被进一步还原的中间产物, 而NH4+-N是可被进一步氧化的中间产物.由于NO3--N在初始浓度较高时其去除率较低, 故TN在NO3--N初始浓度较高时其去除率也较低, 另外, N2的选择性都在90%以上.
 |
| 图 7 NO3--N初始浓度对NO3--N去除率、NO2--N和NH4+-N转换率、TN去除率及N2选择性的影响 Fig. 7 Effect of initial NO3--N concentration on NO3--N removal rate, NO2--N and NH4+-N conversion rate, TN removal rate and N2 selectivity |
通过对上述5种不同浓度下NO3--N溶液中的脱氮情况分析可知, Bi-TNA电极更适合处理含有低浓度NO3--N的水体.
4.4 Bi-TNA电极处理硝态氮过程的动力学模型采用零级动力学模型(式(15))和一级动力学模型(式(16))进行拟合, 根据拟合模型的R2值(表 2)可知, 对NO3--N的还原反应比较符合一级动力学过程.

|
(15) |

|
(16) |
| 表 2 不同初始浓度下NO3--N还原反应动力学拟合参数R2值 Table 2 Fitting parameters of NO3--N reduction reaction kinetics at different initial concentrations |
式中, k为反应速率常数;t为反应时间(min);C为水中NO3--N浓度(mg·L-1);C0为NO3--N初始浓度(mg·L-1);K′为拟一级动力学的表观速率常数(min-1);a、b为常数.
从图 8可知, 使用Bi-TNA电极为阴极的电化学体系中, ln(C/C0)与反应时间t之间的线性关系更好.表 2所示的零级和一级动力学模型拟合的R2虽然都大于0.95, 但采用一级动力学模型拟合的R2均高于采用零级动力学模型拟合的R2, 说明在使用Bi-TNA电极为阴极的系统中NO3--N的去除反应更适合一级反应动力学, 即NO3--N的反应速率受其初始浓度的控制, 这一结果与4.3.3节中NO3--N去除率随其初始浓度的增加而减小的结果相对应.
 |
| 图 8 NO3--N的C与t的曲线(a)和ln(C/C0)与t的曲线(b) Fig. 8 Relationship between c~t of NO3--N(a) and ln(C/C0)~t of NO3--N (b) |
由于Bi-TNA电极作为电化学还原NO3--N阴极时具有优异的性能, 因此, 本文对其可重复使用性进行评估.在选定的条件下, 采用电沉积时间为8 min、煅烧温度为500 ℃的Bi-TNA电极进行10次NO3--N的电解循环.观察图 9可知, NO3--N的去除效果随着Bi-TNA电极使用次数的增加而下降, 对于新制备的Bi-TNA电极作为还原NO3--N的阴极参与反应2 h后对其去除率可达到93.2%, 在进行2 h的反应10次后, 对其去除率下降至83.66%, 表明此电极的稳定性下降.
 |
| 图 9 Bi-TNA电极的稳定性 Fig. 9 Stability of Bi-TNA electrode in removing nitrate |
图 10展示了使用10个循环后的Bi-TNA电极与新制备的Bi-TNA电极之间XRD图谱的对比.结果表明, 与未使用的Bi-TNA电极相比, 使用后的Bi-TNA电极的XRD图谱显示Bi单质变为氧化物Bi2O3, 在实验过程中也发现铋的表面在电解过程中变黑, 这也意味着在使用过程中发生了表面化合物的形成和分解, 这与XRD显示的结果相符合, 同时这也是导致电极稳定性下降的原因.
 |
| 图 10 Ni-TNA电极未使用和使用10次后的XRD图 Fig. 10 XRD pattern of Ni-TNA electrode not used and after 10 uses |
1) 通过对Bi-TNA电极进行SEM、XRD表征发现, Bi2O3已成功被还原为Bi并负载到TiO2纳米管表面, Bi在其表面呈聚集状存在.
2) 在单因素水平下, 通过研究电流密度、pH、初始浓度对硝态氮去除、亚硝态氮和氨氮转换、总氮去除及氮气选择性的影响, 得出最佳操作条件为:硝态氮浓度50 mg·L-1、电流密度30 mA·cm-2、pH=8.5.
3) 对Bi-TNA电极进行可重复使用性实验发现, 该电极初次使用时对NO3--N有93.2%的去除率, 使用10次后对NO3--N的去除率下降至83.66%, 这是因为使用后电极表面的Bi元素变为了氧化物Bi2O3.
4) Bi-TNA电极对NO3--N的还原反应符合一级反应的动力学模型.
Bergquist A M, Choe J K, Strathmann T J, et al. 2016. Evaluation of a hybrid ion exchange-catalyst treatment technology for nitrate removal from drinking water[J]. Water Research, 96: 177-187. DOI:10.1016/j.watres.2016.03.054 |
Chauhan R, Srivastava V C, Hiwarkar A D. 2016. Electrochemical mineralization of chlorophenol by ruthenium oxide coated titanium electrode[J]. Journal of the Taiwan Institute of Chemical Engineers, 69: 106-117. DOI:10.1016/j.jtice.2016.10.016 |
段小月, 刘伟, 陆丽, 等. 2016. PbO2/TiO2-NT/Ti电极的制备及电催化性能研究[J]. 环境科学学报, 36(9): 3237-3242. |
Gao W C, Gao L L, Li D, et al. 2018. Removal of nitrate from water by the electrocatalytic denitrification on the Cu-Bi electrode[J]. Journal of Electroanalytical Chemistry, 817: 202-209. DOI:10.1016/j.jelechem.2018.04.006 |
Kim D E, Pak D. 2019. Ti plate with TiO2 nanotube arrays as a novel cathode for nitrate reduction[J]. Chemosphere, 228: 611-618. DOI:10.1016/j.chemosphere.2019.04.071 |
Kumar S, Singh S, Srivastava V C. 2015. Electro-oxidation of nitrophenol by ruthenium oxide coated titanium electrode: Parametric, kinetic and mechanistic study[J]. Chemical Engineering, 263: 135-143. DOI:10.1016/j.cej.2014.11.051 |
Li C, Li K, Chen C, et al. 2020. Electrochemical removal of nitrate using a nanosheet structured Co3O4/Ti cathode: Effects of temperature, current and pH adjusting[J]. Separation and Purification Technology, 237: 116485-116494. DOI:10.1016/j.seppur.2019.116485 |
Li M, Feng C, Zhang Z, et al. 2009. Efficient electrochemical reduction of nitrate to nitrogen using Ti/IrO2-Pt anode and different cathodes[J]. Electrochimica Acta, 54(20): 4600-4606. DOI:10.1016/j.electacta.2009.03.064 |
Li M, Feng C, Zhang Z, et al. 2010. Treatment of nitrate contaminated water using an electrochemical method[J]. Bioresour Technol, 101(16): 6553-6557. DOI:10.1016/j.biortech.2010.03.076 |
吕佳奇. 2019. 含氧缺陷的过渡金属氢氧化物材料的制备及其电催化析氧性能的研究[D]. 长春: 东北师范大学
|
毛雨路, 张西, 徐迈, 等. 2018. Ti/TiO2纳米管阵列/PbO2-Pr电极制备及在电氧化有机废水中应用[J]. 应用化学, 35(5): 582-588. |
Marien C B D, Cottineau T, Robert D, et al. 2016. TiO2 Nanotube arrays: Influence of tube length on the photocatalytic degradation of Paraquat[J]. Applied Catalysis B: Environmental, 194: 1-6. DOI:10.1016/j.apcatb.2016.04.040 |
Park J, Hwang Y, Bae S. 2019. Nitrate reduction on surface of Pd/Sn catalysts supported by coal fly ash-derived zeolites[J]. Hazardous Materials, 374: 309-318. DOI:10.1016/j.jhazmat.2019.04.051 |
王龙, 汪家权, 吴康. 2014. Bi-PbO2电极电化学氧化去除模拟废水中氨氮的研究[J]. 环境科学学报, 34(11): 2798-2805. |
王思. 2018. Me/GO/Ti阴极的制备及电催化还原硝酸盐氮的研究[D]. 陕西: 陕西科技大学
|
Wang Z C, Xu M, Wang F W, et al. 2017. Preparation and characterization of a novel Ce doped PbO2 electrode based on NiO modified Ti/TiO2 NTs substrate for the electrocatalytic degradation of phenol wastewater[J]. Electrochimica Acta, 247. DOI:10.1016/j.electacta.2017.07.057 |
杨胜翔. 2017. 铜锌系阴极催化还原NO3-机理研究[D]. 北京: 中国矿业大学
|
Zhao Y, Feng C, Wang Q, et al. 2011. Nitrate removal from groundwater by cooperating heterotrophic with autotrophic denitrification in a biofilm-electrode reactor[J]. Hazardous Materials, 192(3): 1033-1039. DOI:10.1016/j.jhazmat.2011.06.008 |
 2021, Vol. 41
2021, Vol. 41


