铁是地球上最重要的金属元素之一, 其地球生物化学转化过程一直备受关注(Cummings et al., 2000; 胡敏等, 2014).土壤中的铁还原过程是由铁还原菌(Iron Reducing Bacteria, IRB)所驱动的可以将Fe(Ⅲ)还原为Fe(Ⅱ)的生化过程, 在铁的地球化学循环中起到关键作用.当前报道的具备铁还原能力的纯培养细菌主要是Geobacter属和Shewanella属, 均为革兰氏阴性菌(Lovley, 1993).前者属于δ-变形菌门, 是严格厌氧菌, 可以在彻底氧化有机物的同时还原高价位的铁、锰等金属元素, 后者则属于γ-变形菌门, 为兼性厌氧菌, 多发现于极端低温及高压的水生环境中(Gorby et al., 2006; Esther et al., 2015).鉴于铁还原过程的重要性, 人们开展了对典型土壤生境, 如湿地土壤、水稻土等环境中的铁还原菌及菌群的研究.通常, 在湿地土壤及水稻土中发现的纯培养铁还原菌有Clostridium属(张月超等, 2018)和bacillus属(王伟民等, 2008)等.而相关土壤环境中铁还原菌群的研究表明, 菌群中除含有Geobacter或Shewanella属外, 通常还能检测到Brevundimonas、Anaeromyxobacter等细菌属(Treude et al., 2003; Peng et al., 2016).此外, 土壤铁还原菌群的结构还受pH、有机质等环境因子的显著影响(Bongoua-Devisme et al., 2013; 张洪霞等, 2017; Pan et al., 2019).
土壤中的铁还原过程不仅与一些重金属元素的转化相关, 还可与一些有机物污染物, 如苯系物、多环芳烃等的降解相偶联(Lovley, 1997; Botton et al., 2007; Kleemann et al., 2011; Marozava et al., 2018; de Lima e Silva et al., 2018).如Marozava等(2018)报道甲基萘可被富集的铁还原菌群所降解, 降解率可达75%;de Lima e Silva等(2018)发现富含铁还原菌的厌氧反应器可高效降解多氯联苯.尽管铁还原过程与上述有机污染物的代谢偶联机制还不清楚, 但是铁还原菌群在土壤多环芳烃等有机污染物的去除中可能起到重要作用.
油田、油气田等周边的土壤常含有石油烃、多环芳烃等有机污染物, 具有潜在有机污染物污染风险.据报道, 我国大庆、胜利、新疆和华北油田土壤中均检测到多种多环芳烃, 其中华北油田多环芳烃平均浓度最高可达22.954 mg · kg-1(Wang et al., 2015).当前的研究多关注于水稻土等厌氧环境下的铁还原微生物的活性及群落组成, 油气田等土壤中的微生物研究则多集中于总体微生物、反硝化及产甲烷等微生物(Sun et al., 2015; 姚炎红等, 2016; Wang et al., 2020), 而针对具有潜在有机污染物污染风险土壤中的铁还原微生物的相关研究还鲜有报道.本研究选择我国最大的页岩气田-涪陵页岩气田为对象, 探讨该区域土壤基本性质、铁还原微生物活性及群落结构的关系, 为进一步富集分离能够与典型有机污染物相偶联的铁还原微生物提供理论依据.
2 材料与方法(Materials and methods) 2.1 土壤样品的采集共采集6个土壤样品, 均于2018年9月8日采自江汉油田涪陵页岩气田区域0~20 cm的表层.其中4个采集于该气田的油基灰渣堆放区域, 命名为DC1、DC2、DC3和DC4, 2个采集于废弃气井区域, 命名为FS1和FS2.各样品的地理信息见表 1.各样品采集均为随机多点混合采样, 即在100 m2的区域内, 随机选取10个点进行采集并混合成1个样, 各样点重复取样3次.采集好的样品放冰盒后立即运回实验室.过2 mm筛后, 置于4 ℃保存备用.
| 表 1 采样点地理信息 Table 1 Geographic Information of the sampling sites |
土壤pH采用电位法在5 : 1水土比条件下用pH计(PHS-3C, 上海仪电科学仪器股份有限公司, 中国)测定.有机质测定采用水合热重铬酸钾氧化-比色法(杨剑虹等, 2008).用2 mol · L-1 KCl溶液浸提后(液土比为5 : 1), 用连续流动分析仪(AA3, SEAL公司, 德国)测定铵态氮和硝态氮含量.有效磷含量用0.5 mol · L-1 NaHCO3溶液浸提-钼锑抗分光光度法测定(杨剑虹等, 2008).
IRP的测定参照曲东等(2005)的方法, 具体步骤如下: 称取2.00 g鲜土于100 mL血清瓶, 加入灭菌水制成土水比1 : 1的土壤悬浆.用丁基橡胶塞和铝盖密封, 通5 min高纯氮气, 平衡气压后于(30±1) ℃黑暗静止培养84 h, 隔12 h取样.样品用0.5 mol · L-1 HCl振荡(150 r · min-1)提取2 h, 将混合物11000×g离心30 min(Ginn et al., 2017)得到上清液, 参照国家标准HJ-T345—2007测上清液中弱酸溶性Fe(Ⅱ)含量.采用平行实验、空白对照进行质量控制.用以下公式(1)计算各样品的IRP(mmol · kg-1 · d-1).
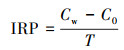
|
(1) |
式中, Cw为铁还原反应平衡时土壤中Fe(Ⅱ)浓度(mmol · kg-1);C0为反应初始时土壤中Fe(Ⅱ)浓度(mmol · kg-1);T为到达平衡时的培养时间(d).
2.3 铁还原菌的富集铁还原菌富集培养基的配制参照Gould等(2003)的方法.具体配方为: CaCl2 · 2H2O 0.1 g · L-1、KCl 0.1 g · L-1、MgCl2 · 6H2O 0.1 g · L-1、MnCl2 · 4H2O 0.005 g · L-1、Na2MoO4 · 2H2O 0.001 g · L-1、NaHCO3 2.50 g · L-1、NaH2PO4 · 2H2O 0.78 g · L-1、Tryptone 1.50 g · L-1、EDTA铁钠盐水合物1.84 g · L-1、NH4Cl 1.50 g · L-1.富集过程简述如下: 称取5 g鲜土于装有45 mL铁还原菌富集培养基的血清瓶中, 密封血清瓶通入5 min氮气并平衡气压, 以180 r · min-1振荡20 min, 置于(30±1)℃黑暗静止培养28 d, 间隔7 d换气.以不接种土壤为对照.
2.4 富集菌群DNA的提取和Illumina MiSeq测序依照Fast DNA® Spin Kit for Soil试剂盒(MP Biomedicals, 美国)说明书提取各样品铁还原菌富集产物(20 mL)DNA.获取的DNA用Nanodrop ND-1000超微量分光光度计(Thermo Fisher, 美国)检测质量和浓度, 并用1%琼脂糖胶电泳检测完整性后, 于-20 ℃保存备用.
提取好的DNA送上海美吉生物医药科技有限公司进行Illumina MiSeq测序.用引物对338F(ACTCCTACGGGAGGCAGCAG)与806R(GGACTAC HVGGGTWTCTAAT)(Xu et al., 2016)对细菌16S rRNA基因的V3~V4高变区进行扩增, PCR产物电泳检测切胶回收并用QuantiFluorTM-ST蓝色荧光定量系统(Promega, 美国)进行检测定量, 构建测序文库.使用FLASH 1.2.11软件拼接reads, fastp软件进行质量控制.在Usearch 7.1软件平台处理优化序列, 按照97%相似性对非重复序列(不含单序列)进行OTU(Operational Taxonomic Units)聚类, 去除嵌合体得到各OTU的代表序列.采用RDP Classifier算法, 将获取的OTU代表序列与Silva数据库(Release 119)在0.7置信区间内比对, 得到对应物种分类信息.原始数据已提交至NCBI数据库, 登录号为PRJNA673157.
2.5 数据处理用Excel 2010(Microsoft, 美国)整理数据, 用SPSS 26.0(IBM, 美国)单因素方差分析比较不同样品间的差异显著性(p < 0.05为差异显著), 用Origin 2019(OriginLab, 美国)绘图.Illumina Miseq测序获取的富集菌群数据均在R3.6.3(http://www.r-project.org)软件中进行分析, 具体如下.利用Vegan包进行基于菌群门水平的聚类分析、基于OTU水平的PCoA(Principal Co-ordinates Analysis)分析及Adonis分析.利用Vegan包中的“envfit”命令来进行群落结构与环境因子间的Mantel correlation分析(Oksanen et al., 2012).用Pheatmap包绘制基于菌群属水平的热图.用Deseq2包进行高IRP与低IRP组的差异OTU分析, 用ggplot2包绘制显示OTU差异的火山图.依据上述Vegan包进行PCoA分析的结果, 用ggplot2包绘制PCoA图, 并用Ellipse命令在90%的置信区间添加椭圆.利用SPSS软件计算IRP与样品基本性质、富集菌群多样性及群落结构(以PCoA结果中对群落结构解释量最高的轴1为指标)之间的Spearman相关系数, 选择与IRP显著相关的参数在Amos 22.0(IBM, 美国)中构建反映影响土壤铁还原活性因子的结构方程模型.
3 结果分析(Results and analysis) 3.1 土壤基本理化性质及铁还原活性各样品基本性质见表 2.各土壤样品均呈碱性, pH为8.09~9.93, 且气井样品FS2的pH最高.样品间有机质含量存在显著差异, 油基灰渣(DC)样品均显著高于气井(FS)样品.各样品铵态氮含量差异不显著, FS2硝态氮含量显著高于其余样品(p < 0.05).比较有效磷含量, DC样品均显著高于FS样品.
| 表 2 页岩气田土壤基本性质 Table 2 Basic properties of the soil samples in the Shale Gas Field |
测得土壤中弱酸溶性Fe(Ⅱ)浓度在培养36 h时达到平衡.根据式(1)计算出各样品的铁还原活性(图 1)由高至低依次为: FS2(10.03 mmol · kg-1 · d-1)、DC4(7.36 mmol · kg-1 · d-1)、DC1(3.50 mmol · kg-1 · d-1)、FS1(2.30 mmol · kg-1 · d-1)、DC2(0.19 mmol · kg-1 · d-1)、DC3(0.01 mmol · kg-1 · d-1), DC与FS样品IRP无明显区分.按照IRP的大小将样品分为高IRP(FS2、DC4)、中IRP(DC1、FS1)和低IRP(DC2、DC3)3组.
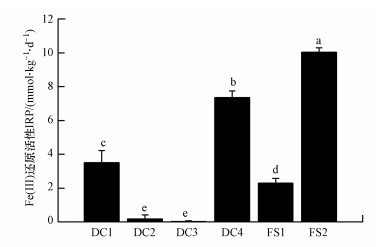 |
| 图 1 土壤样品的Fe(Ⅲ)还原活性 (误差棒表示标准偏差差(n=3), 柱上方不同字母表示存在显著差异(p < 0.05)) Fig. 1 Iron reducing potential of the soil samples |
所有土壤样品中富集的铁还原菌群通过Illumina Miseq测序共得到756977条有效序列, 表 3为各铁还原富集细菌群落97%相似水平的α多样性指数.各样品的平均覆盖率在99.6%以上, 表明测序结果可信.与其他样品相比, 高IRP组FS2中铁还原菌群的Sobs、Chao、Shannon指数值最低, DC4的Sobs、Chao指数值最高, Shannon指数值无显著差异.此外, 各样品间Simpson指数值无显著差异.
| 表 3 各铁还原富集菌群的α多样性指数(相似性97%) Table 3 Alpha-diversity indices of the iron-reducing bacterial community enriched from each soil sample (97% similarity) |
图 2为基于各样品菌群细菌门水平的相对丰度及聚类图.可见, 页岩气田土壤富集的铁还原菌群含有15个已知的细菌门.其中厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)在各样品中均具有较高丰度.此外, 在DC4-2、DC3-3及FS1-1中检测到较高丰度的Halanaerobiaeota.通过门水平的聚类分析发现, DC样品和FS样品没有分开, 高IRP样品和低IRP样品也没有分开(图 2).但是DC1、DC2样品与其它样品显著分开, 相较于其它样品, DC1、DC2中变形菌门相对丰度较高(图 2).
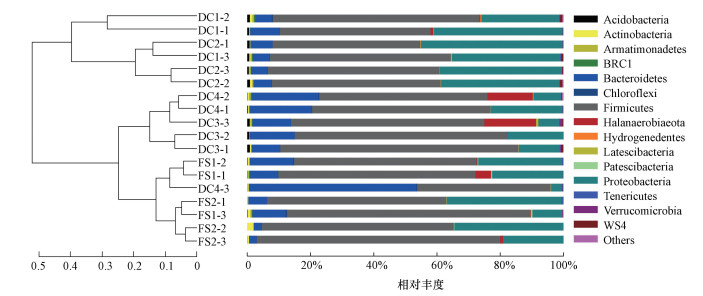 |
| 图 2 各样品富集铁还原菌群门水平相对丰度及聚类分析 Fig. 2 Relative abundance and cluster analysis on the phylum level in the iron-reducing bacterial community from each soil sample |
由各样品菌群属水平相对丰度热图(图 3)可知, 各富集菌群中均有较高丰度的Pseudomonas、norank Peptococcaceae、Lentimicrobium.尽管DC与FS样品或高IRP与低IRP样品在属水平上也没有区分, 但相较于其它样品, 高IRP样品(FS2和DC4) 中具有较高丰度的Pseudomonas、Acetoanaerobium、Tessaracoccus.各样品的富集铁还原菌群中均检测到典型的铁还原菌Geobacter, 但其相对丰度不高(DC4:0.07%、FS2:0.38%、DC1:0.41%、DC3:0.89%、DC2:1.57%、FS1:1.68%), 且在高IRP组中的相对丰度最低.
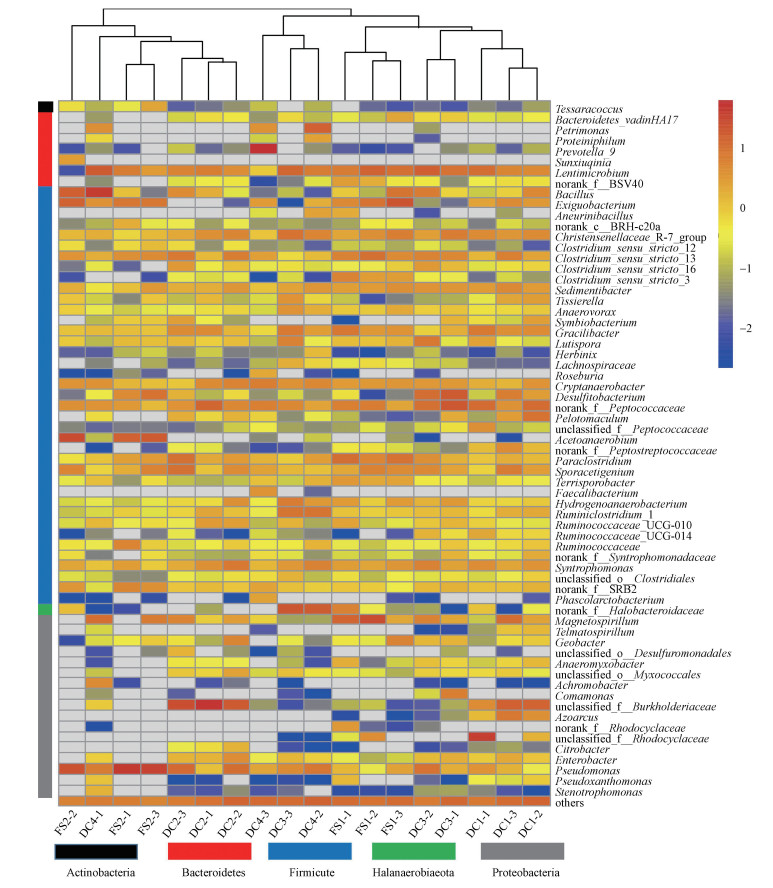 |
| 图 3 基于各富集铁还原菌群中相对丰度前65菌属构建的热图 Fig. 3 Heat map constructed from top 65 bacterial genera in each iron-reducing bacterial community |
依据样品铁还原活性高IRP(FS2、DC4)、中IRP(DC1、FS1)和低IRP(DC2、DC3)分组进行基于各富集样品细菌OTU组成的PCoA分析, 结果见图 4a.可见, 高IRP的DC4和FS2样品的细菌群落组成与其它样品明显分开, 且置信椭圆也基本可将高、中、低3组样品分别囊括.对基于各组样品的OTU组成进行了Adonis分析, 结果表明3组之间的OTU组成存在显著差异(R2=0.25, p < 0.001).因此, 尽管图 2的结果表明基于门或属水平不能将不同铁还原活性样品分开, 但样品的铁还原活性与样品中富集的铁还原菌群的OTU组成存在显著的相关性.火山图(图 4b)进一步显示了高IRP组与低IRP组的差异OTUs.与低IRP组比较, 高IRP组中Exiguobacterium(OTU681)、Acetoanaerobium(OTU1214、OTU1236、OTU1272)、Tessaracoccus(OTU1302)、Proteiniclasticum(OTU1228)、Proteiniphilum(OTU687)、Petrimonas(OTU600)等丰度显著上调, 而Ruminococcaceae_UCG-010(OTU283)、Anaeromyxobacter(OTU435)、AKIW659(OTU101)、Pseudomonas(OTU125)、Citrobacter(OTU354)、Desulfitobacterium(OTU495)等显著下调.
 |
| 图 4 基于铁还原富集菌群OTU组成的PCoA分析(a)及高、低IRP组差异OTUs火山图(b) Fig. 4 PCoA analysis based on the OTU level in the iron-reducing bacterial community (a) and the volcano plot showing the significant different OTUs in the high and low IRP groups (b) |
利用Vegan包envfit命令考察环境因子与群落结构间关系, 结果见表 4.各环境因子与富集菌群的OTU组成均显著相关, 其中IRP与菌群OTU组成在0.001水平上显著相关(r2= 0.8662).样品环境因子、富集菌群多样性及群落结构与铁还原活性Spearman相关分析表明, 铵态氮(r=-0.624, p=0.006)、有效磷(r=-0.508, p=0.031)、富集菌群群落结构(r=-0.814, p=0)与IRP显著相关.基于样品基本性质、铁还原活性、富集菌群多样性及群落结构(基于OTU)构建的结构方程模型如图 5所示.该模型对样品铁还原活性的总体解释度为82%, 富集菌群的群落结构是直接影响土壤IRP的因子.有效磷和铵态氮可通过影响富集菌群群落结构间接影响土壤IRP, 其中铵态氮还可通过影响土壤有效磷含量来间接作用于土壤IRP.
| 表 4 土壤性质与铁还原菌群落结构间的相关性 Table 4 Mantel correlation between soil properties and iron-reducing bacteria community structure |
 |
| 图 5 基于土壤基本性质、微生物群落特征及土壤IRP构建的结构方程模型 (线上的数字为标准化路径系数, 实线和虚线箭头分别表示显著(p < 0.05)和不显著(p > 0.05)相关) Fig. 5 The structural equation model constructed from the soil properties, microbial community characteristic, and IRP |
目前已报道的铁还原富集菌群中, 常常能检测到的细菌门主要有Firmicutes、Proteobacteria、脱铁杆菌门(Deferribacteres)、栖热袍菌门(Thermotogae)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、Bacteroidetes以及产水菌门(Aquificae)等(Fredrickson et al., 1996; Esther et al., 2015).本研究的结果表明, 涪陵页岩气田区域土壤铁还原菌群的优势菌门为Firmicutes、Proteobacteria和Bacteroidetes, 它们均属于铁还原富集物中的常见菌门.此外, Fan等(2018)报道, Proteobacteria和Firmicutes是巢湖沉积物中的铁还原富集菌群的优势菌门, 它们也是湖南冷水江市锑矿区非污染水稻土中铁还原菌群中的优势菌门(黎慧娟等, 2011), 这些均与本研究的结果基本一致.
本研究中, 典型铁还原菌属Geobacter在页岩气田土壤铁还原富集菌群中的相对丰度不高, 同时在高IRP样品中并未表现出显著上调(图 4b).可见, Geobacter丰度不是决定该区域土壤IRP的主要因子.各富集菌群中, Pseudomonas、norank Peptococcaceae、Lentimicrobium等菌属具有较高丰度(图 3), 但目前没有研究确认这些菌属具备直接的铁还原能力.其中Pseudomonas是铁还原菌群中较为常见的菌属(Pan et al., 2017; 苏三宝等, 2018), Norank Peptococcaceae可能具备矿化苯的能力(Luo et al., 2014), 而Lentimicrobium同样可能具备代谢复杂有机物的能力(Sun et al., 2016).因此, 推测这些高丰度菌属可能为该气田土壤铁还原菌提供了更易利用的碳源, 从而间接影响土壤IRP.本研究中, 与低IRP样品相比, 高IRP样品中以OTU681为代表的Exiguobacterium、OTUs(1214、1236、1272)为代表的Acetoanaerobium、OTU1302为代表的Tessaracoccus、OTU687为代表的Proteiniphilum、OTU600为代表的Petrimonas等菌属显著上调(图 4b).其中Acetoanaerobium、Proteiniphilum、Petrimonas均报道具备在厌氧条件下发酵产生乙酸等有机酸的能力, 而乙酸是铁还原菌的重要电子供体(Sleat et al., 1985; Lovley et al., 2004; Chen et al., 2005; 王晓华等, 2016).因此, 这3个菌属在高IRP富集菌群中可起到为铁还原菌提供易于利用的电子供体的作用.Exiguobacterium和Tessaracoccus均有从石油污染等土壤中分离的报道(Cai et al., 2011; 张莹等, 2013), 表明它们具备较强的复杂有机物代谢能力.此外, Exiguobacterium菌属中存在具备铁还原能力的菌株, 并具有解除重金属毒性的潜力(司友斌等, 2015; Aneksampant et al., 2018; White et al., 2019).因此, 这2个菌属可能与气田土壤具有潜在有机污染物风险的特征有关, 它们一方面能代谢复杂碳氢化合物为铁还原菌提供电子供体间接影响土壤铁还原过程, 另一方面还可能直接参与土壤的铁还原反应.
本研究的结果表明, 土壤pH、有机质、硝态氮、铵态氮和有效磷均与该气田土壤富集铁还原菌群的群落结构(OTU组成)显著相关(表 4).已有的研究也表明铁还原菌的群落结构受环境因子的强烈影响(Bongoua-Devisme et al., 2013; 张洪霞等, 2017; Pan et al., 2019).如, Pan等(2019)发现沉积物中铁还原微生物群落主要受到pH和氧化还原电位的影响, Bongoua-Devisme等(2013)报道土壤有机质含量能强烈影响其中铁还原菌群的群落结构.可见, 土壤铁还原菌群对环境因子具有较为敏感的响应.基于土壤基本性质、铁还原菌群群落组成及IRP构建的结构方程模型(图 5)表明, 铁还原菌群的群落组成是直接影响土壤IRP的主要因子.尽管目前还鲜有关于铁还原菌群群落结构与IRP关系的报道, 但微生物的群落结构与其功能密切相关已成为共识(Tyson et al., 2004; Wei et al., 2018).且土壤中一些重要的功能微生物, 如氨氧化菌、硫酸盐还原菌、反硝化菌及产甲烷菌等的活性均与其菌群群落结构相关(Xia et al., 2014; Ding et al., 2020; Wang et al., 2020; Euler et al., 2020; 施昊坤等, 2020).因而, 本研究证实了土壤铁还原菌群的群落结构也与其活性直接关联.图 4的结果还表明, 氨氮和有效磷均能通过影响铁还原菌群落结构来间接影响土壤IRP, 且氨氮还可以通过直接影响土壤有效磷来间接作用于铁还原菌群.氮、磷作为微生物生长必须的重要营养元素, 它们对土壤功能微生物群落结构的直接影响也常有报道(Leff et al., 2015; Wang et al., 2016; 郭魏等, 2017; Zhang et al., 2018).土壤铵态氮可通过影响土壤微生物的生长和磷酸酶的分泌来影响土壤有效磷的含量(李银等, 2011), 这可能是氨氮可通过影响有效磷含量间接影响铁还原菌群落结构的主要原因.
5 结论(Conclusions)1) 涪陵页岩气田土壤铁还原菌群的优势细菌门为Firmicutes、Proteobacteria和Bacteroidetes, 一些分属于Acetoanaerobium、Proteiniphilum、Petrimonas、Tessaracoccus及Exiguobacterium菌属中的OTUs在高IRP样品中显著上调, 表明这些菌属在铁还原过程起到重要的作用.
2) 富集的铁还原菌群落结构与土壤性质显著相关, 表明铁还原菌群对环境因子有较为敏感的响应.
3) 铁还原微生物群落结构是直接影响该气田土壤IRP的关键因子, 而土壤铵态氮、有效磷可以通过影响铁还原微生物群落结构间接影响IRP, 且氨氮还可通过直接影响有效磷来间接作用于IRP.
Aneksampant A, Tanaka A, Tu X F, et al. 2018. Roles of microbial activity and anthraquinone-2, 7-disulfonate as a model of humic substances in leaching of iron from hematite into seawater[J]. Analytical Sciences, 34(11): 1303-1308. |
Bongoua-Devisme A J, Cebron A, Kassin K E, et al. 2013. Microbial communities involved in Fe reduction and mobility during soil organic matter (SOM) mineralization in two contrasted paddy soils[J]. Geomicrobiology Journal, 30(4): 347-361. |
Botton S, Parsons J R. 2007. Degradation of BTX by dissimilatory iron-reducing cultures[J]. Biodegradation, 18(3): 371-381. |
Cai M, Wang L, Cai H, et al. 2011. Salinarimonas ramus sp. nov. and Tessaracoccus oleiagri sp. nov., isolated from a crude oil-contaminated saline soil[J]. International Journal of Systematic and Evolutionary Microbiology, 61(8): 1767-1775. |
Chen S Y, Dong X Z. 2005. Proteiniphilum acetatigenes gen. nov., sp. nov., from a UASB reactor treating brewery wastewater[J]. International Journal of Systematic and Evolutionary Microbiology, 55(6): 2257-2261. |
Cummings D E, March A W, Bostick B, et al. 2000. Evidence for microbial Fe(Ⅲ) reduction in anoxic, mining-impacted lake sediments (Lake Coeur d'Alene, Idaho)[J]. Applied and Environmental Microbiology, 66(1): 154-162. |
de Lima e Silva M R, Correa R C, Sakamoto I K, et al. 2018. Microbial characterization of methanogenic and iron-reducing consortium in reactors with polychlorinated biphenyls[J]. Current Microbiology, 75(6): 666-676. |
Ding B J, Luo W Q, Qin Y B, et al. 2020. Effects of the addition of nitrogen and phosphorus on anaerobic ammonium oxidation coupled with iron reduction (Feammox) in the farmland soils[J]. Science of the Total Environment, 737: 139849. |
Esther J, Sukla L B, Pradhan N, et al. 2015. Fe (Ⅲ) reduction strategies of dissimilatory iron reducing bacteria[J]. Korean Journal of Chemical Engineering, 32(1): 1-14. |
Euler S, Jeffrey L C, Maher D T, et al. 2020. Shifts in methanogenic archaea communities and methane dynamics along a subtropical estuarine land use gradient[J]. Plos One, 15(11): e0242339. |
Fan Y Y, Li B B, Yang Z C, et al. 2018. Abundance and diversity of iron reducing bacteria communities in the sediments of a heavily polluted freshwater lake[J]. Applied Microbiology and Biotechnology, 102(24): 10791-10801. |
Fredrickson J K, Gorby Y A. 1996. Environmental processes mediated by iron-reducing bacteria[J]. Current Opinion in Biotechnology, 7(3): 287-294. |
Ginn B, Meile C, Wilmoth J, et al. 2017. Rapid iron reduction rates are stimulated by high-amplitude redox fluctuations in a tropical forest soil[J]. Environmental Science & Technology, 51(6): 3250-3259. |
Gorby Y A, Yanina S, McLean J S, et al. 2006. Electrically conductive bacterial nanowires produced by Shewanella oneidensis strain MR-1 and other microorganisms[J]. Proceedings of the National Academy of Sciences of the United States of America, 103(30): 11358-11363. |
Gould W D, Stichbury M, Francis M, et al. 2003. An MPN method for the enumeration of iron-reducing bacteria[C]. Mining and the Environment Conference. 1-5
|
郭魏, 齐学斌, 李平, 等. 2017. 不同施氮水平下再生水灌溉对土壤细菌群落结构影响研究[J]. 环境科学学报, 37(1): 280-287. |
胡敏, 李芳柏. 2014. 土壤微生物铁循环及其环境意义[J]. 土壤学报, 51(4): 683-698. |
Kleemann R, Meckenstock R U. 2011. Anaerobic naphthalene degradation by Gram-positive, iron-reducing bacteria[J]. FEMS Microbiology Ecology, 78(3): 488-496. |
Leff J W, Jones S E, Prober S M, et al. 2015. Consistent responses of soil microbial communities to elevated nutrient inputs in grasslands across the globe[J]. Proceedings of the National Academy of Sciences of the United States of America, 112(35): 10967-10972. |
黎慧娟, 彭静静. 2011. 水稻土中铁还原菌多样性[J]. 应用生态学报, 22(10): 2705-2710. |
李银, 曾曙才, 黄文娟. 2011. 模拟氮沉降对鼎湖山森林土壤酸性磷酸单酯酶活性和有效磷含量的影响[J]. 应用生态学报, 22(3): 631-636. |
Lovley D R, Holmes D E, Nevin K P. 2004. Dissimilatory Fe (Ⅲ) and Mn (Ⅳ) reduction[J]. Advances in Microbial Physiology, 49: 219-286. |
Lovley D R. 1993. Dissimilatory metal reduction[J]. Annual Review of Microbiology, 47: 263-290. |
Lovley D R. 1997. Microbial Fe(Ⅲ) reduction in subsurface environments[J]. FEMS Microbiology Reviews, 20(3): 305-313. |
Luo F, Gitiafroz R, Devine C E, et al. 2014. Metatranscriptome of an anaerobic benzene-degrading, nitrate-reducing enrichment culture reveals involvement of carboxylation in benzene ring activation[J]. Applied and Environmental Microbiology, 80(14): 4095-4107. |
Marozava S, Mouttaki H, Müller H, et al. 2018. Anaerobic degradation of 1-methylnaphthalene by a member of the Thermoanaerobacteraceae contained in an iron-reducing enrichment culture[J]. Biodegradation, 29(1): 23-39. |
Oksanen J, Blanchet F G, Kindt R, et al. 2012. Vegan: Community ecology package[EB/OL]. URL http://CRAN.Rproject.org/package=vegan
|
Pan Y Y, Yang X A, Xu M Y, et al. 2017. The role of enriched microbial consortium on iron-reducing bioaugmentation in sediments[J]. Frontiers in Microbiology, 8: 462. |
Pan Y Y, Yang X N, Sun G P, et al. 2019. Functional response of sediment bacterial community to iron-reducing bioaugmentation with Shewanella decolorationis S12[J]. Applied Microbiology and Biotechnology, 103(12): 4997-5005. |
Peng Q A, Shaaban M, Wu Y P, et al. 2016. The diversity of iron reducing bacteria communities in subtropical paddy soils of China[J]. Applied Soil Ecology, 101: 20-27. |
曲东, 贺江舟, 孙丽蓉. 2005. 不同水稻土中氧化铁的微生物还原特征[J]. 西北农林科技大学学报(自然科学版), 33(4): 97-101. |
施昊坤, 吴次芳, 张茂鑫, 等. 2020. 土地整治对工业区周边土壤微生物多样性和群落结构影响分析[J]. 环境科学学报, 40(1): 212-223. |
司友斌, 王娟. 2015. 异化铁还原对土壤中重金属形态转化及其有效性影响[J]. 环境科学, 36(9): 3533-3542. |
Sleat R, Mah R A, Robinson R. 1985. Acetoanaerobium noterae gen. nov., sp. nov.: An anaerobic bacterium that forms acetate from H2 and CO2[J]. International Journal of Systematic Bacteriology, 35(1): 10-15. |
Sun L W, Toyonaga M, Ohashi A, et al. 2016. Lentimicrobium saccharophilum gen. nov., sp. nov., a strictly anaerobic bacterium representing a new family in the phylum Bacteroidetes, and proposal of Lentimicrobiaceae fam. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 66(7): 2635-2642. |
苏三宝, 张凡, 喻高明, 等. 2018. 油藏环境异化铁还原菌的生物多样性[J]. 科学技术与工程, 18(30): 30-34. |
Sun W M, Dong Y R, Gao P, et al. 2015. Microbial communities inhabiting oil-contaminated soils from two major oilfields in Northern China: Implications for active petroleum degrading capacity[J]. Journal of Microbiology, 53: 371-378. |
Treude N, Rosencrantz D, Liesack W, et al. 2003. Strain FAc12, a dissimilatory iron-reducing member of the Anaeromyxobacter subgroup of Myxococcales[J]. FEMS Microbiology Ecology, 44(2): 261-269. |
Tyson G W, Chapman J, Hugenholtz P, et al. 2004. Community structure and metabolism through reconstruction of microbial genomes from the environment[J]. Nature, 428(6978): 37-43. |
Wang J, Cao X F, Liao J Q, et al. 2015. Carcinogenic potential of PAHs in oil-contaminated soils from the main oil fields across China[J]. Environmental Science and Pollution Research, 22(14): 10902-10909. |
王伟民, 曲东, 徐佳. 2008. 水稻土中铁还原菌的分离纯化及铁还原能力分析[J]. 西北农林科技大学学报(自然科学版), 36(10): 103-109. |
王晓华, 李蕾, 何琴, 等. 2016. 驯化对餐厨垃圾厌氧消化系统微生物群落结构的影响[J]. 环境科学学报, 36(12): 4421-4427. |
Wang Y Q, Xiao G Q, Cheng Y Y, et al. 2020. The linkage between methane production activity and prokaryotic community structure in the soil within a shale gas field in China[J]. Environmental Science and Pollution Research, 27(7): 7453-7462. |
Wang Y, Ji H F, Gao C Q. 2016. Differential responses of soil bacterial taxa to long-term P, N, and organic manure application[J]. Journal of Soils and Sediments, 16(3): 1046-1058. |
Wei H W, Wang L H, Hassan M, et al. 2018. Succession of the functional microbial communities and the metabolic functions in maize straw composting process[J]. Bioresource Technology, 256: 333-341. |
White R A, Soles S A, Gavelis G, et al. 2019. The complete genome and physiological analysis of the eurythermal firmicute Exiguobacterium chiriqhucha strain RW2 isolated from a freshwater microbialite, widely adaptable to broad thermal, pH, and salinity ranges[J]. Frontiers in Microbiology, 9: 3189. |
Xia F F, Su Y, Wei X M, et al. 2014. Diversity and activity of sulphur-oxidizing bacteria and sulphate-reducing bacteria in landfill cover soils[J]. Letters in Applied Microbiology, 59(1): 26-34. |
Xu N, Tan G C, Wang H Y, et al. 2016. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 74: 1-8. |
杨剑虹, 王成林, 代亨林, 等. 2008. 土壤农化分析与环境监测[M]. 北京: 中国大地出版社.
|
姚炎红, 王明霞, 左小虎, 等. 2016. 典型油田多环芳烃污染对土壤反硝化微生物群落结构的影响[J]. 环境科学, 37(12): 4750-4759. |
张洪霞, 郑世玲, 魏文超, 等. 2017. 水分条件对滨海芦苇湿地土壤微生物多样性的影响[J]. 海洋科学, 41(5): 144-152. |
Zhang T A, Chen H Y H, Ruan H H, et al. 2018. Global negative effects of nitrogen deposition on soil microbes[J]. ISME Journal, 12(7): 1817-1825. |
张月超, 肖雷雷, 王欧美, 等. 2018. 异化铁还原梭菌Clostridium bifermentans EZ-1产氢与电化学特性[J]. 微生物学报, 58(4): 525-537. |
张莹, 石萍, 马炯. 2013. 微小杆菌Exiguobacterium spp.及其环境应用研究进展[J]. 应用与环境生物学报, 19(5): 898-904. |
 2021, Vol. 41
2021, Vol. 41


