2. 永清环保股份有限公司上海分公司, 上海 200051;
3. 上海格林曼环境技术有限公司, 上海 200001
2. Branch of Shanghai, Yonker Environmental Protection Co., Ltd., Shanghai 200051;
3. Shanghai Greenment Environment Technology Co., Ltd., Shanghai 200001
苯、甲苯、乙苯和二甲苯(Benzene, Toluene, Ethylbenzene, and Xylene, BTEX)因具有“三致”效应而被各国列为优先控制污染物(Ran et al., 2018; Mohd et al., 2019).BTEX在农药、石化等污染土壤和地下水中频繁检出, 且浓度高、易挥发, 尤其在开挖、运输和治理等异位修复过程中会产生二次污染(Usman et al., 2020).近年来, BETX污染土壤与地下水的微生物原位修复备受关注.
人们围绕纯培养体系中BTEX的微生物降解特性、途径、机理等已开展了较为系统的研究(Smith et al., 1990; Ines et al., 2008; Poyraz et al., 2021).纯培养降解菌在实验室条件下降解效率较高, 但在实际污染场地修复中降解菌的存活率低, 降解效率受环境因素影响波动大, 修复效果并不理想(Lee et al., 2019).因此, 构建适应能力强、降解活性高、结构稳定的降解菌群是成功原位修复的关键.Nagarajan将恶臭假单胞菌(Pseudomonas putida)、红球菌(Rhodococcus)和斯氏假单胞菌(Pseudomonas stanieri)混合培养, 对BTEX的降解率显著提高(Nagarajan et al., 2007).周月明等(2014)将Pseudomonas putida等8株单菌混合, 对BTEX降解率最高为91.6%, 而单菌的降解效率最高仅为80%.马小丽等(2018)利用Pseudomonas sp.菌构建的混菌处理实际地下水, 25 h内能够完全去除水中25 mg·L-1的苯、甲苯、乙苯混合物.目前针对菌群的研究大多关注菌群的降解特性、各菌种间的协同作用, 对菌群结构的稳定性却很少关注, 而菌群的结构与其降解功能密切相关(蒋婧等, 2010).
基于此, 本研究采集扬州某农药厂苯系物污染土壤, 通过驯化、富集的方式获得苯高效降解菌群, 并开展该菌群降解苯特性、降解途径、功能基因, 以及不同污染物环镜下群落结构稳定性等相关研究, 以期为实际污染土壤与地下水原位生物修复提供基础数据和生物材料支撑.
2 材料与方法(Materials and methods) 2.1 菌种来源采集江苏扬州某农药厂苯系物污染土壤, 采集后样品存放于棕色玻璃瓶内, 并低温当日送至实验室.经检测该污染土壤中苯含量为565 mg·kg-1, 为GB36600-2018第二类用地筛选值的141倍.
2.2 培养基无机盐培养基(SSDM): 0.2 g·L-1 NH4Cl、7.95 g·L-1 NaCl、0.77 g·L-1 MgCl2·6H2O、1.05 g·L-1 MgSO4·7H2O、0.076 g·L-1 CaCl2、0.22 g·L-1 KCl、0.01 g·L-1 NaHCO3、0.026 g·L-1 NaBr、0.25 g·L-1 K2HPO4;微量元素(张燕可, 2017)每1 L培养基中添加1 mL;调节pH至8.0, 121 ℃灭菌20 min后备用.
LB培养基: 10 g·L-1蛋白胨、5 g·L-1酵母粉、10 g·L-1 NaCl.
固体培养基: 在上述LB培养基基础上添加1.2 g·L-1的琼脂粉, 灭菌后备用.
2.3 主要试剂与设备试剂: 苯、甲苯、乙苯、二甲苯、苯酚和邻苯二酚均为优级纯, 购自国药集团.
仪器: ZQZY-78CN全温振荡培养箱(上海知楚仪器有限公司)、GC-7890B气相色谱(Agilent, 美国);LC-20高效液相色谱仪(Shimadzu, 日本)、LCMS-9030 Q-TOF四级杆-飞行时间质谱仪(Shimadzu, 日本)、DC-12氮气吹干仪(上海安谱科学仪器有限公司).
2.4 实验方法 2.4.1 苯降解菌群的富集每个血清瓶中盛装30 mL SSDM培养基, 加入6 g污染土壤后密封, 再用注射器注入一定量苯系物作为唯一碳源, 混合苯系物(苯、甲苯、乙苯、邻二甲苯体积比=1∶1∶1∶1)总浓度为200 mg·L-1(周月明等, 2013), 放入28 ℃、180 r·min-1恒温振荡培养箱培养3 d, 再按10%接种量转接到新鲜培养基中富集培养, 如此重复5次.采用顶空气相色谱测定降解体系中苯残留浓度(张燕可, 2017), 苯、甲苯和乙苯的保留时间分别在2.5、3.5和4.6 min.
2.4.2 菌群降解苯的特性研究降解菌群在含有苯的LB培养基诱导培养后, 于8000 r·min-1下离心5 min, 并用SSDM培养基重悬, 洗去酵母粉等碳源;然后向盛装20 mL含100 mg·L-1苯的SSDM培养基的150 mL血清瓶中加入菌液(OD600值为0.1), 12 h后取样测定苯的残留浓度.分别改变苯的初始浓度、培养温度、初始pH值、添加酵母粉等因素, 探究各因素对苯降解效率的影响.每个条件做3个平行, 以未接菌的含苯培养基作为对照, 降解率D=(C0-Ct-CL)/(C0-CL)×100%, 其中, C0为培养基中苯的初始浓度, Ct为降解一定时间后培养基中苯的浓度, CL为挥发损失的浓度.
2.4.3 菌群降解苯的中间代谢产物的鉴定合并降解体系5个血清瓶中的培养基, 并用等体积的乙酸乙酯萃取上清液3次.合并的萃取物用无水硫酸钠干燥, 并通过氮气流蒸发至干.然后将浓缩的样品重新溶解在乙腈中, 通过孔径为0.22 μm的有机溶剂滤膜过滤.使用LC-20/LCMS-9030进行分析, 色谱条件: Eclipse XDB-C18色谱柱(5 μm, 4.6 mm×250 mm), 柱温40 ℃, 检测波长270 nm, 进样体积10 μL, 流动相由CH3OH/水组成, 梯度洗脱: 0 min, 5%甲醇;30 min, 50%甲醇;45 min, 50%甲醇;60 min, 5%甲醇;流速为0.8 mL·min-1(Zhang et al., 2013).质谱条件: 大气压化学电离源(APCI)负离子条件, 毛细管电压1.9 kV, 接口温度350 ℃.
2.4.4 菌群对苯酚、邻苯二酚、BTEX混合物的降解特性苯酚、邻苯二酚初始浓度为50 mg·L-1, 降解12 h后取样测定培养基中残留浓度;BTEX混合物中每种污染物初始浓度为30 mg·L-1, 1~2 h间隔取样测定培养基中残留浓度.
2.4.5 菌群群落结构解析取已驯化富集60 d的菌群分别转接于含苯200 mg·L-1、含BTEX总浓度200 mg·L-1的SSDM培养基中(含酵母粉100 mg·L-1), 在不同底物下条件下富集培养, 2 d转接1次, 收集第7次转接液中的菌体送上海生工生物工程股份有限公司进行高通量测序分析.
2.4.6 菌群降解苯功能基因的检测以菌群基因组DNA为模板, 利用表 1中引物进行PCR扩增(Baldwin et al., 2003; 张倩, 2012).TMOA用于检测单加氧酶基因, TBMD适用于所有芳香族单氧酶的羟化酶复合物1亚科α亚基编码基因的检测, 1, 2-CTD用于检测邻苯二酚1, 2加氧酶基因.定性PCR采用50 μL体系(毛心慰等, 2009), 由上海生工生物工程股份有限公司合成引物和进行PCR产物测序.
| 表 1 PCR所用到的引物 Table 1 Primers used in PCR |
以200 mg·L-1苯为唯一碳源对该土壤样品中的菌群进行富集, 富集过程中培养基转接1 d后由清澈变浑浊, 说明该菌群能以苯为唯一碳源生长.重复转接5次, 检测降解2 d后培养基中残留苯的浓度, 结果显示, 苯浓度低于检测限, 而对照中苯的浓度未有明显变化, 初步表明该菌群能高效降解苯.
3.2 菌群降解苯系物的特性菌群降解苯的特性如图 1所示.由图 1a可知, 菌群在50~300 mg·L-1范围内均可降解苯, 其中在12 h内能完全降解100 mg·L-1的苯, 且在300 mg·L-1苯浓度下, 菌群仍可降解42%的苯.由图 1b可知, 菌群在pH值6~9范围内均能降解苯, 与相关文献报道比较接近(Jo et al., 2008);在pH值6~8范围内100 mg·L-1的苯可被完全降解, 但pH值为9时, 降解率仅为60%.由图 1c可知, 随着酵母粉浓度由50 mg·L-1增至100 mg·L-1, 苯的降解效果显著提升, 降解率由55%提高到100%, 加入酵母粉能够有效缩短降解污染物的时间(Nicholson et al., 2008);继续增加酵母粉浓度至200 mg·L-1, 苯的降解率并没有显著提高.由图 1d可知, 温度对苯的降解率影响较大, 28 ℃条件下苯降解率达100%, 而15 ℃和37 ℃条件下降解率仅为40%.研究表明, 温度过高不利于菌的存活, 温度过低则影响代谢酶的活性(孙文静, 2009).该菌群降解特性与毛心蔚等(2009)的研究结果相似, 菌群的降解率随酵母粉浓度升高而提高, 在筛选温度28 ℃条件下有最佳的降解效率.该菌群能耐受降解高浓度苯, 在地下水污染修复方面具有潜在的应用前景.
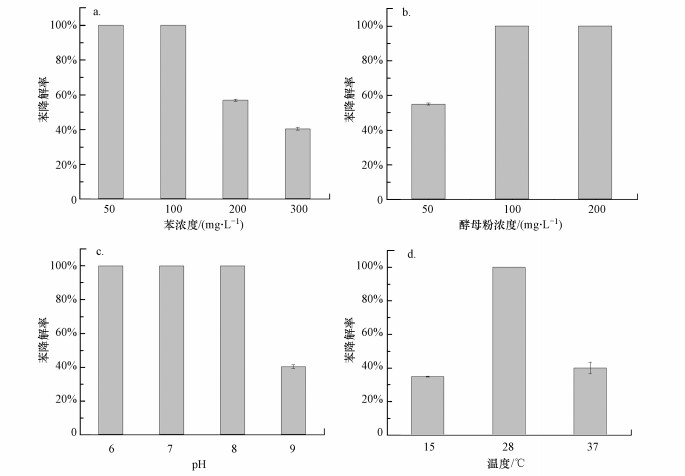 |
| 图 1 不同因素对菌群降解苯的影响 (a.苯浓度, b.酵母粉浓度, c.pH, d.温度) Fig. 1 Effects of different factors on benzene degradation by bacteria colony (a.benzene concentration, b.yeast powder concentration, c.pH, d.temperature) |
最优条件下菌群降解苯的特性如图 2所示, 结果显示, 该菌群在最优条件下能够在6 h内全部降解100 mg·L-1的苯, 平均降解速率为16.7 mg·L-1·h-1.在前5 h内, 99%的苯被该菌群降解;6 h后, 溶液中的苯浓度低于检出限而未检出, 说明此时苯已被全部降解.孙文静(2009)富集得到的降解菌群在最优条件下降解72 mg·L-1的苯需要50 h, 从降解速率上说本菌群具有一定的优势.
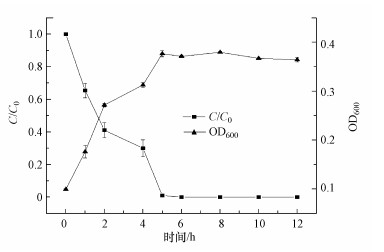 |
| 图 2 最优条件下菌群以苯为碳源的降解和生长曲线 Fig. 2 Degradation and growth curve of bacterial flora using benzene as carbon source under optimal conditions |
降解产物经HPLC分析结果如图 3a所示, 在保留时间16.45、25.70 min处有两个产物峰, 与苯酚标准品和邻苯二酚标准品保留时间(16.45、25.70 min)一致.降解产物进一步由Q-TOF分析一级质谱如图 3b所示, 保留时间为16.45 min的产物最大质荷比为109, 保留时间为25.70 min的产物最大质荷比为93, 一级质谱图和二级质谱图与邻苯二酚标准品、苯酚标准品相同(二级质谱与标准品质谱图未显示).综上, 确定该菌群降解苯是通过苯酚、邻苯二酚等途径.细菌降解苯主要有两种路径: 一是苯通过单加氧酶生成苯酚和邻苯二酚;二是直接在双加氧酶作用下生成邻苯二酚(Jindrov et al., 2002; Mahesh et al., 2020).本研究在降解5 h后从溶液中检测到了中间产物苯酚和邻苯二酚, 推测菌群降解苯的途径可能为苯通过加氧酶生成苯酚, 再通过加氧酶作用生成邻苯二酚.
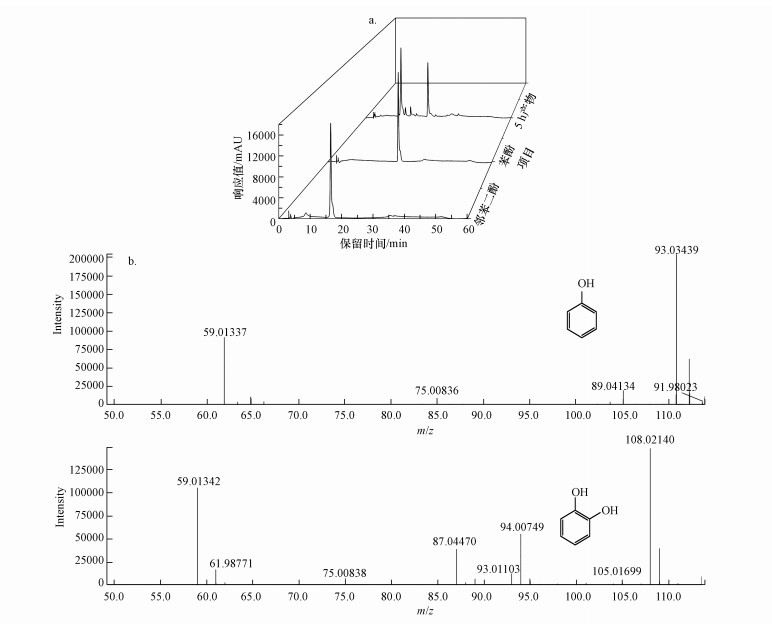 |
| 图 3 苯降解主要中间产物的色谱图(a)和质谱图(b) Fig. 3 Chromatogram (a) and mass spectrum (b) of the main intermediate products of benzene degradation |
通过菌群对苯酚、邻苯二酚降解实验发现, 对照组(不加底物)OD600值为0.149±0.001, 以苯酚为降解底物的菌液OD600值为0.152±0.002, 以邻苯二酚为降解底物的菌液OD600值为0.220±0.007, 说明菌群能够利用苯酚和邻苯二酚生长, 但相同时间内菌群利用邻苯二酚的生长量要远大于菌群利用苯酚的生长量, 通过HPLC检测苯酚和邻苯二酚残留浓度显示, 菌群对邻苯二酚的降解率为99.74%, 而对苯酚的降解率仅为5.36%, 这与OD600值结果一致.同时, 在前面的研究中发现菌群降解苯的中间产物苯酚的累积量要高于邻苯二酚的累积量, 推测苯酚生成邻苯二酚是该菌群降解苯的限速步骤.
3.5 菌群降解苯系物的功能基因通过TBMD引物扩增得到了636 bp的基因片段, 而其余两种引物并未获得目的基因.将测序结果在NCBI(National Coalition Building Institute)网站上进行对比, 发现与Pseudomonas oryzae strain KCTC 32247的苯酚单加氧酶P3亚基有90%的相似度, 证明该菌群中存在苯代谢的功能基因, GenBank登录号为MW388722.
3.6 菌群对BTEX降解能力多底物混合情况下菌群的降解情况如图 4所示, 当菌群接种于6种BTEX混合物中后, 苯、甲苯、乙苯分别在9、22、30 h内被完全降解, 3种二甲苯的浓度并没有显著变化, 菌群对苯系物的降解能力依次为苯>甲苯>乙苯>二甲苯, 这与杨卫兵等(2010)的研究结果相似.对比3.3节中以苯为唯一底物时的降解速率(16.7 mg·L-1·h-1), 混合底物中苯的降解速率为3.33 mg·L-1·h-1, 降解速率明显下降, 说明当同时存在多种底物时, 某些物质的降解可能被抑制(Hamed et al., 2003; Zhang et al., 2013; 张燕可, 2017; Mohd et al., 2019).推测未能降解化合物的存在抑制了其他化合物降解基因的表达, 甚至可能导致降解菌死亡(Foght et al., 2008).
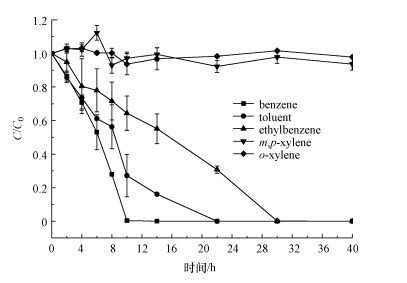 |
| 图 4 菌群对BTEX的降解能力 Fig. 4 BTEX degradation ability of flora |
在表征生物降解过程的模型中, Monod反应方程常用来描述低浓度(≤500 mg·L-1)下的代谢动力学, 对图 4中该菌群降解BTEX的数据进行拟合, 发现该菌群降解30 mg·L-1的BTEX混合物符合Monod零级反应动力学方程(C=-C0Kt+A, 其中, t为降解时间(h), C为降解t小时底物浓度(mg·L-1), C0为初始底物浓度(mg·L-1), K为零级速率常数, A为常数).进一步将该方程改写为y=-Kt+B, 其中, y=C/C0, B=A/C0.
对于Monod零级反应动力学返程, 当C/C0=1/2时, 即底物降解1/2时, 此时t为半衰期, 可以得到该菌群对BTEX的降解动力学方程, 具体结果如表 2所示, 该菌群降解30 mg·L-1苯的半衰期为5.65 h, 降解甲苯的半衰期为7.91 h, 降解乙苯的半衰期为14.5 h.
| 表 2 BTE的降解动力学方程 Table 2 Degradation kinetic equation of BTE |
通过比较不同菌群对BTEX的降解特性(表 3)发现, 目前对混合底物中苯降解最快的菌群能够在20 h内完全降解45 mg·L-1的苯, 平均降解率为2.25 mg·L-1·h-1, 而本研究获得的菌群能够在9 h内完全降解30 mg·L-1的苯, 平均降解率为3.33 mg·L-1·h-1.从降解速率上来看, 本菌群具有明显的优势.
| 表 3 不同菌群对BTEX的降解特性 Table 3 The degradation of BTEX by different bacterial groups |
对不同底物条件驯化后菌群的群落结构组成进行高通量测序分析, 结果如图 5所示.由图可知, 在以BTEX为底物驯化后, 菌群中含有Cupriavidus(48.4%)、Arthrobacter(13.15%)、Dyella(7.93%)、Corynebacterium(9.76%)、Microbacterium(8.55%);在以苯为底物驯化后, 菌群中含有Cupriavidus(40.45%)、Arthrobacter(28.02%)、Dyella(12.25%)、Corynebacterium(5.16%)、Microbacterium(3.38%);在两种不同底物条件下驯化后菌群的菌属一样, 仅丰度发生了改变, 这是因为在不同底物条件下优势菌的生长情况不同.文献中报道较多的苯降解菌有Pseudomonas、Rhodococcus(Hamed et al., 2003; Tsai et al., 2013), 说明该菌群中可能存在比较新的苯系物降解菌, 与Jo等(2008)获得的菌群相比, 本菌群中也存在Corynebacterium, 可能是降解苯系物的功能菌属.并且在不同底物驯化条件下, 以上菌属都稳定存在, 且相对丰度变化不大, 说明该菌群稳定性高, 具有很好的应用前景.
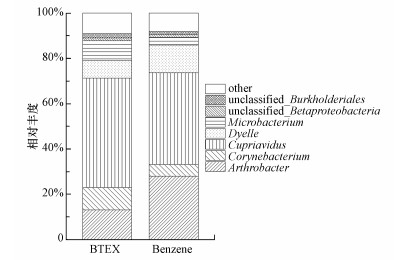 |
| 图 5 菌群分别在以苯和6种苯系物为底物条件下驯化的群落结构及相对丰度 Fig. 5 The community structure and relative abundance of the bacterial flora acclimatized under the conditions of benzene and six benzene series as substrates |
1) 从苯污染土壤中通过富集培养可获得高效苯降解菌群, 少量酵母粉的添加能显著提高该菌群降解苯的效率, 同时该菌群也能降解甲苯和乙苯.
2) 该菌群通过苯酚、邻苯二酚等途径降解苯, 苯酚到邻苯二酚是该菌群降解苯的限速步骤.
3) 该菌群群落结构稳定, 菌群中含有Cupriavidus、Arthrobacter、Dyella、Corynebacterium、Microbacterium等菌属, 其中优势菌为Cupriavidus.
Baldwin B R, Nakatsu C H, Nies L. 2003. Detection and enumeration of aromatic oxygenase genes by multiplex and real-time PCR[J]. Applied and Environmental Microbiology, 69: 3350-3358. DOI:10.1128/AEM.69.6.3350-3358.2003 |
Foght J. 2008. Anaerobic biodegradation of aromatic hydrocarbons: Pathways and prospects[J]. Journal of Molecular Microbiology and Biotechnology, 15: 93-120. DOI:10.1159/000121324 |
Hamed T A, Bayraktar E, Mehmetoglu T, et al. 2003. Substrate interactions during the biodegradation of benzene, toluene and phenol mixtures[J]. Process Biochemistry, 39: 27-35. DOI:10.1016/S0032-9592(02)00293-5 |
Ines G P, Irmene O, Sergio H, et al. 2008. Biofiltration of BTEX by the fungus Pacilomyces variotii[J]. International Biodeterioration & Biodegradation, 62: 442-447. |
蒋婧, 王慧, 张丽花, 等. 2010. 嗜盐菌群在甲苯降解过程中群落结构的变化解析[J]. 中国环境科学, 30(2): 216-221. |
Jindrov E, Citocova M, Demnerov K, et al. 2002. Bacterial aerobic degradation of benzene, toluene, ethylbenzene and xylene[J]. Folia Microbiologica, 47(2): 83-93. DOI:10.1007/BF02817664 |
Jo M S, Rene E R, Kim S H, et al. 2008. An analysis of synergistic and antagonistic behavior during BTEX removal in batch system using response surface methodology[J]. Journal of Hazardous Materials, 152: 76-84. |
Lee Y H, Lee Y H, Jeon C O. 2019. Biodegradation of naphthalene, BTEX, and aliphatic hydrocarbons by Paraburkholderia aromaticivorans BN5 isolated from petroleum-contaminated soil[J]. Scientific Reports, 9(860): 1-12. |
马小丽, 岳秀萍, 王国英. 2018. 苯系物降解菌群的降解特性分析及模拟应用[J]. 环境科学与技术, 41(10): 42-46. |
Mahesh A, Sneha B, Nichith K R. 2020. Biodegradation of aromatics such as benzene, toluene and phenol by Pseudomonas Strain[J]. European Journal of Environment and Earth Sciences, 3(1): 1-5. |
毛心慰, 王慧, 赵百锁. 2009. BTEX降解嗜盐菌群的多样性及其降解特性[J]. 环境科学学报, 29(4): 709-715. DOI:10.3321/j.issn:0253-2468.2009.04.006 |
Mohd T L, Haris H A H, Fatimah A, et al. 2019. BTEX compositions and its potential health impacts in Malaysia[J]. Chemosphere, 237: 124451-124462. DOI:10.1016/j.chemosphere.2019.124451 |
Morlett-Chávez J A, Ascacio-Martínez J A, Rivas-Estilla A M, et al. 2010. Kinetics of BTEX biodegradation by a microbial consortium acclimatized to unleaded gasoline and bacterial strains isolated from it[J]. International Biodeterioration & Biodegradation, 64: 581-587. |
Nagarajan K, Loh K C. 2007. Concoction of bacteria for biodegradation of BTEX[R]. Singapore: National University of Singapore
|
Nicholson C A, Fathepure B Z. 2005. Aerobic biodegradation of benzene and toluene under hypersaline conditions at the Great Salt Plains, Oklahoma[J]. FEMS Microbiology Letters, 245: 257-262. DOI:10.1016/j.femsle.2005.03.014 |
Poyraz N. 2021. Isolation of novel toluene degrading bacteria from waste water treatment plants and determination of their toluene tolerance and other biotechnological potential[J]. Polish Journal Environmental Study, 3(1): 811-821. |
Ran J, Qiu H, Sun S, et al. 2018. Short-term effects of ambient benzene and TEX (toluene, ethylbenzene, and xylene combined) on cardiorespiratory mortality in Hong Kong[J]. Environment International, 117: 91-98. DOI:10.1016/j.envint.2018.04.049 |
Smith M R. 1990. The biodegradation of aromatic hydrocarbon by bacteria[J]. Biodegradation, 1: 191-206. DOI:10.1007/BF00058836 |
孙文静. 2009. BTEX降解菌的驯化及其好氧降解规律的研究[D]. 天津: 天津大学
|
Tsai S L, Lin C W, Wu C H, et al. 2013. Kinetics of xenobiotic biodegradation by the Pseudomonas sp. YATO411 strain in suspension and cell-immobilized beads[J]. Journal of the Taiwan Institute of Chemical Engineers, 44: 303-309. DOI:10.1016/j.jtice.2012.11.004 |
Usman N, Atta H I, Tijjani M B. 2020. Biodegradation studies of benzene, toluene, ethylbenzene and xylene (BTEX) Compounds by Gliocladium sp.and Aspergillus terreus[J]. Journal of Applied Sciences and Environmental Management, 24(6): 1063-1069. DOI:10.4314/jasem.v24i6.19 |
Xin B P, Wu C H, Wu C H. 2013. Bioaugmented remediation of high concentration BTEX-contaminated groundwater by permeable reactive barrier with immobilized bead[J]. Journal of Hazardous Materials, 244: 765-762. |
杨卫兵, 朱润晔, 张丽丽, 等. 2010. 1株BTEX降解新菌株的分离鉴定及其降解特性研究[J]. 环境科学, 31(3): 821-827. |
张倩. 2012. 高盐条件BTEX降解菌群多样性、降解基因型及相容性溶质分析[D]. 上海: 华东理工大学
|
Zhang L, Zhang C, Cheng Z, et al. 2013. Biodegradation of benzene, toluene, ethylbenzene, and o-xylene by the bacterium Mycobacterium cosmeticum byf-4[J]. Chemosphere, 90: 1340-1347. DOI:10.1016/j.chemosphere.2012.06.043 |
张燕可. 2017. 苯系物降解菌及生物除苯初步研究[D]. 无锡: 江南大学
|
周月明, 刘娜, 李斗, 等. 2014. 苯系物降解单菌间的协同耦合作用[J]. 环境工程学报, 8(11): 5049-5056. |
周月明, 刘娜, 张兰英, 等. 2010. 耐低温混菌降解苯系物的特性及菌种鉴定研究[J]. 生态环境学报, 19(8): 1893-1900. DOI:10.3969/j.issn.1674-5906.2010.08.022 |
 2021, Vol. 41
2021, Vol. 41


