2. 深圳市铁汉生态环境股份有限公司, 深圳 518040;
3. 浙江省土壤污染生物修复重点实验室, 杭州 311300;
4. 浙江农林大学文法学院, 杭州 311300
2. Shenzhen Techand Ecology & Environment Co., Ltd, Shenzhen 518040;
3. Key Laboratory of Soil Contamination Bioremediation of Zhejiang Province, Hangzhou 311300;
4. School of Humanities and Law, Zhejiang A&F University, Hangzhou 311300
汞是一种在空气、水、沉积物、土壤和生物之间循环的全球性污染物(Moreno et al., 2005).环境中有机汞存在的主要形式是甲基汞(MeHg), 而在水生生态系统中, MeHg拥有生物积累和生物放大效应, 生物富集因子可以达到104~107 (Lavoie et al., 2013).摄食鱼类等海产品是人类暴露MeHg的重要来源, 致使水生生态环境系统中的汞污染问题受到了极大的关注(Hammerschmidt et al., 2006; Dorea, 2008; Chen et al., 2009).
水生环境是汞形态发生转化的一个重要场所, 经历了氧化和还原、甲基化和去甲基化、硫化及吸附等一系列化学或物理过程, 影响了汞在固相和水相之间的形态和迁移(Morel et al., 1998; Fitzgerald et al., 2007).沉积物是汞在水生环境中最重要的分布相, 全球范围内超过98%的汞在海底沉积物中(刘金铃等, 2007; Balcom et al., 2008).而沉积物-水界面是汞形态发生转化的最为活跃的场所(Guimares et al., 2000; 刘金铃等, 2007).水生环境中影响汞甲基化的环境因素主要有温度、pH、有机质含量与组成、硫化物及无机汞含量等(冯新斌等, 2013).其中有机质含量与组成被认为是影响汞形态发生转化的重要因素.
溶解性有机质(DOM)普遍存在于自然界各种水生生态环境中, 淡水河流及近海海水中主要为陆源性溶解性有机质大部分来自于动物和植物, 而湖泊和海洋中主要为自源性溶解性有机质大部分来自于浮游植物(刘奕君等, 2019).水生环境中的DOM是由不同化学结构、不同分子量大小的有机化合物组成的非均匀混合物(Jones et al., 1998; Ravichandran, 2004), 具有很强的反应活性和转移活性.现有研究已经证实, DOM能够有效络合微量金属元素, 从而影响它们的形态、溶解性、流动性和毒性(Buffle et al., 1988).
目前, 全球关于DOM对汞甲基化研究尚存分歧.有研究表明, 与DOM的络合作用限制了Hg2+被甲基化细菌的可利用程度(Barkay et al., 1997; Choi et al., 1998), 这会导致汞甲基化程度降低.但是同时, 也有其它研究认为结构简单、分子量较小的DOM可以促进Hg2+的生物甲基化, 是因为有机物中的营养元素会增强微生物活性所致(冯新斌等, 2009);此外, 小分子量、不带电荷的DOM与汞发生络合的产物会轻易的被汞甲基化微生物同化利用, 这也是增强生物甲基化能力的原因之一(Gu et al., 2011).
近年来集约化水产养殖的规模不断增大, 海水水产养殖活动所导致的环境污染问题也日益明显.海水养殖中投入的饲料转换效率通常在0.59左右, 饲料浪费和养殖类动物排泄物作为有机固体悬浮或沉积于网箱底部(Chatvijitkul et al., 2007).此外, Wu(1995)研究发现海水水产养殖过程中发现80%以上的N、P、C都通过饵料投食过程的浪费及养殖鱼类排泄产生的排泄物进入水生环境中.因此, 渔业养殖底栖环境中有机质主要来源包括未食用的鱼饲料及鱼粪便.
由于不同来源DOM在化学结构与性质上存在着差异性, 所以在探讨DOM对汞的影响研究有着较多的见解.其中有研究表明长时间养殖的水体中甲基汞含量及汞甲基化速率都要高于养殖时间较短的水体(蒋红梅等, 2007; Shao et al., 2011; 何杉杉等, 2015).这可能与养殖区沉积物中有机质的腐解过程及腐殖化程度有关, 腐解过程中改变了DOM的结构和特性.因此, 从更微观的角度, 探究DOM自身结构与特性的改变及其对汞形态发生转化的作用机制有着更为重要的意义, 而有关DOM亚组分对汞形态转化过程的研究还鲜有报道.因此, 本文以渔业养殖环境中鱼体排泄物、残留鱼粮和沉积物为研究目标, 将3种来源的DOM进行逐步分离, 根据DOM的极性和电荷特性, 将DOM分成了6个亚组分, 即亲水与疏水的酸性、碱性和中性物质.系统研究6种亚组分对汞甲基化的影响效应及机理.
2 材料和方法(Materials and methods) 2.1 样品采集鱼粪便:在浙江省舟山市岱山县某渔业养殖区采集养殖鱼类的新鲜排泄物, 在网箱底设置细纱网收集, 进行鱼苗喂食后再收集鱼粪便.采集到的排泄物, 利用4 ℃恒温箱保存, 在带回实验室后采用冻干机进行冷冻干燥的方法处理、保存、备用.
鱼粮:选用岱山县某渔业养殖区长期用于投食养殖鱼类所用的饲料, 采集到的饲料, 利用4 ℃恒温箱保存, 在带回实验室后采用冻干机进行冷冻干燥的方法处理、保存、备用.
底泥:采集自岱山县某渔业养殖区长期鱼类养殖所堆积于底部的沉积物, 采集到的饲料, 利用4 ℃恒温箱保存, 在带回实验室后采用冻干机进行冷冻干燥的方法处理、保存、备用.
2.2 DOM的提取与测定分别称取10.0 g处理后的3种有机质放置于3个2 L的烧杯中, 每个烧杯中加入1 L的0.3%NaCl溶液(模拟渔业养殖区海水浓度)在恒温培养箱内进行模拟分期腐解试验.腐解试验开始后的第0、5、10、20、30、60、90、120 d取样, 并冷冻干燥, 每种样品充分混合均匀后研磨过120目筛保存.试验时称取3 g过120目筛后的有机质与超纯水按照质量比1∶10比例添加进离心管中, 采用水浸提的方法进行DOM的提取与分离(Ohno et al., 2006; Yu et al., 2012; 高洁等, 2015), 按试验要求保存在4 ℃冰箱内备用.并采用总有机碳自动分析仪(multi N/C 2300)测定不同腐解时间的DOM总有机碳浓度(TOCDOM).
2.3 DOM亚组分分离 2.3.1 树脂柱的制作本试验采用蠕动泵进样的方式将DOM样品自动通过装填好树脂的树脂柱, 树脂装填完成跟样品进样时都需要用玻璃砂芯固定, 这是因为树脂层保存时跟使用中都不能有气泡存在.本试验所用树脂柱装填高径比为5.测定渗出液体中样品流出量为进样样品浓度的10%时停止进样吸附完成.根据DOM本身不同有机物的性质差异选用不同种类的淋洗液以得到目的产物.
2.3.2 树脂柱预处理本试验树脂选用Amberlite XAD-4、XAD-8大孔吸附树脂, BIO-RAD AG-MP-50阳离子交换树脂, DUOLITE A-7阴离子交换树脂.为了赶出树脂内的气泡, 所用Amberlite XAD大孔吸附树脂使用无水乙醇或者甲醇过柱, 处理完成后保存备用.将准备装柱使用的阴、阳离子交换树脂用55 ℃热水浸洗, 并不时的搅动, 反复清洗至清洗液体已不带褐色, 液体表面已无明显泡沫存在为止.水洗后, 再经酸碱处理.阳离子交换树脂用浓度为5%的HCl、NaCl和NaOH溶液按照酸-超纯水-NaCl溶液-碱-超纯水-酸-超纯水的进样方式依次处理树脂柱, 阴离子交换树脂处理方法同理.将已经处理完成的树脂柱保存备用.
2.3.3 亚组分富集分离依据不同种类的树脂其本身性质的差异, 再在Lenheer等(1976)和Chefetz等(2010)所用方法的基础上加以改进, 故本研究采用Amberlite XAD-8、XAD-4大孔树脂、BIO-RAD AG-MP-50饱和的阳离子交换树脂、DUOLITE A-7阴离子交换树脂以及HCL、NaOH、CH3OH和NH4OH溶液, 依据不同种类的树脂对DOM的吸附差异性, 将DOM可分成疏水性酸性物质(HOA)、疏水性碱性物质(HOB)、疏水性中性物质(HON)、亲水性酸性物质(HIA)、亲水性碱性物质(HIB)、亲水性中性物质(HIN)6种有机亚组分.
本试验用0.1和0.01 mol·L-1 HCl洗脱树脂柱, 得到组分HOB;用0.1 mol·L-1 NaOH及超纯水洗脱树脂柱, 得到组分HOA;将XAD-8树脂柱在室温下干燥24 h, 用甲醇索氏提取法提取组分HON;用1.0 mol·L-1氨水对阳离子交换树脂进行洗出, 得到组分HIB;用3.0 mol·L-1氨水对阴离子交换树脂进行洗出, 得到组分HIA;用超纯水洗脱阴离子交换树脂, 得到组分HIN.洗脱后得到的亚组分液体都在40 ℃下用旋转蒸发仪进行旋转蒸发, 经过冷冻干燥后获得固体样品.
2.4 试验设计试验采用模拟手段方式进行.在100 mL离心管中, 首先加入25 mL 1000 ng·L-1的硝酸汞溶液, 再分别加入25 mL经TOC调节一致的组分HOA、HOB、HON、HIA、HIB、HIN溶液及超纯水进行培养试验.以上各亚组分即为3种有机质在不同腐解时期所提取的各亚组分.将溶液混合均匀后, 放置在模拟气候培养箱内培养24 h.每个处理设置4个平行.反应结束后, 取5 mL溶液进行甲基汞含量测定.
2.5 样品分析 2.5.1 甲基汞测定采用蒋红梅等(2007)的方法(蒸馏-乙基化结合气相色谱-冷原子荧光, CVAFS法)在BROOKS RAND测汞仪上测定甲基汞质量浓度(最低检出限为0.009 ng·L-1).本试验测定的重复样品的相对标准偏差 < 12%.本试验测定的重复样品的相对标准偏差 < 11.8%.
2.5.2 DOM亚组分的IR测定首先将未经腐解的DOM各亚组分用冻干机进行冷冻干燥获得固体样品.获得的固体状态DOM样品与在白炽灯下高温烘干后研磨完全的KBr均匀混合, 用压片机进行压片制样后, 用傅立叶变换红外光谱仪(IR Prestige-21)测定未经腐解的DOM各亚组分的红外光谱, 使用的傅立叶变换红外光谱仪波数扫描设定为399~4001 cm-1, 波数精度为0.01 cm-1.每一个DOM亚组分样品光谱都经过32次扫描得到.每一个DOM亚组分样品光谱都通过校正背景值以降低环境干扰.
2.6 数据处理与分析数据处理统计分析采用Excel2019和SPSS17.0, 图表制作采用Origin2017.
3 结果与讨论(Results and discussion) 3.1 未经腐解DOM各亚组分红外光谱特征DOM上不同基团的差异主要影响其与Hg2+之间的络合能力.小分子量DOM中的含氧官能团(羧基、酚类、羰基)对Hg2+有较强的络合能力(Wrobel et al., 2003; Wu et al., 2004; Oliveira et al., 2020).从图 1中可以看出亲水性亚组分羟基、羧基结构明显, 尤其是组分HIA.因此, 亲水性亚组分与汞离子结合的能力要强于疏水性亚组分.有研究表明, 类蛋白物质对汞的络合能力要高于类腐殖物质(Xi et al., 2012).从图 1中可以看出在疏水性亚组分中组分HOA有着明显的酰胺类结构, 为蛋白类物质的主要结构之一.因此, 组分HOA络合汞离子的能力要强于另外两种疏水性亚组分.不同官能团提供电子能力也有差异, 弱极性官能团(如酚羟基)比强极性官能团(如羧基)更容易提供电子.还原性含硫基团也容易提供电子.由图 1可知, 鱼粪便的HOA和HOB中的酚羟基峰强较高.而HON中则主要含有还原硫基团.因此, 鱼粪便疏水性组分更容易提供电子, 促使DOM与汞之间发生电子迁移反应, 这有利于汞甲基化反应的发生.
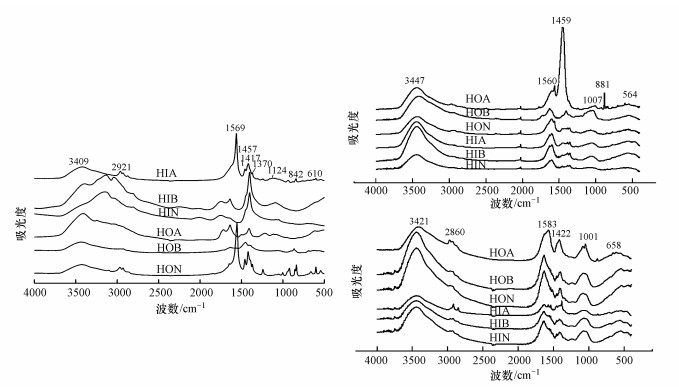 |
| 图 1 不同来源DOM各组分红外光谱图 (a.鱼粪便;b.鱼粮;c.底泥) Fig. 1 IR spectra of DOM subcomponents from fish aquaculture area (a.fish fece; b. fish diet; c. sediment) |
从图 2可以看出, 在整个腐解阶段, 3种不同来源的DOM中, 疏水性有机物始终都占据较大的比重, 说明疏水组分在整个腐解阶段占据主导地位, 且三者的关系为TOC鱼粮>TOC鱼粪便>TOC底泥.与组分HOA和HON相比, 腐解开始阶段组分HOB在DOM中占主要地位.随着腐解时间的增加, 鱼粪便DOM的TOCHOB在腐解第30 d开始明显降低, 并随后保持稳定在1.55 g·L-1;而鱼粮和底泥DOM的TOCHOB则相对稳定, HOB占总体DOM的比例超过了50%.而HOA和HON则相对稳定, 特别是在鱼粮和底泥DOM中, 两者所占比例为10%~20%.而在鱼粪便的腐解过程中, HOA和HON也随着腐解时间的延长而逐渐降低, 在60 d后保持稳定.从图 2还可以看出, DOM各亲水性有机组分的TOC相对稳定.鱼粪便DOM与鱼粮DOM的TOCHIA相似, 随着腐解时间的增加始终稳定在0.59 g·L-1和0.06 g·L-1;而底泥DOM的TOCHIA随着腐解时间的增加先增大后降低, 在腐解第20 d开始稳定在0.04 g·L-1.在整个腐解过程中, 鱼粪便、鱼粮与底泥DOM疏水性组分之间的关系为MHOB>MHOA>MHON, 鱼粪便DOM亲水性组分之间关系为MHIN>MHIB>MHIA.鱼粮与底泥DOM亲水性组分之间的关系为MHIA>MHIB>MHIN.
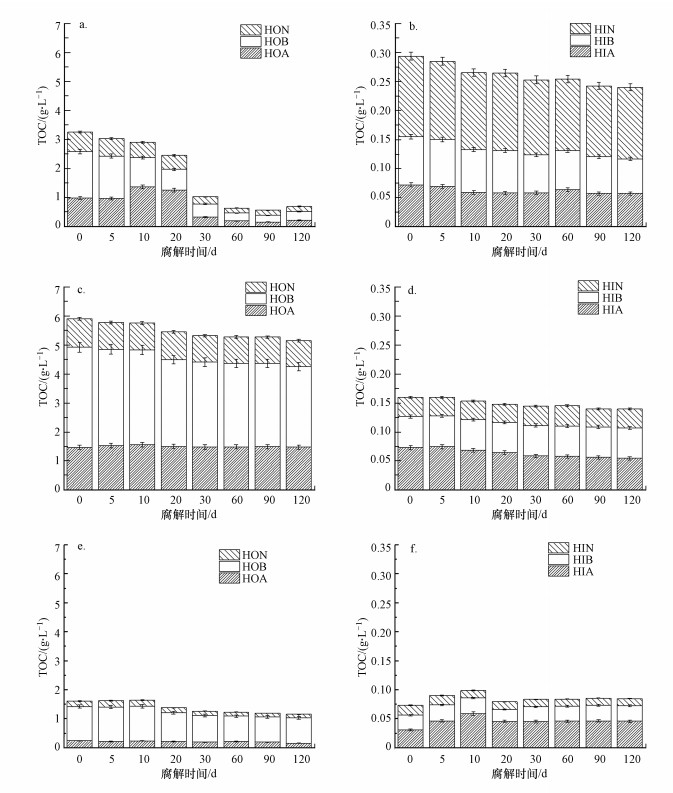 |
| 图 2 不同腐解时间鱼粪便(a, b)、鱼粮(c, d)及底泥(e, f)DOM各组分总有机碳浓度 Fig. 2 Total organic carbon concentrations of each component of DOM in fish feces(a, b), fish diet(c, d) and sediment(e, f) at different decomposition times |
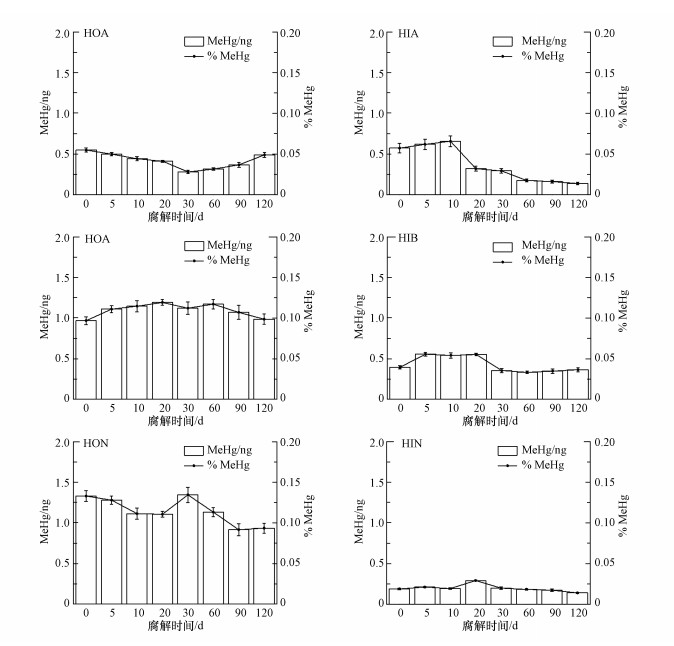
图 3显示了鱼粪便DOM亲水和疏水性组分在不同腐解时间的汞甲基化能力.随着DOM腐解时间的增加, 疏水性组分中的HOA促进汞的甲基化能力不断增强, 在腐解第90 d时为最大值, MeHg转化量为0.26 ng, 腐解第90 d以后的组分HOA对汞的甲基化趋于稳定, MeHg转化量稳定在0.25 ng, MeHg转化率为0.025%.疏水性组分中的HOB和HON具有较明显的促进汞甲基化的能力.腐解前10 d的组分HOB和HON的汞甲基化能力会随着腐解时间的增加而降低, MeHg转化量从0.42 ng和1.47 ng降至0.20 ng和1.20 ng;在腐解第10~60 d, 随着腐解时间的增加MeHg转化量有着明显的增大;当腐解的时间在60~120 d时, 组分HOB和HON对汞甲基化的能力先降低后增强, MeHg转化量从0.62 ng和1.44 ng增大到0.74 ng和1.61 ng.相比于疏水性组分, 亲水性组分促进汞甲基化的能力较低.从图中可以看出疏水性组分HON促进汞甲基化的能力最强, 其次是组分HOB和组分HIA, 其他组分贡献较小.
 |
| 图 3 不同腐解时期鱼粪便DOM各组分的MeHg转化量及转换率 Fig. 3 The variation of DOM subcomponents in fish feces at different decomposing periods |
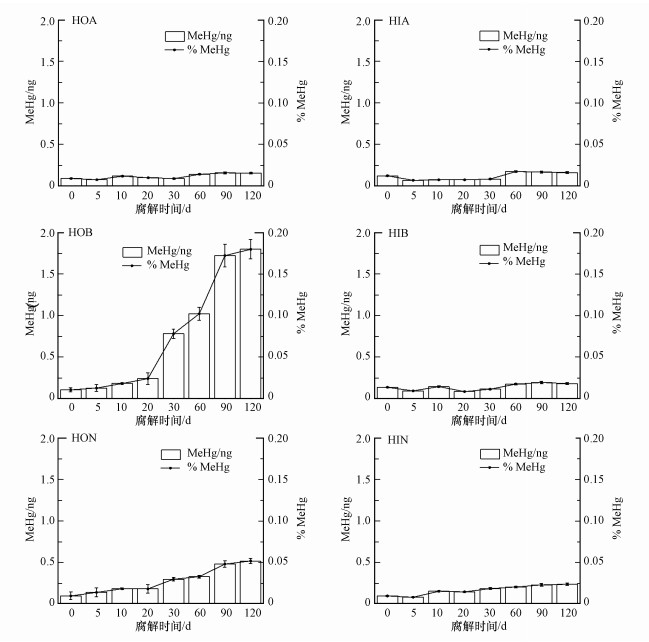
图 4显示了鱼粮DOM亲水和疏水性组分在不同腐解时间的汞甲基化能力.随着腐解时间的增加, 疏水性组分HOB和HON促进汞甲基化的能力与亲水性组分相似, 但是具有显著的促进汞甲基化的能力, 组分HOB的汞甲基化能力在腐解第20 d达到最大值, MeHg转化量达到了1.19 ng.但是在整个腐解阶段, 组分HOB的汞甲基化能力并没有发生明显的变化, 稳定在0.97~0.99 ng, 组分HON对汞甲基化能力的最大值出现在腐解第30 d, MeHg转化量为1.35 ng.随着腐解时间的增加, 在腐解第90 d以后趋于稳定, MeHg转化量为0.92 ng.而组分HOA促进汞的甲基化能力先减弱后增强.在腐解第30 dMeHg转化量只有0.28 ng;在腐解第30 d到腐解第120 d, 组分HOA的汞甲基化能力不断增强, MeHg转化量从0.29 ng增大到0.49 ng.同样, 相对于疏水性组分, 亲水性组分促进汞甲基化的能力较低;从图中可以看出疏水性组分HOB和HON促进汞甲基化的能力最强, 其次是组分HOA、HIB和HIA.
 |
| 图 4 不同腐解时期鱼粮DOM各组分的MeHg转化量及转换率 Fig. 4 The variation of DOM subcomponents of fish diet in different decomposing periods |
图 5显示了底泥DOM亲水和疏水性组分在不同腐解时间的汞甲基化能力.随着腐解时间的增加, 疏水性组分HOB和HON促进汞甲基化的能力不断增强, 而组分HOA的汞甲基能力跟亲水性组分相似并未发生明显的变化.随着腐解时间的增加, 组分HOB在腐解第30 d其汞甲基化能力发生了显著变化, MeHg转化量达到了0.78 ng.腐解第90 d以后, 组分HOB对汞甲基化的能力不再显著增大.在腐解第120 d达到峰值, MeHg转化量为1.80 ng.与组分HOB相似, 组分HON在时间为120 d的腐解试验中的汞甲基化能力随着腐解时间的增加而增强, 其MeHg转化量从腐解时间开始时的0.09 ng增大到腐解第120 d的0.51 ng.但组分HOA但随着腐解时间的增加无明显的差异变化, MeHg转化量最大值仅有0.16 ng.
 |
| 图 5 不同腐解时期底泥DOM各组分的MeHg转化量及转换率 Fig. 5 The variation of DOM subcomponents of sediment in different decomposing periods |
以上结果表明, 不同来源的DOM中, 3种疏水性组分对汞甲基化产生的影响要强于3种亲水性组分, 特别是组分HOB和HON对汞甲基化的促进作用更明显.这主要是由于不同亚组分对汞离子的络合能力以及提供电子能力有差异, 进而影响汞离子被甲基化细菌利用的生物有效性以及汞与DOM之间的电子迁移反应能力.在本研究的不同亚组分中, 亲水性亚组分对汞的络合能力要明显强于疏水性亚组分, 而在疏水性亚组分中, HOA和HOB也强于HON.Guggenberger等(1994)的研究表明, 亲水性酸性物质对金属离子有较强的络合能力, 是疏水性酸性物质的2~8倍.在本研究中亲水性有机组分更易与溶液中的Hg2+结合, 从而降低了Hg2+的生物有效性, 在整体上抑制汞的甲基化能力(Liang et al., 2011);生物配体模型阐述了有关DOM对金属离子有效性的影响.该模型认为亲水性DOM亚组分与自由金属离子络合后使得自由离子平衡浓度下降, 进而使得金属离子在有DOM存在的条件下有效性降低.这与本研究所观察到的现象也较为一致.而相反, 疏水性有机组分中HOB与HON都含有能够提供电子的基团, 如酚羟基、还原性含硫基团等, 使得DOM易于Hg2+之间发生电子迁移反应, 进而促进甲基化反应进行(Yin et al., 2013).
腐解过程会导致DOM结构、提供电子能力等方面发生变化, 进而影响与汞的络合能力和甲基化能力.在本研究中, 亲水组分HIA对汞甲基化的影响能力会逐渐减弱, 而疏水性亚组分HOB则逐渐增强汞甲基化的能力, 其他组分对汞的甲基化能力影响不明显.HIA中含有大量羧基、羟基, 一方面可能是随着腐解的进行, 这些基团与汞络合的能力逐渐增强, 另一方面也可能是前期产生的甲基汞发生了去甲基化反应.而对于HOB, 一方面可能是随着腐解过程, 提供更多的电子, 从而有利于DOM与汞之间发生电子迁移过程, 促进汞的甲基化反应(Liang et al., 2018).另一方面, 组分HOB具有较强的芳香性, 溶解的有机物, 特别是芳香性有机物, 可以促进汞甲基化(Holloway et al., 2009).
研究近海海水养殖区这一特殊水生环境中的汞形态及其转化过程, 探究其关键性影响因子具有重要的意义, 如养殖区3大不同来源有机质对水生环境下汞甲基化都具有一定的促进作用, 可通过控制有机质的进入, 如提高养殖过程中饲料的使用率, 饲料来源的选择性, 特别是选择亲水性有机组分较高的饲料, 及时清理表面沉积物等方式, 减少养殖区水体中甲基汞的生成.不同类别的底泥, 因其粒径组成、有机质含量等差异, 对汞甲基化影响能力也有所不同, 未来研究中应进一步研究不同类别底泥DOM对汞甲基化影响的差异.
4 结论(Conclusions)1) 不同来源DOM中亲水性亚组分所含的基团组成和数量要比疏水性亚组分的更加丰富.组分HIB与HIN官能团组成丰富, 数量更多, 它们与Hg2+结合的能力相对更强;组分HOB与HON基团组成简单, 数量较少, 它们与Hg2+结合的能力相对更弱.
2) 随着腐解时间的增加, 疏水性有机亚组分始终在DOM中占据着主要物质量.虽然随着腐解时间的增加, 占溶解性有机质总量的比例会有所下降, 但最终会趋于稳定状态.组分HOB在DOM中是占比最大的组分.
3) 疏水性有机组分对汞甲基化的促进作用显著高于亲水性有机组分;这主要是因为亲水性有机组分含有大量的羧基、羟基等官能团, 可以更好地与活性Hg2+结合, 降低甲基化反应的底物浓度, 从而抑制甲基化发生.而疏水性组分对汞亲和性较弱, 而且所含酚羟基以及还原性含硫基团等都可作为电子供体, 从而促进汞甲基化的发生.
Balcom P H, Hammerschmidt C R, Fitzgerald W F, et al. 2008. Seasonal distributions and cycling of mercury and methylmercury in the waters of New York/New Jersey Harbor Estuary[J]. Marine Chemistry, 109(1/2): 1-17. |
Barkay T, Gillman M, Turner R R. 1997. Effects of dissolved organic carbon and salinity on bioavailability of mercury[J]. Applied and Environmental Microbiology, 63(11): 4267. DOI:10.1128/aem.63.11.4267-4271.1997 |
Buffle J, Chalmers R A. 1990. Complexation reactions in aquatic systems[J]. Geochimica et Cosmochimica Acta, 54(4): 1195. |
Chatvijitkul S, Boyd C E, Allen Davis D, et al. 2007. Pollution potential indicators for feed-based fish and shrimp culture[J]. Aquaculture, 477: 43-49. |
Chefetz B, Hader Y, Chen Y. 2010. Dissolved organic carbon fractions formed during composting of municipal solid waste: Properties and significance[J]. Acta Hydrochimica et Hydrobiologica, 26(3): 172-179. |
Chen C Y, Dionne M, Mayes B M, et al. 2009. Mercury Bioavailability and bioaccumulation in estuarine food webs in the gulf of maine[J]. Environmental Science & Technology, 43(6): 1804. |
Choi E H, Lee H J. 1998. Clinical outcome of invasive infections by penicillin-resistant streptococcus pneumoniae in korean children[J]. Clinical Infectious Diseases, 26(6): 1346-1354. DOI:10.1086/516340 |
Dorea J G. 2008. Persistent, bioaccumulative and toxic substances in fish: Human health considerations[J]. Science of The Total Environment, 400(1/3): 93-114. |
冯新斌, 仇广乐, 付学吾, 等. 2009. 环境汞污染[J]. 化学进展, 21(2): 436-457. |
冯新斌, 陈玖斌, 付学吾, 等. 2013. 汞的环境地球化学研究进展[J]. 矿物岩石地球化学通报, 32(5): 503-530. |
Fitzgerald W F, Lamborg C H, Hammerschmidt C R. 2007. Marine biogeochemical cycling of mercury[J]. Chemical Reviews, 107(2): 641-662. DOI:10.1021/cr050353m |
高洁, 江韬, 李璐璐, 等. 2015. 三峡库区消落带土壤中溶解性有机质(DOM)吸收及荧光光谱特征[J]. 环境科学, 36(1): 151-162. DOI:10.3969/j.issn.1673-288X.2015.01.042 |
Gu B, Bian Y R, Miller C L, et al. 2011. Mercury reduction and complexation by natural organic matter in anoxic environments[J]. Proceedings of the National Academy of Sciences of the United States of America, 108(4): 1479-1483. DOI:10.1073/pnas.1008747108 |
Guggenberger G, Glaser B, Zech W. 1994. Heavy metal binding by hydrophobic and hydrophilic dissolved organic carbon fractions in a Spodosol A and B horizon[J]. Water Air &Soil Pollution, 72(1/4): 111-127. |
Guimares J R D, Meili M, Hylander L D, et al. 2000. Mercury net methylation in five tropical flood plain regions of Brazil: High in the root zone of floating macrophyte mats but low in surface sediments and flooded soils[J]. Science of the Total Environment, 261(1/3): 99-107. |
Hammerschmidt C R, Fitzgerald W F. 2006. Bioaccumulation and trophic transfer of methylmercury in Long Island Sound[J]. Archives of Environmental Contamination and Toxicology, 51(3): 416. DOI:10.1007/s00244-005-0265-7 |
何杉杉, 尤琼智, 吴胜春, 等. 2015. 渔业养殖区水环境中汞的形态分布[J]. 环境化学, (10): 1911-1917. DOI:10.7524/j.issn.0254-6108.2015.10.2015052104 |
Holloway J A M, Goldhaber M B, Scow K M, et al. 2009. Spatial and seasonal variations in mercury methylation and microbial community structure in a historic mercury mining area, Yolo County, California[J]. Chemical Geology, 267(1/2): 85-95. |
蒋红梅, 冯新斌. 2007. 水库汞生物地球化学循环研究进展[J]. 水科学进展, 18(3): 462-467. DOI:10.3321/j.issn:1001-6791.2007.03.025 |
Jones M N, Bryan N D. 1998. Colloidal properties of humic substances[J]. Advances in Colloid and Interface Science, 78(1): 1-48. DOI:10.1016/S0001-8686(98)00058-X |
Lavoie R A, Jardine T D, Chumchal M M, et al. 2013. Biomagnification of mercury in aquatic food webs: A worldwide meta-analysis[J]. Environmental Science & Technology, 47(23): 13385-13394. |
刘金铃, 丁振华. 2007. 汞的甲基化研究进展[J]. 地球与环境, (3): 215-222. |
Lenheer J A, Huffman E W D. 1976. Classification of organic solutes in water by using macroreticular resin[J]. Journal of Research of the U. S. Geological Survey, 4(6): 737-751. |
Liang P, Wu S C, Zhang C, et al. 2018. The role of antibiotics in mercury methylation in marine sediments[J]. Journal of Hazardous Materials, 360: 1-5. DOI:10.1016/j.jhazmat.2018.07.096 |
Liang P, Shao D D, Wu S C, et al. 2011. The influence of mariculture on mercury distribution in sediments and fish around Hong Kong and adjacent mainland China waters[J]. Chemosphere, 82(7): 1038-1043. DOI:10.1016/j.chemosphere.2010.10.061 |
刘奕君, 原杰, 王宝利, 等. 2019. 平寨水库荧光溶解性有机质的来源、特征及其动态转化[J]. 地球与环境, 47(6): 795-804. |
Morel F M M, Kraepiel A M L, Amyot M. 1998. The chemical cycle and bioaccumulation of mercury[J]. Annual Review of Ecology and Systematics, 29(1): 543-566. DOI:10.1146/annurev.ecolsys.29.1.543 |
Moreno F N, Anderson C W, Stewart R B, et al. 2005. Mercury volatilisation and phytoextraction from base-metal mine tailings[J]. Environmental Pollution, 136(2): 341-352. DOI:10.1016/j.envpol.2004.11.020 |
Ohno T, Bro R. 2006. Dissolved organic matter characterization using multiway spectral decomposition of fluorescence landscapes[J]. Soil Science Society of America Journal, 70(6): 2028-2037. DOI:10.2136/sssaj2006.0005 |
Oliveira J R, Vasques I C F, Lima F R D, et al. 2020. Mercury adsorption in tropical soils and zeolite: characterization by Fourier-transform infrared spectroscopy[J]. Archives of Agronomy and Soil Science: 1-16. |
Ravichandran M. 2004. Interactions between mercury and dissolved organic matter-A review[J]. Chemosphere, 55(3): 319-331. DOI:10.1016/j.chemosphere.2003.11.011 |
Shao D, Liang P, Kang Y, et al. 2011. Mercury species of sediment and fish in freshwater fish ponds around the Pearl River Delta, PR China: human health risk assessment[J]. Chemosphere, 83(4): 443-448. DOI:10.1016/j.chemosphere.2010.12.080 |
Wrobel K, Sadi B B M, Wrobel K, et al. 2003. Effect of metal ions on the molecular weight distribution of humic substances derived from municipal compost: Ultrafiltration and size exclusion chromatography with spectrophotometric and inductively coupled plasma-MS detection[J]. Analytical Chemistry, 75(4): 761-767. DOI:10.1021/ac0261193 |
Wu R S S. 1995. The environmental impact of marine fish culture: Towards a sustainable future[J]. Marine Pollution Bulletin, 31(4/12): 159-166. |
Wu F C, Cai Y R, Evans D, et al. 2004. Complexation between Hg (Ⅱ) and dissolved organic matter in stream waters: an application of fluorescence spectroscopy[J]. Biogeochemistry, 71(3): 339-351. DOI:10.1007/s10533-004-0058-5 |
Xi B D, He X S, Wei Z M, et al. 2012. The composition and mercury complexation characteristics of dissolved organic matter in landfill leachates with different ages[J]. Ecotoxicology and Environmental Safety, 86: 227-232. DOI:10.1016/j.ecoenv.2012.09.024 |
Yin Y, Li Y, Ma X, et al. 2013. Role of natural organic matter in the biogeochemical cycle of mercury: Binding and molecular transformation[J]. Progress in Chemistry, 25(12): 2169-2177. |
Yu G H, Wu M J, Wei G R, et al. 2012. Binding of organic ligands with al(Ⅲ) in dissolved organic matter from soil: Implications for soil organic carbon storage[J]. Environmental Science & Technology, 46(11): 6102. |
 2021, Vol. 41
2021, Vol. 41


