2. 中国环境科学研究院环境污染控制工程技术研究中心, 北京 100012
2. Research Center for Environmental Pollution Control Engineering Technology, Chinese Research Academy of Environmental Sciences, Beijing 100012
异养反硝化脱氮是污水生物脱氮的主要途径之一, 其原理是反硝化细菌利用电子供体有机碳源将硝酸盐或亚硝酸盐还原为气态氮或氮氧化物的过程(Park et al., 2009; Qian et al., 2018).污水处理厂尾水、农田退水等具有低C/N比、高NO3--N占比等特点, 由于碳源不足导致NO3--N去除较难, 往往需要通过外加碳源来解决(Fu et al., 2017).传统外加碳源主要有液体碳源如甲醇、乙醇和乙酸等, 但存在成本高、存储运输危险、剂量难以控制等缺点(李斌等, 2013).近年来, 固相反硝化引起了研究人员的广泛关注, 尤其是植物碳源, 因其廉价易得, 逐渐成为反硝化碳源的研究热点(Wang et al., 2016).
枸杞属植物广泛分布于我国西北、华中、华北和西南等地区(陈亮等, 2015).枸杞枝是枸杞树管理过程中修剪下来的废弃物, 据估算, 宁夏地区枸杞枝条年剪枝量可达20万t以上, 但其绝大多部分被焚烧、废弃(陈志龙等, 2020).因此, 研究利用枸杞枝作为植物碳源进行反硝化具有十分重大的意义, 能够实现枸杞枝废弃物的资源化利用.
植物碳源细胞壁由木质纤维素(主要包含纤维素、半纤维素及木质素三部分)构成(胡秋龙等, 2011), 其中, 木质素较难被微生物降解利用, 纤维素和半纤维素较易被微生物降解利用(Alexander et al., 1978; Elefsiniotis et al., 2004).通常纤维素被包裹在木质素和半纤维素中, 使得纤维素难以降解利用, 因此, 采用适宜的改性方法破坏木质素可以使纤维素暴露出来, 有利于提高植物碳源的反硝化利用率, 达到强化脱氮的目的(武海涛, 2013).常用的改性方法有机械粉碎、微波、超声波、高能辐射处理等物理法(Yang et al., 2019), 酸碱处理、离子液体处理、臭氧分解、有机溶剂法等化学法(Brandt et al., 2013; 赵文莉等, 2014), 以及微生物处理的生物法(Wan et al., 2010).其中, 有机溶剂法是一种利用有机溶剂(如甲醇、乙醇、乙二醇、乙烯等)单独或者配合催化剂(如无机酸、有机酸或者碱类等)在高温下蒸煮木材原料的方法, 该法能够打破木质素和半纤维素内部连接的化学键, 使木质纤维素结构变得更加疏松、易被微生物降解利用(Xu et al., 2016).Zhao等(2009)采用60%(体积比)乙醇和正丙胺对玉米秸秆进行处理, 使得木质素的去除率高达81.7%.
基于此, 本研究拟选取常见的农业废弃物枸杞枝为研究对象, 采取碱处理法联合有机溶剂法对其进行前处理, 即分别采取0、20%、50%、100%(体积比)甲醇-水-NaOH(0.01 g·mL-1)溶液对枸杞枝进行改性处理, 研究不同试验条件下枸杞枝的静态碳、氮、磷释放特征及静态反硝化特性, 筛选出最优的改性条件, 以期为甲醇-水-NaOH体系改性枸杞枝作为反硝化外加碳源强化脱氮提供理论依据.
2 材料与方法(Material and methods) 2.1 试验材料枸杞枝取自甘肃省某农村, 用自来水冲洗干净后在60 ℃烘箱中烘干至恒重, 随后用破碎机切割成3~5 cm长度的碎段备用.
2.2 静态释碳试验称取3份2 g枸杞枝碎段(3~5 cm)分别置于250 mL锥形瓶中, 注入250 mL蒸馏水浸泡, 锥形瓶口用胶塞密封, 常温静置, 每日彻底更换蒸馏水并测定浸泡液中TOC、COD、TN和TP的浓度.分别用二级动力学方程(式(1)~(2))(邵留等, 2011)和Ritger-Peppas方程(式(3))(Ritger et al., 1987)拟合碳释放过程.
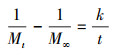
|
(1) |
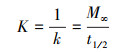
|
(2) |
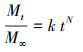
|
(3) |
式中, Mt为t时释放的COD量(mg·g-1·L-1);M∞为COD释放的最终总量(mg·g-1·L-1);k为碳释放速率常数(g·L·d·mg-1);K为传质系数(mg·g-1·L-1·d-1);t1/2为释碳特征曲线中COD达到最终释放总量(M∞)1/2时所需的时间(d);N为碳释放指数, 当N<0.45时扩散过程占优势, 当N值在0.45~0.89之间时主要机制为扩散和分解, 当N>0.89时分解过程占优势(Ritger et al., 1987).
2.3 枸杞枝改性方法将枸杞枝碎段在蒸馏水中浸泡3 d进行预处理, 之后于60 ℃下烘干至恒重.分别量取400 mL不同体积比(0、20%、50%、100%)的甲醇水溶液于蓝盖瓶中, 加入NaOH至0.01 g·mL-1, 搅拌混匀;然后加入80 g预处理后的枸杞枝碎段, 拧紧瓶盖放入80 ℃水浴锅中反应1 h, 反应结束后放入通风橱中冷却至室温;之后从蓝盖瓶中取出枸杞枝进行抽滤(剩余甲醇进行密封保存和循环利用), 抽滤后洗涤直至洗涤液呈中性, 最后于105 ℃烘干至恒重.本试验中, 将甲醇(体积占比分别为0、20%、50%、100%)-水-NaOH(0.01 g·mL-1)体系改性的枸杞枝依次命名为0-G、20%-G、50%-G和100%-G, 只用蒸馏水浸泡3 d未作改性处理的枸杞枝命名为D-G, 将未作任何处理的原枸杞枝命名为Y-G.
2.4 静态反硝化试验静态反硝化试验于1 L锥形瓶中进行, 瓶口用封口膜密封.接种污泥来自北京某A2/O污水处理厂缺氧段的成熟污泥(污泥取回后用超纯水清洗3次).采用NaNO3和KH2PO4配制试验用水, 氮磷比例为5, 并且加入微量元素溶液, 控制试验配水中NO3--N浓度为100 mg·L-1, pH值为7.5左右.
在5个1 L锥形瓶中分别加入未改性和改性的枸杞枝碎段各5 g, 并增设1个无枸杞枝碎段的空白组, 添加20 mL成熟污泥和980 mL试验配水, 接种污泥浓度MLSS为300 mg·L-1, 氮吹若干分钟使锥形瓶中溶解氧(DO)浓度低于0.5 mg·L-1, 密封后放入恒温振荡培养箱中培养((25±1) ℃、160 r·min-1), 每隔24 h取样30 mL, 使用0.45 μm滤膜过滤后测定COD、TOC、TN、NO3--N和NO2--N浓度.将0-G、20%-G、50%-G和100%-G作为反硝化碳源的试验组依次命名为0组、20%组、50%组和100%组, 将添加D-G的试验组命名为对照组, 将不添加任何碳源的试验组命名为空白组.
使用Monod方程描述NO3--N的比降解速率, 具体如下(Zhang et al., 2014; Medhi et al., 2017):

|
(4) |
式中, V为NO3--N的比降解速率(mg·g-1·d-1);Vm为NO3--N的最大比降解速率(mg·g-1·d-1);c为NO3--N浓度(mg·L-1);Ks为半饱和常数(mg·L -1).
2.5 分析指标与检测方法 2.5.1 常规指标分析方法试验中常规水质指标及其分析方法如表 1所示.
| 表 1 常规指标和分析方法 Table 1 Analysis indices and analytical methods |
对于改性前后的枸杞枝, 进行干燥和喷金后, 置于SEM电镜下观察枸杞枝表面的形态及其变化(谢家仪等, 2005).
2.5.3 元素组成及纤维素等含量分析取若干试验所用形状大小相似的枸杞枝及改性枸杞枝, 使用Flash 2000元素测定仪测定(Thermo Scientific Fisher, 美国)碳、氮含量, 采用iCAPQ电感耦合等离子体发射光谱仪(Thermo Fisher, 美国)测定磷含量, 利用范式法测定纤维素、半纤维素和木质素含量(Van Soest et al., 1991)
3 结果与讨论(Results and discussion) 3.1 原枸杞枝静态释碳特性 3.1.1 原枸杞枝静态释碳特征原枸杞枝(Y-G)碳源释放情况如图 1所示, 主要分为第Ⅰ阶段(1~3 d)和第Ⅱ阶段(4~21 d), 其中, 第Ⅰ阶段为碳源快速释放阶段, 0.4 d时COD释放速率达到最高值284.14 mg·g-1·d-1;第Ⅱ阶段COD释放速率相对稳定, 但与第Ⅰ阶段相比有所降低, 平均COD释放速率为3.56 mg·g-1·d-1.碳源释放出现两个阶段的原因是:第Ⅰ阶段, 枸杞枝表面上的水溶性物质迅速释放, 浸泡液中COD快速增加;第Ⅱ阶段, 水溶性物质已基本释放完, 由于枸杞枝本身携带极少量微生物, 枸杞枝中的纤维素和半纤维素在少量微生物酶的作用下水解, 分解速度相对较慢且稳定, 这与已报道的植物碳源释放结果类似(Moore et al., 2001; 李晓崴等, 2013; Yang et al., 2015; 熊家晴等, 2018).
 |
| 图 1 改性前枸杞枝COD释放情况 Fig. 1 COD release of the Chinese wolfberry branches before modification |
分别采用二级动力学方程(式(1)~(2))和Ritger-peppas方程(式(3))拟合Y-G的释碳动力学过程, 发现Y-G的释碳过程同时符合二级动力学方程(R2=0.9742)和Ritger-peppas方程(R2=0.9663)(表 2).采用Ritger-peppas方程拟合时, Y-G的碳释放指数N小于0.45, 表明枸杞枝表面的碳源通过扩散转移到溶液中(Ritger et al., 1987).二级动力学方程拟合参数中, M∞越大, 材料的COD最终释放总量越大;K越大, 材料的传质阻力越小;t1/2越小, 表示COD释放达到平衡状态的速度越快.原枸杞枝的COD最终释放总量(M∞)为666.67 mg·g-1·L-1, 传质系数(K)为666.67 mg·g-1·L-1·d-1, t1/2为1 d.原枸杞枝的COD最终释放总量大, 表明枸杞枝的释碳能力强;传质系数也大, 表明其传质阻力小, 释碳迅速.
| 表 2 原枸杞枝释碳动力学拟合 Table 2 Kinetic fitting of carbon release process of the raw Chinese wolfberry branches |
理论上, 当还原性物质均为含碳有机物时, 1 g COD=0.38 g TOC(m(C)/m(O2)=12/32=0.38), 即TOC/COD比值为0.38(Xiong et al., 2020).本试验中Y-G第Ⅰ阶段快速释放期的TOC/COD平均值为0.51, 第Ⅱ阶段平稳期的TOC/COD平均值为0.27(图 2), 表明第Ⅱ阶段与第Ⅰ阶段相比释放COD中含碳有机物占比下降.
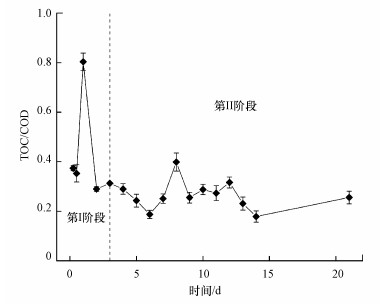 |
| 图 2 原枸杞枝释碳过程中TOC/COD比值变化 Fig. 2 Changes of TOC/COD ratio in the carbon release process of the raw Chinese wolfberry branches |
在静态释碳的同时, 原枸杞枝(Y-G)也有一定的氮、磷释放, Y-G中TN和TP释放速率在第1 d达到最高, 分别为5.79 mg·g-1·d-1和1.51 mg·g-1·d-1, 第2 d时TN和TP释放速率迅速下降, 分别低于1 mg·g-1·d-1和0.02 mg·g-1·d-1, 经过3 d的第Ⅰ阶段的快速释放期后, 氮、磷释放速率基本接近于0 mg·g-1·d-1(图 3).这与已报道的玉米秸秆、大豆秸秆、水稻秸秆释放规律接近(张雯等, 2017).
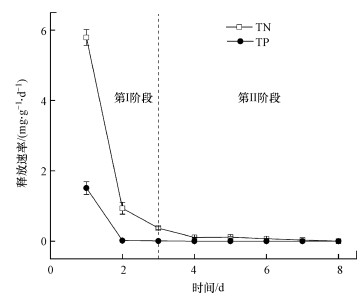 |
| 图 3 原枸杞枝TN和TP释放情况 Fig. 3 The TN and TP release of the raw Chinese wolfberry branches |
由3.1.1节可知, 前3 d枸杞枝释放碳速率高, 如果直接作为反硝化碳源, 可能会影响出水水质的COD指标.因此, 本研究用自来水浸泡枸杞枝3 d进行预处理, 以去除掉初期释放快的碳源, 再对枸杞枝进行改性处理, 提高枸杞枝的稳态释碳速率.
改性前后枸杞枝的组成如表 3所示, Y-G主要由纤维素、半纤维素和木质素组成, 其中, 纤维素和半纤维素总占比为45.4%;经3 d水浸泡预处理的D-G的纤维素和半纤维素总占比为44.9%;与D-G相比, 改性后的0-G的纤维素和半纤维素总占比增加了8.7%, 20%-G的纤维素和半纤维素总占比增加了31.6%, 100%-G的纤维素和半纤维素总占比增加了35.2%.这主要是因为甲醇作为有机溶剂, 能够打破木质素和半纤维素内部连接的化学键, 降低木质素含量和占比, 相应纤维素和半纤维素总占比增加(Yuan et al., 2018).
| 表 3 改性前后枸杞枝组成分析 Table 3 Composition analysis of the raw Chinese wolfberry branches and modified ones |
碳元素是改性前后枸杞枝中的主要组成成分(43.23%~76.22%), 氮和磷的含量非常低, 占比分别为1.30%~12.47%和0.02%~0.11%.这表明枸杞枝作为反硝化脱氮填料有释放大量碳源物质的可行性, 可为反硝化微生物提供大量的电子供体, 强化系统脱氮, 但氮、磷也会有一定量的释放, 要加以关注并在必要时采取相应的措施.
3.2.2 改性前后枸杞枝表面形态特征图 4为改性前后枸杞枝的扫描电镜图, 可以看出Y-G结构紧密且平整光滑, 而经过改性处理后枸杞枝表面粗糙度增加, 并且D-G、0-G、20%-G、50%-G有不规则的孔洞产生, 有助于微生物的附着生长, 其中, 可以很明显地观察到20%-G表面粗糙程度最大, 孔洞最多, 并且孔洞分布相对均匀, 更适合微生物的附着生长.
 |
| 图 4 改性前后枸杞枝扫描电镜图 Fig. 4 SEM images of the Chinese wolfberry branches before and after modification |
图 5a显示了改性前后枸杞枝静态反硝化试验过程中NO3--N和TN浓度变化, 空白组未加碳源, NO3--N浓度基本保持不变;添加不同改性枸杞枝的各组, 随着运行时间延长NO3--N浓度变化呈现出显著差异.对照组前4 d NO3--N浓度无变化, 而不同改性枸杞枝组从第2 d开始NO3--N浓度逐日下降, 主要是由于改性后的枸杞枝木质素结构遭到破坏, 纤维素和半纤维素暴露出来, 更容易被反硝化细菌利用, 其NO3--N去除速率大小依次为20%组>50%组>0组>100%组>对照组>空白组, 且20%组NO3--N去除率在第12 d就达到80%以上, 运行至第20 d时NO3--N去除率达到99%.而张雯等(2017)使用小麦秸秆、玉米秸秆、甘蔗渣、稻壳、木屑、玉米棒5种植物碳源进行脱氮效率试验, 在进水硝氮浓度为50 mg·L-1条件下, 第49~56 d时各体系中NO3--N去除率才达到80%以上.第22 d时100%组NO3--N去除率仅为86%, 原因是该组改性枸杞枝表面粗糙度相对较低, 且无孔洞(图 4f), 微生物较难附着, 因此, 在使用甲醇-水- NaOH体系改性枸杞枝时, 要选择适宜的甲醇添加量.
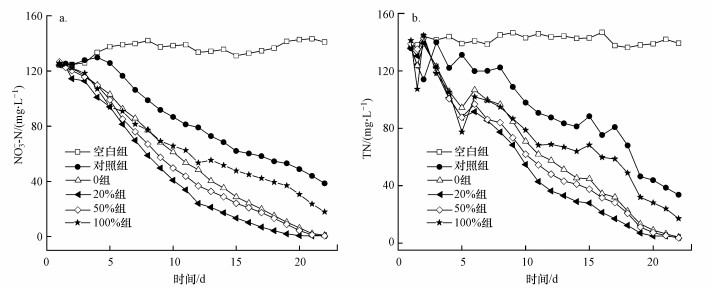 |
| 图 5 反硝化过程中NO3--N(a)和TN(b)浓度的变化 Fig. 5 Concentration changes of NO3--N (a) and TN (b) during the denitrification process |
图 5b显示了改性前后枸杞枝静态反硝化试验过程中TN浓度变化.由图可知, TN的变化趋势与NO3--N一致, 表现为20%组>50%组>0组>100%组>对照组>空白组, 其中, 20%组在第18 d时TN去除率达到90%以上.
3.3.2 反硝化过程中COD、TOC的变化图 6a显示了各试验组反硝化过程中COD的变化, 1~13 d添加改性枸杞枝的各组出水中COD小幅上升, 且NO3--N去除率也高于对照组;14~22 d出水COD逐渐下降, 原因是反硝化细菌大量生长繁殖, 耗碳量增加, 最终达到释碳和反硝化耗碳的平衡.本实验中第7 d时各组出水TOC含量相对较低, 为46.6~60.3 mg·L-1, 其中, 20%组出水TOC为49.4 mg·L-1, 低于Xiong等(2020)以未经任何预处理的花生壳和玉米芯为碳源进行静态反硝化实验时出水的TOC含量(90 mg·L-1), 这与枸杞枝用水浸泡3 d后表面易溶解的小分子有机物释放到水中有关.图 6b显示了各试验组反硝化过程中TOC/COD的变化, 对照组和各改性组出水TOC/COD在前14 d稳定在0.6左右, 说明可被微生物利用的含碳有机物占比较多, 后期随着反硝化细菌的利用, TOC/COD逐渐降低至0.2~0.4.
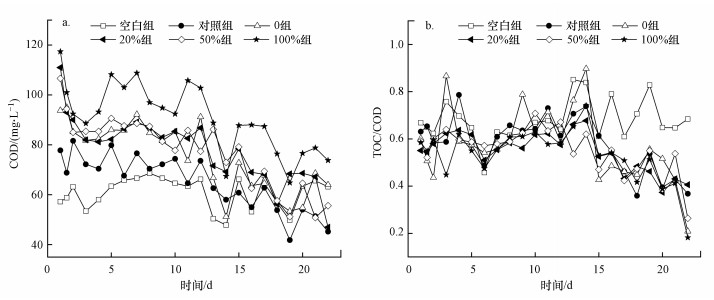 |
| 图 6 反硝化过程中COD(a)和TOC/COD比值(b)的变化 Fig. 6 Changes of COD (a) and TOC/COD ratio (b) during the denitrification process |
反硝化细菌将NO3--N转化为N2的过程主要依赖硝酸盐还原酶和亚硝酸盐还原酶, 且硝酸盐还原酶对碳源的竞争能力强于亚硝酸还原酶, 当碳源不足时, 容易引起NO2--N的积累(赵文莉等, 2014).图 7显示了不同改性枸杞枝条件下NO2--N浓度的变化, 0组、20%组、50%组和100%组在1~13 d期间, 其出水NO2--N浓度逐渐增加, 第13 d分别达到峰值11.43、12.60、10.29和13.68 mg·L-1, 可能由于前期提供的碳源主要被硝酸盐还原酶利用;第13 d后由于0组、20%组、50%组和100%组NO3--N浓度较低, 硝酸盐还原酶对碳源的需求降低, 使得亚硝酸盐还原酶可利用的碳源增加, NO2--N含量逐渐降低;而最后几天各改性组出水中NO2--N浓度又呈现稍微增加的趋势, 原因可能与枸杞枝释放碳源不足有关;对照组NO2--N一直积累, 主要是由于枸杞枝中木质素的“壁垒”作用和纤维素本身的结晶结构, 导致纤维素和半纤维素不能充分被微生物利用, 造成碳源供给不足(赵文莉等, 2014).
 |
| 图 7 反硝化过程中NO2--N浓度的变化 Fig. 7 Concentration changes of NO2--N during the denitrification process |
图 8显示了不同改性枸杞枝试验组反硝化速率随时间的变化情况, 20%组在第2 d时反硝化速率达到最大值(2.85 mg·g-1·d-1), 平均反硝化速率为0.76 mg·g-1·d-1.16 d后各组反硝化速率逐渐趋于稳定, 各组平均反硝化速率大小依次为20%组>50%组>0组>100%组>对照组, 分别为0.91、0.82、0.72、0.64、0.50 mg·g-1·d-1.由图 4可知, 0组、20%组和50%组改性枸杞枝的表面粗糙度高于其他改性组, 其微生物的附着能力也高于其他改性组, 因此其反硝化速率也相对较高.
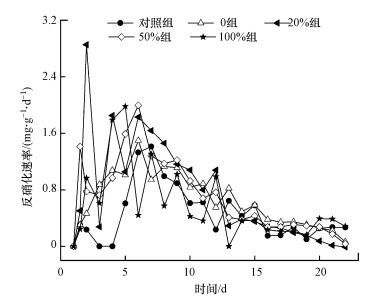 |
| 图 8 不同改性条件枸杞枝试验组反硝化速率变化 Fig. 8 Denitrification rate of the Chinese wolfberry branches modified with different methods |
Monod方程(式(4))拟合结果如表 4所示, 对于NO3--N去除率较高的0组、20%组和50%组, 其对应的Monod方程的可决系数(R2)分别为0.92、0.96和0.92;NO3--N去除率较低的对照组和100%组, 其对应的Monod方程的R2只有0.21和0.2.由式(4)可知, Ks越大, 表明基质浓度对反硝化速率的影响越大, Vm越大, 表明系统的最大反应速率越快, 效率越高.从表 4可以看出, 20%组的Vm最大, 这是因为该组添加的20%-G表面结构最为粗糙、不规则且有大量的孔洞产生, 适合微生物附着生长, 以其作为反硝化碳源可以获得最大的反硝化速率;但20%组的Ks相比其他组也较大, 表明20%组的反硝化速率受基质浓度影响较大.对比其他文献发现20%组的Vm比农业废弃物(花生壳、玉米芯)和高分子有机物(聚已内酯、聚丁二酸丁二酯、海藻酸钠-聚乙烯醇)的Vm都高, 但Ks值比农业废弃物(花生壳、玉米芯)高, 比高分子有机物(聚已内酯、聚丁二酸丁二酯、海藻酸钠-聚乙烯醇)低(Xiong et al., 2020).
| 表 4 不同改性枸杞枝试验组脱氮动力学方程 Table 4 Nitrogen removal kinetic parameters of the Chinese wolfberry branches modified with different methods |
1) 改性后枸杞枝中纤维素和半纤维素含量比改性前增加了8.7%~35.2%, 改性后枸杞枝的表面粗糙度增加, 且20%-G表面粗糙程度最大、孔洞最多且分布相对均匀, 更适合微生物附着生长.
2) 原枸杞枝静态释碳过程同时符合二级动力学方程和Ritger-Peppas方程, 第Ⅰ阶段(第1~3 d)处于快速释放阶段, 第Ⅱ阶段(第4~21 d)为稳定释放阶段, COD释放量为666.67 mg·g-1·L-1;在静态释碳时也有一定的氮、磷释放, 但经过第Ⅰ阶段后, 氮、磷释放基本接近于零.
3) 各枸杞枝改性试验组的反硝化速率大小依次为20%组>50%组>0组>100%组>对照组>空白组.20%甲醇-水-NaOH(0.01 g·mL-1)体系改性的枸杞枝作为反硝化碳源时反硝化速率最高, 第2 d就达到最大值(2.85 mg·g-1·d-1), 平均值为0.76 mg·g-1·d-1, 其反硝化过程符合Monod方程, 可决系数R2为0.96.
Alexander M. 1978. Introduction to soil microbiology[J]. Soil Science, 125(5): 331. |
Brandt A, Gräsvik J, Hallett J P, et al. 2013. Deconstruction of lignocellulosic biomass with ionic liquids[J]. Green Chemistry, 15(3): 550-583. DOI:10.1039/c2gc36364j |
陈亮, 张凌青, 尹庆宁, 等. 2015. 宁夏枸杞资源及饲料化利用现状及对策[J]. 饲料研究, 22: 61-63. |
陈志龙, 李毓华, 杨宇为, 等. 2020. 不同处理方式对枸杞枝条青贮品质的影响[J]. 饲料研究, 43(6): 87-90. |
Elefsiniotis P, Wareham D G, Smith M O. 2004. Use of volatile fatty acids from an acid-phase digester for denitrification[J]. Journal of Biotechnology, 114(3): 289-297. DOI:10.1016/j.jbiotec.2004.02.016 |
Fu G P, Huangshen L K, Guo Z P, et al. 2017. Effect of plant-based carbon sources on denitrifying microorganisms in a vertical flow constructed wetland[J]. Bioresource Technology, 224: 214-221. DOI:10.1016/j.biortech.2016.11.007 |
胡秋龙, 熊兴耀, 谭琳, 等. 2011. 木质纤维素生物质预处理技术的研究进展[J]. 中国农学通报, 27(10): 1-7. DOI:10.3969/j.issn.1007-7774.2011.10.001 |
李斌, 郝瑞霞. 2013. 固体纤维素类废物作为反硝化碳源滤料的比选[J]. 环境科学, 34(4): 1428-1434. |
李晓崴, 贾亚红, 李冰, 等. 2013. 人工湿地植物缓释碳源的预处理方式及释碳性能研究[J]. 水处理技术, 39(12): 46-48+52. DOI:10.3969/j.issn.1000-3770.2013.12.011 |
Medhi K, SinghalL A, Chauhan D K, et al. 2017. Investigating the nitrification and denitrification kinetics under aerobic and anaerobic conditions by Paracoccus denitrificans ISTOD1[J]. Bioresource Technology, 242: 334-343. DOI:10.1016/j.biortech.2017.03.084 |
Moore T R, Dalva M. 2001. Some controls on the release of dissolved organic carbon by plant tissues and soils[J]. Soil Science, 166(1): 38-47. DOI:10.1097/00010694-200101000-00007 |
Park J B K, Craggs R J, Sukias J P S. 2009. Removal of nitrate and phosphorus from hydroponic wastewater using a hybrid denitrification filter (HDF)[J]. Bioresource Technology, 100(13): 3175-3179. DOI:10.1016/j.biortech.2009.01.036 |
Qian G S, Ye L L, Li L, et al. 2018. Influence of electric field and iron on the denitrification process from nitrogen-rich wastewater in a periodic reversal bio-electrocoagulation system[J]. Bioresource Technology, 258: 177-186. DOI:10.1016/j.biortech.2018.02.112 |
Ritger P L, Peppas N A. 1987. A simple equation for description of solute release Ⅱ.Fickian and anomalous release from swellable devices[J]. Journal of Controlled Release, 5(1): 37-42. DOI:10.1016/0168-3659(87)90035-6 |
Rocher V M, Laverman A, Gasperi J., et al. 2015. Nitrite accumulation during denitrification depends on the carbon quality and quantity in wastewater treatment with biofilters[J]. Environmental Science and Pollution Research, 22(13): 10179-10188. DOI:10.1007/s11356-015-4196-1 |
邵留, 徐祖信, 王晟, 等. 2011. 新型反硝化固体碳源释碳性能研究[J]. 环境科学, 32(8): 2323-2327. |
Van Soest P J, Robertson J B, Lewis B A. 1991. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
Wan C X, Li Y B. 2010. Microbial pretreatment of corn stover with Ceriporiopsis subvermispora for enzymatic hydrolysis and ethanol production[J]. Bioresource Technology, 101(16): 6398-6403. DOI:10.1016/j.biortech.2010.03.070 |
Wang J L, Chu L B. 2016. Biological nitrate removal from water and wastewater by solid-phase denitrification process[J]. Biotechnology Advances, 34(6): 1103-1112. DOI:10.1016/j.biotechadv.2016.07.001 |
武海涛. 2013. 人工湿地反硝化脱氮外加碳源选择研究[D]. 杭州: 浙江大学
|
谢家仪, 董光军, 刘振英. 2005. 扫描电镜的微生物样品制备方法[J]. 电子显微学报, 24(4): 440-440. DOI:10.3969/j.issn.1000-6281.2005.04.191 |
熊家晴, 孙建民, 郑于聪, 等. 2018. 植物固体碳源添加对人工湿地脱氮效果的影响[J]. 工业水处理, 38(9): 41-44. |
Xiong R, Yu X X, Zhang Y E, et al. 2020. Comparison of agricultural wastes and synthetic macromolecules as solid carbon source in treating low carbon nitrogen wastewater[J]. Science of the Total Environment, 739: 139885. DOI:10.1016/j.scitotenv.2020.139885 |
Xu G C, Ding J C, Han R Z, et al. 2016. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation[J]. Bioresource Technology, 203: 364-369. DOI:10.1016/j.biortech.2015.11.002 |
Yang X L, Jiang Q, Song H L, et al. 2015. Selection and application of agricultural wastes as solid carbon sources and biofilm carriers in MBR[J]. Journal of Hazardous Materials, 283: 186-192. DOI:10.1016/j.jhazmat.2014.09.036 |
Yang X L, Xu J Y, Song H L, et al. 2020. Enhanced removal of antibiotics in wastewater by membrane bioreactor with addition of rice straw[J]. International Biodeterioration & Biodegradation, 148. DOI:10.1016/j.ibiod.2019.104868 |
Yuan W, Gong Z W, Wang G H, et al. 2018. Alkaline organosolv pretreatment of corn stover for enhancing the enzymatic digestibility[J]. Bioresource Technology, 265: 464-470. DOI:10.1016/j.biortech.2018.06.038 |
Zhang S F, Wang Y Y, He W T, et al. 2014. Impacts of temperature and nitrifying community on nitrification kinetics in a moving-bed biofilm reactor treating polluted raw water[J]. Chemical Engineering Journal, 236: 242-250. DOI:10.1016/j.cej.2013.09.086 |
张雯, 张亚平, 尹琳, 等. 2017. 以10种农业废弃物为基料的地下水反硝化碳源属性的实验研究[J]. 环境科学学报, 37(5): 1787-1797. |
赵文莉, 郝瑞霞, 李斌, 等. 2014. 预处理方法对玉米芯作为反硝化固体碳源的影响[J]. 环境科学, 35(3): 987-994. |
Zhao X B, Cheng K K, Liu D H. 2009. Organosolv pretreatment of lignocellulosic biomass for enzymatic hydrolysis[J]. Applied Microbiology and Biotechnology, 82(5): 815-827. DOI:10.1007/s00253-009-1883-1 |
 2021, Vol. 41
2021, Vol. 41


