2. 国家城市环境污染控制工程技术研究中心, 北京 100037
2. National Urban Environment Pollution Control Engineering Techniques Research Center, Beijing 100037
多环芳烃(PAHs)是一种广泛存在于环境中的有机污染物, 具有致癌、致畸、致突变的“三致效应”, 且在环境中化学性质稳定, 因此不易自然降解(Ololade et al., 2016;Zhang et al., 2017).自然环境中的PAHs来源主要是人为排放, 如煤和石油等化石燃料的燃烧以及石油泄漏和生物质的燃烧等(倪进治等, 2007;Klimkowicz et al., 2017;Alharbi et al., 2018;Ukalska et al., 2020).由于大多数的PAHs的水溶性低以及土壤对其吸附性强, 因此PAHs在陆地环境中有着较高的持久性(Ehlers et al., 2006).随着现代经济和工业的飞速发展, 化石燃料的使用量逐年增加, 导致PAHs的排放量迅速增加, 土壤中的PAHs在世界范围内增加了5个数量级以上, 由于土壤中SOM(土壤有机质)的作用(Agarwal et al., 2009;Klimkowicz et al., 2017;Ukalska et al., 2019a), 土壤对PAHs的吸附, 在PAHs的迁移和赋存中扮演着重要的角色(Duan et al., 2013;Kuppusamy et al., 2016), 土壤对PAHs的吸附作用分为矿物组分和土壤有机质吸附两部分, 有机质吸附为主要部分(包桂奇等, 2013), 土壤有机质(SOM)是影响土壤环境中多环芳烃命运的主要因素(Maliszewska et al., 2009;Luo et al., 2012;Bielińska et al., 2018), SOM对土壤的PAHs吸附最初为快速且可逆过程, 有报道称PAHs的提取能力以及生物利用度会随着SOM对PAHs的吸附解吸时间而显著降低(Oleszczuk et al., 2012;Yang et al., 2012;Koltowski et al., 2016), PAHs生物利用度随着土壤中PAHs总量的增加而降低, 这可能与土壤中多环芳烃的螯合有关(Cachada et al., 2018), 通常认为土壤有机质包括不同分子量、官能团以及极性的多种成分组成, 主要成分为腐殖质(HS)和黑炭(BC), 由于不同组分之间的疏水、静电相互作用以及化学键的形成以及分子结构, 进而影响污染物的动力学过程, 可能会对PAHs总量有着显著的影响(Pignatello et al., 2011;Chen et al., 2017;Bejger et al., 2018;Ukalska et al., 2018), SOM是影响PAHs降解的重要因素, 大量研究表明, PAHs的生物利用度受PAHs与土壤有机质之间的相互控制, 以及碳质材料的固存(Cornelissen et al., 2005).已有吸收实验证明PAHs在土壤有机质的固存机理为特异性吸附和微孔填充, PAHs降解产物需要通过SOM周转才能彻底净化(Pan et al., 2006), PAHs自身性质也决定了其环境行为.SOM最常用的分组方法是利用SOM在酸、碱溶液中的溶解度的不一致将其分为富里酸(FA)、胡敏酸(HA)和胡敏素(HN), 有研究表明SOM对PAHs的慢吸附过程中主要发生在HN区域(Pan et al., 2006).将SOM分为不含矿物质组分(部分分解的植物残体和微生物生物量)的轻组(LF)和有机-矿物复合物(有机质吸附在矿物表面或锁定在微团聚体内部)的重组(HF)(Ni et al., 2008), 在此基础上将HF进一步分为为松散组合(H1)、稳定组合(H2)和紧密组合(H3)的腐殖质(熊毅, 1985).PAHs的吸附主要发生在占比为0.1%~1.4%的LF中, HF中的PAHs主要与H3有关, 对比各组分的毒性评价表明, LF中毒性当量浓度远远高于HF以及原污染土样(Ni et al., 2008;包桂奇等, 2013;刘文静等, 2020).
目前, 已有许多关于SOM不同组分对PAHs影响的研究, 包括对PAHs的吸附以及评价其环境风险, 大多是从富里酸(FA)等、黑碳(BC)、溶解有机物(DOM)等进行研究(Pan et al., 2006;郭瑾等, 2018;郝丽虹等, 2018, 邹祎萍等, 2019), 也有少量是基于典型企业周边污染土壤中HF、LF报道研究(包桂奇等, 2013;刘文静等, 2020), 但是关于焦化土壤中PAHs的生物有效性方面的研究较少, 并且先前的研究都是针对低浓度的PAHs污染土壤, 因此, 本文选取三个不同焦化污染土壤为研究对象, PAHs污染严重, 利用过硫酸盐氧化法测定16种USEPA优控的PAHs其生物有效性, 分析其浓度与组成, 为进一步了解高浓度PAHs在环境中的生物可利用性提供理论参考.
2 材料与方法(Materials and methods) 2.1 土壤样品的采集于同时期在北京、太原、重庆PAHs污染场地采集多个样品, 其中, 3个场地均布设了4个采样点, 最大采样深度为15 m, 平均采样深度约为10 m.采样地点多为污染较重区域, 如焦油、化产区、焦炉区、精苯、水处理区等.所采样品多为砂土, 根据污染情况, 选择其中部分代表性样品, 将土壤样品过2 mm筛, 风干, 去除杂质、冷冻干燥, 密封冷藏, 以进行PAHs分析.
2.2 16种PAHs的测定采用气相色谱法-质谱法(Agilent7890-5975-GC-MS)具体参考US EPA8270D-2007的分析方法对US EPA规定的16种优先控制的PAHs进行检测分析.简言之:将保存的土壤进行冷冻干燥, 之后过2 mm筛, 再将筛完的土样分别定量称取20 g, 加入丙酮和蒸馏水, 体积比为4 ∶ 1, 且固液比为1 ∶ 10的溶液, 室温下以150 r · min-1振荡1 h, 之后于3000 r · min-1离心5 min, 取离心后的萃取液, 进行液相色谱-质谱(GC-MS)检测, 测定的16种优先控制的PAHs, 包括萘(Nap)、苊烯(Acy)、苊(Ace)、芴(Flu)、菲(Phe)、蒽(Ant)、荧蒽(Flt)、芘(Pyr)、苯并(a)蒽(BaA)、(Chr)、苯并(b)荧蒽(BbF)、苯并(k)荧蒽(BkF)、苯并(a)芘(BaP)、茚并(1, 2, 3-cd)芘(Ipy)、二苯并(a, h)蒽(DBA)、苯并(g, h, i)苝(BgP).
2.3 土壤各组分分离按照Spycher等(1983)的方法将土壤按照密度分离成LF以及HF, 简言之, 取30 g冻干土壤(< 2 mm)称重至200 mL特氟隆离心管中, 加入100 mL溴化锌(ZnBr2)(密度~1.8 g · cm-3)溶液, 混合物被放置在旋转摇床上分散后, 以2500 r · min-1离心10 min, 悬浮物的轻馏分(LF)转移到预先称重的并且用二氯甲烷萃取过的滤纸中, 用去蒸馏水、离子水彻底洗净;再加入100 mL ZnBr2, 重新悬浮离心管中剩余的土壤, 重复这一步骤以获得第二次LF, 将两次的LF冷冻干燥称重后获得LF的干重, 将离心管中剩余的土壤(HF)与蒸馏水、去离子水混合, 多次漂洗去除ZnBr2, 然后冷冻干燥分离组合腐殖质.
根据Fu(1985)所述方法进行一些修改, 将得到的HF进一步分解为松散组合(H1)、稳定组合(H2)和紧密组合(H3)的腐殖质.即将10 g HF土壤称重到200 mL特氟隆离心管中, 每管加入120 mL、0.1 mol · L-1的NaOH.混合物在25 ℃的旋转摇床(200 r · min-1)上摇一晚上.对其进行离心(12000 r · min-1, 15 min), 将上清液从土壤残渣固体分离出来, 保存在棕色瓶中.用120 mL、0.1 mol · L-1的NaOH提取, 重复4~5次, 直到上清液清澈, 所有的上清液一起得到H1.将100 mL、0.1 mol · L-1的NaOH和0.1 mol · L-1的Na4P2O7混合液加入含有固体残渣的离心管中, 按上述方法搅拌摇动, 提取3~4次, 直到上清液清澈.所有的上清液一起得到H2.残留在土壤中的有机物被认为是H3.离心管中的残余土用蒸馏水冲洗至pH值约为7, 冷冻干燥后进行进一步分析.
2.4 土壤过硫酸盐氧化使用美国Leco公司的TruSpecCN元素分析仪测定ω(SOM), 按照Cuypers等(2000)的测试方法:称取制备好的土壤样品, 加入适量的过硫酸钾(K2S2O8)以及去离子水, 混合均匀, 使混合液中过硫酸根离子(S2O82-)与土壤有机质(SOM)满足质量比为12 ∶ 1, 并且过硫酸根离子密度ρ(S2O82-)为0.0357 g · mL-1, 水浴振荡3 h(70 ℃、120 r · min-1), 之后将氧化后的样品过滤, 采用1.2节方法测定PAHs残留量.每个样品重复3次, 取平均值.
2.5 土壤有机碳FTIR检测运用FTIR(傅里叶变换红外光谱)法测定SOM的结构组成:将已烘干待测的待测土壤样品与溴化钾(KBr)以质量比为1 ∶ 100在玛瑙研钵中混合研磨均匀, 压片, 利用傅里叶变换红外光谱仪(VERTEX 70, Bruker公司, 德国)测定土壤有机质(SOM)的组成, 采用OPUS软件处理红外图谱, 扫描次数为32, 分辨率为4.000 cm-1, 扫描范围为600~4000 cm-1.对光谱进行校正, 以去除水气和CO2的影响.
3 结果与分析(Results and analysis) 3.1 土壤中分离量与回收率其中土壤分离成LF和HF以及H3相关数据如表 1所示, 其中太原、重庆、北京3个场地中分别用前缀符号T、C、S表示, 用S、HF、LF、H3表示原土、重组、轻组以及紧密结合的腐殖质.由表可知, 原土样回收率(分离得到的LF和HF总和占原土样的质量百分数)为84.08%~93.06%, 而重组(HF)回收率(分离得到的H1、H2、H3占HF的质量百分数)则为87.19%~91.78%, 可以看出, 分离过程中损失的样品均较少, 因此, 这里使用的分级方法适合研究PAHs在不同土壤有机质组分中的分布特征.从质量组成上看, 原土样基本由HF组成, 其中轻组(LF)占原土样质量百分比1.06%~1.41%, 相比于HF, LF所占质量低得多.其中原土、轻组、重组中土壤有机质(SOM)含量分别为26.75~32.77、53.36~150.20、20.80~28.85 g · kg-1.通常情况下, 测试结果中SOM大于1.00 g · kg-1时, 土壤中绝大部分的PAHs均被SOM吸附, PAHs属于非极性有机污染物, 其憎水性强导致易于被SOM吸附, 土壤中大部分PAHs污染均集中在有机质浓度高的部分(Cuyper et al., 2000;夏天翔等, 2015).从总氮(TN)以及总有机质来看, 各个组分相差较大, 尤其是紧密结合的腐殖质(H3)中, 这表明大部分有机物质多存于其他组分中(如LF中), 焦化污染土壤中, 3个场地中pH值为6.54~6.88, 由于生产等因素, 多为弱酸性土壤.
| 表 1 土壤分离量和回收率 Table 1 The separation and recovery rate of soil |
将土壤分离成轻组(LF)和重组(HF)后, 取每个场地中的LF和HF的PAHs浓度平均值(表 2), 可以看到LF和HF中多环芳烃浓度相差较大, 轻组中的浓度要远高于重组中, 这和(Ni et al., 2008)报道的一致, 其中少部分的轻组(1.06%~1.41%), 所含的PAHs占土壤中PAHs总量的13%~17%, 当土壤PAHs污染较严重时, HF中可能存在较多的PAHs, 有报道农业污染土壤中0.1%~1.4%的LF所含PAHs占原土壤PAHs的17.9%~61.4%, 工业和养殖业污染土壤LF中所含PAHs占总PAHs的5.9%~75%, 以及河流地区的质量百分比小于5%的LF, 所含的PAHs为70%(倪进治等, 2007;Yang et al., 2008).对比各组分SOM含量可知, 原土、HF、H3中SOM含量基本一致, 而LF中SOM含量与其他组分相差较为显著, 这可以为LF中PAHs要远高于其他组分提供解释, 对于土壤中疏水性有机物而言, 有报道称PAHs在土壤中的吸附主要取决于SOM与PAHs的相互作用, 并且这种互动作用很大程度上取决于SOM的性质与类型, 其中BC、干酪根以及胡敏素等对PAHs有着较强的吸附能力, 然而, 土壤中SOM并不是一成不变的, 其他物质的存在也会改变其性质, 有报道称生物炭的存在可改变土壤SOM的凝结性和刚性, 对土壤吸附双酚A等有机物污染物具有显著的提高效应(Pan et al., 2006;Ran et al., 2007), 因此, 土壤中的PAHs不仅仅取决于SOM含量, 其他物质的存在也会影响土壤对PAHs的富集程度.此外, 尽管该研究的LF质量和已有研究结果相差较大(刘文静等, 2020), 可以肯定的是, 土壤中浓度极低的LF在土壤对PAHs的吸附中起着主要作用.尽管结果有所差异(刘文静等, 2020), 但是可以肯定的是, 土壤中浓度极低的LF在土壤对PAHs的吸附中起着主要作用.
| 表 2 LF和HF的PAHs浓度 Table 2 The content of PAHs in LF and HF |
有研究表明土壤中多环芳烃的浓度不仅与有机质的浓度有关, 而且与有机质的质量有关(Shi et al., 2018;Ukalska et al., 2019b), 原土样中∑PAHs与SOM百分比为0.21%~10.13%, 该值上限比以往研究结果(0.08%~0.72%)偏大, 其中北京地区该值最高(10.13%)(Cuyper et al., 2000;夏天翔等, 2015), 这可能是跟该地区土壤多为粗粉有关, 有研究表明有机质的富集能力在粗粉质中最高, 而在粘土中最低(Ni et al., 2008), 本研究该值说明样品中单位SOM所富集的PAHs较高, 土壤富集能力强.对于受到PAHs的土壤来说, 生物修复仅对低分子PAHs有效, 而对高分子PAHs无效, 因此有人提出可利用LF对PAHs的非选择高富集性, 可以从中分离出LF组分, 从而对环境中的PAHs去除, 但是有研究表明LF中可能含有的BC以及未分解和部分分解的动植物残留物, 这些物质存在或将影响LF的分解性(Gregorich et al., 1996), 总的来说, 提高污染土壤中的SOM浓度, 促进土壤中PAHs的富集, 可能会对PAHs污染土壤的修复带来一定的高效便捷与低成本经济性.
从各组分中不同环数PAHs的组成可知, 原土、LF、HF在不同环数组成上虽然略有差异, 但都以2~3环为主, 其次为4环, 从不同场地看, 太原的原土中2~3环比例高于其他两地, 在自然环境中, 一般低环PAHs比高环PAHs更容易降解, 这也许解释了太原地区总多环芳烃(∑PAHs)较小的原因, 从不同组分上看, 各场地中PAHs以2~3环和4环为主, 且组成大致相同, 说明PAHs的环数以及性质不会影响各组分的分配, 进一步说明PAHs在不同土壤组分中的分配受外界因素影响而非自身因素.有研究表明LF中的有机质被是土壤中的活性有机质组分, 容易被生物利用, 与其结合的PAHs可能同时被生物利用或者释放倒土壤环境中再次在土壤组分中重新分配(刘文静等, 2020).将HF分离之后, 四环PAHs占比均有所增加, HF中PAHs组成上的略微差异可能来源于污染物分子与土壤有机质和矿物有机复合物中结合形式, 从而分配不均, 有机污染物一般通过疏水分配或通过化学或物理键形成与土壤或沉积物成分结合(胡庆亮等, 2014).
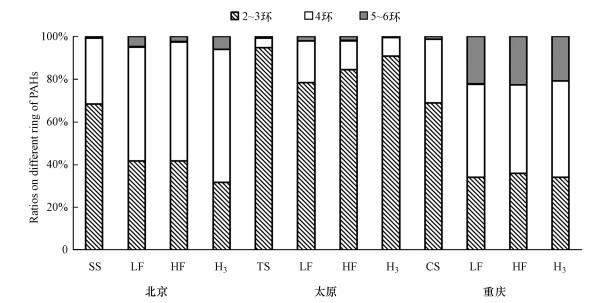 |
| 图 1 不同组分中PAHs的组成 Fig. 1 Composition of PAHs in different components |
将土壤在一定条件下进行过硫酸盐氧化, 氧化后残留的PAHs作为非生物有效态PAHs, 被氧化去除的PAHs(生物有效态PAHs)与氧化前的PAHs的比值作为生物有效性(Cuyper et al., 2000;夏天翔等, 2015).由实验结果可知, 3个场地中, 原土中2~3环的PAHs生物有效性为0.48~0.81, 均值为0.68, 略高于∑PAHs均值(0.67)、4环(0.55)以及5~6环(0.30);而HF中4环PAHs生物有效性为0.58~0.68, 均值为0.61, 略高于∑PAHs均值(0.56)、5~6环(0.45)以及2~3环(0.60), 夏天翔等(2015)报道原土中PAHs生物有效性均值在0.46左右, 该值在本研究结果要相对较大, 可能是由于所选样品多为低环PAHs, 有研究表明LMPAHs(低分子量多环芳烃)由于分子量较小更容易进入土壤三维孔隙中从而被封锁, 且本研究所取的样品中均以易生物降解的低环PAHs为主, 因此低环PAHs生物有效性要低于高环.研究表明, 由于SOM对LMPAHs吸附能力较弱, LMPAHs在氧化中容易去除(Nam et al., 2001).土壤中SOM的浓度不仅会影响PAHs在土壤中的吸附, 也会影响其生物有效性, 夏天翔等(2015)将土壤中SOM的浓度和2~3环、4环、5~6环PAHs的生物有效性分别进行对数方程拟合, 得到了拟合度(∑PAHs的R2=0.831)较高的方程式, 表明在一定程度上, 土壤中的PAHs生物有效性可用SOM定量描述.此外, 有研究发现Fenton试剂对PAHs的氧化效率会随着SOM浓度增加而降低, 过硫酸盐氧化可使SOM缩合度加剧, 导致土壤中SOM憎水性增强(Sun et al., 2007;Yang et al., 2010), 较小缩合度的SOM有利于提高土壤对PAHs的富集性.并且, 有研究表明黑炭、干酪根和胡敏素等高度聚合的有机质与Koc值呈正相关, 因而是影响土壤PAHs等疏水性有机化合物生物有效性的重要组成部分(Pan et al., 2006;焦立新等, 2010).可见, PAHs生物有效性和SOM浓度之间依然受到多种因素的影响, 并不取决于一种.
疏水性有机污染物(HOCs)如PAHs生物有效性取决于污染物、土壤和受体的物理、化学和生物特性, 并由污染物、基质和生物之间的3种相互作用决定, 涉及3个不同的过程:物理化学, 生理吸收和毒理学.近年来已广泛讨论的物理化学过程, 包括吸附、扩散和分配, 并受土壤和化合物的性质(例如土壤有机质(SOM)的含量和质量, 土壤无机成分和化合物的亲脂性)(Riding et al., 2013).土壤类型的差异:土壤有机质以及黏粒含量都可能影响其生物有效性(吕正勇等, 2011), 土壤基质和持久性有机污染物之间的相互作用极大地影响这些物质在环境中的生物有效性, 即通过与土壤和沉积物中固体基质的缔合, 保留或吸附机制进行固存是影响PAHs保留和生物有效性的重要过程(Rostami et al., 2011), 而本研究的PAHs生物有效性较高, 推测可能是因为, 相比于其他的粉土来说, 此次所采样品多为砂土, 砂土与土壤有机质类物质结合更为不紧密, 从而提高了生物有效性.许多研究表明, HOCs在土壤中经历老化过程, 与土壤长期接触的有机化合物的生物利用度降低, 那么, 老化土壤中PAHs生物有效性要更低, PAHs在老化开始时更容易为生物所利用, 并且随着土壤与PAH接触时间的增加, 其利用率迅速下降(Ling et al., 2010);相比于老化污染土壤, 另一个原因可能是, 本次样品污染土壤老化时间不长, 因此, 合理利用PAHs高生物有效性时期, 对土壤中的PAHs进行治理尤为重要, 并且评估PAHs的生物有效性对于评估其对环境和人类健康的风险极为重要.
HF分离出H1、H2、H3, 结果表明, H3中PAHs浓度为HF的58%~78%, 与Ni等(2008)研究结果一致.HF中BC主要存在于组分H3中, 因而HF中PAHs大多与H3有关(Pan et al., 2006;Ni et al., 2008).各组分对PAHs的富集能力为H1 < H2 < H3, 但由萃取剂强度及其他研究结果推测PAHs生物有效性为H1>H2>H3, 并且H3中PAHs结合紧密, 导致其生物有效性降低, 由于H1、H2存在于萃取液中, 没有进行SOM等分析, 还需进一步研究, 以阐明HF各组分中PAHs和SOM、BC等浓度之间的关系.
| 表 3 原土和HF中PAHs浓度及其生物有效性 Table 3 The content and bioavailability of PAHs in original soil and HF |
FTIR是定性分析有机物官能团的重要手段之一, 根据红外吸收曲线的峰位、峰强以及峰形来判断化合物中存在的官能团(夏天翔等, 2015).由土壤各组分红外光谱可知, 根据对红外光谱吸收峰的位置以及对应的官能团(Ran et al., 2007;Tivet et al., 2013), 各组分出现官能团主要包括:3500~3300 cm-1的宽峰是缔合的O—H伸缩振动吸收峰, 1616 cm-1为芳香环的环伸缩C C振动和羧酸COO—振动、1384 cm-1为C—H甲基弯曲振动、1033 cm-1为伯醇或芳香脂中的C—O振动、875 cm-1可能为黏粒O—H弯曲振动, 1000~650 cm-1主要是双键碳原子相连的C—H弯曲振动以及脂类化合物C—C键伸缩振动.3个场地土壤的FTIR吸收峰基本一致, 表明样品中土壤组成类似, 部分差异可能是SOM浓度导致其吸收峰面积不一致.有研究表明, 土壤对PAHs的吸附与脂肪族碳(主要为2852和2922 cm-1)相关, 而与芳香族碳(1632 cm-1)呈负相关(Tivet et al., 2013), 但是脂肪族碳和芳香族碳起主要作用存在着争议的(Dazy et al., 2009;Rostami et al., 2011;贾晓洋等, 2011;王培俊等, 2011);对比同一个土壤的不同组分可知, 虽然同一土壤的不同有机质组分的吸收峰比较相似, 但吸收峰的面积不一致, 这反映了有机质结构上的差别(包桂奇等, 2013).
为了探究不同组分结构上的差异, 根据文献(Tivet et al., 2013), 采用相对吸光度表征原土样、LF、HF、H3中SOM组成变化, 根据式(1)计算FTIR光谱中主要吸收峰的相对吸光度.

|
(1) |
式中, rAx、Ax分别为在波长为x cm-1处吸收峰的相对吸光度以及吸光度, ∑A(875~3439)为875~3439 cm-1范围内主要吸收峰的吸光度之和.
由相对吸光度可知(图 2), 比较LF和HF, 两者主要差别在于波长为1033 cm-1以及3500~3300 cm-1部分, 即含伯醇或芳香脂中的C—O官能团以及含O—H官能团组分, LF比HF在1033 cm-1相对吸光度明显增加, 增幅为11.41%~22.62%, 而在3500~3300 cm-1处LF比HF相对吸光度则略有下降, 降幅为1.57%~16.36%, 说明土壤分离后, LF中含C—O官能团的物质较多, 表明LF比HF含有更多的碳水化合物, 这可能是由于LF中含有更多的活性有机质组分, 因而更容易被微生物利用, 也可能是由于其所含高度聚合物如BC、胡敏素等有关, 这些高度聚合物对PAHs通常具有较高的吸附能力(Pan et al., 2006;Ran et al., 2007), 因此, 推测轻组中的PAHs生物有效性要比其他组分高, 对比HF和H3相对吸光度发现, H3中含O—H物质明显高于HF, 前人的研究发现(Xu et al., 1995), 松散结合的腐殖质(H1)主要与游离Fe和Al阳离子有关, 而稳定结合的腐殖质(H2)主要与Ca2+阳离子有关, 并且H3是PAHs缓慢吸附的主要区域, 相当于胡敏素, 在该部分中分布的被吸附PAHs数量随时间增加而增加(Pan et al., 2006).土壤HF部分分离成H1、H2、H3, 但多数PAHs主要存在于H3, 这可能是由于H3中存在较高含O—H的疏水性有机质, 如胡敏素.
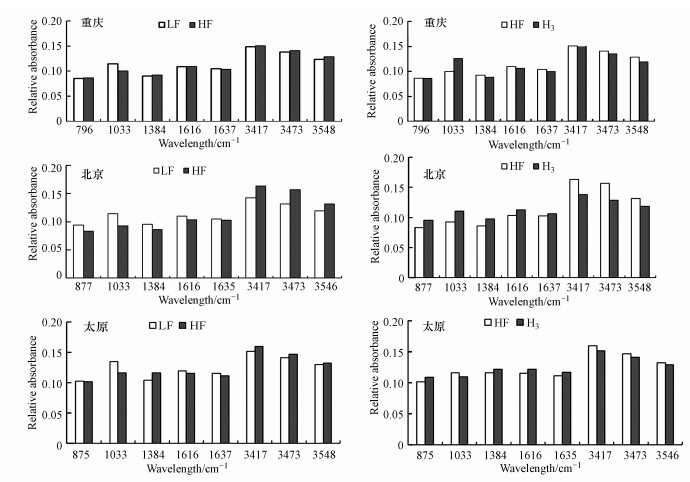 |
| 图 2 各组分中的相对吸光度 Fig. 2 Relative absorbance in each component |
1) LF中PAHs含量为226.51~11240.40 mg · kg-1, LF占总样品质量百分比仅为1.41%~2.43%, 但所含的PAHs占土壤中PAHs总量的13%~17%, LF富集PAHs的能力要远大于HF.不过, 当土壤PAHs的含量较高时, HF中的PAHs可能依然占有较大比重.
2) 所选取的原土样品中2~3环的PAHs生物有效性为0.48~0.81, 均值0.68, 略高于4环(0.55)以及5~6环(0.30);而HF中4环PAHs生物有效性为0.58~0.68, 均值为0.61, 略高5~6环(0.45)以及2~3环(0.60), 原土中PAHs生物有效性均值要比HF高.低环PAHs生物有效性要高于高环, HF中的PAHs也应当得到重视.
3) FTIR(傅里叶变换红外光谱)分析结果显示, LF比HF在1033 cm-1相对吸光度明显增加, 增幅为11.41%~22.62%, 而在3500~3300 cm-1处LF比HF相对吸光度则略有下降, 表明LF比HF含有更多的碳水化合物以及高度聚合物, 导致LF中所含的PAHs远高于HF组分, 而HF中PAHs大多数分布于H3中, 可能是由于H3中存在较高的疏水性有机质, 如胡敏素有关.
Agarwal T, Khillare P S, Shridhar V, Ray S. 2009. Pattern, sources and toxic potential of PAHs in the agricultural soils of Delhi, India[J]. Journal of Hazardous Materials, 163(2/3): 1033-1039. |
Alharbi O M, Khattab R A, ALI I. 2018. Health and environmental effects of persistent organic pollutants[J]. Journal of Molecular Liquids, 263: 442-453. DOI:10.1016/j.molliq.2018.05.029 |
包桂奇, 倪进治, 魏然, 等. 2013. 土壤不同有机质组分对菲的吸附特征研究[J]. 中国环境科学, 33(5): 861-867. DOI:10.3969/j.issn.1000-6923.2013.05.015 |
Bejger R, Mielnik L, Włodarczyk M, et al. 2018. Studying of the interaction between peat humic acids and metazachlor using spectroscopy methods[J]. Journal of Soils and Sediments, 18(8): 2675-2681. DOI:10.1007/s11368-018-1917-3 |
Bielińska J, Futa B, Ukalska-Jaruga A, et al. 2018. Mutual relations between PAHs derived from atmosphericdeposition, enzymatic activity, and humic substances in soils of differently urbanized areas[J]. Journal of Soils and Sediments, 18: 2682-2691. DOI:10.1007/s11368-018-1937-z |
Cachada A, Coelho C, Gavina A, et al. 2018. Availability of polycyclic aromatic hydrocarbons to earthworms in urban soils and its implications for risk assessment[J]. Chemosphere, 191: 196-203. DOI:10.1016/j.chemosphere.2017.10.013 |
Chen W, Wang H, Gao Q, et al. 2017. Association of 16 priority polycyclic aromatic hydrocarbons with humic acid and humin fractions in a peat soil and implications for their long-term retention[J]. Environmental Pollution Research, 230: 882-890. DOI:10.1016/j.envpol.2017.07.038 |
Cornelissen G, Gustafsson Ö, Bucheli T D, et al. 2005. Extensive sorption of organic compounds to black carbon, coal, and kerogen in sediments and soils: mechanisms and consequences for distribution, bioaccumulation, and biodegradation[J]. Environmental Science & Technology, 39(18): 6881-6895. |
Cuypers C, Grotenhuis T, Joziasse J, et al. 2000. Rapidpersulfate oxidation predicts PAH bioavailability in soils and sediments[J]. Environmental Science&Technology, 34(10): 2057-2063. |
Dazy M, Férard J F, Masfaraud J F. 2009. Use of a plant multiple-species experiment for assessing the habitat function of a coke factory soil before and after thermal desorption treatment[J]. Ecological Engineering, 35(10): 1493-1500. DOI:10.1016/j.ecoleng.2009.06.006 |
Duan L, Naidu R, Thavamani P, et al. 2013. Managing long-term polycyclic aromatic hydrocarbon contaminated soils: A risk-based approach[J]. Environmental Science and Pollution Research International, 22(12): 8927-8941. |
Ehlers G A, Loibner A P. 2006. Linking organic pollutant (bio) availability with geosorbent properties and biomimetic methodology: A review of geosorbent characterisation and (bio) availability prediction[J]. Environmental Pollution, 141(3): 494-512. DOI:10.1016/j.envpol.2005.08.063 |
Fu J P. 1985. Fractionation of soil organo-mineral complexes[M]. Soil Colloid, Part I: Methods for Soil Colloid Research[M]. Beijing: Science Press. 40-73
|
Gregorich E G. 1996. Storage of soil carbon in the light fraction and macro organic matter[J]. Structure and Organic Matter Storage in Agricultural Soils: 167-190. |
郭瑾, 葛蔚, 柴超, 等. 2018. 化学工业区周边土壤中多环芳烃含量、来源及健康风险评估[J]. 环境化学, 37(2): 296-309. |
郝丽虹, 张世晨, 武志花, 等. 2018. 低山丘陵区焦化厂土壤中PAHs空间分布特征[J]. 中国环境科学, 38(7): 2625-2631. DOI:10.3969/j.issn.1000-6923.2018.07.031 |
胡庆亮, 黄宁宝, 王艳, 等. 2014. 模拟胃肠液用Tenax提取法测定多溴联苯醚的生物有效性[J]. 环境化学, 33(8): 1253-1260. |
焦立新, 孟伟, 郑丙辉, 等. 2010. 渤海湾潮滩不同粒径沉积物中多环芳烃的分布[J]. 中国环境科学, 30(9): 1241-1248. |
贾晓洋, 姜林, 夏天翔, 等. 2011. 焦化厂土壤中PAHs的累积、垂向分布特征及来源分析[J]. 化工学报, 62(12): 3525-3531. DOI:10.3969/j.issn.0438-1157.2011.12.033 |
Klimkowicz-Pawlas A, Smreczak B, Ukalska-Jaruga A. 2017. The impact of selected soil organic matter fractions on the PAH accumulation in the agricultural soils from areas of different anthropopressure[J]. Environmental Science and Pollution Research, 24(12): 10955-10965. DOI:10.1007/s11356-016-6610-8 |
Koltowski M, Hiber I, Bucheli T, et al. 2016. Effect of activated carbon and biochars on the bioavailability of polycyclic aromatic hydrocarbons in different industrially contaminated soils[J]. Environmental Science and Pollution Research, 23(11): 11058-11068. DOI:10.1007/s11356-016-6196-1 |
Kuppusamy S, Palanisami T, Megharaj M, et al. 2016. In-situ remediation approaches for the management of contaminated sites: a comprehensive overview[J]. Reviews of Environment Contamination and Toxicology, 236: 1-115. |
刘文静, 李广坡, 倪进治. 2020. 土壤有机质组分中多环芳烃分配特征和生态风险[J]. 中国环境科学, 40(4): 1620-1627. DOI:10.3969/j.issn.1000-6923.2020.04.029 |
Ling W T, Zeng Y C, Gao Y Z, et al. 2010. Availability of polycyclic aromatic hydrocarbons in aging soils[J]. Journal of Soils and Sediments, 10(5): 799-807. DOI:10.1007/s11368-010-0187-5 |
Luo L, Lin S, Huang H, et al. 2012. Relationships between aging of PAHs and soil properties[J]. Environmental Pollution, 170: 177-182. DOI:10.1016/j.envpol.2012.07.003 |
吕正勇, 杨兴伦, 王芳, 等. 2011. 温和溶剂提取预测土壤中多环芳烃的生物有效性[J]. 环境科学, 32(8): 2462-2469. |
Maliszewska-Kordybach B, Smreczak B, Klimkowicz-Pawlas A. 2009. Concentrations, sources, and spatial distribution of individual polycyclic aromatic hydrocarbons (PAHs) in agricultural soils in the Eastern part of the EU: Poland as a case study[J]. Science of the Total Environment, 407: 3746-3753. DOI:10.1016/j.scitotenv.2009.01.010 |
Nam K, Rodriguez W, Kukor J J. 2001. Enhanced degradation of polycyclic aromatic hydrocarbons by biodegradation combined with a modified Fenton reaction[J]. Chemosphere, 45(1): 11-20. DOI:10.1016/S0045-6535(01)00051-0 |
Ni J, Luo Y, Wei R, et al. 2008. Distribution patterns of polycyclic aromatic hydrocarbons among different organic carbon fractions of polluted agricultural soils[J]. Geoderma, 146(1/2): 277-282. |
倪进治, 骆永明, 魏然, 等. 2007. 长江三角洲地区土壤环境质量与修复研究Ⅳ.多环芳烃在土壤不同有机质组分中分配特征的研究[J]. 土壤学报, 44(5): 817-822. DOI:10.3321/j.issn:0564-3929.2007.05.007 |
Oleszczuk P, Hale S, Lehmann J, et al. 2012. Activated carbon and biochar amendments decrease pore-water concentrations of polycyclic aromatic hydrocarbons (PAHs) in sewage sludge[J]. Bioresource Technology, 111: 84-91. DOI:10.1016/j.biortech.2012.02.030 |
Ololade I A, Adetiba B O, Oloye F F, et al. 2016. Bioavailability of polycyclic aromatic hydrocarbons (PAHs) and environmental risk (ER) assessment: The case of the Ogbese River, Nigeria[J]. Regional Studies in Marine Science, 9: 9-16. |
Pan B, Xing B S, Liu W X, et al. 2006. Distribution of sorbed phenanthrene and pyrene in different humic fractions of soils and importance of humin[J]. Environmental Pollution, 143(1): 24-33. DOI:10.1016/j.envpol.2005.11.009 |
Pignatello J J. 2011. Interactions of anthropogenic organic chemicals with natural organic matter and black carbon in environmental particles[J]. Biophysico-Chemical Processes of Anthropogenic Organic Compounds in Environmental Systems: 1-50. |
Ran Y, Sun K, Yang Y, et al. 2007. Strong sorption of phenanthrene by condensed organic matter in soils and sediments[J]. Environmental Science & Technology, 41(11): 3952-3958. |
Riding M J, Doick K J, Martin F L, et al. 2013. Chemical measures of bioavailability bioaccessibility of PAHs in soil: fundamental to application[J]. Journal of Hazardous Material, 261: 687-700. DOI:10.1016/j.jhazmat.2013.03.033 |
Rostami I, Juhasz A L. 2011. Assessment of persistent organic pollutant (POP) bioavailability and bioaccessibility for human health exposure assessment: a critical review[J]. Critical Reviews in Environmental Science and Technology, 41(7): 623-656. DOI:10.1080/10643380903044178 |
Shi H, Zhu S, Qiao Y, et al. 2018. Characterization and phenanthrene sorption of organic matter fractions isolated from organic and mineral soils[J]. Environmental Science and Pollution Research, 25(16): 15971-15979. DOI:10.1007/s11356-018-1814-8 |
Spycher G, Sollins P, Rose S. 1983. Carbon and nitrogen in the light fraction of a forest soil: vertical distribution and seasonal patterns[J]. Soil Science, 135(2): 79-87. DOI:10.1097/00010694-198302000-00002 |
Sun H W, Yan Q S. 2007. Influence of Fenton oxidation on soil organic matter and its sorption and desorption of pyrene[J]. Journal of Hazardous Materials, 144(1/2): 164-170. |
Tivet F, De Moraes Sá J C, Lal R, et al. 2013. Assessing humification and organic C compounds by laser-induced fluorescence and FTIR spectroscopies under conventional and no-till management in Brazilian Oxisols[J]. Geoderma, 207: 71-81. |
Ukalska-Jaruga A, Debaene G, Smreczak B, et al. 2018. Particle and structure characterization of fulvic acids from agricultural soils[J]. Journal of Soils and Sediments, 18(8): 2833-2843. DOI:10.1007/s11368-018-2008-1 |
Ukalska-Jaruga A, Klimkowicz-Pawlas A, Smreczak B. 2019. Characterization of organic matter fractions in the top layer of soils under different land uses in Central-Eastern Europe[J]. Soil Use and Management, 35(4): 595-606. DOI:10.1111/sum.12514 |
Ukalska-Jaruga A, Lewińska K, Mammadov E, et al. 2020. Residues of persistent organic pollutants (POPs) in agricultural soils adjacent to historical sources of their storage and distribution-The case study of Azerbaijan[J]. Molecules, 25(8): 1815. DOI:10.3390/molecules25081815 |
Ukalska-Jaruga A, Smreczak B, Klimkowicz-Pawlas A. 2019. Soil organic matter composition as a factor affecting the accumulation of polycyclic aromatic hydrocarbons[J]. Journal of Soils and Sediments, 19(4): 1890-1900. DOI:10.1007/s11368-018-2214-x |
US EPA. 2007. Method 8270D: Semivolatile organic compounds by gas chromatography/mass spectrometer(GC/MS)[S]. Washington DC
|
王培俊, 刘俐, 李发生, 等. 2011. 西南某焦化场地土壤中典型污染物的特征分布[J]. 煤炭学报, 36(9): 1587-1592. |
夏天翔, 潘吉秀, 姜林, 等. 2015. 应用过硫酸盐氧化法预测焦化厂土壤中PAHs的生物有效性[J]. 环境科学研究, 28(7): 1099-1106. |
熊毅. 1985. 土壤胶体(第二册)[M]. 北京: 科学出版社, 40-67.
|
Xu J, Yuan K. 1995. Studies on organo-mineral complexes in soil Ⅶ. formation and binding characteristics of soil combined humus[J]. Acta Pedologica Sinica, 32: 158-165. |
Yang W, Lampert D, Zhao N, et al. 2012. Link between black carbon and resistant desorption of PAHs on soil and sediment[J]. Journal of Soils and Sediments, 12(5): 713-723. DOI:10.1007/s11368-012-0494-0 |
Yang Y, Ligouis B, Pies C, et al. 2008. Occurrence of coal and coal-derived particle-bound polycyclic aromatic hydrocarbons (PAHs) in a river floodplain soil[J]. Environmental Pollution, 151(1): 121-129. DOI:10.1016/j.envpol.2007.02.020 |
Yang Y, Zhang N, Xue M, et al. 2010. Impact of soil organic matter on the distribution of polycyclic aromatic hydrocarbons (PAHs) in soils[J]. Environmental Pollution, 158(6): 2170-2174. DOI:10.1016/j.envpol.2010.02.019 |
Zhang P, Chen P, Chen Y. 2017. Polycyclic aromatic hydrocarbons contamination in surface soil of China: A review[J]. Science of the Total Environment, 605: 1011-1020. |
邹祎萍, 娄满君, 么琳颖, 等. 2019. 燃煤电厂土壤中多环芳烃污染特征及其源解析[J]. 矿业科学学报, 4(2): 170-178. |
 2021, Vol. 41
2021, Vol. 41


