2, 4, 6-三氯苯酚是一种无色或浅黄色晶体, 可溶于水、醚和醇等溶剂, 具有强烈刺激性气味, 被广泛用作重要农药合成中的中间体(Gaya et al., 2010), 并且经常在废水、地表水、地下水和废水处理厂的过量污泥中被检测到(Song et al., 2019).它被认为是水生环境的主要污染物, 并且由于其有毒和顽强的特性而可能对人类健康造成巨大伤害(Zhang et al., 2018;Xu et al., 2018), 因此, 引起了广泛的关注(Song et al., 2019).
废水中2, 4, 6-三氯苯酚的存在是一个亟待解决的问题, 其中厌氧生物降解被认为是消除污染物的经济和生态友好的方法.厌氧生物降解2, 4, 6-TCP主要依靠还原脱氯这一途径, 即在厌氧或缺氧的环境下, 脱卤呼吸菌通过呼吸作用, 以有机物碳源或氢气为电子供体, 以2, 4, 6-TCP为呼吸链末端电子受体, 得到电子的同时脱去苯环上氯取代基并产生能量供微生物自身生长的过程(Deweerd et al., 1986).目前, 许多研究者从被污染的土壤、河流底泥和水体中分离、富集可以厌氧降解2, 4, 6-TCP的菌株, 或对厌氧反应器活性污泥进行驯化使之产生对2, 4, 6-TCP的还原脱氯能力, 均取得很好的研究成果.Song等(2015)驯化的厌氧活性污泥可在乳酸钠作为电子供体时, 对2, 4, 6-TCP进行还原脱氯.驯化的污泥最快可在9~24 h内将初始浓度为40~80 μmol · L-1的2, 4, 6-TCP完全转化为4-氯酚和苯酚.Li等(2013)从受氯代脂肪烃污染的沉积物中富集了具有对2, 4, 6-TCP还原脱氯能力的培养物, 该培养物以氢气为电子供体, 以酵母浸出物为碳源, 在15 d内将初始浓度为100 μmol · L-1的2, 4, 6-TCP脱氯为4-氯酚.
然而, 由于污染物的化学和生物稳定性、生物可利用浓度低, 以及在许多情况下本地有机卤化物呼吸菌的数量、多样性和活性低, 在厌氧条件下对卤化物进行原位微生物还原脱氯是一个缓慢的过程(Cho et al., 2003;Fagervold et al., 2005;Kjellerup et al., 2014), 这是制约生物污染修复的又一瓶颈问题, 而材料学的发展丰富了生物载体的选择, 为以上问题的解决提供了思路.其中电气石由于其具有自发微电场的特性而备受关注(Wang et al., 2020), 这种微电场的能量可以刺激微生物并提高代谢过程中的生物酶的活性, 加速微生物增殖及底物降解, 对生物法处理污染废水具有强化促进作用(邱乙伦, 2018).除此之外, 电气石还可使周围的水分子持续电解生成氢离子和氢氧根, 其中氢离子会从电气石电极之间的电流中得到电子生成微量氢气, 具有很好的应用前景.因此, 本研究拟通过制备电气石复合功能载体材料, 考察其对2, 4, 6-TCP厌氧生物还原脱氯过程的强化效果, 并研究其作为2, 4, 6-TCP厌氧生物还原脱氯过程电子供体的可能性.
2 材料和方法(Materials and methods) 2.1 菌源和培养基污泥来源于国内卤代有机物污染场地的土壤和河底沉积物, 将100 g污泥经过筛网除去较大杂质后与500 mL自来水混合配制成泥水混合物.
以污泥为菌源的驯化阶段采用表 1中的液体驯化培养基, 培养基依靠PBS缓冲体系调节pH为7.2左右.以驯化培养物为接种源的富集阶段采用去离子水配制表 1中的液体富集培养基, 培养基依靠PBS缓冲体系调节pH为7.2左右.
| 表 1 液体培养基成分 Table 1 Liquid media components |
矿质元素1基础液配方为:0.5 mg · L-1 MnCl2 · 4H2O、0.5 mg · L-1 NiCl2 · 6H2O、0.5 mg · L-1 ZnCl2、0.5 mg · L-1 Na2MoO4 · 2 H2O、2.5 mg · L-1 CoCl2 · 6H2O、0.5 mg · L-1 H3BO3;矿质元素2基础液配方为:0.5 mg · L-1 NH4VO3、10 mg · L-1 (NaPO3)16、2.5 mg · L-1 KI.
2.2 方法 2.2.1 厌氧还原脱氯菌的驯化和富集配制液体驯化培养基, 将100 g作为菌源的泥土经过筛网除去较大杂质后与500 mL自来水混合配制成泥水混合物.将100 mL泥水混合物与500 mL培养液混合均匀, 每60 mL分装至100 mL血清瓶中, 通入高纯氮气10 min进行除氧处理, 完成后将血清瓶密封.利用微量注射器向密封血清瓶中注入200 μmol · L-1 2, 4, 6-TCP, 摇匀后移置(30±1) ℃恒温培养箱中.培养过程中每24 h取样一次, 利用液相色谱仪检测其中2, 4, 6-TCP及其脱氯中间产物2, 4-二氯酚(2, 4-DCP)、终产物4-氯酚(4-CP)的浓度, 当2, 4, 6-TCP开始降解并检测到脱氯产物, 以混合培养物为接种源, 5%的接种量接种至新鲜液体驯化培养基中, 并补充2, 4, 6-TCP, 每次转接至少设置3个平行培养物.重复以上步骤进行连续多轮驯化培养, 使培养物对2, 4, 6-TCP的还原脱氯能力逐渐增强, 同时使培养物中泥土的含量逐渐减少直至完全消失.
配制液体富集培养基, 培养基依靠PBS缓冲体系调节pH为7.2左右.配置完成后向其中加入0.1 mL · L-1刃天青作为氧气指示剂, 每60 mL培养液分装至100 mL血清瓶中, 通入高纯氮气20 min排出瓶内空气, 血清瓶经密封后置于高压蒸汽灭菌锅中, 在121 ℃下灭菌30 min.向冷却的培养基中注入0.2 mmol · L-1 Na2S作为除氧剂, 可以看到瓶内液体由淡蓝色先变为淡粉色, 混合均匀后最终保持无色, 表示培养基处于严格无氧状态.依次向血清瓶中注入5 mmol · L-1乙酸钠、1 mL · L-1维生素和100 μmol · L-1 2, 4, 6-三氯酚(TCP), 以最新的驯化培养物为接种源, 按照5%的比例接种驯化培养物, 最后注入10 mL氢气, 移至30 ℃恒温箱中培养, 定期检测其中2, 4, 6-TCP、2, 4-DCP、4-CP的浓度.当2, 4, 6-TCP开始降解并检测到脱氯产物, 再将培养物按5%的接种量接种至新鲜液体富集培养基中, 并补充2, 4, 6-TCP, 每次转接至少设置3个平行培养物.
2.2.2 电气石复合功能生物载体的制备以800目铁电气石粉作为功能材料, 网状聚氨酯泡沫作为载体, 水性聚氨酯为粘合剂, 取网状聚氨酯泡沫置于烧杯, 加入适量水性聚氨酯, 直至浸泡至内部吸满液体.取出网状聚氨酯泡沫并挤压出多余的水性聚氨酯后, 将其与过量电气石粉末混合, 反复揉搓使内外沾满粉末.随后用吹风机慢风吹至网格通透, 并在80 ℃的烘箱内干燥.烘干后用去离子水洗去未固定的浮粉, 并在80 ℃的烘箱内干燥, 从而得到了电气石复合功能生物载体.
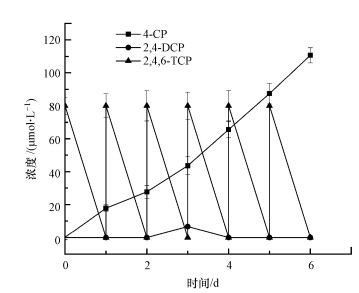
电气石复合功能生物载体的表观密度计算方法见式(1).由式(1)计算得到复合功能生物载体的表观密度为0.143 g · cm-3.
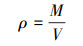
|
(1) |
式中, ρ为复合功能生物载体的表观密度(g · cm-3);M为复合功能生物载体的质量(g);V为复合功能生物载体的体积(cm3).
2.2.3 电气石复合功能生物载体对2, 4, 6-TCP脱氯的强化方法按照表 1展示的成分配制液体培养基, 100 mL血清瓶作为实验装置, 每瓶60 mL液体培养基作为微生物培养液, 随后将10颗(约1.45 g)电气石复合功能生物载体投入到血清瓶内.向瓶中通入高纯氮气10 min排出瓶内空气, 然后将血清瓶密封.向每个培养物中依次加入1 mL · L-1维生素、5 mmol · L-1乙酸钠和80 μmol · L-1 2, 4, 6-TCP.共设置3个培养物(分别命名为T1、T2、T3), 其中培养物T1按5%的比例接种最新的传代培养物作为空白对照, 培养物T2按5%的比例接种最新的传代培养物并加入复合功能生物载体, 培养物T3不接种, 并加入复合功能生物载体作为对照.最后将血清瓶置于培养箱中恒温30 ℃培养, 并定期采用液相色谱检测其中2, 4, 6-TCP、2, 4-DCP、4-CP的浓度.
2.2.4 微生物群落分析方法① 细菌富集液预处理及DNA提取.将需要测定微生物群落结构的培养物在10000 r · min-1转速下离心10 min后抽取上清液, 保留离心管底部沉淀物.对样品进行DNA提取并利用1%琼脂糖凝胶电泳检测抽提的基因组DNA.
② 样品PCR扩增.成功提取富集培养物的DNA后, 利用多样性通用正向引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和反向引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)对样品DNA进行PCR扩增, 反应体系组成成分为5×FastPlu Buffer 4 μL、2.5 mmol · L-1 dNTPs 2 μL、Forward Primer(5 μmol · L-1) 0.8 μL、Reverse Priner(5 μmol · L-1) 0.8 μL、FastPfu Polymerase 0.4 μL、BSA 0.2 μL、Temlate DNA 10 ng, 以ddH2O补充至20 μL.
反应体系建立完成后, 以ABI GeneAmp 9700型PCR仪进行扩增, 反应参数为:95 ℃预变性3 min, 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s, 经过27个循环后, 72 ℃延伸10 min.
将PCR扩增产物以2%琼脂糖凝胶电泳检测, 产生了清晰独立、大小正确的条带, 说明产物浓度合适, 可以进行后续实验.
③ 产物纯化回收与定量.使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物, 并用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)对PCR产物进行检测定量.
④ 测序与分析.通过Illumina平台完成测序过程, 对结果进行OTU聚类分析和物种分类学分析, 并基于OUT进行物种多样性指数分析等.
3 结果与讨论(Results and discussion) 3.1 2, 4, 6-TCP厌氧还原脱氯菌群的驯化和富集补料分批培养过程中2, 4, 6-TCP及其脱氯产物浓度变化如图 1所示.可以看出, 降解周期正在逐步缩短, 补充的2, 4, 6-TCP均完全脱氯, 并且周期最终维持在6 d, 此时营养物质及生长空间充足, 微生物增长处于对数期, 培养物中厌氧脱氯菌的活性非常高.同时采用直接注入氢气作为电子供体, 采用更简单的乙酸钠作为共代谢碳源的模式, 可使培养物中脱卤呼吸菌占据优势并抑制其它微生物(发酵菌等)的大量生长, 实现脱氯核心功能菌的富集目的.
 |
| 图 1 富集脱卤呼吸菌过程中培养物的脱氯情况 Fig. 1 Dechlorination in the enrichment of dehalogenated respiring bacteria |
为了探究复合生物载体的强化作用, 实验共设置3个培养物(分别命名为T1、T2、T3), 其中T2为实验组, 按5%的比例接种最新的传代培养物, 并投入1.45 g电气石复合功能生物载体, 培养过程中仅加入乙酸钠作为碳源, 不加氢气.培养物T1和培养物T3为对照组, 培养物T1中以乙酸钠为碳源, 加氢的条件下按5%的比例接种了最新的传代培养物, 培养物T3仅投入了电气石复合功能生物载体.
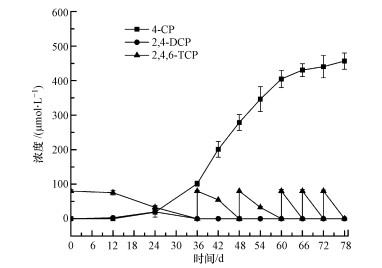
图 2a为对照组T1组脱氯效果图.从图中可知2, 4, 6-TCP加入后, 第1~4 d内2, 4, 6-TCP浓度出现缓慢下降趋势, 同时2, 4-DCP浓度缓慢上升, 而从第5 d开始2, 4, 6-TCP浓度出现大幅下降的现象, 并且4-CP浓度大幅度升高.图 2c为对照组T3组脱氯效果图.图中2, 4, 6-TCP在投入复合功能生物载体后浓度骤降, 反应6 h之后浓度始终保持在13 μmol · L-1左右, 并未出现明显变化, 而2, 4-DCP、4-CP浓度始终为0.
 |
| 图 2 不同体系脱氯效果对比图(a. T1, b. T2, c.T3) Fig. 2 Comparison diagram of dechlorination effect of different systems (a. T1, b. T2, c.T3) |
图 2b为实验组T2脱氯效果图.图中显示培养物T2中的2, 4, 6-TCP在反应前6 h内浓度骤降, 在反应进行6 h后浓度已经降至10 μmol · L-1, 此时2, 4-DCP与4-CP浓度并没有发生明显变化, 在此后一段时间内2, 4, 6-TCP浓度缓慢下降, 在第24 h时浓度降至0, 而2, 4-DCP浓度保持稳定, 4-CP浓度在第12 h起出现了较大幅度的提升, 达到了22 μmol · L-1.与图 2c进行对比分析, 认为反应前期2, 4, 6-TCP浓度骤降是因为污染物被电气石复合功能生物载体大量吸附, 而随后T2中2, 4, 6-TCP浓度的持续性下降和4-CP浓度的上升证明了体系中发生了2, 4, 6-TCP的生物脱氯过程.与图 2a相比, 降解周期由6 d缩短至1 d, 反应结束时脱氯产物4-CP浓度的大幅度下降, 表明脱氯降解速度明显提高, 电气石复合功能生物载体对于2, 4, 6-TCP生物厌氧还原脱氯具有显著的强化效能.且T2体系在不加入外源电子供体的情况下高效稳定运行, 表明2, 4, 6-TCP的脱氯降解并不仅仅因为电气石复合功能生物载体的物理化学作用, 更是因为电气石复合功能生物载体为混合菌群的提供了电子, 促进了2, 4, 6-TCP的厌氧生物脱氯.
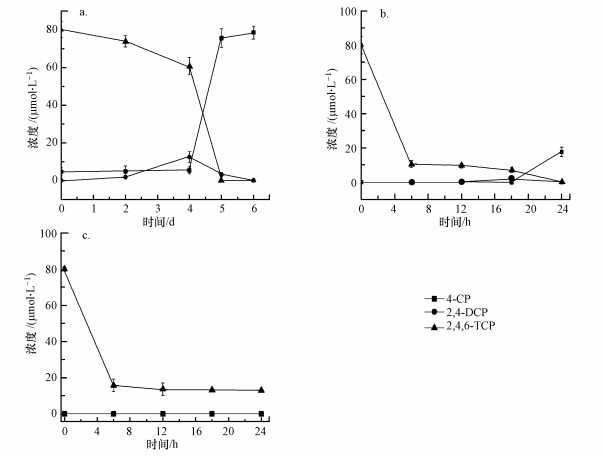
图 3为电气石复合功能生物载体与厌氧脱卤菌连续实验6个周期的脱氯效果图.从图中可以看到, 6个周期都保持着高效的2, 4, 6-TCP脱氯效果, 去除率都达到了100%, 4-CP浓度慢慢上升, 说明体系中生物降解反应的发生.图 3证明了电气石复合功能生物载体对厌氧脱卤菌的强化作用具有长效性.
 |
| 图 3 实验组T2长效运行效果图 Fig. 3 Group T2 long-running effect diagram |
原始网状聚氨酯泡沫, 制备得到的负载电气石复合功能生物载体及反应后电气石复合功能生物载体的扫描电镜照片如图 4所示.图 4a为原始网状聚氨酯泡沫的扫描电镜图.可以看到, 未负载任何物质的原始网状聚氨酯泡沫纤维表面光滑, 网孔清晰且边缘锐利.而图 4b为负载电气石复合功能生物载体的扫描电镜图.负载了电气石聚氨酯泡沫纤维表面因粘合了粉末而变得粗糙, 比表面积增大, 有利于微生物挂膜.图 4c为反应后电气石复合功能生物载体的扫描电镜图.对比反应前的电气石复合功能生物载体的扫描电镜图, 可以发现表层厚度明显增加, 可见生物富集的结果.
 |
| 图 4 功能生物载体扫描电镜图 Fig. 4 Scanning electron microscopy of functional biological carriers |
为了更好地探究筛分培养的细菌富集液的微生物群落结构和功能潜力, 将3个样品(G1、G2、G3)的序列数据与生物信息数据库进行比对, 进一步在属水平上分析微生物群落组成情况, 其中G1为接种源菌液、G2为富集菌液, G3为功能生物载体生物膜样品.对样品进行测序共鉴定到20个菌属, 其中19个为两样品的共有菌属, 群落中相对丰度大于0.1%的菌属(共14个)及其所占比例如图 5所示.假单胞菌属(Pseudomonas)在3个样品中都占据主导地位, 其相对丰度在G1、G2和G3中分别达到61.26%、92.26%和95.12%.而Magnetospirillum、norank_f_Paludibacteraceae、Sphaerochaeta、Desulfitobacterium菌属在G1样本中原本较为突出, 所占比例共近30%, 但经过传代培养后均被削弱, 丰度大幅下降, 其中菌属Magnetospirillum丰度下降最为明显, 在G3样本中几乎全部消失, 可以说明传代培养条件的设置对假单胞菌最为有利, 并且有效地抑制了其他菌属的生长, 而生物载体的强化作用进一步提高了假单胞菌的占比.
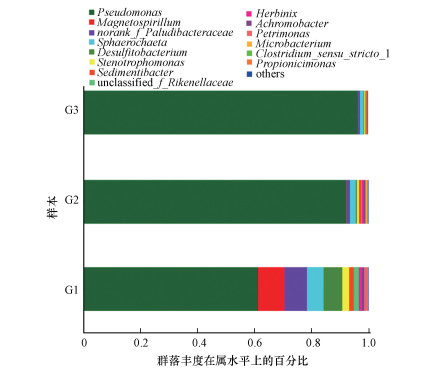 |
| 图 5 G1, G2和G3在属水平上的群落组成 Fig. 5 Community composition at genus level of samples G1, G2, and G3 |
很明显, 假单胞菌属为2, 4, 6-TCP厌氧还原脱氯富集培养物中的优势菌属.假单胞菌属是自然界中分布最广泛的微生物之一, 在多种环境中都曾被发现.由于生存环境的多样性, 假单胞菌属所包含的菌种浩繁, 生长特性各不相同, 代谢功能多而庞杂, 以上特点造就了假单胞菌属巨大的研究价值和应用潜力.假单胞菌属通常具有较强的有毒有机物耐受能力(Xu et al., 2015), 在多种有机污染场地均可存活并逐渐进化出降解该种污染物的独特能力, 其在污染修复和污水处理领域有着广泛的应用.有很多研究报道假单胞菌属可以脱卤降解某些典型卤代有机物, 包括4-氯苯甲酸(Banta et al., 2007)、3-氯苯甲酸酯(Sahasrabudhe et al., 1988)、多氯联苯(任何军等, 2009)、五氯苯酚(Shah et al., 2003)、四氯化碳(刘帅, 2019)等.
经过以上分析, 可以在功能上认为假单胞菌属为潜在厌氧还原脱氯菌, 其对2, 4, 6-TCP的脱氯降解起主要作用.由于在富集培养的过程中, 选择乙酸钠作为碳源, 直接注入氢气作为电子供体, 该种简单的营养结构有效抑制了具有较宽生态幅微生物(如发酵菌)的生长, 而生物载体的强化作用使假单胞菌属愈发占据主导地位.使从样本群落结构可以看出, 假单胞菌属对2, 4, 6-三氯酚具有稳定且高效的还原脱氯能力.
4 结论(Conclusions)1) 驯化富集了具有稳定厌氧还原脱氯2, 4, 6-三氯酚能力的混合菌群, 在添加乙酸钠(5 mmol · L-1)和氢气(10 mL)情况下, 在6 d内将2, 4, 6-三氯酚还原脱卤为4-氯酚.
2) 电气石负载聚氨酯泡沫可在无外加氢气的情况下, 强化2, 4, 6-TCP的厌氧生物还原效能, 还原脱卤效能稳定, 且较未负载的情况效能提升了6倍.
3) 扫描电镜证实了电气石负载聚氨酯泡沫作为生物载体可显著富集微生物, 16S rRNA高通量测序表明微生物菌群以Pseudomonas为主导, 电气石负载聚氨酯泡沫作为生物载体, 显著提升了Pseudomonas的丰度.
Banta G, Kahlon R S. 2007. Dehalogenation of 4-Chlorobenzoic Acid by Pseudomonas isolates[J]. Indian Journal of Microbiology, 47(2): 139-143. DOI:10.1007/s12088-007-0027-5 |
Cho Y, Sokol R C, Frohnhoefer R C, et al. 2003. Reductive dechlorination of polychlorinated biphenyls:Threshold concentration and dechlorination kinetics of individual congeners in aroclor 1248[J]. Environmental Science & Technology, 37(24): 5651-5656. |
Deweerd K A, Suflita J M, Linkfield T, et al. 1986. The relationship between reductive dehalogenation and other aryl substituent removal reactions catalyzed by anaerobes[J]. FEMS Microbiology Letters, 38(6): 331-339. DOI:10.1111/j.1574-6968.1986.tb01745.x |
Fagervold S K, Watts J, May H D, et al. 2005. Sequential reductive dechlorination of meta-chlorinated polychlorinated biphenyl congeners in sediment microcosms by two different Chloroflexi phylotypes[J]. Applied and Environmental Microbiology, 71(12): 8085-8090. DOI:10.1128/AEM.71.12.8085-8090.2005 |
Gaya U I, Abdullah A H, Hussein M Z, et al. 2010. Photocatalytic removal of 2, 4, 6-trichlorophenol from water exploiting commercial ZnO powder[J]. Desalination, 263(1): 176-182. |
Kjellerup B V, Naff C, Edwards S J, et al. 2014. Effects of activated carbon on reductive dechlorination of PCBs by organohalide respiring bacteria indigenous to sediments[J]. Water Research, 52: 1-10. DOI:10.1016/j.watres.2013.12.030 |
刘帅. 2019.氯代烷烃在垃圾填埋场覆盖层中的迁移转化及降解机制研究[D].重庆: 重庆理工大学
|
Li Z, Suzuki D, Zhang C, et al. 2013. Involvement of Dehalobacter strains in the anaerobic dechlorination of 2, 4, 6-trichlorophenol[J]. Journal of Bioscience and Bioengineering, 116(5): 602-609. DOI:10.1016/j.jbiosc.2013.05.009 |
邱乙伦. 2018.电气石强化好氧反硝化菌Pseudomonas sp.T13脱氮效能及机制研究[D].哈尔滨: 哈尔滨工业大学
|
任何军, 高松, 张玉玲, 等. 2009. 多氯联苯降解菌Pseudomonas sp. DN2的分离鉴定及其降解特性研究[J]. 环境科学, 30(3): 857-863. |
Sahasrabudhe S R, Modi A J, Modi V V. 1988. Dehalogenation of 3-chlorobenzoate by immobilized pseudomonas sp. b-13 cells[J]. Biotechnology and Bioengineering, 31(8): 889-893. DOI:10.1002/bit.260310818 |
Shah S, Thakur I S. 2003. Enzymatic dehalogenation of pentachlorophenol by Pseudomonas fluorescens of the microbial community from tannery effluent[J]. Current Microbiology, 47(1): 65-70. DOI:10.1007/s00284-002-3927-y |
Song J, Li L, Sheng F, et al. 2015. 2, 4, 6-Trichlorophenol mineralization promoted by anaerobic reductive dechlorination of acclimated sludge and extracellular respiration dechlorination pathway[J]. Environmental Science, 36(10). |
Song J, Zhao Q, Guo J, et al. 2019. The microbial community responsible for dechlorination and benzene ring opening during anaerobic degradation of 2, 4, 6-trichlorophenol[J]. Science of the Total Environment, 651: 1368-1376. DOI:10.1016/j.scitotenv.2018.09.300 |
Song J, Zhao Q, Guo J, et al. 2019. The microbial community responsible for dechlorination and benzene ring opening during anaerobic degradation of 2, 4, 6-trichlorophenol[J]. Science of the Total Environment, 651: 1368-1376. DOI:10.1016/j.scitotenv.2018.09.300 |
Wang C, Chen Q, Guo T, et al. 2020. Environmental effects and enhancement mechanism of graphene/tourmaline composites[J]. Journal of Cleaner Production, 262: 121313. DOI:10.1016/j.jclepro.2020.121313 |
Xu H, Tong N, Huang S, et al. 2018. Degradation of 2, 4, 6-trichlorophenol and determination of bacterial community structure by micro-electrical stimulation with or without external organic carbon source[J]. Bioresource Technology, 263: 266-272. DOI:10.1016/j.biortech.2018.05.015 |
Xu J, Liu H, Liu J, et al. 2015. Isolation and characterization of Pseudomonas aeruginosa strain SJTD-2 for degrading long-chain n-alkanes and crude oil[J]. Acta Microbiologica Sinica, 55(6): 755-763. |
Zhang Y, Gupta S, Ilstad-Minnihan A, et al. 2018. Interleukin-1 in monocyte activation phenotypes in systemic juvenile idiopathic arthritis:Observations from a clinical trial of rilonacept, an interleukin-1 inhibitor[J]. Clinical Immunology, 194: 9-18. |
 2020, Vol. 40
2020, Vol. 40


