2. 中南林业科技大学稻米品质安全控制湖南省工程实验室, 长沙 410004
2. Hunan Engineering Laboratory for Control of Rice Quality and Safety, Central South University of Forestry and Technology, Changsha 410004
近年来, 由于工业活动和农业废弃物的随意处置, 造成大量农田土壤中重金属含量超标(靳琪等, 2018;韩廿等, 2019), 土壤污染形势十分严峻.2014年4月, 国家环保部、国土资源部公布的全国土壤污染状况调查公报显示, 镉(Cd)、砷(As)点位超标率分别达到7%和2.7%.Cd、As均为极具生物毒性的环境污染元素, 其在耕地土壤中的累积不仅会影响耕地土壤生态功能, 还可通过耕地土壤-植物系统危害作物生长, 最终危害人类健康(Chaney et al., 2004;陈英旭, 2005;陈朗等, 2008;崔岩山等, 2010).因此, 选择合适的方法修复Cd、As污染土壤成为亟待解决的环境问题.
研究发现, 一些分离自重金属污染土壤、对多种重金属具有较高耐受性的植物根际促生菌(Plant growth-promoting rhizobacteria, PGPR)能够促进重金属污染土壤中修复植物的生长, 提高植物修复效率(韦革宏等, 2010;Long et al., 2017).微生物与有机肥混为一体制成药肥两用的微生物肥料, 兼具微生物肥料和有机肥料的优点, 在提高农田生产力和修复重金属污染方面表现出非常优越的性质(Li et al., 2014;Ansari et al., 2017).陈可等(2018)研究表明, 在博落回根际接种荧光假单胞菌(Pseudomonas fluorescens)、绿针假单胞菌橙色亚种(Pseudomonas chlororaphis sub sp. aurantiaca), 对博落回的株高、植株生物量、叶绿素含量有促进作用;刘莉华等(2013)利用3株龙葵内生菌混菌处理后, 植株地上和地下部Cd富集量分别增加109.53%和83.01%.此外, PGPR在特殊极端环境下的植物修复方面也表现出巨大潜力, Meena等(2017)研究发现, 一株具有多种植物促生属性的Brevibacterium frigoritolerans SMA23在10 ℃低温下对小麦生长有积极影响;Kacar等(2002)利用白腐真菌(Phanerochaete chrysosporium)对Cd2+进行低温吸附, 发现其生物吸附能力无明显改变, 说明Phanerochaete chrysosporium在低温下的重金属修复方面具有较好的应用前景.
一般情况下, 长江中下游部分农业区土地在秋收之后直至第2年播种前这段时间被大量闲置, 冬闲田面积曾达到耕地总面积的45%(翟孟源等, 2012).由于长江中下游地区又是我国工业生产基地, 土壤重金属污染与冬闲田分布区域有高度重叠性, 因此, 选择一种既能治理重金属污染, 又能有效利用冬闲耕地的经济作物来修复重金属污染农田, 已成为当前重要选择.巨菌草(Pennisetum sinese)是我国学者于1983年引进的优势禾本科狼尾属植物.有研究表明, 黄壤中生长的巨菌草具有较大的Cd富集系数和转移系数(王丽萍等, 2015);也有研究表明, 即使在3 ℃低温条件下, 巨菌草也能生长, 存活率可达97%(林兴生等, 2013).
综合上述研究可知, 一方面, PGPR可以促进植物生长, 提高植物对重金属污染土壤的修复效率, 而且部分PGPR在低温条件下仍能保持其活性;另一方面, 巨菌草生物量大, 是一种经济型的能源植物, 且具备一定的耐低温能力, 适合在南方冬季种植.迄今, 于南方冬闲时期, 利用微生物与巨菌草联合修复镉砷复合污染土壤的研究鲜见报道.基于此, 本文拟通过研究3株不同根际促生菌及其与肥料配施对镉砷复合污染土壤中巨菌草迁移累积Cd、As的影响, 以期为农田镉砷复合污染土壤修复提供基础数据与理论依据.
2 材料与方法(Materials and methods) 2.1 试验地点与材料供试土壤与试验条件:供试土壤采自湖南省湘潭县旱地Cd污染土壤表层土(112°80.56′E, 28°02.47′N), 土壤全Cd含量为3.01 mg·kg-1, 全As含量为24.55 mg·kg-1.土样在阴凉通风处风干, 研磨后过筛保存.盆栽试验地点位于湖南省长沙市中南林业科技大学实验基地(112°98.97′E, 28°13.61′N), 该地属亚热带季风气候.根据湖南省统计年鉴, 长沙市2017—2019年10、11、12月的月平均气温分别为17.97、12.10、7.67 ℃.
供试菌株:3株真菌菌株由实验室提供, 分离自中南林业科技大学校园内生科楼旁的一株植物根际土壤(土壤全Cd含量为3.05 mg·kg-1, 全As含量为63.35 mg·kg-1, 属于镉砷复合污染土壤), 分别命名为M1、M2、M3.菌株的促生能力见表 1.
| 表 1 菌株的促生能力检测指标 Table 1 Indicators of bacterial growth promoting ability |
供试植物和肥料:巨菌草购于江西稻草人农业园;供试肥料为实验室研制, 由农家纯干鸡粪+微量元素构成, 其中, 鸡粪购于旺德福肥料企业直营店, 鸡粪中有机质占45%, 粗蛋白素占30%, 氮、磷、钾占6%左右, 微量元素包括钙、镁等.
2.2 试验设计 2.2.1 菌株的活化与计数将4 ℃低温保存的不同菌株分别接种于马铃薯葡萄糖琼脂(PDA)培养基上, 于28 ℃生化培养箱下培养3~5 d;再挑取菌丝至含100 mL液体培养基的250 mL锥形瓶中, 放于摇床中于28 ℃、150 r·min-1条件下持续培养3~5 d;过滤后在5000 r·min-1的条件下离心10 min, 弃去上清液, 无菌水洗涤菌体, 离心, 再次弃去上清液, 如此重复洗涤3次, 收集菌体, 制备菌悬液并用血球计数板计数, 使菌悬液的浓度为2×108 CFU·mL-1, 最后于4 ℃冰箱保存备用.
2.2.2 菌株的鉴定分子生物学鉴定:18S rRNA基因PCR扩增测序, 采用真菌通用引物ITS1 (TCCGTAGGTGAACCTGCGG)和ITS4 (TCCTCCG CTTATTGATATGC)(陈文艳等, 2020).由基源(长沙)生物科技有限公司完成菌株M1、M2、M3的分子生物学鉴定.PCR扩增体系包括PCR Mix酶25 μL, 模板1 μL, 10 μmol·L-1 ITS1、ITS4引物各2 μL, ddH2O 20 μL.反应条件:98 ℃预变性2 min;98 ℃变性10 s, 54 ℃退火10 s, 72 ℃延伸10 s, 35个循环;72 ℃延伸5 min. PCR产物经10 g·L-1琼脂糖凝胶电泳检测后进行基因测序, 测序结果利用BLAST在GenBank基因库中进行同源性比较并进行鉴定.利用MEGA 7进行基因序列比对与系统发育树构建(采取Neighbor-Joining法, Bootstrap value为1000).
2.2.3 温度对菌株生长的影响将已筛选出来的菌株制成相同浓度的孢子悬液, 各移取2 mL悬液于100 mL的马铃薯葡萄糖肉汤(PDB)培养基, 于振荡培养箱中培养.根据盆栽试验开展时可能的室外温度, 设置7、15、25 ℃ 3个温度, 150 r·min-1下培养7 d, 离心收集不同培养时间的菌体, 用无菌水洗涤3次, 80 ℃烘干至恒质量.每24 h取样1次, 绘制生长曲线.
2.2.4 盆栽试验设计采用无盖圆柱形塑料盆(内径200 mm, 高290 mm)种植巨菌草, 每盆装自然风干且混合均匀的土壤2.0 kg.设置8个处理:CK处理, 不施加菌株及肥料;F处理, 单独施加肥料;M1、M2、M3处理, 分别代表单独施加菌株M1、M2、M3;M1+F、M2+F、M3+F处理, 分别代表菌株M1、M2、M3与肥料配施.每个处理设3个重复, 共24盆, 每盆种植3株巨菌草.试验时间为2019年10月20日—2019年12月21日, 按先施加肥料, 再扦插幼苗, 然后施菌的程序进行.其中, 肥料的施加量为2 g·株-1, 菌株以10 mL·株-1菌悬液的形式一次性施入根际土壤中.单独施菌时, 菌悬液施加浓度为2×108 CFU·mL-1, 当菌株与肥料配施时, 菌悬液施加浓度为2×107 CFU·g-1.自然条件下培养, 整个试验期间保持土壤湿润.2个月后, 分地上、地下部分进行收获(沿地面剪取, 地面以上为地上部, 地面以下为地下部), 依次用自来水、去离子水清洗植物样品, 晾干水分之后, 存放于4 ℃冰箱中备用.
2.3 样品的制备与分析生物量测定:将采集的植物样品在105 ℃下杀青处理30 min后, 于70 ℃下烘干至恒重, 分别称量地上部和地下部干重.
植物样品与根际土壤Cd、As元素分析:植物样品用粉碎机粉碎, 均采用干灰法消解(GB/T 5009.15-2003, GB/T 5009.11-2003), 采用石墨炉原子吸收分光光度计(iCE-3500, Thermo公司, 美国)测定消化液中Cd的浓度;采用AFS-8220原子荧光分光光度计(北京吉天仪器有限公司)测定消化液中As的浓度.根际土壤样品在室内自然风干, 除去其中的石块、植物根系和凋落物等, 并研磨过0.15 mm尼龙筛.土壤总Cd采用微波消解仪, 王水与高氯酸消解, 原子吸收分光光度计测定(型号同上);土壤总As用水浴消解/原子荧光法测定(型号同上).
根际土壤pH测定:土壤采用无CO2蒸馏水按1∶ 2.5土水比浸提, pH计(雷磁pHS-3E)测定.
2.4 数据处理及统计应用富集系数(Bioaccumulation Factor, BCF, 植物某一部位重金属含量与土壤中重金属含量的比值)(Ghosh et al., 2005)、转运系数(Translocation Factor, TF, 植物后一部位中重金属含量与前一部位中重金属含量的比值)(Mishra et al., 2008)研究Cd和As在巨菌草各部位中的富集转运能力, 计算公式见式(1)~(2).试验数据均为3次重复的平均值, 采用显著性F检验和Duncan多重比较法(p < 0.05和p < 0.01)进行统计分析;数据结果采用Excel 2010进行平均值和方差分析, 差异性及相关性采用SPSS 24进行统计分析, 绘图采用Origin 9.0.

|
(1) |
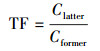
|
(2) |
式中, Cr为巨菌草各部位重金属Cd或As含量(mg·kg-1); Cs为土壤中重金属Cd或As含量(mg·kg-1); Clatter为巨菌草后一部位(茎叶)中重金属Cd或As含量(mg·kg-1); Cformer为巨菌草前一部位(根)中重金属Cd或As含量(mg·kg-1).
3 结果与分析(Results and analysis) 3.1 菌株的形态观察与分子鉴定如图 1所示, 在固体培养基上, 菌株M1的菌落形态呈白色, 表面较平整, 饼状兼絮状, 背面呈淡黄色;菌株M2的菌落形态呈白色, 菌落稍隆起, 质地疏松, 绒状兼絮状, 背面呈淡黄色;菌株M3则呈白色至乳白色, 毛毡状, 菌落上出现稀疏的黑色分生孢子器, 近球形, 背面呈褐色.
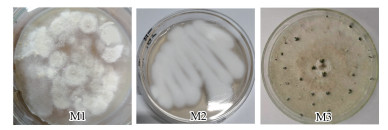 |
| 图 1 分离菌株M1、M2、M3在PDB培养基上的形态 Fig. 1 Morphology of isolated strains M1, M2 and M3 on PDB medium |
菌株M1、M2、M3经分子鉴定, 得到其片段基因序列长度分别为579、650、567 bp (NCBI登录号分别为MT912744、MT913587、MT912746).将测序结果在NCBI数据库进行BLAST比对后, 选取同源性相近的菌株, 建立系统发育树(图 2).经过BLAST比对, M1与Trichoderma yunnanense的基因序列有99%以上的同源性, M2与Gongronella butleri的基因序列有99%以上的同源性, M3与Diaporthe vaccinii的基因序列有100%的同源性.根据菌株M1、M2、M3的菌落形态, 结合18S rRNA基因测序结果, 可将根际促生真菌M1、M2、M3初步鉴定为云南木霉(Trichoderma yunnanense)、卵形孢球托霉(Gongronella butleri)、越橘间座壳菌(Diaporthe vaccinii).
 |
| 图 2 菌株M1、M2、M3系统进化发育树 Fig. 2 Phylogenetic tree of strains M1, M2 and M3(The GenBank accession numbers are given in parentheses. The number at each branch points is the percentage supported by bootstrap(Bar 0.20, 0.0050, 0.50 at the bottom is the sequence divergence)) |
图 3表明, 在相同培养温度条件下, 3株真菌的菌体干重基本随培养时间的延长而增加;在相同培养时间内, 温度不同, 菌体干重不同.当培养温度分别为7、15、25 ℃时, 菌株M1、M3干重随温度的升高而增加;而菌株M2则不同, 当培养时间为1~2 d时, 25 ℃条件下菌株干重比15 ℃时高, 第3~5 d时, 15 ℃条件下菌株干重比25 ℃时高, 第5~7 d时, 两个温度条件下的菌体干重相当, 说明菌株M2在15 ℃条件下生长相对较好.当培养温度为7 ℃时, 3株真菌在培养的第1~3 d均生长缓慢, 之后随着培养时间的延长, 3株真菌的菌体干重基本增加, 说明3株真菌即使在低温条件下仍能生存, 只是生长较为缓慢.
 |
| 图 3 3株菌在不同温度下的生长状况 Fig. 3 Growth of the three strains at different temperatures |
由图 4可知, 不施加菌株(M1、M2、M3)与肥料(F)时, 种植巨菌草后土壤pH值为5.86;而单独施加肥料时, 土壤pH显著下降至5.32, 降低了0.54(p < 0.05), 这说明加入肥料酸化了土壤环境.与CK相比, M1、M2处理后土壤pH值基本相同, 说明菌株M1、M2的加入不会影响土壤pH值;M3处理的土壤pH值有小幅下降, 说明菌株M3本身或利用土壤中营养成分产生了酸性物质.总体来看, 肥料处理会显著降低土壤pH值, 而单独施加菌株, 或菌株与肥料配施处理对pH值的影响较小.
 |
| 图 4 不同处理对土壤pH值的影响(图中不同字母表示各处理间差异显著, p < 0.05, 下同) Fig. 4 Effects of different treatments on soil pH(Different letters in the figure indicate significant differences between treatments, p < 0.05. The same below) |
图 4同时也显示, M1+F、M2+F和M3+F处理后, 土壤pH值分别提高了0.09、0.05和0.04;而F处理的土壤pH值出现明显下降, M1、M2和M3处理对土壤pH影响较小, 说明这3株真菌的加入能有效地抑制肥料施用所带来的土壤pH下降.
3.4 不同处理对巨菌草生物量的影响图 5为不同处理对巨菌草生物量(以干质量计)的影响.可以看出, 与CK相比, F、M1和M2处理使巨菌草根系质量分别增加21.25%、23.17%和23.30%, 但影响均不显著(p>0.05);M3、M1+F、M2+F和M3+F处理使根系质量分别增加33.65%、68.70%、42.14%和44.22%, 影响均显著(p < 0.05).图 5同时显示, 不同处理提高了巨菌草的茎叶生物量及植株生物量, 与CK相比, F、M1、M2和M3处理使巨菌草的茎叶生物量分别增加13.36%、51.91%、14.12%和84.35%, 植株生物量分别增加14.91%、46.49%、18.13%和74.85%;M1+F、M2+F和M3+F处理使巨菌草的茎叶生物量分别增加57.25%、116.79%和143.13%, 植株生物量分别增加66.67%、109.06%和128.65%.这说明单独施加菌株或肥料均能促进巨菌草生长, 且菌株与肥料配施对巨菌草的促生效果更好.在所有处理组中, 菌株M3与肥料配施的植株茎叶生物量和植株生物量最大.
 |
| 图 5 不同处理对巨菌草生物量的影响 Fig. 5 Effects of different treatments on the biomass of Pennisetum sinese |
由图 6可知, 巨菌草各部位Cd、As含量的分布均为根>茎叶.如图 6a所示, 与CK处理相比, 单独施菌或肥料及菌株与肥料联合施加均降低了巨菌草根系Cd含量, 降低幅度为12.75%~85.40%, 其中, M1+F处理影响最大, 说明菌株和(或)肥料的加入减少了植物根系对Cd的吸收.与CK处理相比, M2、M3处理能使茎叶Cd含量分别增加26.81%、31.16%, 而F、M1、M1+F、M2+F和M3+F处理则使茎叶Cd含量分别降低6.52%、7.97%、26.81%、27.54%、25.36%, 但影响均不显著(p>0.05).说明在降低茎叶Cd方面, 3株真菌与肥料配施能起到协同作用.
 |
| 图 6 不同处理对巨菌草各部位Cd(a)、As(b)含量的影响 Fig. 6 Effects of different treatments on the concentrations of Cd(a) and As(b) in various tissues of Pennisetum sinese |
如图 6b所示, 与CK处理相比, F、M1、M2和M3处理能使巨菌草根系As含量分别降低39.38%、40.78%、11.41%、25.00%;M1+F、M2+F和M3+F处理均使根系As含量增加, 分别增加了6.72%、21.72%、10.78%, 说明菌株与肥料配施会促进巨菌草根系对As的吸收.另外, 由图 6b可以看出, 单独施加菌株或肥料及菌株与肥料配施均使巨菌草茎叶As含量降低, 但影响均不显著(p>0.05).
3.6 不同处理对巨菌草各部位Cd、As积累量的影响如图 7a所示, 与CK处理相比, F、M2、M3、M1+F、M2+F和M3+F处理均使根Cd积累量下降, 降低幅度为16.08%~72.65%, 其中, M1+F处理对根Cd积累量的影响显著, 降低72.65%(p < 0.05);另外, 从降低效果来看, 菌株M3与肥料配施在降低根Cd积累量方面有协同作用.从图 7a还可知, 与CK处理相比, F、M1、M2和M3处理能使巨菌草茎叶Cd积累量分别增加8.61%、37.50%、46.11%、145.83%;M1+F、M2+F和M3+F处理使茎叶Cd积累量增加14.17%、54.72%、94.17%.可以看出, 就茎叶Cd积累量而言, 单独施菌时M3处理效果相对较好, 当菌株与肥料配施时M3+F处理效果相对较好.
 |
| 图 7 不同处理对巨菌草各部位Cd(a)、As(b) 积累量的影响 Fig. 7 Effects of different treatments on the accumulation of Cd(a) and As(b) in various tissues of Pennisetum sinese |
如图 7b所示, 与CK处理相比, F、M1处理会降低巨菌草根系As积累量, 但影响不显著(p>0.05);而M1+F、M2+F和M3+F处理导致根系As积累量增加, 分别提高109.77%、114.94%、93.68%, 说明当菌株与肥料联合施用时会使得根系As的积累量上升.与CK处理相比, F、M2处理后巨菌草茎叶As的积累量略有降低;M1、M3、M1+F、M2+F和M3+F处理均提高了巨菌草茎叶As的积累量, 分别增加14.39%、64.03%、38.13%、88.49%、142.45%.可以看出, 就茎叶As积累量而言, 单独施菌时M3处理效果相对较好, 当菌株与肥料配施时M3+F处理效果相对较好.
3.7 不同处理对巨菌草富集转运Cd、As的影响重金属通过根系的吸收富集在植物根系中, 再从根系运输至植物茎叶部位, 这个过程是重金属从地下部转运至地上部的关键.富集系数可用来评价植物从土壤中积累重金属的能力, 富集系数越大, 对重金属的富集能力越强.转运系数则用于评价植物从前一部位向后一部位转运重金属的能力, 转运系数越大, 说明该部位对重金属的转运能力越强.
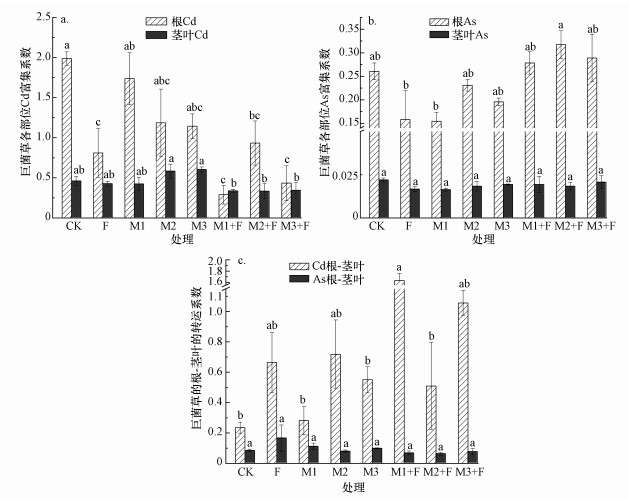
由图 8a、8b可知, 在所有处理中, 巨菌草根系对土壤Cd的富集系数(BCF根Cd)为0.39~1.99, 茎叶对土壤Cd的富集系数(BCF茎叶Cd)为0.33~0.60, 在同一处理下, BCF根Cd>BCF茎叶Cd.另外, 巨菌草根系对土壤As的富集系数(BCF根As)为0.15~0.32, 茎叶对土壤As的富集系数(BCF茎叶As)为0.016~0.022, 在同一处理下, BCF根As> BCF茎叶As.
 |
| 图 8 不同处理对巨菌草富集转运Cd、As的影响 Fig. 8 Effects of different treatments on the bioaccumulation factors and translocation quantity factors of Cd and As in Pennisetum sinese |
由图 8c可知, 与CK处理相比, 单独施菌或肥料及菌株与肥料联合施加后, 均提高了巨菌草将Cd自根系转运至茎叶的转运系数TF根-茎叶, 提高幅度为16.67%~579.17%, 其中, M1+F、M3+F处理后转运系数分别从0.24提高到1.63、1.06, 分别增加了5.79倍、3.42倍, 说明菌株M1、M3与肥料配施对Cd在根-茎叶转运能力的提升效果最好.另外, 巨菌草将As自根系转运至茎叶的转运系数TF根-茎叶为0.063~0.167, 与CK处理相比, F、M1、M3处理均提高了TF根-茎叶, 分别增加了96.47%、31.76%、16.47%.
4 讨论(Discussion)在利用PGPR进行土壤修复的过程中, 微生物菌剂的选择具有决定性作用.对于条件苛刻的特殊生境, 接种外源PGPR菌剂到特殊生境会受到来自生存环境变化的挑战, 从而限制了外源PGPR接种剂的存活及功能活性, 选择土著PGPR作为接种剂, 可以更好地适应本土环境, 有助于发挥预期效果(Schlaeppi et al., 2016).何敏等(2020)从西藏土壤中成功筛选得到2株耐低温细菌, 可以有效促进当地牧草生长.本试验中, 3株促生菌株均分离于当地镉砷复合污染土壤中, 可以更好地应用于镉砷复合污染土壤的修复, 并适应当地冬季的低温环境.
图 5显示, 3株真菌单独或与肥料联合配施, 能够增加巨菌草的总重及茎叶干重, 说明这3株真菌能够耐低温, 且能促进植物生长(姬朋朋等, 2016).这可能与菌株M1、M2具有较强的产铁载体能力、菌株M3具有产IAA能力、3株菌均具有溶磷能力(表 1)有关.这些特性或能增加植物有效吸收环境中铁元素的重要媒介, 或能直接促进植物生长, 或能将土壤中不溶性无机磷释放, 在这些因素的综合作用下, 植物生物量增加(Sikadar et al., 1998).当然, 图 5也显示, 与CK相比, 单独施加肥料时, 植株生物量、茎叶生物量分别增加14.91%、13.36%;单独施加菌株时, 植株生物量、茎叶生物量分别增加18.13%~74.85%、14.12%~84.35%;当菌株与肥料联合施加后, 植株生物量、茎叶生物量分别增加66.67%~128.65%、57.25%~143.13%, 说明菌株与肥料配施, 两者之间产生了协同作用.这可能是因为:一方面, 植物或土壤中的微生物能直接利用肥料中的营养物质;另一方面, 菌株M1、M2、M3的加入也能将肥料中的有机质、粗蛋白、氮磷钾及微量元素作为食源, 用于生长繁殖, 产生更多的铁载体或IAA或溶解更多的无机磷, 从而促进植物生长.图 3的结果也表明, 单独施加肥料时土壤pH显著下降, 可能是肥料中的有机质分解所导致, 而加入菌株M1、M2、M3后, 肥料中的有机质和(或)蛋白质被菌株利用, 使其分解不产生酸性物质或酸性物质被转化为其他物质, 所以土壤pH值基本稳定.
植物根际促生菌可促进植物生长, 也可通过微生物-重金属和微生物-植物的相互作用影响植物吸收、转移和累积重金属, 改变植物重金属富集量(Kirkham, 2006;Burd et al., 2014).由图 7可知, 与CK处理相比, 单独施加3株真菌及3株真菌与肥料配施均会提高巨菌草茎叶Cd、As的积累量, 且单独施加菌株时, M3处理使茎叶Cd、As积累量提升最多, 分别提升145.83%、64.03%;菌株与肥料配施时, M3与肥料配施使茎叶Cd、As积累量提升最多, 分别提升94.17%、142.45%, 说明菌株M3可促进巨菌草茎叶对Cd、As的积累.这可能是因为植物根际促生菌增加了巨菌草茎叶干重(图 5), 从而使其Cd、As积累量增加(Guo et al., 2014).
由图 8可知, 与CK相比, M2、M3处理可提高植物茎叶中Cd的富集系数, 其中, 施加菌株M3时达到了0.6, 有研究发现巨菌草Cd富集系数在0.55左右(王丽萍等, 2015), 相比提高了9.1%.另外, 单独施菌或肥料及菌株与肥料联合施加均提高了巨菌草中Cd自根系转运至茎叶的转运系数, 其中, 菌株M1、M3与肥料配施使TF根-茎叶分别提高341.67%与579.17%, 可能是因为菌株与肥料配施促进了Cd由巨菌草根部向地上部分转移(蒋淼等, 2019).
巨菌草为多年生植物, 具有非常强的再生能力, 收割后可留根发芽, 施用肥料促其再生(Lu et al., 2014), 因此, 巨菌草茎叶部的Cd、As含量与积累量是影响土壤重金属污染修复的关键因素.由图 6可以看出, 与CK处理相比, 单独施菌或肥料及菌株与肥料联合施加处理下, 巨菌草茎叶Cd、As含量变化并不显著, 而茎叶部Cd、As积累量的变化规律与茎叶部干重的变化规律一致, 单独施菌时, M3处理的茎叶部干重达到最大, 其Cd、As积累量也达到最大值;菌株与肥料配施时, M3+F处理的茎叶部干重达到最大, 其Cd、As积累量也达到最大值, Cd自根系转运至茎叶的转运系数也达到最大值.实际应用中, 为了达到最大化去除土壤中的Cd、As, 往往通过多次收刈植物茎叶的方式来进行.因此, 在对植物盆栽试验结果评价过程中, 用植物茎叶Cd、As积累量而非Cd、As含量(或浓度)作为评价指标应该较为科学.本试验中, 与CK处理相比, M1、M2、M3、M1+F、M2+F和M3+F处理均可提高巨菌草茎叶部Cd、As积累量, 其中, 单独施菌时M3处理效果相对较好, 菌株与肥料配施时M3+F处理效果相对较好(图 7), 说明菌株M3单施或与肥料配施, 可以通过多次收刈巨菌草的茎叶部而带走相对较多的土壤重金属Cd、As.
5 结论(Conclusions)1) 结合形态观察及18S rRNA基因序列分析, 初步鉴定3株根际促生菌M1、M2、M3分别为云南木霉(Trichoderma yunnanense)、卵形孢球托霉(Gongronella butleri)、越橘间座壳菌(Diaporthe vaccinii), 且均可在南方冬季条件下生长.
2) 与CK处理相比, 单独施菌或肥料及菌株与肥料联合施加均能提高巨菌草茎叶生物量, 分别提高14.12%~84.35%、13.36%、57.25%~143.13%.单独施加菌株或肥料均能促进巨菌草生长, 菌株与肥料配施对巨菌草的促生效果更好.在所有处理中, 菌株M3与肥料配施处理下植株茎叶生物量及植株生物量达到最大.
3) 不同处理可影响巨菌草对Cd和As的吸收积累, 但对巨菌草各部位影响不同.单独施加菌株时, M3处理对巨菌草茎叶Cd、As积累量提升最多, 分别提高145.83%, 64.03%;当菌株与肥料配施时, M3与肥料配施对巨菌草茎叶Cd、As积累量提升最多, 分别提高94.17%, 142.45%.可见, M3可作为治理镉砷复合污染土壤的优势菌株, 供进一步研究.
Ansari R A, Mahmood I. 2017. Optimization of organic and bio-organic fertilizers on soil properties and growth of pigeon pea[J]. Scientia Horticulturae, 226(7): 1-9. |
Burd G I, Dixon D G, Glick B R. 2000. Plant growth-promoting bacteria that decrease heavy metal toxicity in plants[J]. Canadian Journal of Microbiology, 46(3): 237-245. DOI:10.1139/w99-143 |
Chaney R L, Reeves P G, Ryan J A, et al. 2004. An improved understanding of soil Cd risk to humans and low cost methods to phytoextract Cd from contaminated soils to prevent soil Cd risks[J]. Biometals, 17(5): 549-553. DOI:10.1023/B:BIOM.0000045737.85738.cf |
陈可, 胡南, 陈威, 等. 2018. 两种植物根际促生菌对博落回抗干旱及富集铀性能的增强作用研究[J]. 环境科学学报, 38(10): 4142-4149. |
陈朗, 宋玉芳, 张薇, 等. 2008. 土壤镉污染毒性效应的多指标综合评价[J]. 环境科学, 29(9): 2606-2612. DOI:10.3321/j.issn:0250-3301.2008.09.037 |
陈文艳, 耿庆芬, 王燕, 等. 2020. 重金属污染土壤的植物修复及植物联合修复研究进展[J]. 广东化工, 47(2): 87-88+95. DOI:10.3969/j.issn.1007-1865.2020.02.039 |
陈英旭. 2005. 环境学[M]. 北京: 中国环境科学出版社, 113-114.
|
崔岩山, 陈晓晨. 2010. 土壤中镉的生物可给性及其对人体的健康风险评估[J]. 环境科学, 31(2): 403-408. |
Ghosh M, Singh S P. 2005. A comparative study of cadmium phytoextraction by accumulator and weed species[J]. Environmental Pollution, 133(2): 365-371. DOI:10.1016/j.envpol.2004.05.015 |
Guo J K, Chi J. 2014. Effect of Cd-tolerant plant growth-promoting rhizobium on plant growth and Cd uptake by Lolium multiflorum Lam and Glycine max (L.) Merr.in Cd-contaminated soil[J]. Plant and Soil, 375(1/2): 205-214. |
韩廿, 黄益宗, 魏祥东, 等. 2019. 螯合剂对油葵修复镉砷复合污染土壤的影响[J]. 农业环境科学学报, 38(8): 1891-1900. |
何敏, 王秀璞, 李彦, 等. 2020. 两株耐寒PGPB的分离及其对藏北当地牧草生长的影响[J]. 广西植物. DOI:10.11931/guihaia.gxzw202003010 |
姬朋朋, 尹光彩, 陈志良, 等. 2016. 两种AMF对巨菌草根际土壤Cd生物可利用性以及Cd积累的影响[J]. 农业环境科学学报, 35(12): 2306-2313. DOI:10.11654/jaes.2016-0878 |
蒋淼, 张丹, 支月娥, 等. 2019. 强化龙葵富集镉根际促生菌的分离、筛选与鉴定[J]. 微生物学通报, 46(9): 2231-2240. |
靳琪, 高红, 岳波, 等. 2018. 村镇生活垃圾重金属含量及其来源分析[J]. 环境科学, 39(9): 4385-4392. |
Kacar Y, Arpa C, Tan S, et al. 2002. Biosorption of Hg(II) and Cd(II) from aqueous solutions: comparison of biosorptive capacity of alginate and immobilized live and heat inactivated Phanerochaete chrysosporium[J]. Process Biochemistry, 37(6): 601-610. DOI:10.1016/S0032-9592(01)00248-5 |
Kirkham M. 2006. Cadmium in plants on polluted soils: effects of soil factors, hyperaccumulation, and amendments[J]. Geoderma, 137(1/2): 19-32. |
Li X G, Wang X X, Dai C C, et al. 2014. Effects of intercropping with Atractylodes lancea and application of bio-organic fertiliser on soil invertebrates, disease control and peanut productivity in continuous peanut cropping field in subtropical China[J]. Agroforestry Systems, 88(1): 41-52. DOI:10.1007/s10457-013-9653-6 |
林兴生, 林占熺, 林冬梅, 等. 2013. 低温胁迫5种菌草的抗寒性评价[J]. 草业学报, 22(2): 227-234. |
刘莉华, 刘淑杰, 陈福明, 等. 2013. 接种内生细菌对龙葵吸收积累镉的影响[J]. 环境科学学报, 33(12): 3368-3375. |
Long X X, Chen X M, Wong J W C, et al. 2013. Feasibility of enhanced phytoextraction of Zn contaminated soil with Zn mobilizing and plant growth promoting endophytic bacteria[J]. Transactions of Nonferrous Metals Society of China, 23(8): 2389-2396. DOI:10.1016/S1003-6326(13)62746-6 |
Lu Q L, Tang L R, Wang S Q, et al. 2014. An investigation on the characteristics of cellulose nanocrystals from Pennisetum sinese[J]. Biomass and Bioenergy, 70: 267-272. DOI:10.1016/j.biombioe.2014.09.012 |
Meena, Tara N, Saharan B S. 2017. Plant growth promoting traits shown by bacteria Brevibacterium frigrotolerans SMA23 isolated from Aloe vera rhizosphere[J]. Agrie Sci Digest, 37(3): 226-231. |
Mishra V K, Upadhyaya A R, Pandey S K, et al. 2008. Heavy metal pollution induced due to coal mining effluent on surrounding aquatic ecosystem and its management through naturally occurring aquatic macrophytes[J]. Bioresource Technology, 99(5): 930-936. DOI:10.1016/j.biortech.2007.03.010 |
Schlaeppi K, Bender S F, Mascher F, et al. 2016. High-resolution community profiling of arbuscular mycorrhizal fungi[J]. New Phytologist, 212(3): 780-791. DOI:10.1111/nph.14070 |
Sikadar A, Hamid N, Naginan N, et al. 1998. Screening of phosphate solubilizing microorganisims using different original and modifiled culture media[J]. Biologia, 44: 110-122. |
王丽萍, 张健, 胡红玲, 等. 2015. 巨菌草对镉污染土壤的修复特性[J]. 应用与环境生物学报, 21(4): 725-732. |
韦革宏, 马占强. 2010. 根瘤菌-豆科植物共生体系在重金属污染环境修复中的地位、应用及潜力[J]. 微生物学报, 50(11): 1421-1430. |
翟孟源, 徐新良, 姜小三. 2012. 我国长江中下游农业区冬闲田的遥感监测分析[J]. 地球信息科学学报, 14(3): 389-397. |
 2021, Vol. 41
2021, Vol. 41


