2. 二氧化碳捕集与封存国家与地方工程研究中心, 西安 710127;
3. 陕西省地表系统与环境承载力重点实验室, 西安 710127;
4. 西安市环境卫生科学研究所, 西安 710065;
5. 榆林学院生命科学学院, 榆林 719000
2. National & Local Joint Engineering Research Center of Carbon Capture and Storage Technology, Xi'an 710127;
3. Shaanxi Key Laboratory of Earth Surface System and Environmental Carrying Capacity, Xi'an 710127;
4. Institute of Environmental Health Science in Xi'an, Xi'an 710065;
5. College of Life Science, Yulin University, Yulin 719000
二氧化碳捕集与封存(CO2 Capture and Storage, CCS)自提出以来, 已逐步发展成为全球减少温室气体排放的重要战略(IPCC, 2014).根据国际能源机构的数据, 截止到2019年, 全球共有43个大规模CCS项目, 其中19个项目正在运营, 规模达到3400×104 t·a-1(IEA, 2020).目前中国已开展了12个地质利用与封存全流程示范项目, 其中, 地质利用与封存规模为100×104 t·a-1(蔡博峰等, 2020).但在实际地质封存过程中, 封存的CO2可能会通过未被发现的断层或者废弃井等发生泄漏, 从而对泄漏区周围的植被、土壤生态系统造成风险.因此, 开展地质封存CO2泄漏对土壤、植物及地表水等生态系统的影响研究意义重大.
泄漏对典型植物的影响研究较多, 主要集中于植物的形态指标、生理指标、生物量指标等方面(伍洋等, 2012;He et al., 2016;Kim et al., 2017;韩耀杰等, 2019;纪翔等, 2019);有关CO2泄漏对土壤的影响研究主要集中于土壤组成、性质、肥力等方面(陈妮等, 2015;聂莉娟等, 2015;裴宇等, 2016;张丙华等, 2016), 针对土壤微生物的影响研究尚处于初步探讨阶段(Oppermann et al., 2010;田地等, 2013;陈浮等, 2017).以细菌为代表的土壤微生物作为土壤生态系统中最活跃的因素(邓书林等, 2016), 既受土壤环境变化的影响, 又对土壤的碳氮循环及土壤性质有着明显的影响.
目前, 有关CO2封存泄漏的生态影响研究多以旱作植物及土壤为对象, 针对水稻及稻田土壤的影响研究报道较少.大型盆地因其完整的地质构造单元和良好的地质稳定性, 以及CO2储存容量大, 可作为大规模开发应用CCS的潜力区域(李小春等, 2006).而湿润、半湿润气候区的盆地和平原地区, 又是水稻集中种植的区域.因此, 本文以水稻及稻田土壤为对象, 通过设置CO2模拟泄漏研究平台, 开展水稻种植实验, 并利用高通量测序技术, 探讨CO2泄漏对稻田土壤细菌组成及多样性的影响, 以期为利用稻田土壤细菌监测CO2泄漏风险提供依据.
2 材料与方法(Materials and methods) 2.1 实验设计实验在西北大学长安校区校实验场地进行, 该地属暖温带半湿润大陆性季风型气候, 年平均气温为15.5 ℃, 多年平均降水量为573 mm.供试土壤类型为褐土, 土壤pH为7.56, 有机质含量为3.26%, 土壤质地类型为粉砂质粘壤土, 砂粒、粉粒及粘粒含量分别为11.80%、68.47%及19.73%, 阳离子交换量为10.30 cmol·kg-1.
实验采用15个70 cm×48 cm×45 cm的透明塑料箱作为水稻种植箱.箱体自下向上由布气层、土壤层、水层组成.其中, 布气层厚5 cm, 铺设5~10 mm的花岗岩碎石, 在布气层内均匀布设4个曝气头;布气层上铺设一层20目乙烯网, 用以隔离布气层与上部土壤层;乙烯网之上设30 cm土壤层, 作为水稻生长的基质;在种植条件下, 保证土壤层之上覆水层4~6 cm.CO2气体来源于CO2高压气瓶, 利用减压阀和流量计控制CO2的泄漏速率, 通过软管和四通阀将CO2分流到水稻种植箱的4个曝气头中, 调整四通阀, 以保证均衡布气(图 1).
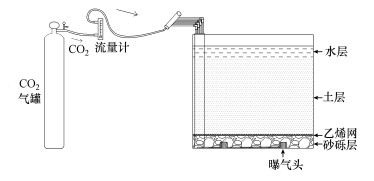 |
| 图 1 实验装置图 Fig. 1 The experimental device |
供试水稻品种为龙稻18号, 于2019年6月6日进行插秧, 7月6日开始向种植箱中通入CO2, 24小时不间断通气84 d, 直至9月28日实验结束.大量研究表明, 天然CO2泄漏速率在1000~3000 g·m-1·d-1(West et al., 2004;Beaubien et al., 2008), 因此, 本实验设计1个对照组(CK)和4个CO2泄漏组, 泄漏速率分别为0.06(D1)、0.12(D2)、0.24(D3)和0.48 L·m-2·min-1(D4), 每组重复3次.
2.2 样品采集在2019年9月28日实验结束时, 分别采集水稻和土壤样品, 水稻样品采集后立即送至实验室进行生长指标测定;按照多点混合法采集100 g左右新鲜稻田土壤样品(采样深度0~30 cm), 除去植物根茎、石砾等较大杂质后混合均匀, 一部分置于室内风干, 过2 mm筛, 4 ℃冷藏备用;另一部分取2~3 g置于2 mL离心管中, 放入冰盒送往上海派森诺生物科技公司, 委托其开展稻田土壤细菌的16S rRNA V3~V4区Illumina MiSeq高通量测序, 研究稻田土壤细菌组成及其多样性.
2.3 测定指标及分析方法 2.3.1 稻田土壤性质及水稻生长指标测定稻田土壤pH采用电位法测定, 电导率采用电导率仪进行原位土壤测定.用米尺测量每穴水稻根茎分割处到最高叶尖的距离作为株高指标, 最大根系长度作为根长指标.
2.3.2 稻田土壤基因测序① 稻田土壤样本细菌总DNA提取及16S rRNA V3~V4区片段扩增:利用土壤DNA提取试剂盒提取15个稻田土壤样本的DNA, 并通过1.2%琼脂糖凝胶电泳检测DNA的提取质量.根据序列中的保守区域设计前引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)及后引物806R(5′-GGACTACHVGGGTWTCTAAT-3′), 对16S rRNA V3~V4区进行PCR扩增.具体扩增程序包括:98 ℃预变性2 min;98 ℃变性15 s, 55 ℃退火30 s, 72 ℃延伸30 s, 如此循环25~30个周期;72 ℃最终延伸5 min结束.
② 扩增产物纯化与定量:通过DNA聚合酶获得稻田土壤细菌的PCR扩增产物后, 利用样品体积0.8倍的磁珠, 进行扩增产物的纯化回收;再使用荧光试剂(Quant-iT PicoGreen dsDNA Assay Kit)及酶标分析仪(BioTek, FLx800)进行PCR扩增回收产物的荧光定量分析.
③ 测序文库制备、上机测序:对纯化、定量后的扩增产物进行序列末端修复, 保证目标序列与测序序列接头相连;对连上接头的DNA片段进行PCR扩增, 富集测序文库模板, 最后对文库富集产物进行选择与纯化;再利用荧光定量系统(Promega QuantiFluor)对文库进行定量分析, 合格的文库浓度应在2 nmol·L-1以上;将合格的上机测序文库梯度稀释后, 按比例混合, 经NaOH变性为单链进行上机测序.利用Illumina MiSeq平台对稻田土壤细菌DNA片段进行双端(Paired-end)测序;对原始序列进行质控、去噪、拼接、去嵌合体, 通过稀疏曲线判断测序深度的合理性.
2.4 数据处理利用丰富度指数Chao 1、多样性指数Shannon及均匀度指数Pielou′s evenness 3个指数来反映稻田土壤细菌的α多样性;利用主成分分析法(Principal Component Analysis, PCA)、非度量多维度分析(Nonmetric Multidimensional scaling, NMDS)和聚类分析法来表征稻田土壤细菌的β多样性, 判断各土壤样本间的差异及其影响因素.
根据供试土壤细菌在门、属分类水平的丰度及类型信息, 分析CO2泄漏引起的稻田土壤中优势菌群及稀有菌群的变化, 分析CO2的泄漏引起土壤细菌类型的变化特征, 寻找稻田土壤CO2泄漏的敏感监测指标.利用Excel、Origin及SPSS进行数据处理与图表绘制.
3 结果与分析(Results and analysis) 3.1 CO2泄漏对稻田土壤性质及水稻生长的影响 3.1.1 CO2泄漏对稻田土壤pH及电导率的影响稻田土壤pH及电导率在不同CO2泄漏速率下的变化规律见图 2.可以看出, pH随CO2泄漏速率的增加而显著降低, 由CK组的7.78直接减小至6.64~6.82, CO2泄漏组的pH显著低于CK组(p < 0.05).电导率随着CO2泄漏速率的增加而逐渐升高, 即由CK组的2238 μS·cm-1逐渐升高至2552~3561 μS·cm-1, CO2泄漏组显著高于CK组(p < 0.05).
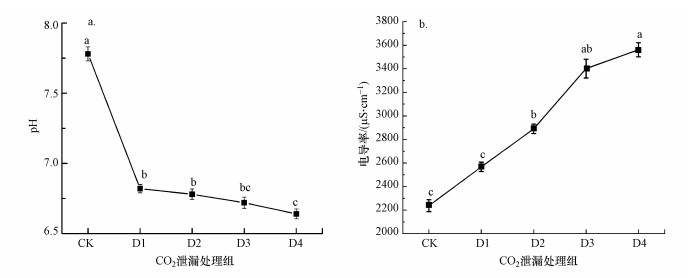 |
| 图 2 CO2泄漏对稻田土壤pH(a)及电导率(b)的影响(不同小写字母表示不同处理之间差异显著, p < 0.05, 下同) Fig. 2 Effect of CO2 leakage on pH(a) and conductivity(b) of paddy soil |
在不同CO2泄漏速率的影响下, 水稻的株高、根长变化见图 3.随着CO2泄漏速率的增加, 水稻的株高及根长均呈现出减小的趋势, CO2泄漏组与CK组具有显著差异(p < 0.05).其中, CK组株高最高(93.50 cm), CO2泄漏组较CK组减小了5.80%~8.70%;CK组根长最大(40.10 cm), CO2泄漏组较CK组减小了12.22%~18.70%.
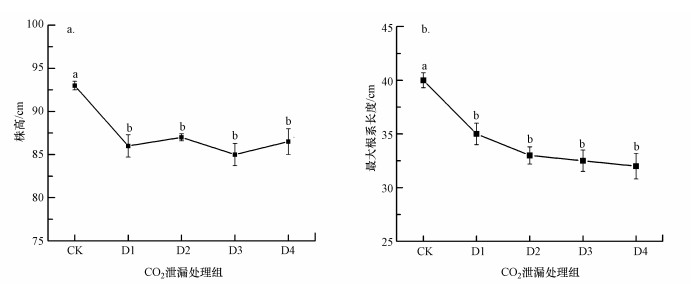 |
| 图 3 CO2泄漏对水稻株高(a)、根长(b)的影响 Fig. 3 Effect of CO2 leakage on rice plant height(a) and the root length(b) of rice |
通过对15个稻田土壤样本的高通量测序, 共得到55529条扩增子序列变体(Amplicon Sequence Variants, ASVs)读数.以每个样本中随机抽取一定数量的序列为横坐标, 以给定的测序深度下所包含的物种数为纵坐标, 绘制稀疏曲线(图 4).由图可知, 随测序深度的增加, 物种数量的增加逐渐趋于平缓, 说明样本测序的数据量足以反映稻田土壤细菌的多样性.
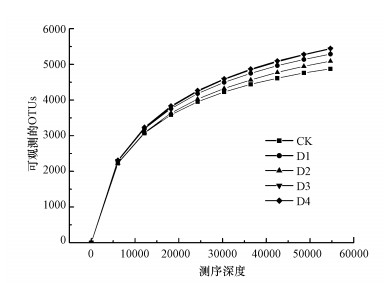 |
| 图 4 稻田土壤样本稀疏曲线 Fig. 4 Rarefaction curves of paddy soil samples |
稻田土壤细菌的α多样性包括丰富度指数(Chao1)、多样性指数(Shannon)及均匀度指数(Pielou′s evenness)(表 1).随着泄漏速率的增加, 丰富度指数(Chao1)和多样性指数(Shannon)逐渐增大, 而均匀度指数(Pielou′s evenness)有所减小.即与CK相比, 土壤细菌的丰富度和多样性随着CO2泄漏速率的增加而增加, 均匀度则呈相反的规律.
| 表 1 稻田土壤细菌α多样性指数 Table 1 Bacteria′s α diversity of paddy soil samples |
通过对CK组和CO2泄漏组多样性指数的差异性分析发现, 不同CO2泄漏速率组稻田土壤细菌Chao 1指数相对于CK组分别上升了12.90%、16.41%、18.61%及19.95%, 即不同泄漏速率组与CK组之间存在显著差异;不同CO2泄漏速率组之间的差异也较为显著(p < 0.05).不同CO2泄漏速率组的Shannon指数和Poelou′s evenness指数及其与CK组之间的差异不显著.
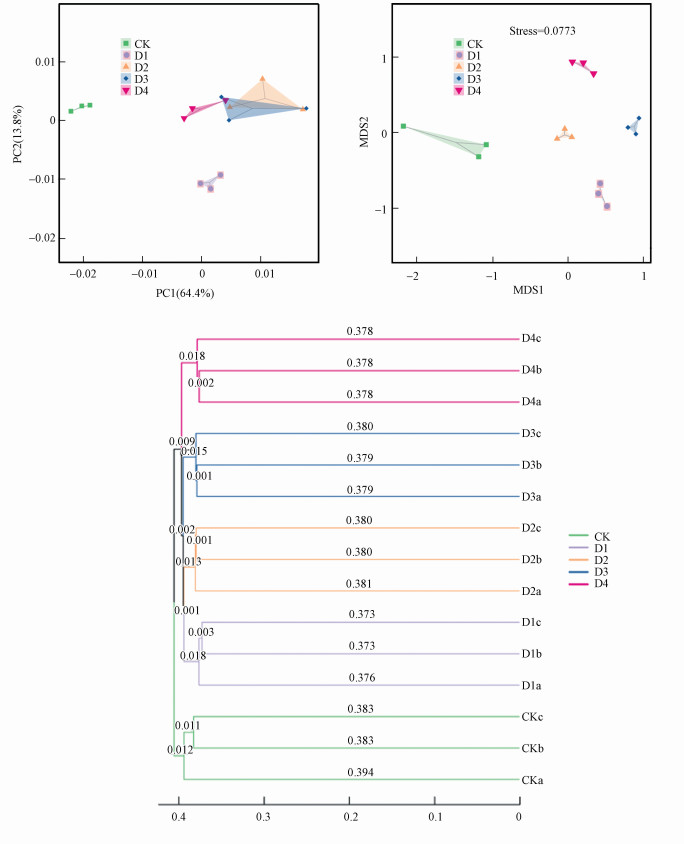
3.2.2 CO2泄漏对稻田土壤细菌β多样性的影响β多样性分析可反映环境梯度变化下不同样本之间物种组成的差异.本文采用PCA、基于Jaccard距离的NMDS和聚类分析来衡量稻田土壤细菌在不同CO2泄漏速率下的差异, 其中, NMDS和聚类分析是基于强调物种有无的Jaccard距离计算的.供试稻田土壤细菌的β多样性分析结果见图 5.
 |
| 图 5 稻田土壤细菌β多样性分析 Fig. 5 Bacteria′s β diversity of paddy soil samples |
由PCA分析结果(图 5a)可知, 主成分PC1的贡献率为64.4%, 主成分PC2的贡献率为13.8%, 其贡献率之和为78.2%, 是样本差异的主要来源.CK组位于PC1坐标轴左侧的负值区, 与位于坐标轴右侧正值区的各CO2泄漏组距离较远, 其中, CO2泄漏速率较高的组即D2、D3和D4距离较近且与CK、D1相距较远.与CK组相比, CO2泄漏组主要受PC1的影响, D1组与D2、D3、D4组的分异还受PC2的影响.
由NMDS分析结果(图 5b)可知, 稻田土壤细菌分析的应力值(stress)为0.0773, 明显小于0.2的NMDS分析应力阈值, 结果可靠.NMDS结果与PCA结果基本一致, 但D2、D3、D4分异更为明显.CO2泄漏组与CK组的差异主要受MDS1的影响, 而不同泄漏速率下的分异更多地受MDS2的影响, 其中, D2、D3的差异主要受MDS1的影响.
由聚类分析结果(图 5c)可知, CK组与CO2泄漏组的距离最远, D2和D3、D4的位置最为接近.说明CO2泄漏对稻田土壤细菌分异的影响最为重要.
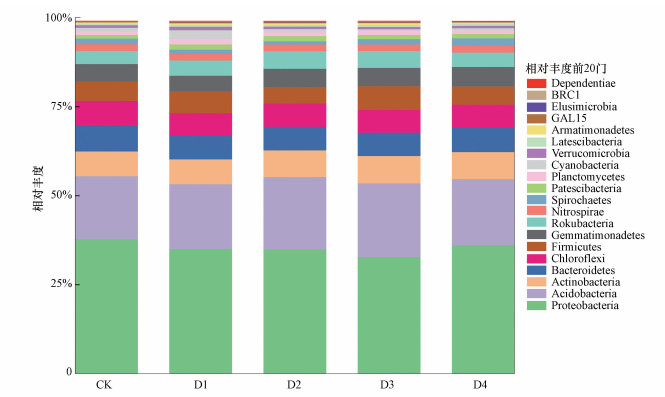
3.3 CO2泄漏对稻田土壤优势细菌的影响 3.3.1 门水平上稻田土壤优势细菌的变化在门水平分类上, 供试土壤共分析出50种细菌门, CK组及各CO2泄漏速率组分别检出43和43、44、44、42门.门水平上相对丰度前20的门见图 6, 其中, 相对丰度前10门的累积丰度为95%以上, 分别为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、Rokubacteria、硝化螺旋菌门(Nitrospirae)及螺旋体门(Spirochaetes).从图 6可以看出, 变形菌门相对丰度最高, 为32.75%~37.79%;酸杆菌门次之, 为17.68%~20.69%;再者是放线菌门、拟杆菌门、绿弯菌门、厚壁菌门等, 相对丰度为5.51%~7.72%.
 |
| 图 6 门水平细菌相对丰度变化 Fig. 6 Changes in relative abundance of phylum |
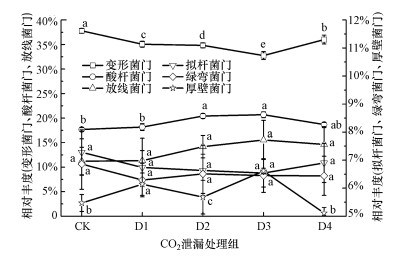
以相对丰度大于5%为条件, 稻田土壤中优势菌门的相对丰度随CO2泄漏速率的变化见图 7.由图 7可知, 在不同CO2泄漏速率条件下, 变形菌门的相对丰度较CK组(37.79%)降低了1.78%~5.04%;酸杆菌门与变形菌门相反, CO2泄漏组较CK组(17.68%)升高了0.49%~3.01%;放线菌门与酸杆菌门相对丰度的变化趋势相同, 拟杆菌门、绿弯菌门与变形菌门相对丰度的变化趋势相同, 但相对丰度的变化幅度更小, 厚壁菌门的变化规律不明显.对CK组和CO2泄漏组各优势菌门的相对丰度进行差异性分析, 其中, 变形菌门、酸杆菌门及厚壁菌门的相对丰度变化差异显著(p < 0.05), 放线菌门、拟杆菌门及绿弯菌门的相对丰度变化没有显著差异.
 |
| 图 7 门水平优势细菌相对丰度变化 Fig. 7 Changes in relative abundance of predominant phylum |
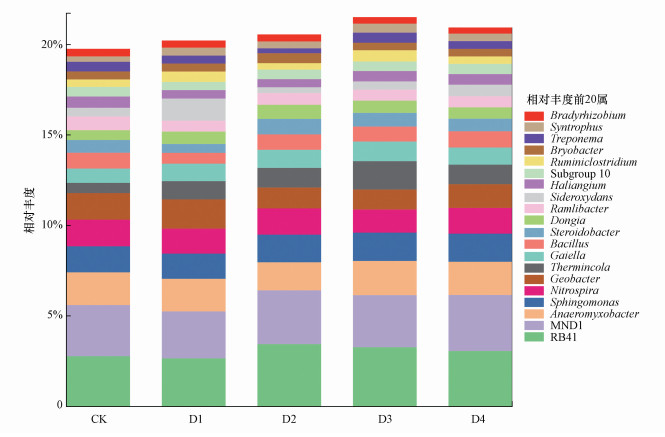
在属的分类水平上共检出1752属, 其中, CK组及各CO2泄漏速率组分别有1202和1201、1150、1169、1199属.在属水平上, 前20属的相对丰度占所有细菌总丰度的21.55%, 其中, 前10的细菌属的相对丰度为10.56%~13.07%, 分别为RB41、MND1、厌氧粘细菌(Anaeromyxobacter)、鞘脂单胞菌属(Sphingomonas)、硝化螺旋菌属(Nitrospira)、地杆菌属(Geobacter)、Thermincola、Gaiella、芽孢杆菌属(Bacillus)及类固醇杆菌属(Steroidobacter)(图 8).其中, RB41的相对丰度最高, 为2.64%~3.43%;MND1次之, 为2.60%~3.10%;厌氧粘细菌、鞘脂单胞菌属、硝化螺旋菌属等的相对丰度均小于2%.
 |
| 图 8 属水平细菌相对丰度变化 Fig. 8 Changes in relative abundance of genus |
以相对丰度大于1%为条件, 与CK组相比, RB41、MND1、厌氧粘菌属及鞘脂单胞菌属的相对丰度在CO2泄漏速率增大时总体呈增加趋势, 其中, 厌氧粘菌属的增加最为稳定;而硝化螺旋菌属的相对丰度则相反(图 9).对CK组和CO2泄漏组的优势菌属的相对丰度进行差异性分析, 发现RB41、MND1、硝化螺旋菌属及厌氧粘菌属相对丰度变化差异显著(p < 0.05), 鞘脂单胞菌属相对丰度差异不显著.
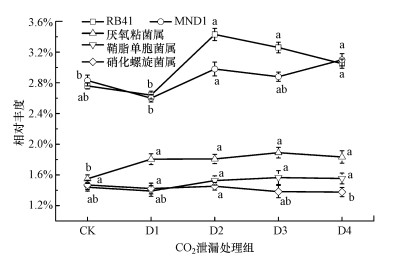 |
| 图 9 属水平优势细菌相对丰度变化 Fig. 9 Changes in relative abundance of predominant genus |
按照Galand等(2009)、Nyirabuhoro等(2009)对细菌的划分方法, 将相对丰度小于0.01%的细菌定义为稀有细菌.在CO2地质封存中, CO2泄漏可能导致因CO2毒性胁迫而出现稻田土壤已有稀有土壤细菌消亡, 或CO2的泄漏诱发土壤环境条件变化而出现新的稀有细菌类型.根据测序所识别的稀有土壤细菌类别, 比较不同分类水平下CK组和CO2泄漏组稀有细菌的存在与否, 可将CK组分为存在和不存在2类, 将CO2泄漏速率组分为不存在、部分存在和全部存在3类.按照CK组和泄漏速率组土壤稀有细菌的组合特征, 可将已检出的稀有细菌分为泄漏适应类、泄漏部分消亡类、泄漏全部消亡类、诱发部分出现类、诱发全部出现类等5种类型(表 2).依据上述分类, 分别统计门和属两个分类水平的土壤稀有细菌的类型及其数量.
| 表 2 基于相对丰度的土壤稀有细菌类型划分 Table 2 Classification of paddy soil rare bacteria based on relative abundance |
在门分类水平上, 共检出16个相对丰度小于0.01%的稀有门(表 3), 其中7个门为CO2泄漏适应类, 5个门属于泄漏部分消亡类, 1个门为泄漏全部消亡类, 1个门属于泄漏部分诱发出现类, 2个门为泄漏诱发全部出现类.在土壤稀有菌门中, 变化最大的两类稀有细菌相对丰度变化见表 4, 即粘胶球形菌门(Lentisphaerae)及柔膜菌门(Tenericutes)为所有CO2泄漏组均可诱发出的稀有细菌门, FBP为CO2泄漏下全部消亡类的稀有细菌门.
| 表 3 CO2泄漏下的门水平土壤稀有细菌类型数统计 Table 3 Statistics on the number of rare phylum under CO2 leakage |
| 表 4 CO2泄漏下消亡和诱发的稀有细菌门的相对丰度 Table 4 Relative abundance of rare phylum that died out and induced under CO2 leakage |
在属分类水平上, 共检出915种相对丰度小于0.01%的稀有细菌(表 5), 其中78属为CO2泄漏适应类, 372属为泄漏部分消亡类, 1属为泄漏全部消亡类, 462属为泄漏部分诱发出现类, 2属为泄漏诱发全部出现类.CO2泄漏诱发全部出现的细菌属包括双头菌属(Labrys)及硫杆菌属(Sulfurifustis), CO2泄漏全部消亡的细菌属为假单胞菌属(Pseudohongiella)(表 6).
| 表 5 CO2泄漏下属水平土壤稀有细菌类型数统计 Table 5 Statistics on the number of rare genus under CO2 leakage |
| 表 6 CO2泄漏下消亡和诱发的稀有菌属的相对丰度 Table 6 Relative abundance of rare genus that died out and induced under CO2 leakage |
本实验通过对不同CO2泄漏速率条件下土壤性质(pH、电导率)及水稻生长指标(株高、根长)的变化研究发现, CO2泄漏导致稻田土壤的pH明显降低, 电导率显著升高;水稻的株高及根长明显减小, CO2的泄漏显著抑制了水稻的生长, 且泄漏速率越大, 影响越严重.这与景立权等(2016)对大气CO2浓度升高对水稻生长的研究结果不同, 可能是由于大气CO2浓度的升高促进了水稻的光合作用, 刺激了水稻的生长, 而稻田土壤中CO2泄漏会导致土壤中氧含量降低, 甚至呈现缺氧状态, 从而引起水稻的光合作用减弱, 抑制水稻生长.
4.2 CO2泄漏条件下稻田土壤细菌多样性的变化就α多样性指数而言, CO2泄漏组的丰富度指数和多样性指数明显高于CK组, 也就是说CO2泄漏使稻田土壤的细菌类型及多样性均有所增加, 而反映均匀度的Pielou′s evenness指数与CK相比均有所降低, 3种多样性指数之间的匹配性良好.这与陈浮等(2017)、张帆等(2015)、张旺园等(2017)对CO2泄漏对各种旱作植物土壤的影响研究结果不同, 其差异可能是由于稻田土壤处于淹水还原环境, 与旱作土壤的性质差异较大;根据土壤pH变化及刘丹等有关稻田水的研究结论(刘丹等, 2020), 在CO2泄漏条件下, 土壤及稻田水的pH由种植前的弱碱性降低到通气后的中性到弱酸性, 土壤酸化现象不明显, 土壤细菌α多样性亦应无明显的指示意义.
综合分析利用PCA、NMDS和聚类分析所反映的稻田土壤细菌的β多样性可以看出:3种方法均能反映CO2泄漏影响下稻田土壤细菌的β多样性随着CO2泄漏速率的变化, 首先明显反映了有CO2泄漏和无CO2泄漏的稻田土壤细菌的差异;其次反映了不同CO2泄漏速率之间的差异.从PCA和NMDS结果发现, PCA反映的是优势菌属的相似性, 而NMDS由于以样本间的非共有物种在所有物种中的比例为特征参数, D2和D3分化较为明显, 能够更好地反映不同样本之间的差异, 即参数选择对分析结果有重要影响.聚类分析结果发现, D2、D3和D4距离相近优先聚为一类, 然后与D1聚为一类, 最后与CK聚为一体, 即与CK组及低CO2泄漏组相比, 高CO2泄漏组之间具有更大的相似性, 此结果与邓红章等(2018)有关黑麦草种植土壤微生物的研究结论基本一致, 但邓红章研究中使用的CO2泄漏浓度概念与本文使用的流量概念没有直接的可比性.本实验采用的CO2泄漏速率分别为0.06、0.12、0.24和0.48 L·m-2·min-1, 相当于Fernández-Montiel等(2015)实验方案的28.8、57.6、105.2和210.4 L·h-1, 显著大于其实验中20 L·h-1和40 L·h-1的低CO2泄漏速率, 本研究结果的D2~D4组间的相近性及其与D1和CK之间的差异性, 与Fernández-Montiel等的研究结果并无冲突, 即在低CO2泄漏速率时, CO2泄漏对土壤细菌无显著影响, 而中高CO2泄漏对土壤细菌具有相对明显的影响.
4.3 CO2泄漏条件下稻田土壤细菌相对丰度的变化细菌组成分析结果表明, 在门水平上稻田土壤的优势细菌为变形菌门、酸杆菌门, 其次是放线菌门、拟杆菌门、绿弯菌门及厚壁菌门, 这与吴朝晖等(2018)、袁红朝等(2015)对稻田微生物的研究结果一致.研究表明, 不同类型耕作土壤的优势菌大多都是变形菌, 变形菌是细菌中最大的门, 喜好在营养富足的土壤环境中生活(Ciccarelli et al., 2006;Jangid et al., 2008;Liu et al., 2015).王光华等(2016)指出酸杆菌对于CO2升高的反应较为敏感;酸杆菌属于嗜酸菌, 应该与CO2泄漏土壤中pH的降低有直接关系(张慧慧等, 2016).当CO2从模拟种植箱体底部泄漏时, 大部分直接向上扩散溶于稻田水中, 使稻田水pH降低, 少部分CO2沿着土壤空隙直接向土壤溶液内扩散, 使稻田土壤pH降低, 直接引起土壤溶液酸化(Andrews et al., 2001).
本文通过对稻田土壤细菌属分类水平上的变化研究发现, 稻田土壤中相对丰度大于1%的已知优势菌属为酸杆菌门的RB41属, 变形菌门的MND1属、厌氧粘菌属和鞘脂单胞菌属, 以及硝化菌门的硝化螺旋菌属, 这一结果与狄霖等(2019)对稻田微生物结构的研究结论基本相同.其中, 厌氧粘菌属、鞘脂单胞菌属于Fe(Ⅲ)还原菌, 可以利用H2、乙酸作为电子供体将三价铁还原为二价铁(Chao et al., 2010), 控制稻田土壤的铁循环过程(Qu et al., 2004).一般认为, Fe(Ⅲ)还原菌一般为厌氧或兼性厌氧微生物(Lovley et al., 1993);已有研究表明, 稻田土壤中的优势Fe(Ⅲ)还原菌为厌氧粘细菌, Fe(Ⅲ)在缺氧状态下被厌氧粘细菌还原(Hori et al., 2010;Call et al., 2011).随着Fe(Ⅲ)还原菌丰度的增加, 促进了Fe(Ⅲ)还原和Fe(Ⅱ)浓度的升高, 在土壤中硫含量较高时, 可与H2S反应生成FeS, 种植箱体周围出现的泛黑现象可能与FeS的存在有直接关系.硝化螺旋菌属于硝化菌门, 能够促进土壤硝化作用的进行, 本实验中CO2泄漏组硝化螺旋菌属的丰度低于CK组, 说明CO2的泄漏抑制了硝化过程的进行.另外, Fe(Ⅱ)也可能参与了NO3-和NO2-的还原过程, 促进反硝化作用的进行(颜青等, 2020).
4.4 CO2泄漏条件下稻田土壤监测指标筛选 4.4.1 优势细菌筛选通过对不同分类水平的优势细菌相对丰度研究可知, 在门分类水平下, 随着CO2泄漏速率的增加, 变形菌门、拟杆菌门、绿弯菌门总体呈减少的趋势, 而酸杆菌门和放线菌门则反之, 厚壁菌门变化规律不明显(图 7).其中, 变形菌门的减少和酸杆菌门的增加最为稳定, 可以作为反映CO2泄漏的优势菌门的监测指标.在属分类水平下, 在CO2泄漏速率增大时, RB41、MND1、厌氧粘菌属及鞘脂单胞菌属的相对丰度总体呈增加趋势, 而硝化螺旋菌属的相对丰度则相反, 其中, CO2泄漏组的厌氧粘菌属的相对丰度与CK组差异明显, RB41、MND1的相对丰度在高泄漏组与CK组差异明显, 而硝化螺旋菌属的相对丰度差异不显著(图 9), 因此, RB41、MND1和厌氧粘菌属的增加可以作为反映CO2泄漏的优势菌属的监测指标.由于变形菌门、酸杆菌门(田地等, 2013;陈浮等, 2017;Delgado-Baquerizo et al., 2018)属于大多数土壤的优势菌门, RB41、MND1及厌氧粘菌属作为湿润地区酸性稻田土壤的优势菌属均有报道(李倩等, 2016;王家楠等, 2019;王晓彤等, 2019;李强等, 2020), 因此, 该结论适用于其他水稻土壤.
4.4.2 稀有细菌筛选根据前述CO2泄漏条件下土壤稀有细菌的分类统计, 泄漏适应类细菌对CO2泄漏无指示意义, 不作为CO2泄漏监测的筛选对象;CO2泄漏消亡类和CO2泄漏诱发出现类均可分为部分和全部消亡或出现, 其中, 全部消亡或全部出现较部分消亡或出现更具有CO2泄漏的指示意义.通过前述CO2泄漏全部消亡类和CO2泄漏诱发全部出现类细菌的环境适应性特征分析, CO2泄漏诱发全部出现的粘胶球形菌门及柔膜菌门均为适宜于厌氧环境的细菌门(van Passel Mark et al., 2011;Skennerton et al., 2016), 双头菌属和硫杆菌属均属于酸性环境中存在的细菌属(Fritz et al., 2004;Kojima et al., 2015), 而CO2泄漏全部消亡的假单胞菌属属于好氧菌(Xu et al., 2016), FBP门的功能还鲜有报道.即CO2泄漏可能会导致一些厌氧、喜酸的细菌出现和好氧菌的消亡.鉴于不同类型土壤稀有菌存在的不确定性和CO2泄漏导致土壤pH变化的阶段性差异, 粘胶球形菌门、柔膜菌门及双头菌属、硫杆菌属等适宜厌氧、酸性环境细菌的指示作用仍需进一步验证.
5 结论(Conclusions)1) 高通量测序方法是利用稻田土壤监测CO2地质封存中CO2泄漏的有效方法, 可以获得在CO2泄漏胁迫下, 稻田土壤细菌多样性、优势细菌及稀有细菌相对丰度的丰富信息.
2) 根据土壤优势细菌相对丰度、差异性分析及变化趋势研究结果, 建议将变形菌门的减少和酸杆菌门的增多, 以及RB41、MND1、厌氧粘菌属的增加作为CO2泄漏监测的推荐指标.
3) 根据本文构建的土壤稀有细菌筛选方法及实验结果, 建议将CO2泄漏下全部出现的粘胶球形菌门、柔膜菌门及双头菌属、硫杆菌属, 以及CO2泄漏后全部消亡的假单胞菌属作为稻田土壤CO2泄漏监测指标筛选中有待验证的指标.
Andrews J A, Schlesinger W H. 2001. Soil CO2 dynamics, acidification, and chemical weathering in a temperate forest with experimental CO2 enrichment[J]. Global Biogeochemical Cycles, 15(1): 149-162. DOI:10.1029/2000GB001278 |
Beaubien S E, Ciotoli G, Coombs P, et al. 2008. The impact of a naturally occurring CO2 gas vent on the shallow ecosystem and soil chemistry of a Mediterranean pasture(Latera, Italy)[J]. International Journal of Greenhouse Gas Control, 2(3): 373-387. DOI:10.1016/j.ijggc.2008.03.005 |
蔡博峰, 李琦, 林千果, 等. 2020. 中国二氧化碳捕集、利用与封存(CCUS)报告(2019)[R]. 北京: 生态环境部环境规划院气候变化与环境政府研究中心
|
陈妮, 马俊杰, 华雯, 等. 2015. 土壤无机离子对CO2封存泄漏的响应[J]. 水土保持通报, 35(1): 37-41. |
陈浮, 杨宝丹, 马静, 等. 2017. 高浓度CO2地下泄漏对土壤微生物群落结构的影响[J]. 土壤学报, 54(1): 180-190. |
Ciccarelli F D, Doerks T, von Mering C, et al. 2006. Toward automatic reconstruction of a highly resolved tree of life[J]. Science, 311(5765): 1283-1287. DOI:10.1126/science.1123061 |
Chao T C, Kalinowski J, Nyalwidhe J, et al. 2010. Comprehensive proteome profiling of the Fe(III)-reducing myxobacterium Anaeromyxobacter dehalogenans 2CP-C during growth with fumarate and ferric citrate[J]. Proteomics, 10(8): 1673-1684. DOI:10.1002/pmic.200900687 |
Call D F, Logan B E. 2011. Lactate oxidation coupled to iron or electrode reduction by geobacter sulfurreducens PCA[J]. Applied & Environmental Microbiology, 77(24): 8791-8794. |
邓书林, 刘芙蓉, 张咏梅, 等. 2016. 增温和CO2浓度加倍对川西亚高山针叶林土壤微生物群落结构的影响[J]. 应用与环境生物学报, 22(1): 20-26. |
邓红章. 2018. 高浓度二氧化碳入侵包气带对土壤-植物的影响研究[D]. 西安: 长安大学
|
狄霖, 刘玲玲, 钟志仁, 等. 2019. 水稻田铁氧化菌的丰度及微生物群落结构组成[J]. 江苏农业科学, 47(10): 296-300. |
Delgado-Baquerizo M, Angela M O, Tess E B, et al. 2018. A global atlas of the dominant bacteria found in soil[J]. Science, 359(6373): 320-325. DOI:10.1126/science.aap9516 |
Fernández-Montiel I, Touceda M, Pedescoll A, et al. 2015. Short-term effects of simulated below-ground carbon dioxide leakage on a soil microbial community[J]. International Journal of Greenhouse Gas Control, 36: 51-59. DOI:10.1016/j.ijggc.2015.02.012 |
Fritz I, Strömpl C, Abraham W, et al. 2004. Phylogenetic relationships of the genera Stella, Labrys and Angulomicrobium within the 'Alphaproteobacteria' and description of Angulomicrobium amanitiforme sp.nov.[J]. International Journal of Systematic & Evolutionary Microbiology, 54(3): 651-657. |
Galand P E, Casamayor E O, Kirchman D L, et al. 2009. Ecology of the rare microbial biosphere of the Arctic Ocean[J]. Proceedings of the National Academy of sciences of the United Stated of America, 105(52): 22427-22432. |
韩耀杰, 张雪艳, 马欣, 等. 2019. 地质封存CO2泄漏对玉米根系形态的影响[J]. 生态学报, 39(20): 7737-7744. |
He W, Moonis M, Chung H, et al. 2016. Effects of high soil CO2 concentrations on seed germination and soil microbial activities[J]. International Journal of Greenhouse Gas Control, 53: 117-126. DOI:10.1016/j.ijggc.2016.07.023 |
Hori T M, Alexandra I, Yasuo C, et al. 2010. Identification of iron-reducing microorganisms in anoxic rice paddy soil by 13C-acetate probing[J]. Isme Journal, 4(2): 267-278. DOI:10.1038/ismej.2009.100 |
IPCC.2014.Climate change 2014: Mitigation of Climate Change//Contribution of Working Group III to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change[M].Cambridge, United Kingdom and New York, USA: Cambridge University Press.18-28
|
IEA.2020.CCUS in Industry and Transformation[OL].Paris: IEA.2020-09-15. https://www.iea.org/reports/ccus-in-industry-and-transformation
|
Jangid K, Williams M A, Franzluebbers A J, et al. 2008. Relative impacts of land-use, management intensity and fertilization upon soil microbial community structure in agricultural systems[J]. Soil Biology and Biochemistry, 40(11): 2843-2853. DOI:10.1016/j.soilbio.2008.07.030 |
纪翔, 王玉涛, 张雪艳, 等. 2019. 植物粟对模拟封存CO2泄漏的生理响应[J]. 中国农业气象, 40(6): 350-356. DOI:10.3969/j.issn.1000-6362.2019.06.002 |
景立权, 赖上坤, 王云霞, 等. 2016. 大气CO2浓度和温度互作对水稻生长发育的影响[J]. 生态学报, 36(14): 4254-4265. |
Kim Y J, He W, Ko D, et al. 2017. Increased N2O emission by inhibited plant growth in the CO2 leaked soil environment: Simulation of CO2 leakage from carbon capture and storage (CCS) site[J]. Science of the Total Environment, 607-608: 1278-1285. DOI:10.1016/j.scitotenv.2017.07.030 |
Kojima H, Shinohara A, Fukui M. 2015. Sulfurifustis variabilis gen.nov.sp nov.a sulfur oxidizer isolated from a lake, and proposal of Acidiferrobacteraceae fam.nov and Acidiferrobacterales ord.nov[J]. International Journal of Systematic And Evolutionary Microbiology, 65(10): 3709-3713. |
李小春, 刘延锋, 白冰, 等. 2006. 中国深部咸水含水层CO2储存优先区域选择[J]. 岩石力学与工程学报, (5): 963-968. DOI:10.3321/j.issn:1000-6915.2006.05.015 |
刘丹, 马俊杰, 程萌, 等. 2020. CO2泄漏对稻田水基础水质指标的影响研究[J]. 环境科学学报, 40(4): 1298-1308. |
Liu J J, Sui Y Y, Yu Z H, et al. 2015. Soil carbon content drives the biogeographical distribution of fungal communities in the black soil zone of northeast China[J]. Soil Biology and Biochemistry, 83: 29-39. DOI:10.1016/j.soilbio.2015.01.009 |
Lovley D R. 1993. Dissimilatory metal reduction-annual review of microbiology[J]. Iron Manganese Uranium Selenium Chromium, 47(1): 263. |
李强. 2020. 土地利用方式对岩溶断陷盆地土壤细菌和真核生物群落结构的影响[J]. 地球学报. DOI:10.3975/cagsb.2020.100701 |
李倩, 袁玲, 杨水平, 等. 2016. 连作对黄花蒿生长及土壤细菌群落结构的影响[J]. 中国中药杂志, 41(10): 1803-1810. |
聂莉娟, 马俊杰, 赵雪峰, 等. 2015. 模拟CCS技术CO2泄漏对C3、C4作物土壤化学性质的影响[J]. 水土保持学报, 29(5): 200-205. |
Nyirabuhoro P, Liu M, Xiao P, et al. 2020. Seasonal variability of conditionally rare taxa in the water column bacterioplankton community of subtropical reservoirs in China[J]. Microbial Ecology, 80(1): 14-26. DOI:10.1007/s00248-019-01458-9 |
Oppermann B I, Michaelis W, Blumenberg M, et al. 2010. Soil microbial community changes as a result of long-term exposure to a natural CO2 vent[J]. Geochemica Cosmochimica Acta, 74(9): 2697-2716. DOI:10.1016/j.gca.2010.02.006 |
裴宇, 赵晓红, 邓红章, 等. 2016. 高浓度二氧化碳入侵对土壤理化性质的影响[J]. 当代化工, 45(4): 682-686. DOI:10.3969/j.issn.1671-0460.2016.04.007 |
Qu D, Ratering S, Schnell S. 2004. Microbial reduction of weakly crystalline iron (III) oxides and suppression of methanogenesis in paddy soil[J]. Bulletin of environmental contamination and toxicology, 72(6): 1172-1181. |
Skennerton C T, Haroon M F, Briegel A, et al. 2016. Phylogenomic analysis of Candidatus 'Izimaplasma' species: free-living representatives from a Tenericutes clade found in methane seeps[J]. Isme Journal, 10(11): 2679-2692. DOI:10.1038/ismej.2016.55 |
田地, 马欣, 李玉娥, 等. 2013. 利用高通量测序对封存CO2泄漏情景下土壤细菌的研究[J]. 环境科学, 34(10): 4096-4104. |
van Passel Mark W J, Kant Ravi, Palva Airi, et al. 2011. Genome sequence of Victivallis vadensis ATCC BAA-548, an anaerobic bacterium from the phylum Lentisphaerae, isolated from the human gastrointestinal tract[J]. Journal of Bacteriology, 193(9): 2373-2374. DOI:10.1128/JB.00271-11 |
West J M, Pearce J M.2006.Environmental Issues and the Geological Storage of CO2 a European Perspective[C].International Conference on Greenhouse Gas control
|
伍洋, 马欣, 李玉娥, 等. 2012. 地质封存CO2泄漏对农田生态系统的影响评估及耐受阈值[J]. 农业工程学报, 28(2): 196-205. DOI:10.3969/j.issn.1002-6819.2012.02.035 |
吴朝晖, 刘清术, 孙继民, 等. 2018. 基于高通量测序的超级稻不同生育期土壤细菌和古菌群落动态变化[J]. 农业现代化研究, 39(2): 342-351. |
王光华, 刘俊杰, 于镇华, 等. 2016. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 32(2): 14-20. |
王家楠, 蒋勇军, 贺秋芳, 等. 2019. 中梁山岩溶槽谷区荒草地土壤微生物群落对隧道建设的响应[J]. 生态学报, 39(16): 6136-6145. |
王晓彤, 蓝兴福, 安婉丽, 等. 2019. 模拟酸雨对福州平原稻田土壤细菌丰度及多样性的影响[J]. 中国环境科学, 39(3): 1237-1244. DOI:10.3969/j.issn.1000-6923.2019.03.041 |
Xu L, Wu Y H, Jian S L, et al. 2016. Pseudohongiella nitratireducens sp nov, : , isolated from seawater, and emended description of the genus pseudohongiella[J]. International Journal of Systematic and Evolutionary Microbiology, 66(12): 5155-5160. DOI:10.1099/ijsem.0.001489 |
袁红朝, 吴昊, 葛体达, 等. 2015. 长期施肥对稻田土壤细菌、古菌多样性和群落结构的影响[J]. 应用生态学报, 26(6): 1807-1813. |
颜青, 赖睿特, 张克强, 等. 2020. 土壤化学反硝化及N2O产生机理研究进展[J]. 环境科学研究, 33(3): 736-743. |
张丙华, 张倩, 耿春香, 等. 2016. 地质封存CO2泄露对土壤理化性质的影响[J]. 广州化工, 44(7): 156-159. DOI:10.3969/j.issn.1001-9677.2016.07.054 |
张慧慧, 李春荣, 王文科, 等. 2016. 高通量测序助力地质封存CO2泄漏情景下土壤细菌群落信息的挖掘[J]. 农业环境科学学报, 35(12): 2440-2448. DOI:10.11654/jaes.2016-0835 |
张帆, 李春荣, 邓红章, 等. 2015. 高浓度CO2入侵包气带对土壤微生物的影响[J]. 应用化工, 44(10): 1779-1783. |
张旺园, 张绍良, 陈浮, 等. 2017. 模拟地下CO2泄漏对土壤微生物群落的短期影响[J]. 农业环境科学学报, 36(6): 1167-1176. |
 2021, Vol. 41
2021, Vol. 41


