2. 中国科学院生态环境研究中心, 环境水质学国家重点实验室, 北京 100085
2. State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
氟元素是人类生命活动所必需的微量元素, 对牙齿、骨骼的生长发育都有一定促进作用;但同时也是目前仅有的经饮用水长期暴露会导致人群健康危害的两项指标之一(Wang et al., 2007; Jadhav et al., 2015).摄入氟元素超标, 会引起氟骨病、氟斑牙等疾病;也有研究证实摄氟过多对儿童智力有一定影响(刘锐平, 2019; Yadav et al., 2019).中国成为全世界氟中毒人数最多的国家之一, 主要有两个原因: 一是我国有近八千万人生活在高氟水地区, 二是对含氟的表面活性剂、加工助剂等全氟化合物的大量使用对地表河流造成污染(王鑫璇等, 2018;方淑红等, 2019).我国《生活饮用水卫生标准》(GB 5749—2006)规定饮用水中氟含量小于1 mg·L-1;世界卫生组织建议饮用水氟含量不得大于1.5 mg·L-1(Organization, 2011).目前, 主流除氟技术有吸附法、混凝沉淀法、膜分离法(反渗透、电渗析等)等.吸附法以其成本低廉、操作管理方便、技术成熟和吸附剂再生容易等特点成为除氟工程中的普遍技术, 但大多数吸附剂的主要缺点吸附容量低、处理容量小等也在一定程度上限制了它的发展(Etawi et al., 2007).国内外常用的吸附剂有活性氧化铝(刘雪岩等, 2012)、羟基磷灰石、沸石、新型磁性氧化锆等.羟基磷灰石(Hydroxyapatite, 简称HAP)常用作生物活体性材料, 由于其表面性能优异、易再生等优点, 成为一种新型环境功能材料应用于废水除氟和饮用水净化工程中(Sankannavar et al., 2019).
羟基磷灰石的分子式为Ca5(PO4)3(OH), 为六方晶系, 结构为六角柱体.研究表明, HAP主要是通过—OH交换F-生成氟磷灰石Ca5(PO4)3F或者通过双水解反应生成CaF2去除水体的氟离子(Bhatnagar et al., 2011; Chen et al., 2016).HAP因其吸附容量十分有限, 需要通过表面改性或掺杂离子、外加剂及有机物来改变HAP微晶形态, 提高HAP的吸附容量(Prabhu et al., 2016).Muthu等(2014)通过阳离子表面活性剂改性后的HAP材料除氟容量提升了3倍多, 且除氟速率增加.Sahu等(2015)通过湿化学法将Al3+掺杂在羟基磷灰石表面, 比表面积增加到157.96 m2·g-1.Nie等(2012)利用共沉淀法制备了铝改性羟基磷灰石(Al-HAP), 增加了表面的羟基吸附位点, 对氟的吸附效果提升了两倍.
本研究以化学沉淀法制备了Al13([AlO4Al12(OH)24(H2O)12]7+)改性后的羟基磷灰石吸附材料, 以应用于生活饮用水或中水回用, 以及中度氟化物污染废水中氟的去除.对制备的吸附材料进行FTIR、SEM、XRD、BET等测试以表征吸附材料的结构和理化性质, 并通过批量实验研究pH效应、吸附动力学、吸附等温线, 以期深入了解其除氟性能和机理, 更好地推广应用.
2 材料与方法(Materials and methods) 2.1 主要实验材料与设备四水合硝酸钙(AR, 国药集团上海化学试剂有限公司)、磷酸氢二铵(AR, 国药集团上海化学试剂有限公司)、氨水溶液、氢氧化钠(AR, 国药集团上海化学试剂有限公司)、六水合氯化铝(AR, 上海阿拉丁生化科技股份有限公司)、氟化钠(AR, 国药集团上海化学试剂有限公司).
氟离子选择性电极(雷磁PXSJ-216F)、恒温振荡箱、电子天平、电磁搅拌器(90-4, 上海振荣科学仪器有限公司)、pH计(梅特勒FE28)、冷冻干燥机(LGT-10, 北京天林恒泰有限公司)、马弗炉(上海一恒SX2-4-13N).
2.2 实验方法 2.2.1 改性HAP的制备利用慢速滴碱法制备出[OH+]与[Al3+]物质的量的比为2.2∶1的PACl溶液, 然后加硫酸钠形成硫酸铝十三沉淀, 利用氯化钡溶液置换出Alb含量大于90%, Al含量为0.1 mol·L-1的Al13溶液;向(NH4)2HPO4溶液中加入5%氨水调节pH至10左右, 配置成(NH4)3PO4溶液.然后在65 ℃的条件下分别将配置好的Al13溶液和(NH4)3PO4溶液按一定的比例(Al/Ca=0.7、0.4、0.15)缓慢加入装有一定量Ca(NO3)2溶液的三口烧瓶中, 保持快速搅拌使其反应充分;快速搅拌反应6 h后停止搅拌, 陈化6~8 h, 将生成的白色沉淀抽滤洗涤至滤液pH=7, 置于冷冻干燥机干燥后于650 ℃条件下烧结6 h, 最后研磨成细颗粒.
2.2.2 吸附热力学和吸附动力学通过吸附热力学的研究可以了解吸附过程进行的程度和驱动力, 间接的证明吸附反应能否自发进行, 也可以深入的分析各种因素对吸附过程影响的原因(He et al., 2016).Al13-HAP吸附剂投加量为1 g·L-1, 初始F-浓度为1~6 mg·L-1, 置于50 mL离心管中, 分别在20、25、30 ℃振荡培养箱反应24 h, 取上清液过0.45 μm滤膜, 测量氟离子浓度.根据实验结果计算出相应的焓变(ΔH)、熵变(ΔS)和吉布斯自由能(ΔG), 并模拟计算出Langmuir和Freundlich等温模型(Horsfall et al., 2005).
在1 L烧杯中加入一定体积的5 mg·L-1 F-溶液, 称取一定质量的Al13-HAP吸附剂, 在25 ℃下不断搅拌, 每隔一段时间取4 mL上清液过0.45 μm滤膜, 测量滤液的氟离子浓度.对实验结果采用一、二级动力学拟合.
2.3 改性HAP的结构表征红外光谱分析采用傅里叶变换红外光谱仪(FTIR-650), 扫描范围为400~4000 cm-1, 分辨率为4 cm-1·s-1.用扫描电子显微镜(SU 8000)观察吸附材料表面形貌, 观察前对样品表面进行70 s喷金处理.用D8 Advance型X射线衍射仪进行晶相分析, 扫描范围为2θ=3°~70°, 扫描速度为5°·min-1, 管电压为40 kV, 管电流为40 mA, 铜靶Kα辐射, 波长λ=0.15406 nm.利用比表面积分析仪(Belsorp-max ver2.1)测定材料的吸脱附曲线, 选用氮气为吸附气体, 经过BET方法和BJH方法计算材料的比表面积与空隙体积.
3 结果与讨论(Results and discussion) 3.1 Al13-HAP的结构表征为了研究化学沉淀法合成的Al13-HAP材料的矿化性质, 从X-ray diffraction(XRD)结果得到了改性前后的HAP吸附材料的晶体信息, 如图 1a所示.XRD光谱中出现了明显的衍射峰, 其中衍射角2θ=26.04°(002)、31.82°(211)、49.65°(213)、53.28°(004)的衍射峰为HAP晶体的特征衍射峰(JCPDS No.74-0566)(Mourabet et al., 2015);但其强度发生了明显的变化.在衍射角2θ=39.68°处出现了Al(222)平面结构的衍射峰(Sahu et al., 2015).当Al/Ca值增大时, 各衍射峰峰强降低, 同时晶体性变差.根据(002)处衍射峰位置计算出HAP该位置层间距为6.906 Å, 随着Al/Ca值增大, 层间距降低了0.03~0.07 Å.这可能由于HAP属于六方晶系, 原子紧密堆积, 理论晶胞常数c=6.881 Å, 当体积较小的Al13(旋转半径为6 Å)基团嵌入其中时, 晶格产生缺陷, 导致层间距降低;同时也说明掺入的阳离子基团与阴离子排斥力降低(Hermann-Muñoz et al., 2019; Xilong et al., 2019).
 |
| 图 1 不同Al/Ca值的Al13-HAP的XRD(a)与FTIR(b) Fig. 1 XRD (a) and FTIR (b) of Al13-HAP with different Al / Ca |
改性前后的HAP吸附材料的Fourier Transform infrared spectroscopy(FTIR)结果见图 1b.表明HAP的形成的重要依据主要由于PO4基团振动的不对称拉伸模式在1000~1200 cm-1处的显示出的特征峰(Singh et al., 2020).在1091.51、1029.80 cm-1处出现了明显属于PO4基团的拉伸振动特征峰;在563.11、599.75 cm-1处出现属于PO4基团的弯曲振动特征峰;在3436.53、3569.59、1635.34 cm-1处的吸收峰属于羟基的伸缩振动, 其中3569.59 cm-1处的峰可能由于Al13上的—OH引起的, 3种不同Al/Ca比值的Al13-HAP的峰强均大于HAP材料, 说明Al13的改性使得材料中—OH数量增加(Gogoi et al., 2015; Tomar et al., 2015).在630.61 cm-1处的峰可能是Al···P键引起的P···O键的弯曲振动改变所产生的(Bouiahya et al., 2019).
用Scanning Electron Microscope(SEM)分析了改性前后的HAP吸附材料的表面形态, 用Energy Dispersive Spectrometer(EDS)元素分布, 结果如图 2所示.从图 2a中看出未经改性的HAP形态为短棒状, Al13的掺入改变了HAP原有的形态结构, 不同Al/Ca比值的Al13-HAP均比HAP更加蓬松多孔, 且颗粒粒径降低.当Al/Ca=0.15、0.4时, Al13-HAP的形态为扁平柱状, 径向直径变小, 长度略微改变, 而当Al/Ca增大到0.7时, Al13-HAP形态变的不规则, 颗粒粒径更小, 整体变得更为蓬松.同时Al13-HAP中氧元素占比大于HAP.图 2b为Al/Ca=0.4的能谱面扫图, 可以看到铝元素与氧元素所在位置绝大面积重合, 说明Al13-HAP中氧元素的增加与Al13的掺入有关.
 |
| 图 2 不同Al/Ca值的Al13-HAP的扫描电镜图(a)及Al/Ca=0.4的能谱面扫图(b) Fig. 2 SEM of Al13-HAP with different Al / Ca values(a) and EDS surface scan of Al / Ca = 0.4(b) |
Brunauer-Emmet-Teller(BET)比表面积测试法测试结果如表 1所示, 不同Al/Ca值的Al13-HAP材料比表面积及孔径均比原HAP材料增长了数倍.随着Al/Ca值的增大, 比表面积逐渐增大, 同时孔径稍微减少, 孔容增大, 说明Al/Ca值越大, Al13-HAP材料更加疏松多孔.当Al/Ca=0.7时, 比表面积最大为137.2001 m2·g-1.说明Al13的掺入通过增加比表面积和孔容, 增多了Al13-HAP表面的活性位点, 有利于增大材料的吸附容量和吸附速率.
| 表 1 不同Al/Ca值的Al13-HAP的BET测试结果 Table 1 BET results of Al13-HAP with different Al/Ca |
对不同Al/Ca比值的Al13-HAP进行吸附实验, 初始F-浓度为5 mg·L-1, 吸附剂投加量为1 g·L-1, 结果如图 3a所示.吸附开始时Al13-HAP材料的吸附效果优于HAP材料, 在120 min后表现的最为明显.Al/Ca值为0.4时, Al13-HAP的吸附效果优于Al/Ca=0.7, 但是Al/Ca=0.4的Al13-HAP的比表面积远小于Al/Ca=0.7的Al13-HAP, 说明Al13-HAP吸附F-不仅存在物理作用, 同时也有化学作用.此外, 测定了3种Al13-HAP材料吸附实验后溶液中的余铝浓度, 以确定其铝离子的消耗量;微波消解Al13-HAP材料, 之后测定其含铝量, 结果如图 3b所示.3种材料的吸附实验后溶液中的余铝浓度分别为0.10、0.14、0.21 mg·L-1, 算出铝离子消耗比例分别为0.17%、0.12%、0.12%.这表明Al13-HAP在除氟过程中比较稳定.根据上述结果, 后续吸附实验均使用Al/Ca=0.4的Al13-HAP材料.
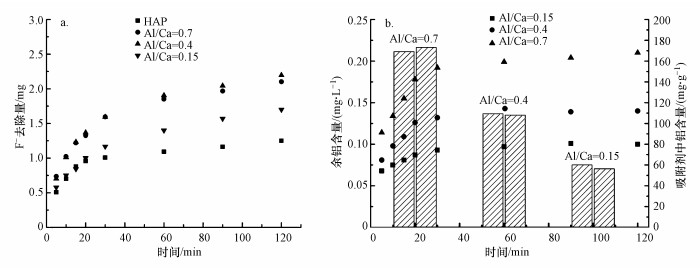 |
| 图 3 不同吸附材料的吸附F-及其余铝曲线 Fig. 3 Adsorption F- and residual aluminum curves of different adsorption materials |
用500 mg·L-1 F-储备液分别稀释出50 mL不同F-浓度样品, 用0.1 mol·L-1 NaOH溶液或5%盐酸调接pH值至4~9, 再分别加入0.05 g Al13-HAP吸附材料, 反应24 h后取样测剩余F-浓度.因Al13-HAP材料无特性吸附官能团, pH值的高低会影响Al13-HAP材料表面电荷形态, 了解该材料的零电荷点pHpzc对了解pH值的影响极其重要(何豪等, 2019).本次测量零电荷点采用质量滴定法.
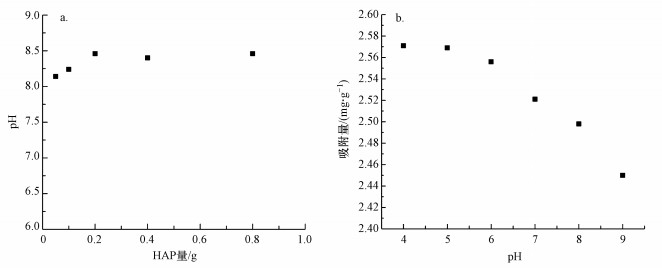 |
| 图 4 pH值对Al13-HAP除氟影响 (a.pHPZC, b.pH值影响) Fig. 4 Effect of pH value on fluoride removal byAl13-HA(a. pHPZC, b.pH effect) |
根据图 4a的结果, Al13-HAP的pHpzc=8.46.图 4b为pH值对Al13-HAP吸附材料的除氟效果影响.随着pH值的不断增大, Al13-HAP的吸附容量随之下降.在极强酸性条件下, 氟离子多以电中性HF的形式存在, 不利于与吸附材料的吸附, 故不作考虑(Singh et al., 2020).在pH为4~6时, Al13-HAP的吸附容量下降并不快, 这是因为此时材料表面形成—OH2+从而带正电, F-可通过静电吸引被吸附到材料表面(Krestou et al., 2004).当pH值逐渐升高时, 溶液中OH-含量增加, 同时吸附材料表面可结合活性位点减少, F-与材料中—OH竞争中未占优势, 导致吸附效果下降加快.Chen等(2018)证明当pH值高于HAP的零电荷点(pHpzc=8.15)时, 此时吸附材料表面带负电荷, 减弱了F-与材料表面的静电吸引, 降低了F-与材料中—OH竞争的能力.当pH=9, 此时远大于Al13-HAP的零电荷点, 故此时材料的吸附容量下降幅度加大.由于Al13-HAP的pHpzc大于HAP, 故其对天然水体的适用范围更加广泛.
3.2.3 吸附热力学在吸附过程中, 温度可能会是影响材料吸附效果的主要因素.通过Al13-HAP对氟离子的热力学研究能预测化学反应和化学平衡随温度的变化.本研究的热力学参数如表 4所示.结果显示, 在3种温度下吉布斯自由能ΔG均为负值, 这说明反应是自发进行的, 不需要提供外加能源.当温度由293 K增加到303 K时, ΔG由-14.76 kJ·mol-1降低至-15.76 kJ·mol-1, 说明随着温度的升高, 反应自发进行倾向加深;焓变值ΔH大于零, 说明Al13-HAP对氟离子的吸附过程吸热, 提升温度有利于反应的进行;熵变ΔS为正值, 说明当吸附剂吸附氟离子时, 固液界面处的随机性增加, 无序程度加深(Maity et al., 2020).
| 表 2 不同温度下的吸附等温线参数 Table 2 Adsorption isotherm parameters at different temperatures |
| 表 3 吸附动力学参数 Table 3 Adsorption kinetic parameters |
| 表 4 热力学各参数 Table 4 Thermodynamic parameters |
利用Langmuir等温模型对实验数据进行处理, 结果如图 5a所示, 图 5b为Freundlich等温模型拟合处理结果.在30 ℃条件下最大吸附量为5.03 mg·g-1, 而以相同条件制备的普通聚合氯化铝改性后的HAP材料最大吸附量为2.65 mg·L-1.综合比较表 1中Langmuir与Freundlich等温模型拟合方程的决定系数R2, 在293 K和298 K时, Langmuir等温模型略优于Freundlich等温模型的拟合模型, 但在303 K时, Langmuir等温模型拟合结果更适合描述Al13-HAP的除氟过程.这可能是由于温度升高时, 固液界面的无序程度加深, 此时物理吸附作用减弱, 化学吸附作用增强, 而吸附剂表面活性位点分布均匀, 使得此温度条件下更适合Langmuir等温模型拟合(Dong et al., 2013;Wang et al., 2020).上述结果说明改性后的HAP吸附材料更趋近于单层吸附, 吸附过程中化学吸附占主导地位, 物理吸附为辅助作用.
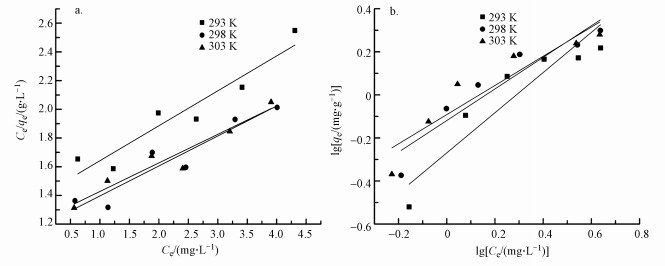 |
| 图 5 不同温度下Al13-HAP对氟的吸附等温线 (a.Langumir;b.Freundlich) Fig. 5 Adsorption isotherms of fluoride by Al13-HAP at different temperatures(a.Langumir; b.Freundlich) |
通过吸附动力学研究能够评估Al13-HAP的吸附效率.图 6显示了在298 K下的拟一级动力学方程和拟二级动力学方程.综合比较拟一级动力学方程和拟二级动力学方程, 该材料吸附过程更符合二级动力学方程, 对氟离子的吸附过程以化学吸附为主导.
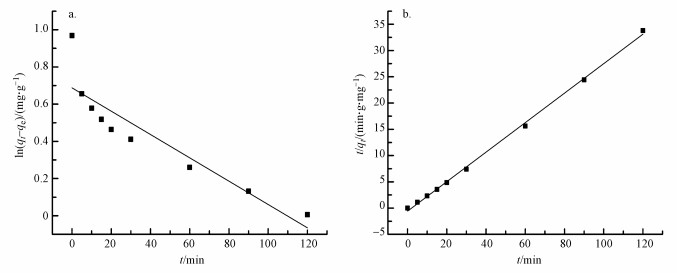 |
| 图 6 Al13-HAP对氟的吸附动力学 (a.准一级动力学;b.准二级动力学) Fig. 6 Adsorption kinetics of fluoride by Al13-HAP (a. Pseudo-first-order kinetics; b. Pseudo-secend-order kinetics) |
图 7a为Al13-HAP吸附F-前后的XRD图.吸附F-后, 代表HAP的主要特征峰从27.24°(210)→27.30°, 31.82°(211) →31.76°, 49.60°(223)→49.47°, 53.20°(004)→53.40°, 代表Al平面结构的特征峰39.68°(222)偏移到39.64°, 同时各峰强度稍微降低.特征峰的偏移可能归因于F-通过交换离子吸附到Al13-HAP的非均匀表面上, 从而引起Al13-HAP晶格的变化(Xia et al., 2019).
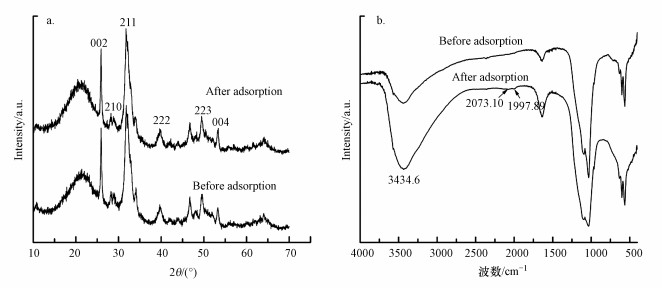 |
| 图 7 Al13-HAP吸附F-前后对比 (a. XRD, b. FTIR) Fig. 7 Comparison of adsorption of F- by Al13-HAP(a. XRD, b. FTIR) |
图 7b为Al13-HAP吸附F-前后的FTIR图.吸附F-后, 红外光谱在3434.6 cm-1峰附近较于吸附前有明显的加深展宽, 这证明了在吸附过程中有OH2+···F键的形成, 由于—OH与F-具有相似的尺寸, 它们可以通过配体交换实现同构置换;在1997.89 cm-1与2073 cm-1处产生的新峰预示着水相中Al13-HAP界面上存在F···H···O键合阶段(Nayak et al., 2017).
图 8为Al13-HAP吸附F-后的SEM/EDS面扫描分析结果, 图 8b为面扫元素分布图, 图中1区域为Al含量高的同时F分布也相对密集, 2区域Al含量低的同时F分布也相对稀疏, 可以看出在Al与F所处区域情况基本一致, 由此说明Al13上的—OH基团大部分被F-取代.
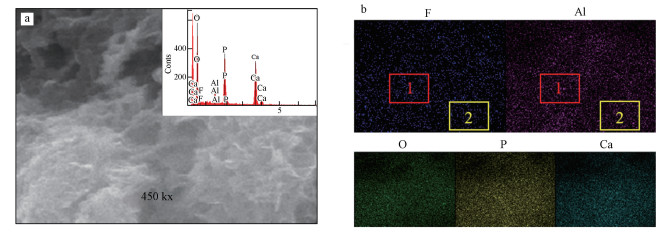 |
| 图 8 Al13-HAP吸附后的面扫描图 (a. SEM, b.元素分布图) Fig. 8 Surface scan of Al13-HAP after adsorption(a. SEM, b. elemental map) |
根据前面所作一系列表征的分析结果, 如图 9所示, Al13-HAP相较于未改性的HAP具有两大优点: 比表面积变大和—OH基团数量增多.Al13-HAP吸附氟主要归因于静电吸引, 配体交换, 氢键作用以及离子交换.在pH小于8.46时, Al13-HAP表面携带正电荷, 大部分F-通过静电作用吸附在材料表面, 其过程如式7所示, 比表面积的增大, Al13-HAP的表面活性位点随之增加, 提高了静电吸引F-的容量.根据FTIR表征结果, 在吸附过程中有OH2+···F键的形成也证实了这一推断.当pH值继续升高, Al13-HAP表面带负电荷, 此时静电作用不再生效.由于F-与—OH具有相似的尺寸, 且更具有亲核性, F-与Al13-HAP材料表面的(OH2)+发生配体交换, 其反应过程如式(8)所示.在pH小于pHPZC=8.46时, 小部分F-会与Al13-HAP表面的—OH通过氢键结合(Samant et al., 2020), 如式(9)所示, FTIR结果也证实了F···H···O键合阶段.有研究表明HAP中的—OH可以在电场中移动, 在含氟溶液中, 一部分被吸附在Al13-HAP表面的F-会直接与相邻近的可移动的—OH交换;同时F-也会直接取代Al13上的—OH(Fan et al., 2003; Wang et al., 2020).
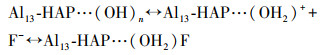
|
(7) |

|
(8) |

|
(9) |
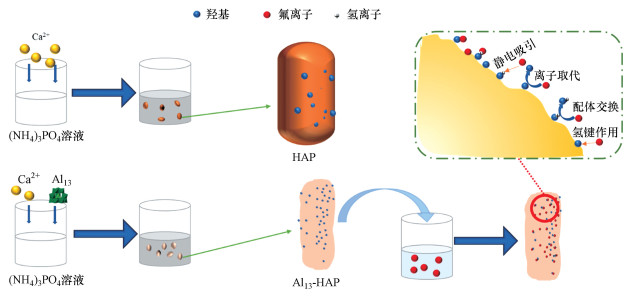 |
| 图 9 Al13-HAP的的大致除氟机理 Fig. 9 The possible mechanism of fluoride removal by Al13-HA |
1) Al13-HAP吸附材料对含氟水吸附实验中表现了吸附速率快, 吸附容量高和去除效果稳定等特点, 其制作工艺简单, 方便, 可批量生产.Al/Ca升高, Al13-HAP除氟性能得到提升, 但同时晶体性越差, 到了一定值反而除氟性能会降低.Al13改性HAP通过带入更多的—OH官能团和提升材料比表面积, 提高材料的除氟能力, 并且对天然水体的适用范围较广.
2) Al13-HAP吸附材料比表面积最大为137.2001 m2·g-1, 孔径为23.9567 nm.Al13-HAP吸附材料符合Langmuir等温吸附模型, 通过对吸附动力学数据模型的计算, 此吸附过程符合二级动力学模型;根据吸附热力学分析, 此吸附过程属于化学吸附, 且是一个自发的吸热过程.Al13-HAP除氟的机理主要是静电吸引和配体交换两个步骤, 同时也存在离子交换和氢键作用.
Bhatnagar A, Kumar E, Sillanpää M. 2011. Fluoride removal from water by adsorption-A review[J]. Chemical Engineering Journal, 171(3): 811-840. DOI:10.1016/j.cej.2011.05.028 |
Bouiahya K, Es-Saidi I, El Bekkali C, et al. 2019. Synthesis and properties of alumina-hydroxyapatite composites from natural phosphate for phenol removal from water[J]. Colloid and Interface Science Communications, 31: 100188. DOI:10.1016/j.colcom.2019.100188 |
Chen L, Zhang K, He J, et al. 2016. Enhanced fluoride removal from water by sulfate-doped hydroxyapatite hierarchical hollow microspheres[J]. Chemical engineering journal (Lausanne, Switzerland: 1996), 285: 616-624. |
Chen Z, Liu Y, Mao L, et al. 2018. Effect of cation doping on the structure of hydroxyapatite and the mechanism of defluoridation[J]. Ceramics International, 44(6): 6002-6009. DOI:10.1016/j.ceramint.2017.12.191 |
Dong J, Hu J, Wang J. 2013. Radiation-induced grafting of sweet sorghum stalk for copper(Ⅱ) removal from aqueous solution[J]. Journal of Hazardous Materials, 262: 845-852. DOI:10.1016/j.jhazmat.2013.09.060 |
Etawi H, Al-Rawajfeh A E, Al-Ma'Abreh A, et al. 2018. Efficiency and mechanism of water defluoridation by mixtures of Jordanian Zeolite, Pozzolana, Feldspar, and Tripoli[J]. Desalination & Water Treatment, 125(SEP.): 75-80. |
方淑红, 岳月, 李成, 等. 2019. 四川省不同地区自来水中全氟化合物的污染特征及健康风险评估[J]. 环境科学学报, 39(4): 1234-1240. |
Fan X. 2003. Adsorption kinetics of fluoride on low cost materials[J]. Water Research, 37(20): 4929-4937. DOI:10.1016/j.watres.2003.08.014 |
Gogoi S, Nath S K, Bordoloi S, et al. 2015. Fluoride removal from groundwater by limestone treatment in presence of phosphoric acid[J]. Journal of Environmental Management, 152: 132-139. |
何豪, 朱宗强, 刘杰, 等. 2019. 镁-钙羟基磷灰石吸附剂对水中Pb2+的去除[J]. 环境科学, 40(9): 4081-4090. |
He J, Zhang K, Wu S, et al. 2016. Performance of novel hydroxyapatite nanowires in treatment of fluoride contaminated water[J]. Journal of Hazardous Materials, 303: 119-130. DOI:10.1016/j.jhazmat.2015.10.028 |
Hermann-Muñoz J A, Rincón-López J A, Clavijo-Mejía G A, et al. 2019. Influence of HVOF parameters on HAp coating generation: An integrated approach using process maps[J]. Surface & Coatings Technology, 358: 299-307. |
Horsfall Jnr M, Spiff A I. 2005. Effect of temperature on the sorption of Pb2+ and Cd2+ from aqueous solution by caladium bicolor (wild cocoyam) biomass[J]. Electronic Journal of Biotechnology, 8(2): 162-169. DOI:10.2225/vol8-issue2-fulltext-4 |
Jadhav S, Bringas E, Yadav C, et al. 2015. Arsenic and fluoride contaminated groundwaters: A review of current technologies for contaminants removal[J]. Journal of Environmental Management, (162): 306-325. |
Krestou A, Xenidis A, Panias D. 2004. Mechanism of aqueous uranium(Ⅵ) uptake by hydroxyapatite[J]. Minerals Engineering, 17(3): 373-381. DOI:10.1016/j.mineng.2003.11.019 |
刘锐平. 2019. 饮用水氟污染控制原理与技术[J]. 应用生态学报, 30(1): 30-36. |
刘雪岩, 姜鑫, 逯义, 等. 2012. 纳米γ-Al2O3去除氟离子的机理及行为研究[J]. 环境科学学报, 32(8): 1833-1841. |
Mourabet M, El Rhilassi A, El Boujaady H, et al. 2015. Removal of fluoride from aqueous solution by adsorption on hydroxyapatite (HAp) using response surface methodology[J]. Journal of Saudi Chemical Society, 19(6): 603-615. DOI:10.1016/j.jscs.2012.03.003 |
Muthu Prabhu S, Meenakshi S. 2014. Synthesis of surface coated hydroxyapatite powders for fluoride removal from aqueous solution[J]. Powder Technology, 268: 306-315. DOI:10.1016/j.powtec.2014.08.041 |
Nayak B, Samant A, Patel R, et al. 2017. Comprehensive understanding of the kinetics and mechanism of fluoride removal over a potent nanocrystalline hydroxyapatite surface[J]. ACS Omega, 2(11): 8118-8128. DOI:10.1021/acsomega.7b00370 |
Nie Y, Hu C, Kong C. 2012. Enhanced fluoride adsorption using Al (Ⅲ) modified calcium hydroxyapatite[J]. Journal of Hazardous Materials, 233-234: 194-199. DOI:10.1016/j.jhazmat.2012.07.020 |
Organization W H. 2011. Guidelines for Drinking-water Quality 4th Ed[M]. Switzerland: WHO Press: Geneva.
|
Prabhu S M, Elanchezhiyan S S, Lee G, et al. 2016. Assembly of nano-sized hydroxyapatite onto graphene oxide sheets via in-situ fabrication method and its prospective application for defluoridation studies[J]. Chemical Engineering Journal, 300: 334-342. DOI:10.1016/j.cej.2016.04.111 |
Sahu H, Mohanty K. 2015. Al grafted natural hydroxyapatite for neem oil transesterification: Kinetic study at optimal point[J]. Chemical Engineering Journal, 280: 564-574. DOI:10.1016/j.cej.2015.06.040 |
Samant A, Nayak B, Misra P K. 2017. Kinetics and mechanistic interpretation of fluoride removal by nanocrystalline hydroxyapatite derived from Limacine artica shells[J]. Journal of Environmental Chemical Engineering, 5(6): 5429-5438. DOI:10.1016/j.jece.2017.09.058 |
Sankannavar R, Chaudhari S. 2019. An imperative approach for fluorosis mitigation: Amending aqueous calcium to suppress hydroxyapatite dissolution in defluoridation[J]. Journal of Environmental Management, 245: 230-237. DOI:10.1016/j.jenvman.2019.05.088 |
Singh S, Khare A, Chaudhari S. 2020. Enhanced fluoride removal from drinking water using non-calcined synthetic hydroxyapatite[J]. Journal of Environmental Chemical Engineering, 8(2): 103704. DOI:10.1016/j.jece.2020.103704 |
Tomar G, Thareja A, Sarkar S. 2015. Enhanced fluoride removal by hydroxyapatite-modified activated alumina[J]. International Journal of Environmental Science and Technology, 12(9): 2809-2818. DOI:10.1007/s13762-014-0653-5 |
Wang J, Guo X. 2020. Adsorption isotherm models: Classification, physical meaning, application and solving method[J]. Chemosphere, 258: 127279. DOI:10.1016/j.chemosphere.2020.127279 |
Wang S, Wang Z, Cheng X, et al. 2007. Arsenic and fluoride exposure in drinking water: Children's IQ and growth in Shanyin County, Shanxi Province, China[J]. Environmental Health Perspectives, (115): 643-647. |
王鑫璇, 张鸿, 王艳萍, 等. 2018. 中国七大流域全氟烷基酸污染水平与饮水暴露风险[J]. 环境科学, 39(2): 703-710. |
Wang X, Xu H, Wang D. 2020. Mechanism of fluoride removal by AlCl3 and Al13: The role of aluminum speciation[J]. Journal of Hazardous Materials, 398: 122987. DOI:10.1016/j.jhazmat.2020.122987 |
Xia Y, Huang X, Li W, et al. 2019. Facile defluoridation of drinking water by forming shell@fluorapatite nanoarray during boiling egg shell[J]. Journal of Hazardous Materials, 361: 321-328. DOI:10.1016/j.jhazmat.2018.09.007 |
Xilong P, Wenjin C, Zongjian H, et al. 2019. Removal of Cu(Ⅱ) fromwastewater using doped HAP-coated-limestone[J]. Journal of Molecular Liquids, 293: 111502. DOI:10.1016/j.molliq.2019.111502 |
Yadav K K, Kumar S, Pham Q B, et al. 2019. Fluoride contamination, health problems and remediation methods in Asian groundwater: A comprehensive review[J]. Ecotoxicology and Environmental Safety, 182: 109362. |
 2021, Vol. 41
2021, Vol. 41


