许多工业和农业行业, 如炼油、石化、制药、发酵和畜禽养殖等行业, 产生了大量的含硫废水(Deng et al., 2017).在厌氧处理含硫废水过程中, 硫酸盐被还原产生硫化物, 硫化物具有强烈腐蚀作用, 毒性高, 严重可致人昏迷和死亡(Jin et al., 2013).常规处理含硫化物废水方法有物理化学和生物法(Kailasa et al., 2020), 如氧化法、汽提法、化学絮凝法和好氧生化法等, 虽可有效去除污染物, 但需外加化学药剂或曝气, 存在高能耗高运行成本的缺陷(Kanjanarong et al., 2017).因此, 亟需探索含硫化物废水新技术.
电化学氧化技术具有适应性强、环境兼容性好、易于与其他工艺结合等优点, 受到越来越多的关注.硫化物化学性质活泼, 可与阳极直接反应, 并将电子传递给电极, 易进行电化学氧化(Cai et al., 2017).不少研究者在阳极电势, 缓冲体系, 电极材料等方面进行了深入研究, 以期提高硫化物氧化性能(De Crisci et al., 2019), 并将该技术应用于处理造纸废水、石化废碱液和畜禽废水等(Dutta et al., 2010; Lu et al., 2015; Zhang et al., 2020).而Dutta等以铁氰化钾溶液(Fe(CN)63-)为阴极电子受体, 采用双室原电池处理含低浓度含硫化物废水(约100 mg·L-1)时, 发现硫化物可进行自发电化学氧化, 不仅无需外加电源, 还可产生电能(Dutta et al., 2008).Kijjanapanich等则以钒(VO2+)作为阴极电子受体, 考察了低浓度(<300 mg·L-1)时硫化物自发电化学氧化性能.研究者常通过加入催化材料, 提高电极材料性能等方式来提高硫化物氧化性能(Kijjanapanich et al., 2015).Zhai等合成新型氧化锰/石墨毡复合电极材料, 并应用于空气阴极燃料电池, 考察其对硫化物的去除性能, 发现可有效降低反应时间, 提高单质硫产率和库伦效率(Zhai et al., 2018).目前, 关于硫化物自发电化学氧化方面研究较少, 且对于高浓度下硫化物自发电化学氧化方面更是有待研究.此外, 作为特殊生物催化剂, 微生物是否会对硫化物自发电化学氧化产生促进作用, 仍需进一步深入探索.
基于此, 本文构建了以高锰酸钾溶液作为阴极电子受体, 以石墨棒为电极的双室燃料电池, 分别考察了自发电化学氧化系统和生物强化后电化学氧化系统的运行性能, 比较生物强化对硫化物去除性能和产电性能的影响, 采用高通量测序技术分析阳极室内细菌群落特征和关键功能微生物种群.
2 材料与方法(Materials and methods) 2.1 试验装置及模拟废水本研究中所采用装置为有机玻璃制成的双室燃料电池.其阳极室和阴极室(总容积均为350 mL, 有效容积为300 mL)中间用质子交换膜(Ultrax CMI-7000 Membrane International, USA)分隔(Cai et al., 2019).以石墨棒作为阳极和阴极电极, 尺寸为6 cm×Φ1 cm, 表面积为18.80 cm2.两极间由钛丝和铜导线连接, 外接负载为1000 Ω.高锰酸钾具有高氧化还原电位, 价格低廉, 其本身或者还原产物(MnO2)对环境没有污染或污染较小(赵庆良等, 2006), 故阴极液采用高锰酸钾溶液(浓度为100 mg·L-1, 50 mmol·L-1磷酸缓冲液, pH=7.0), 并用磁力搅拌器进行搅拌.
阳极液为含硫化物的模拟废水, 并添加NaHCO3(1 g·L-1)、MgCl2(1 g·L-1)、KH2PO4(1 g·L-1)、(NH4)2SO4 (0.24 g·L-1)和微量元素液(1 mL·L-1)(蔡靖, 2010), 进水pH值控制在7.0±0.1.采用回流泵回流加强阳极液混合.
2.2 试验方法本试验采用间歇运行方式, 反应周期为20 h.所试的硫化物浓度范围分别为60、300、540、780和1020 mg·L-1.
试验采用两组相同构型燃料电池, 分别记为AFC(Abitoic Fuel Cell)和BFC (Bitoic Fuel Cell).其中AFC为自发电化学组, 即阳极室内仅加入含硫化物的模拟废水, 每个浓度梯度设3组平行, 进水20 h后测定出水基质浓度, 取其平均值进行分析;BFC为生物强化组, 即阳极室内接种100 mL富集后具有硫化物氧化功能的污泥, 其余操作与AFC一致.待出水基质浓度稳定后(约3~5个反应周期), 逐步将进水硫化物浓度从60 mg·L-1上升至1020 mg·L-1.取每个浓度梯度下出水基质浓度平均值进行分析.
2.3 分析方法硫化物(S2--S)采用亚甲基兰分光光度法测定;硫酸盐(SO42--S)采用铬酸钡分光光度法测定(国家环境保护总局, 2002).pH值采用PHS-9V型酸度计测定.单质硫产量根据进出水硫元素质量守恒进行计算, 则:
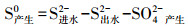
|
(1) |
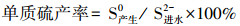
|
(2) |
MFC输出电压(即外阻1000 Ω两端电压)数据由数据采集系统(Agilent 34970A Data Acquisition/Switch Unit) 收集, 每隔10 min自动测定1次.电流密度则根据电流和电极净表面积进行归一化计算.采用SPSS 16.0和Origin 8.5对数据进行统计分析.
2.4 高通量测序及分析待BFC运行性能稳定一段时间后, 从阳极室内取出污泥样品.污泥用磷酸缓冲溶液清洗数次后, 直接送至杭州利贞生物有限公司进行DNA提取, PCR扩增以及高通量测序.所选用的细菌通用扩增引物序列为515F (5′-GTGCCAGCMGCCGCGG-3′) and 907R (5′-CCGTCAATTCMTTTRAGTTT-3′)(Hu et al., 2017).在97% 的相似性水平下, 将所获得原始序列划分可操作分类单元(Operational Taxonomic Units, OTUs), 并采用贝叶斯算法对OTU代表序列进行分类分析, 并在门和属两个分类水平上统计每个样品的群落组成.
3 结果与讨论(Results and discussion) 3.1 硫素去除性能自发电化学法处理含硫废水时AFC阳极室内硫素去除情况如图 1a所示.在所试浓度范围(60~1020 mg·L-1)内, 随着进水硫化物浓度逐渐升高, 出水硫化物浓度也随之升高, 从6.42 mg·L-1升至324.83 mg·L-1;硫化物去除率则从89.30%降至68.15%.所产生的硫酸盐浓度则在0.42~4.67 mg·L-1之间波动, 其产率仅为0.05%~2.67%;根据硫元素质量守恒, 单质硫产量随着进水硫化物浓度上升而上升, 其产率则从86.63%缓慢将至68.10%.这表明, 自发电化学法可去除部分硫化物(68.15%~ 89.30%), 其主要氧化产物为单质硫(68.10%~86.63%).单质硫是一种重要的资源, 可广泛应用于农业生产, 重金属冶炼以及污水处理中(Cai et al., 2017).自发电化学法中单质硫产率高于传统硫化物去除方法偏重亚硫酸钠氧化法(36.63%)(王兵等, 2015), 有助于废水中硫资源的回收再利用.此外, 自发电化学法最大硫化物氧化速率可达34.76 mg·L-1·h-1, 远高于Dutta等研究结果(25.83 mg·L-1·h-1)(Dutta et al., 2008), 这可能与本系统采用的高氧化性阴极电子受体和高进水硫化物浓度有关.
 |
| 图 1 电化学氧化硫化物的硫素去除性能 (a.自发电化学氧化;b.生物强化电化学氧化;c.生物强化贡献率) Fig. 1 Sulfur removal in the electrochemical oxidation system (a. spontaneous electrochemical oxidation; b. biological enhanced electrochemical oxidation; c. contribution of biological enhancement) |
在BFC阳极室内接种100 mL具有硫化物去除功能的厌氧污泥, 采用生物强化电化学法处理含硫废水, 其硫素去除情况如图 1b所示.当进水硫化物浓度低于780 mg·L-1时, 出水硫化物浓度低于1.00 mg·L-1, 硫化物去除率可高达99.80%;出水硫酸盐浓度则随着进水硫化物浓度升高而上升, 从13.19 mg·L-1升至424.50 mg·L-1, 其产率则在21.98%~74.43%之间.当进水硫化物浓度升至1020 mg·L-1时, 出水硫化物浓度激增至101.89 mg·L-1, 去除率则降至90%, 而出水硫酸盐浓度骤降至26.86 mg·L-1, 其产率仅为2.63%, 据文献报道, 硫化物对产甲烷菌的抑制浓度约为200 mg·L-1 (Wang et al., 2020).当进水硫化物浓度低于780 mg·L-1时, 硫化物自发电化学氧化为厌氧污泥降低了阳极室内硫化物浓度, 有效解除了硫化物抑制;而当进水硫化物浓度高达1020 mg·L-1时, 经自发电化学氧化后阳极室内残留硫化物浓度仍为324.83 mg·L-1, 进而抑制了厌氧污泥的硫化物氧化性能.结果表明, 经生物强化后, 在适宜浓度范围(60~780 mg·L-1)内, 该BFC对硫化物去除率高于99.80%, 最大氧化速率可达45.90 mg·L-1·h-1, 且其主要氧化产物为硫酸盐(21.98%~74.43%)和单质硫(25.43%~78.02%).其中生物强化对硫化物氧化贡献率为10.70%~29.40%, 主要通过将进水硫化物和自发电化学氧化产物(单质硫)进一步氧化为硫酸盐(图 1c).
通过两两配对t检验分析, 发现自发电化学氧化的出水硫化物浓度和经生物强化电化学氧化的硫化物浓度之间存在显著差异(p=0.029 < 0.05), 这表明生物强化对硫化物电化学去除性能具有明显影响.采用Monod方程(式(1))进行拟合, 自发电化学氧化的硫化物亲和力系数为58.65 mg·L-1, 最大氧化速率为27.03 mg·L-1·h-1;经生物强化电化学氧化的硫化物亲和力系数仅为0.09 mg·L-1, 最大氧化速率为30.30 mg·L-1·h-1.Kijjanapanich等发现, 当进水硫化物浓度为253 mg·L-1时, 尽管自发电化学氧化可实现硫化物去除率达到91.1%, 但出水中仍残留22.6 mg·L-1硫化物(Kijjanapanich et al., 2015).因此, 生物强化可有效提高自发电化学氧化硫化物的亲和性和反应速率.

|
(3) |
式中, R为硫化物氧化速率(mg·L-1·h-1);Rmax为硫化物氧化速率(mg·L-1·h-1);Ks为硫化物亲和力常数(mg·L-1);Se为出水硫化物浓度(mg·L-1).
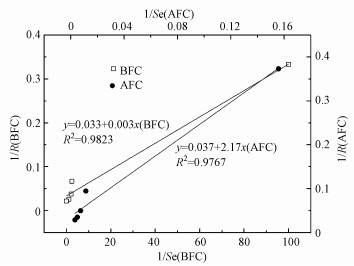 |
| 图 2 Monod方程拟合情况 Fig. 2 The simulation with Monod equation |
在硫化物自发电化学氧化过程中, 当进水硫化物浓度为60 mg·L-1时, 在5 h内, 电流密度迅速从230.52 mA·m-2下降至54.34 mA·m-2, 后在15 h内, 缓慢下降至18.36 mA·m-2(图 3a).随着进水硫化物浓度升高, 其电流密度-时间曲线趋势十分类似, 且其快速下降斜率在29.91~59.85 mA·m-2·h-1之间, 与进水硫化物浓度并无显著关联(P=0.545>0.05).当硫化物浓度下降时, 致使吉布斯自由能下降, 并引起阳极电势升高(Cai et al., 2019), 最终导致电流密度下降.又由于硫化物自发电化学氧化速度恒定(Dutta et al., 2008; Kijjanapanich et al., 2015; Zhai et al., 2018), 不受进水硫化物浓度影响, 因此电流密度下降速度也为恒定值.稳定电流密度(20 h时的电流密度)则随着进水硫化物浓度升高而升高, 从18.36 mA·m-2逐渐升至37.38 mA·m-2.
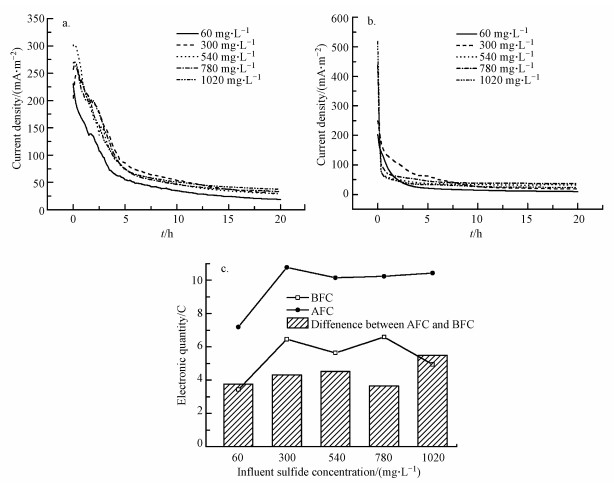 |
| 图 3 电化学氧化硫化物的产电性能 (a.自发电化学氧化;b.生物强化电化学氧化;c. 电量) Fig. 3 Electricity generation of electrochemical sulfide removal (a.spontaneous electrochemical oxidation; b. biological enhanced electrochemical oxidation; c. Electronic quantity) |
在BFC阳极室内接种100 mL同步脱氮除硫污泥, 采用生物强化电化学法处理含硫废水, 其产电性能如图 3b所示.当进水硫化物为60 mg·L-1时, 在3 h内电流密度迅速从202.69 mA·m-2下降至32.33 mA·m-2, 后在17 h内, 缓慢下降至9.62 mA·m-2.随着进水硫化物浓度升高, 其电流密度下降趋势更快, 当进水硫化物浓度为540 mg·L-1时, 仅在0.5 h内电流密度就从426.84 mA·m-2降至了66.50 mA·m-2, 后在19.5 h内缓慢降至31.74 mA·m-2.与自发电化学氧化相比, 其生物强化法电流密度下降斜率较大, 为137.12~898.15 mA·m-2·h-1.进水硫化物浓度对生物强化法电流密度下降斜率存在显著性影响(p=0.02 < 0.05).这可能是由于污泥吸附硫化物, 致使溶液中硫化物快速下降, 导致电流密度迅速下降.稳定电流密度先随着进水硫化物浓度升高而升高, 当进水硫化物浓度为780 mg·L-1时, 稳定电流密度达到最大值36.61 mA·m-2;后骤降至23.94 mA·m-2.如图 3c所示, 生物强化组所产生的电量为3.43~6.58 C, 远低于自发电化学氧化组所产生的电量(7.19~10.77 C);然而, 生物强化组氧化产生的电子数量(6.22~128.29 mmol·L-1)远高于自发电化学组产生的电子数量(3.65~43.55 mmol·L-1).这表明BFC中污泥可以摄取胞外电子, 并在电能驱动下氧化硫化物过程(苏红等, 2019), 致使生物强化组硫化物去除率和硫酸盐产率有所提高.
通过两两配对t检验分析, 发现自发电化学氧化的电流密度下降斜率和经生物强化电化学氧化的电压下降斜率之间存在显著差异(p=0.033 < 0.05), 这表明生物强化对硫化物电化学去除性能具有明显影响.在硫化物氧化过程中, 其主要产物为单质硫和硫酸盐.基质消耗殆尽, 电流密度曲线也趋向于稳定.因此通过Pearson相关性检验分析了进水硫化物浓度, 出水硫素浓度与稳定电流密度之间的相关性.结果表明, 自发电化学氧化时的稳定电流密度与进水(或出水)硫化物浓度之间存在正相关关系(p < 0.01).
| 表 1 Pearson相关性分析 Table 1 Pearson correlation analysis |
本试验中BFC阳极室样品测序所得的总序列数为56972, 将所有序列按照97%相似性进行划分OTU, 得到OTU数量为627, 且Coverage值高于0.9976, 这表明样品文库覆盖率高, 数据可靠.如图 4所示, 在BFC阳极室悬浮污泥中, 含量最高的是变形菌门(Proteobacteria), 其相对丰度高达82.19%.变形菌门微生物多为专性和兼性厌氧, 广泛存在于厌氧反应器中(蔡靖和郑平, 2010);排名第二的是拟杆菌门(Bacteroidetes), 其相对丰度为6.04%;拟杆菌门在生物电化学反应器中较为常见, 通常具有胞外电子传递能力(Delforno et al., 2015).其余绿弯菌门(Chloroflexi), 厚壁菌门(Firmicutes), 互养菌门(Synergistetes), 放线菌门(Actinobacteria), 浮霉菌门(Planctomycetes)和脱铁杆菌门(Deferribacteres)等相对丰度仅为在0.32%~2.61%.
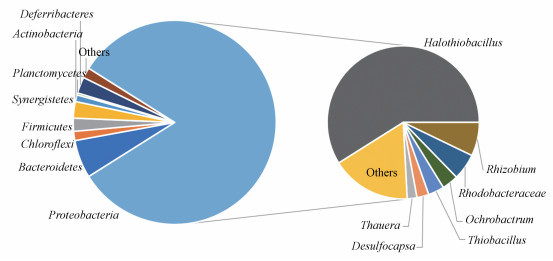 |
| 图 4 门和属分类水平上的生物强化电化学氧化硫化物的微生物群落结构 Fig. 4 Bacterial community of BFC treating sulfide at phylum and genus level |
根据属分类水平上相对丰度, 将污泥中细菌分为优势菌属(相对丰度≥10%)、常见菌属(10%≥相对丰度≥1%)和稀有菌属(相对丰度≤1%(陈浒等, 2018)).在BFC阳极室悬浮污泥中, 含量最高的是盐生硫杆菌属(Halothiobacillus), 其相对丰度高达48.40%, 为优势菌属.Halothiobacillus为化能自养型革兰氏阴性菌, 其可在高盐性条件下利用还原性硫化物作为电子受体, 广泛应用于废水生物脱硫, 且在处理含硫化物废水的生物电化学反应器中也较为常见(Dong et al., 2017; Feng et al., 2018; Blazquez et al., 2019).根瘤菌属(Rhizobium), 红杆菌属(Rhodobacteraceae), 苍白杆菌属(Ochrobactrum), 硫杆菌属(Thiobacillus), 脱硫盒菌属(Desulfocapsa)和陶厄氏菌属(Thauera)的相对丰度在1%~10%之间, 为常见菌属.其中Thauera, Thiobacillus, Desulfocapsa皆具有硫化物氧化功能, 在废水生物脱硫反应器中较为常见(Eddie et al., 2005; Mirzaei et al., 2014; Delforno et al., 2015), 其相对丰度分别为2.79%、2.09%和1.70%;而Rhizobium, Rhodobacteraceae和Ochrobactrum则在生物电化学反应器中较为常见(Kijjanapanich et al., 2015; Wang et al., 2020), 其中Ochrobactrum为典型产电微生物(Li et al., 2018), 其相对丰度分别为5.86%、4.58%和2.86%.
4 结论(Conclusions)本文构建了以高锰酸钾为阴极电子受体, 以石墨棒为电极材料的自发电化学处理含硫化物废水系统.在所试进水硫化物浓度范围(60~1020 mg·L-1)内, 硫化物去除率为68.15%~89.30%, 其主要氧化产物为单质硫(68.10%~86.63%), 最大氧化速率可达34.76 mg·L-1·h-1, 最大稳定电流密度为37.38 mA·m-2;经生物强化后, 该系统硫化物去除率均高于99.80%, 主要氧化产物为硫酸盐(21.98%~74.43%)和单质硫(25.43%~78.02%), 硫化物氧化速率最高可达45.90 mg·L-1·h-1, 最大稳定电流密度为36.61 mA·m-2.并通过高通量测序技术分析生物强化系统中的细菌群落特征.从门分类水平上来看, 含量较高的是变形菌门和拟杆菌门, 其相对丰度分别为82.19%和6.04%;从属分类水平来看, 具有硫化物氧化功能的盐生硫杆菌属为优势菌属, 其相对丰度为48.40%.
Blazquez E, Baeza J A, Gabriel D, et al. 2019. Treatment of real flue gas desulfurization wastewater in an autotrophic biocathode in view of elemental sulfur recovery: Microbial communities involved[J]. Science of the Total Environment, 657: 945-952. DOI:10.1016/j.scitotenv.2018.12.037 |
蔡靖. 2010. 同步厌氧脱氮除硫工艺及微生物学特性的研究[D]. 杭州: 浙江大学
|
Cai J, Mahmood Q, Sun Y. 2020. Effect of external resistance on substrate removal and electricity generation in microbial fuel cell treating sulfide and nitrate simultaneously[J]. Environmental Science and Pollution Research, 27(1): 238-249. DOI:10.1007/s11356-019-06960-8 |
蔡靖, 郑平. 2010. 同步脱氮除硫污泥及其微生物生态学特性[J]. 化工学报, 61(2): 462-468. |
Cai J, Zheng P, Qaisar M, et al. 2017. Elemental sulfur recovery of biological sulfide removal process from wastewater: A review[J]. Critical Reviews in Environmental Science and Technology, 47(21): 2079-2099. DOI:10.1080/10643389.2017.1394154 |
陈浒, 金道超, 林丹丹, 等. 2018. 中度石漠化生态修复初期土壤螨类群落结构变化[J]. 应用生态学报, 29(12): 4152-4164. |
De Crisci A G, Moniri A, Xu Y. 2019. Hydrogen from hydrogen sulfide: towards a more sustainable hydrogen economy[J]. International Journal of Hydrogen Energy, 44(3): 1299-1327. DOI:10.1016/j.ijhydene.2018.10.035 |
Delforno T P, Moura A G L, Okada D Y, et al. 2015. Microbial diversity and the implications of sulfide levels in an anaerobic reactor used to remove an anionic surfactant from laundry wastewater[J]. Bioresource Technology, 192: 37-45. DOI:10.1016/j.biortech.2015.05.050 |
Deng D, Lin L S. 2017. Continuous sulfidogenic wastewater treatment with iron sulfide sludge oxidation and recycle[J]. Water Research, 114: 210-217. DOI:10.1016/j.watres.2017.02.048 |
Dong Z S, Zhao Y, Fan L, et al. 2017. Simultaneous Sulfide removal and hydrogen production in a microbial electrolysis cell[J]. International Journal of Electrochemical Science, 12(11): 10553-10566. |
Dutta P K, Rabaey K, Yuan Z, et al. 2008. Spontaneous electrochemical removal of aqueous sulfide[J]. Water Research, 42(20): 4965-4975. DOI:10.1016/j.watres.2008.09.007 |
Dutta P K, Rabaey K, Yuan Z, et al. 2010. Electrochemical sulfide removal and recovery from paper mill anaerobic treatment effluent[J]. Water Research, 44(8): 2563-2571. DOI:10.1016/j.watres.2010.01.008 |
Eddie C, Jaap V R, Andreas S, et al. 2005. Identification of bacteria potentially responsible for oxic and anoxic sulfide oxidation in biofilters of a recirculating mariculture system[J]. Applied Environmental and Microbiology, 71(10): 6134-6141. DOI:10.1128/AEM.71.10.6134-6141.2005 |
Feng S S, Lin X, Tong Y J, et al. 2018. Biodesulfurization of sulfide wastewater for elemental sulfur recovery by isolated Halothiobacillus neapolitanus in an internal airlift loop reactor[J]. Bioresource Technology, 264: 244-252. DOI:10.1016/j.biortech.2018.05.079 |
国家环境保护总局. 2002. 水和废水监测分析方法[M]. 第四版. 北京: 中国环境科学出版社.
|
Hu Z, Lu X, Sun P, et al. 2017. Understanding the performance of microbial community induced by ZnO nanoparticles in enhanced biological phosphorus removal system and its recoverability[J]. Bioresource Technology, 225: 279-285. DOI:10.1016/j.biortech.2016.11.080 |
Jin R, Yang G F, Zhang Q Q, et al. 2013. The effect of sulfide inhibition on the ANAMMOX process[J]. Water Research, 47(3): 1459-1469. DOI:10.1016/j.watres.2012.12.018 |
Kailasa S K, Koduru J R, Vikrant K, et al. 2020. Recent progress on solution and materials chemistry for the removal of hydrogen sulfide from various gas plants[J]. Journal of Molecular Liquids, 297: 111886. DOI:10.1016/j.molliq.2019.111886 |
Kanjanarong J, Giri B S, Jaisi D P, et al. 2017. Removal of hydrogen sulfide generated during anaerobic treatment of sulfate-laden wastewater using biochar: Evaluation of efficiency and mechanisms[J]. Bioresource Technology, 234: 115. DOI:10.1016/j.biortech.2017.03.009 |
Kijjanapanich P, Kijjanapanich P, Annachhatre A P, et al. 2015. Spontaneous electrochemical treatment for sulfur recovery by a sulfide oxidation/vanadium(V) reduction galvanic cell[J]. Journal of Environmental Management, 149: 263-270. |
Li M, Zhou M, Tian X, et al. 2018. Microbial fuel cell (MFC) power performance improvement through enhanced microbial electrogenicity[J]. Biotechnology Advances, 36(4): 1316-1327. DOI:10.1016/j.biotechadv.2018.04.010 |
Lu Z, Tang J, de Lourdes Mendoza M, et al. 2015. Electrochemical decrease of sulfide in sewage by pulsed power supply[J]. Journal of Electroanalytical Chemistry, 745: 37-43. DOI:10.1016/j.jelechem.2015.02.014 |
Mirzaei M, Amoabediny G, Yazdian F, et al. 2014. An immobilized Thiobacillus thioparus biosensing system for monitoring sulfide hydrogen; optimized parameters in a bioreactor[J]. Process Biochemistry, 49(3): 380-385. DOI:10.1016/j.procbio.2013.12.013 |
苏红, 韩业君. 2019. 亲电微生物及其催化的CO2固定和合成[J]. 化学进展, 31(Z1): 433-441. |
王兵, 林奇, 李永涛, 等. 2015. 高含硫废水中硫的受限氧化过程及影响因素研究[J]. 环境工程学报, 9(02): 737-742. |
Wang Y, Lin H, Ding L, et al. 2020. Low-voltage electrochemical treatment to precipitate sulfide during anaerobic digestion of beet sugar wastewater[J]. Science of the Total Environment, 747: 141243. DOI:10.1016/j.scitotenv.2020.141243 |
Zhai L F, Wang R, Duan M F, et al. 2018. Electrochemical oxide sulfide in an air-cathode fuel cell with manganese oxide/graphite felt composite as anode[J]. Separation and Purification Technology, 197: 47-53. DOI:10.1016/j.seppur.2017.12.046 |
Zhang L, Wang J, Fu G, et al. 2020. Simultaneous electricity generation and nitrogen and carbon removal in single-chamber microbial fuel cell for high-salinity wastewater treatment[J]. Journal of Cleaner Production, 276: 123203. DOI:10.1016/j.jclepro.2020.123203 |
赵庆良, 张金娜, 尤世界, 等. 2006. 不同阴极电子受体从生物燃料电池中发电的比较研究[J]. 环境科学学报, 12: 2052-2057. DOI:10.3321/j.issn:0253-2468.2006.12.019 |
 2021, Vol. 41
2021, Vol. 41


