溶解有机质(Dissolved organic matter, DOM)在动植物生命体、土壤及天然水体等环境介质中广泛存在, 并可在流域不同环境介质间发生迁移、转化等一系列生物地球化学过程.同时, 不同环境中DOM的迁移与转化具有重要的生态环境意义, 例如:①DOM是可溶性有机碳(Dissolved organic carbon, DOC)、有机氮(Dissolved organic nitrogen, DON)、有机磷(Dissolved organic phosphorus, DOP)的载体(Vidon et al., 2010; 赵海超等, 2019), 在生源要素(如碳、氮、磷等)生物地球化学循环中起到了重要作用(曹昌丽等, 2018);②在饮用水消毒过程中, DOM是消毒副产物的前体, 会影响人类健康(柳婷等, 2019);③DOM还能改变环境介质中污染物的环境行为与生态效应(Hernandez-Soriano et al., 2012; Huang et al., 2019).
DOM是一种复杂的混合物, 主要由有机酸、多糖、氨基糖、腐殖酸和碳水化合物等组成(Charles et al., 1994).在过去的研究中, DOM的分离和富集主要依靠XAD大孔树脂分离法、二乙基氨基乙基(DEAE)纤维素吸附法、超滤(Ultrafiltration, UF)和反渗透(Reverse osmosis, RO)等技术.然而, 在DOM的分离和富集过程中, DOM的结构和含量均发生了变化, 分离或富集的研究方法很难反映其原位信息.在DOM的化学组成和结构研究方面, 由于携带了能吸收紫外-可见光和荧光的基团, DOM的光谱(包括紫外-可见吸收光光谱和荧光光谱)在表征环境DOM样品的组成特征方面表现出快捷、准确、不破坏样品等优势(Kellerman et al., 2015; Hu et al., 2017; Peng et al., 2018; Shang et al., 2019; Zhu et al., 2019), 也能揭示DOM的迁移转化历程(蔡明红等, 2012).近年来, Wang等(2019)采用荧光光谱结合区域积分法(Fluorescence regional integration, FRI)和紫外-可见光光谱揭示了流域层面城市污水处理尾水-河流-湖泊连续体中DOM迁移过程中的变化特征.然而, 当前关于流域中典型环境介质(如土壤、植物生命体、水体等)DOM的输入-输出通量尚未见文献报道, 不同环境介质之间的DOM转化历程方面也鲜有报道.
基于此, 本研究以长江中下游巢湖流域典型环境介质(农田土壤、水生植物、浮游藻类及沉积物)DOM样品为研究对象, 利用紫外-可见光光谱和荧光光谱分析巢湖流域典型环境DOM样品的光谱特征, 计算光谱指纹指数, 探讨流域层面典型环境DOM样品组成结构的差异, 以期揭示流域层面典型环境介质间DOM的可能环境行为与生态效应.
2 材料与方法(Materials and methods) 2.1 研究区域介绍、样品采集和预处理巢湖是位于长江中下游的大型浅水湖泊, 流域面积达9258 km2, 流域总人口877万人, 属北热带湿润季风气候区, 多年年均气温为15.8 ℃, 无霜期约为225 d, 流域年均降水量为1120.3 mm.流域土地利用类型以耕地为主, 占流域面积的60%以上, 其次为林地、建设用地和水域, 分别占14.91%、9.58%和8.82%, 草地和未利用土地所占面积最小.巢湖DOM主要来自于入湖河流输入的陆源DOM及水生植物和浮游藻类产生的自生源DOM.结合巢湖流域的用地类型, 本研究以耕地土壤和巢湖沉积物、浮游藻类和水生植物样品为研究对象.
于2019年8月, 在巢湖西部选取3个平行水稻农田进行土壤样品采集, 每个农田土壤样品实施S型布点法并采集0~10 cm的表层土壤, 混合后由四分法取样为一个代表性样品.沉积物、浮游藻类和水生植物样品于2019年9月采自巢湖西部湖区.沉积物样品采用抓泥斗(HAD-XDB0201D)采集, 每个站点采集3个平行样, 现场混匀, 去除大颗粒石块和植物残体.浮游藻类采用浮游生物网于西部湖区范围采集, 浮游藻类以微囊藻为优势种类(占到56%), 同时伴有一定比例的盘星藻(15%)和直链藻(8%), 其他类群(包括鱼腥藻、隐藻等)占比为21%.水生植物主要采集于西部湖滨湿地1 m2样方, 采集区域内所有浮叶植物(水鳖, Hydrocharisdubia)、沉水植物(黑藻, Hydrillaverticillata)完整植株, 以及挺水植物地上部分植株(香蒲, Typhaprzewalskii).上述4种典型环境DOM样品采样点如图 1所示.
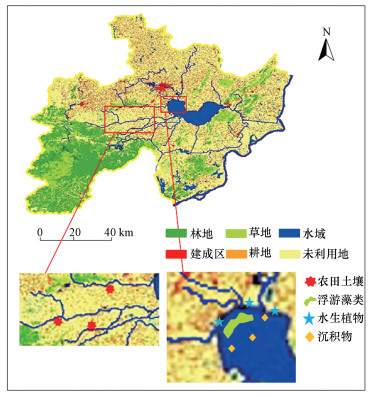 |
| 图 1 巢湖流域典型环境DOM样品采样点示意图 Fig. 1 Schematic diagram of typical environmental DOM sampling locations in Chaohu Lake basin |
样品运回实验室后, 迅速采用冷冻干燥法处理沉积物和土壤样品, 干燥、研磨后过0.107 mm筛, 采用土壤/沉积物(干重)∶水为1∶10于避光条件下180 r·min-1振荡浸提24 h, 6000 r·min-1离心10 min, 制备成DOM母液;水生植物在40 ℃下烘干, 机械破碎后过0.107 mm筛, 采用水生植物(干重)∶水为1∶100浸提24 h, 制备成DOM样品母液(其他条件同前);浮游藻类利用超声破壁仪超声10 min, 重复3次, 制备成DOM母液;所有DOM母液过0.45 μm PVDF(Millipore)滤膜, 滤液即为DOM样品, 用于测定DOC含量、荧光光谱和紫外-可见光光谱.DOC含量采用高温燃烧法在总有机碳分析仪(TOC-VCPH, 岛津)上测定, DOC用于表征DOM的总量(Wang et al., 2019).
2.2 紫外-可见光谱测定及特征参数分析利用双光束紫外-可见分光光度计(TU-1901, 普析)测定DOM的紫外-可见光光谱, 扫描波段为200~700 nm, 步长为1 nm, 以Milli-Q水为参比.吸收系数由式(1)获得.

|
(1) |
式中, λ为参照波长λ处经校正的吸收系数(m-1);A′λ为参照波长λ处经校正的吸光度;L为光程路径(m).
比吸收系数(Specific UV absorbance, SUVA)指特定波长处(λ)的吸收系数与DOC浓度的比值(Liang et al., 2016), 可有效反映DOM的芳香性(本研究λ=280 nm).光谱斜率S可以反映溶解有机质的分子量大小和芳香性.本研究中S275~295通过式(2)经过非线性拟合得到(Keith et al. 2002).
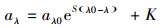
|
(2) |
式中, λ0为参照波长(取440 nm);aλ0和aλ分别为波长λ0和λ处的吸收系数(m-1);S为光谱斜率(nm-1);K为残余散射或残留噪声偏移量(m-1).
2.3 荧光光谱测定及指纹指数分析利用荧光分光光度计(F-4500, 日立)测定DOM样品的三维荧光光谱.扫描波长范围为λEx=220~400 nm, 间隔3 nm;λEm=250~550 nm, 间隔2 nm.为了消除光谱的内滤效应, 应将样品稀释, 确保240 nm处吸光值A240 < 0.1.同时, 所有样品三维荧光光谱采用空白(超纯水)校正和进行拉曼归一化处理.并结合荧光区域积分法(FRI)将DOM样品分为类酪氨酸、类色氨酸、类富里酸、微生物代谢产物、类腐殖酸组分, 计算各组分的相对含量, 计算公式见式(3)~(4)(Chen et al., 2003; Wang et al., 2019).

|
(3) |
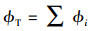
|
(4) |
式中, ϕi(i=1~5)分别为类酪氨酸、类色氨酸、类富里酸、微生物代谢产物、类腐殖酸的区域积分体积(R.U.·nm2);I(λExλEm)为荧光强度(R.U.);本研究中ΔλEx和ΔλEm分别为2 nm和3 nm.
生源指数(Biological index, BIX)为微生物来源有机质与外源有机质的比例, 通过激发波长为310 nm时, 发射波长为380 nm和430 nm时的荧光强度比值计算, 可以反映其生物可利用性(刘丽贞等, 2018);腐殖化指数(Humification index, HIX)用来表征有机质腐殖化的程度, 可以通过激发波长为256 nm时, 发射波长为434~480 nm波段与300~346 nm波段的荧光峰值面积比值计算, HIX指数越高则表示DOM腐殖化程度越高(Ohno et al., 2007).
易生物降解有机质与难生物降解有机质的比值(L-DOM/R-DOM)用于表征易生物降解有机质与难生物降解有机质之间的比例.类蛋白质与类腐殖质的比值(P-L/H-L)为DOM中类蛋白质组分荧光强度与类腐殖质组分荧光强度之比.L-DOM/R-DOM和P-L/H-L均可用来反映DOM组成特征, 计算方法见式(5)~(6)(Wang et al., 2019).
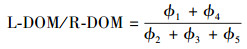
|
(5) |

|
(6) |
采用SPSS 24软件进行统计分析, 包括最大值、最小值、平均数和标准差及差异性检验(t-检验), 置信水平设置为p < 0.05、p < 0.01;光谱斜率S275~295值采用Sigmaplot进行非线性拟合;三维荧光光谱数据在FL Solutions 2.0和Matlab (N-Way)中进行分析处理.
3 结果与讨论(Results and discussion) 3.1 DOC含量与紫外-可见光光谱特征巢湖流域不同环境DOM样品DOC含量各不相同(图 2a).巢湖流域农田土壤、浮游藻类、水生植物和巢湖沉积物样品(上述样品均为干重)DOC含量分别为(204.93±29.19)、26701.59、(9331.00±1497.94)和(141.13±18.64) mg·kg-1.经单因素方差分析, 沉积物和农田土壤样品DOC含量显著低于水生植物样品DOC含量(p < 0.05), 水生植物样品DOC含量显著低于浮游藻类样品DOC含量(p < 0.05).
 |
| 图 2 巢湖流域典型环境DOM样品DOC含量(a)、a280值(b)和紫外-可见光光谱特征(c.农田土壤(稀释2.5倍) DOM样品, d.浮游藻类(稀释10倍) DOM样品, e.水生植物(稀释50倍) DOM样品, f.沉积物DOM样品) Fig. 2 DOC contents (a), a280 values (b), UV-Vis spectra (c~f) of typical environmental DOM samples in Chaohu Lake basin (c~f represented UV-Vis spectra for agricultural soil (diluted 2.5 times), phytoplankton (diluted 10 times), aquatic vegetables(diluted 50 times) and sediment DOM samples) |
为了进一步探明不同环境DOM样品的组成特征, 本研究分析了4种环境DOM样品紫外-可见光光谱特征(图 2c~2f).研究发现, 4种环境DOM样品在250~400 nm紫外区光谱均存在“肩峰”, 这表明受试环境DOM样品的化学结构中存在共轭C=C双键或离域π键, 如不饱和的羰基化合物、芳香化合物等(Qu et al., 2013), 且不同环境DOM样品结构特征各异.另外, 与DOC结果类似的是, 单位干重环境DOM样品的a280值也具有显著差异(p < 0.05, 图 2b), 这说明不同环境DOM样品致色有机质含量也不尽相同, 表现为:a280(水生植物)>a280(浮游藻类)>a280(沉积物)>a280(土壤).
3.2 三维荧光光谱及其组分特征巢湖流域农田土壤、浮游藻类、水生植物和沉积物DOM样品的荧光强度及其组分特征各异(图 3和图 4), 其荧光强度(以区域积分值计)分别为(4996.16±1912.13)、7934.14、(3151.36±1229.60)和(3850.98±877.62) R.U.·nm2.与DOC含量和a280值类似, 单位干重荧光有机质含量浮游藻类最高, 其次为水生植物, 沉积物和农田土壤荧光有机质含量最低(p < 0.05, 图 4).
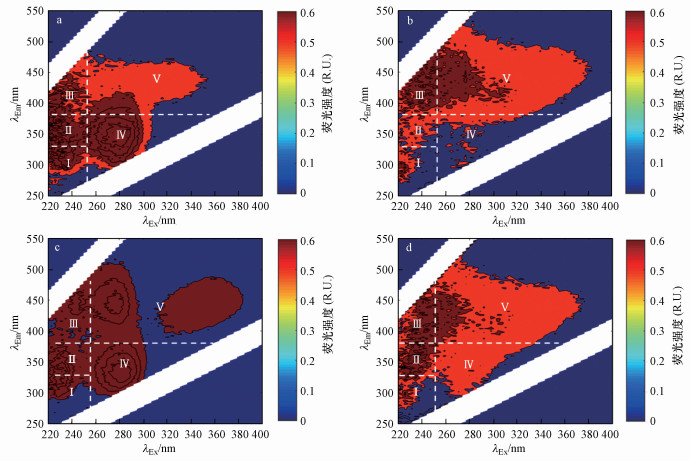 |
| 图 3 巢湖流域农田土壤(a)、浮游藻类(b)、水生植物(c)和沉积物(d)DOM样品三维荧光光谱轮廓图 Fig. 3 Contours of EEMs for DOM derived from agricultural soil (a), phytoplankton (b), aquatic vegetables (c) and sediment (d) samples in Chaohu Lake basin |
 |
| 图 4 巢湖流域农田土壤、浮游藻类、水生植物和沉积物DOM样品荧光强度 Fig. 4 Fluorescent intensities of DOM derived from agricultural soil, phytoplankton, aquatic vegetables and sediment samples in Chaohu Lake basin |
区域积分结果显示, 不同DOM样品5种荧光组分(包括类酪氨酸、类色氨酸、类富里酸、溶解性微生物代谢产物和类腐殖酸)的相对含量也不尽相同(图 5).4种环境DOM样品的类酪氨酸、类色氨酸、类富里酸、溶解性微生物代谢产物和类腐殖酸的比例分别为4.52%~9.77%、4.03%~11.56%、8.97%~14.69%、13.50%~31.19%和37.14%~63.86%.方差分析结果表明, 不同荧光组分相对含量具有显著差异(图 5b), 表现为类腐殖酸>微生物代谢产物>类富里酸>类酪氨酸、类色氨酸(p < 0.05).
 |
| 图 5 典型环境DOM样品荧光组分相对含量 Fig. 5 Relative proportions of DOM fluorescent components in typical environmental samples |
流域环境DOM的“量”受到广大研究者的关注, 特别是在流域污染控制和管理方面, 然而, 现有的研究从流域层面对DOM的“质”方面(即DOM的组成结构和性质等)的了解甚少.光谱指纹信息在揭示环境DOM样品的组成结构特征及其转化历程的研究中提供了丰富的信息(蔡明红等, 2012; Wang et al., 2019).巢湖流域中农田土壤和沉积物DOM样品的SUVA280值显著高于浮游藻类和水生植物样品(图 6a), 这表明农田土壤和沉积物DOM的芳香性程度和腐殖化程度显著高于浮游藻类和水生植物(梁俭等, 2016).另外, 紫外光谱斜率(S275~295)也是揭示DOM组成结构特征的一个重要指标(陈雪霜等, 2016), 其结果表明, 水生植物中水溶性有机质的重均分子量显著小于浮游藻类和沉积物、农田土壤样品(p < 0.05, 图 6b), 这与SUVA280结果一致.
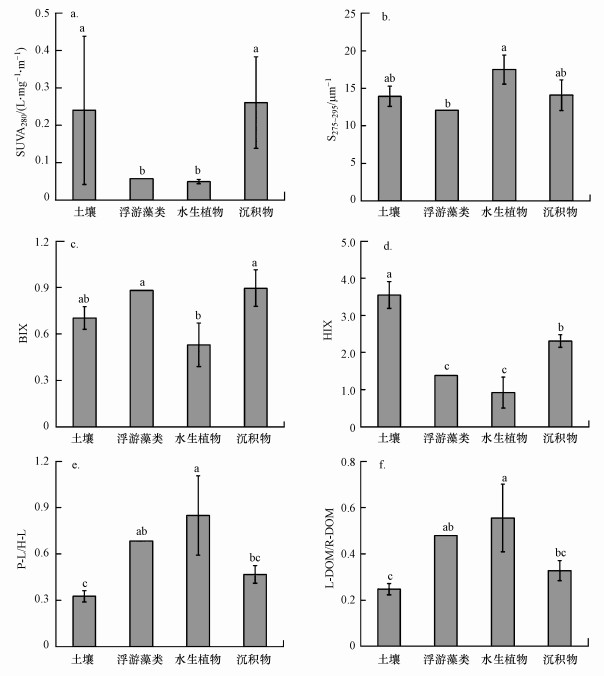 |
| 图 6 巢湖流域典型环境DOM样品光谱指纹信息 Fig. 6 Optical fingerprints of typical environmental DOM samples in Chaihu Lake basin |
生源指数(BIX)和腐殖化指数(HIX)为评价环境DOM样品自生源物质的贡献和转化历程等研究提供了较大的帮助.巢湖流域农田土壤和沉积物DOM样品的BIX值分别为0.70±0.07和0.90±0.12, 这表明农田土壤和沉积物DOM由于微生物的作用均表现出较强的自生源特征(Huguet et al., 2009).研究发现, 巢湖浮游藻类DOM样品BIX值(0.88)与沉积物类似, 但均显著高于水生植物样品(0.53±0.14)(p < 0.05, 图 6c).同时, 农田土壤DOM样品的HIX值(3.55±0.36)高于沉积物样品(2.31±0.17)(p < 0.05), 且均显著高于浮游藻类(1.38)和水生植物(0.92±0.42)样品(p < 0.05, 图 6d).上述结果说明富营养化湖泊沉积物DOM受藻类沉降的影响较大, 外源有机质如水生生物残体和农田土壤退水或径流携带的有机质也会经微生物转化形成具有较强自生源特征的沉积物DOM(朱金杰等, 2020).
另外, 巢湖流域农田土壤、浮游藻类、水生植物和沉积物DOM样品的P-L/H-L值分别为0.33±0.04、0.69、0.85±0.26和0.47±0.06, 且各样品P-L/H-L值之间存在显著差异(p < 0.05, 图 6e).类似地, L-DOM/R-DOM比值也具有类似的特征, 4种环境DOM样品L-DOM/R-DOM比值之间也存在显著差异(p < 0.05, 图 6f), 依次为:水生植物(0.56±0.15)>浮游藻类(0.48)>沉积物(0.33±0.04)>农田土壤(0.25±0.04).另外, 研究发现P-L/H-L和L-DOM/R-DOM比值与S275~295(p < 0.05)和HIX值(p < 0.05)均存在显著相关性, 这表明P-L/H-L和L-DOM/R-DOM比值在表征复杂环境DOM样品的组成结构方面也具有较好的敏感度.
3.4 流域层面有机质迁移转化的概念化模式及其环境指示意义DOM广泛存在于流域不同环境介质中, 但受人为活动和自然的改变导致了不同环境介质DOM“源”和“汇”的关系发生较大的变化, 并影响了污染物(如痕量有机污染物和重金属)的环境行为与生态效应(图 7).
 |
| 图 7 流域层面有机质迁移转化及其环境指示意义的概念化模式图 Fig. 7 Conceptual diagram for transport and transformation of organic matter at watershed level and its environmental implications |
不同环境介质中生产或汇集的DOM会发生迁移, 主要有以下途径:①土壤(包括林地和城市绿地等)、城市道路因地表径流将DOM冲刷至河流、湖泊水体中(于振亚等, 2018);②点源(如城市污水处理厂尾水、雨水管网排水、畜禽养殖废弃物等)携带的有机质直接排放入地表水体(沈烁等, 2014; 陈永娟等, 2016);③浮游藻类或水生植物因光合作用合成的有机物由于根系分泌、残体分解等直接进入水体中(姚昕等, 2014; 苏明舟等, 2016);④水体中DOM因沉降、絮凝等作用进入沉积物介质中(高嵩等, 2014).同时, DOM在不同环境介质的迁移过程中也会因土著微生物或光照而发生微生物降解和光化学降解, 从而导致DOM的组成结构发生变化(Bushaw et al., 1996; Sulzberger et al., 2009; Jiao et al., 2010), 并改变了污染物(如痕量有机污染物和重金属)的环境行为与生态效应(Totsche et al., 1997; Baken et al., 2011; Pernet-Coudrier et al., 2011; Zhang et al., 2020).基于上述提出的流域环境介质中DOM的迁移转化概念化模式和相关研究结果, 本文提出以下建议:
① 与氮、磷等生源要素和污染物类似, DOM也可以在流域环境不同介质之间发生迁移(Mcclain et al., 2003; Wang et al., 2018).考虑到DOM的生态环境效应, 不同环境介质中DOM的总量和组成特征(如芳香性、腐殖化指数、可生物降解组分和难降解组分比例等参数)应在流域污染控制和环境管理实践中加以重视.
② 我们已逐步认识到不同环境介质之间DOM发生迁移的同时, 其组成结构也会因微生物和光化学作用而发生改变(Wang et al., 2019), 如DOM的重均分子量增加, 芳香性和腐殖化程度增强等, 这势必导致其在环境中受微生物和光化学降解等行为, 以及对疏水污染物(如重金属和痕量有机污染物等)的迁移和生物有效性等的影响发生改变.因此, 流域环境中DOM的分子组成动态变化是客观、科学地评价其环境行为和生态效应的基础.
③ 另外, 重金属、有机污染物等在农田土壤、河流、湖库中的生物有效性势必受到DOM总量和组成结构的影响, 且不同环境介质中DOM对其影响的规律并不完全相同.因此, 在评价不同生态单元(如农田土壤、河流、湖库等)重金属、有机污染物的生态风险时需要考虑到其受DOM变化的影响.
4 结论(Conclusions)1) 巢湖流域农田土壤、浮游藻类、水生植物和沉积物DOM样品单位干重DOC含量、a280值和总荧光强度呈显著差异(p < 0.05), 主要表现为:浮游藻类>水生植物>土壤≈沉积物, 这表明巢湖流域典型环境样品(单位干重)中溶解有机质总量、致色有机质和荧光有机质总量各不相同.另外, 不同环境DOM样品的5种荧光组分相对含量也不尽相同, 但均以类腐殖质物质为主, 占到37.14%~63.86%, 其次为溶解性微生物产物(13.50%~31.19%), 类富里酸物质次之(8.97%~14.69%), 类色氨酸、类酪氨酸含量最少.
2) 农田土壤、浮游藻类、水生植物和沉积物样品的DOM组成结构各异, 主要表现为农田土壤、沉积物样品水溶性有机质的重均分子量和腐殖化程度均显著大于浮游藻类和水生植物样品.这主要是因为DOM样品自身组成特征和在环境介质中受光化学和微生物作用的结果.另外, 本研究提出的P-L/H-L和L-DOM/R-DOM比值也可较为敏感地表征DOM结构和性质.
3) 基于流域范围内生态环境单元的连通性, 不同环境介质之间DOM可以进行迁移, 且DOM的迁移过程中受物理、化学和生物要素的影响而发生组成结构和性质的变化, 进而影响环境中污染物的环境行为与生态效应.因此, 在流域环境污染控制和管理过程中, 要加强对变化环境中DOM的环境行为与生态效应的认识.
Baken S, Degryse F, Verheyen L, et al. 2011. Metal complexation properties of freshwater dissolved organic matter are explained by its aromaticity and by anthropogenic ligands[J]. Environmental Science & Technology, 45(7): 2584-2590. |
Bushaw K L, Tarr M A, Schulzjander D, et al. 1996. Photochemical release of biologically available nitrogen from aquatic dissolved organic matter[J]. Nature, 381(6581): 404-407. DOI:10.1038/381404a0 |
Charles T D, Michael D L, Timothy J S. 1994. Modeling the acid-base chemistry of organic solutes in Adirondack, New York, lakes[J]. Water Resources Research, 30(2): 297-306. DOI:10.1029/93WR02888 |
Chen W, Westerhoff P, Leenheer J A, et al. 2003. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 37(24): 5701-5710. |
蔡明红, 肖宜华, 王峰, 等. 2012. 北极孔斯峡湾表层沉积物中溶解有机质的来源与转化历史[J]. 海洋学报, 34(6): 102-113. |
曹昌丽, 梁梦琦, 何桂英, 等. 2018. 城镇化河流溶解性有机质的荧光特性与水质相关性: 以宁波市北仑区芦江为例[J]. 环境科学, 39(4): 1560-1567. |
陈雪霜, 江韬, 卢松, 等. 2016. 典型水库型湖泊中CDOM吸收及荧光光谱变化特征: 基于沿岸生态系统分析[J]. 环境科学, 37(11): 4168-4178. |
陈永娟, 胡玮璇, 庞树江, 等. 2016. 北运河水体中荧光溶解性有机物空间分布特征及来源分析[J]. 环境科学, 37(8): 3017-3025. |
Dai J Y, Zhou J M, Qin S P. 2004. Binding of pyrene to dissolved organic matters: fractionation and characterization[J]. Journal of Environmental Sciences, 16(6): 928-933. |
高嵩, 范士亮, 韩秀荣, 等. 2014. 浒苔绿潮与南黄海近岸海域水质的关系[J]. 中国环境科学, 34(1): 213-218. |
Hernandez-Soriano M C, Jimenez-Lopez J C. 2012. Effects of soil water content and organic matter addition on the speciation and bioavailability of heavy metals[J]. Science of the Total Environment, 423: 55-61. DOI:10.1016/j.scitotenv.2012.02.033 |
Hu B, Wang P, Qian J, et al. 2017. Characteristics, sources, and photobleaching of chromophoric dissolved organic matter (CDOM) in large and shallow Hongze Lake, China[J]. Journal of Great Lakes Research, 43(6): 1165-1172. |
Huang M, Li Z, Luo N, et al. 2019. Application potential of biochar in environment: Insight from degradation of biochar-derived DOM and complexation of DOM with heavy metals[J]. Science of the Total Environment, 646: 220-228. |
Huguet A, Vacher L, Relexans S, et al. 2009. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 40(6): 706-719. |
Jiao N, Herndl G J, Hansell D A, et al. 2010. Microbial production of recalcitrant dissolved organic matter: long-term carbon storage in the global ocean[J]. Nature Reviews Microbiology, 8(8): 593-599. |
Keith D J, Yoder J A, Freeman S A. 2002. Spatial and temporal distribution of coloured dissolved organic matter (CDOM) in Narragansett Bay, Rhode Island: Implications for phytoplankton in coastal waters[J]. Estuarine, Coastal and Shelf Science, 55(5): 705-717. |
Kellerman A M, Kothawala D N, Dittmar T, et al. 2015. Persistence of dissolved organic matter in lakes related to its molecular characteristics[J]. Nature Geoscience, 8(6): 454-457. |
Mcclain M E, Boyer E W, Dent C L, et al. 2003. Biogeochemical hot spots and hot moments at the interface of terrestrial and aquatic ecosystems[J]. Ecosystems, 6(4): 301-312. |
梁俭, 江韬, 卢松, 等. 2016. 淹水条件下三峡库区典型消落带土壤释放DOM的光谱特征: 紫外-可见吸收光谱[J]. 环境科学, 37(7): 2496-2505. |
刘丽贞, 黄琪, 吴永明, 等. 2018. 鄱阳湖CDOM三维荧光光谱的平行因子分析[J]. 中国环境科学, 38(1): 293-302. |
柳婷, 杨海燕, 董慧峪, 等. 2019. 饮用水处理过程中溶解性有机物表征方法的研究进展[J]. 环境化学, 38(2): 263-273. |
Ohno T, Fernandez I J, Hiradate S, et al. 2007. Effects of soil acidification and forest type on water soluble soil organic matter properties[J]. Geoderma, 140(1/2): 176-187. |
Peng S W, He X W, Pan H W. 2018. Spectroscopic study on transformations of dissolved organic matter in coal-to-liquids wastewater under integrated chemical oxidation and biological treatment process[J]. Journal of Environmental Sciences, 30(8): 206-216. |
Pernet-Coudrier B, Companys E, Galceran J, et al. 2011. Pb-binding to various dissolved organic matter in urban aquatic systems: Key role of the most hydrophilic fraction[J]. Geochimica et Cosmochimica Acta, 75(14): 4005-4019. |
Qu X X, Xie L, Lin Y, et al. 2013. Quantitative and qualitative characteristics of dissolved organic matter from eight dominant aquatic macrophytes in Lake Dianchi, China[J]. Environmental Science & Pollution Research International, 20(10): 7413-7423. |
Shang Y, Song K, Jacinthe P A, et al. 2019. Characterization of CDOM in reservoirs and its linkage to trophic status assessment across China using spectroscopic analysis[J]. Journal of Hydrology, 576: 1-11. |
Sulzberger B, Durisch-Kaiser E. 2009. Chemical characterization of dissolved organic matter (DOM): A prerequisite for understanding UV-induced changes of DOM absorption properties and bioavailability[J]. Aquatic Sciences, 71(2): 104-126. |
沈烁, 王育来, 杨长明, 等. 2014. 南淝河不同排口表层沉积物DOM光谱特征[J]. 中国环境科学, 34(9): 2351-2361. |
苏明舟, 张靖天, 余红, 等. 2016. 沉积物溶解性有机氮藻类的可利用性[J]. 环境工程学报, 10(8): 4569-4576. |
Totsche K U, Danzer J, gel-Knabner I K. 1997. Dissolved organic matter-enhanced retention of polycyclic aromatic hydrocarbons in soil miscible displacement experiments[J]. Journal of Environmental Quality, 26: 1090-1100. |
Wang Y L, Hu Y Y, Yang C M, et al. 2019. Variations of DOM quantity and compositions along WWTPs-river-lake continuum: Implications for watershed environmental management[J]. Chemosphere, 218: 468-476. |
Wang Y L, Hu Y Y, Yang C M, et al. 2018. Effects of vegetation types on water-extracted soil organic matter (WSOM) from riparian wetland and its impacts on riverine water quality: Implications for riparian wetland management[J]. Science of the Total Environment, 628: 1249-1257. |
Webster K E, Soranno P A, Cheruvelil K S, et al. 2008. An empirical evaluation of the nutrient-color paradigm for lakes[J]. Limnology and Oceanography, 53(3): 1137-1148. |
姚昕, 张运林, 朱广伟, 等. 2014. 湖泊草、藻来源溶解性有机质及其微生物降解的差异[J]. 环境科学学报, 34(3): 688-694. |
于振亚, 杜晓丽, 高参, 等. 2018. 道路雨水径流溶解性有机物与重金属结合作用分析[J]. 环境科学学报, 38(8): 3004-3011. |
Zhang W, Gu P, Zhu W, et al. 2020. Effects of cyanobacterial accumulation and decomposition on the microenvironment in water and sediment[J]. Journal of Soils and Sediments, 20: 2510-2525. DOI:10.1007/s11368-019-02539-5 |
赵海超, 李艳平, 王圣瑞, 等. 2019. 洱海上覆水DOM荧光特征及对富营养化的指示意义[J]. 光谱学与光谱分析, 39(12): 3888-3896. |
朱爱菊, 孙东耀, 谭季, 等. 2019. 亚热带河口陆基养虾塘水体CDOM三维荧光光谱平行因子分析[J]. 环境科学, 40(1): 164-171. |
朱金杰, 邹楠, 钟寰, 等. 2020. 富营养化巢湖沉积物溶解性有机质光谱时空分布特征及其环境意义[J]. 环境科学学报, 40(7): 2528-2538. |
 2021, Vol. 41
2021, Vol. 41


