2. 中国科学院广州地球化学研究所, 有机地球化学国家重点实验室, 广州 510640;
3. 中国科学院大学, 北京 100049
2. State Key Laboratory of Organic Geochemistry, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640;
3. University of Chinese Academy of Sciences, Beijing 100049
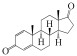
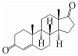
类固醇激素是一类四环脂肪烃化合物, 具有生物活性基团, 根据作用受体不同, 可分为雌激素、雄激素、孕激素、糖皮质激素和盐皮质激素五类(Streck, 2009).1, 4-雄烯二酮(Androsta-1, 4-diene-3, 17-dione, ADD)作为常见的天然雄激素, 是雌激素及其衍生物相互转化的关键中间体, 在生物体内参与代谢后, 以自由态和共轭态的形式随粪便和尿液排出体外, 从而进入到环境中(刘珊, 2013).
现有的污水处理设施如污水处理厂工艺和养殖场储污系统, 不能完全去除ADD.同时, 不同类型和不同形态的类固醇激素之间相互转化, 使得ADD及其它类固醇激素在环境中蓄积(Liu et al., 2012a; 2012c; 杨雷等, 2019a).在中国广东10座污水处理厂及其受纳河流中, ADD检出浓度为ND~4650 ng·L-1(Zhang et al., 2018), 广西养殖场废水中ADD检出浓度为ND~1190 ng·L-1(Liu et al., 2012c), 中国海陵岛水产养殖废水中ADD检出浓度为ND~3.48 ng·L-1(Liu et al., 2015).
作为一种内分泌干扰物, 环境中的ADD具有较强的内分泌干扰效应和生物活性.据报道, 在含有高浓度ADD的造纸厂下游河流中, 食蚊鱼的生长和发育特性受到影响, 可能对种群的繁殖造成不利影响(Hou et al., 2011).马栋栋等(2020)研究发现, 在ADD浓度为4.48 ng·L-1条件下, 对斑马鱼昼夜节律和下丘脑-垂体-性腺轴中相关基因的转录表达具有显著影响.上述研究表明, 环境中残留的ADD可能对人类和水生生态系统构成潜在威胁.因此, 研究环境中ADD的消除技术显得十分重要.
微生物降解是去除环境中类固醇激素的重要途径之一(Chang et al., 2011; Liu et al., 2012a; Liu et al., 2020).目前, 环境中类固醇激素的生物降解研究主要集中在雌激素(Bradley et al., 2009; Combalbert et al., 2010; Wei et al., 2012; Liu et al., 2015b), 以及部分雄激素(Shih et al., 2017; Yang et al., 2010; Viljanto et al., 2020)和部分孕激素(Liu et al., 2013; Yu et al., 2018; Liu et al., 2020).同时, 已有大量文献详细报道了ADD在污水处理厂(Chang et al., 2011; Liu et al., 2012a; Zhang et al., 2018)和养殖场(Liu et al., 2012b; 2012c; 张晋娜, 2019)处理设施中的去除情况, 但关于ADD高效降解菌株的筛选, 尤其是降解速率及可能的转化途径的报道相对较少.
基于此, 本研究从佛山某养殖场废水样品中筛选出1株对ADD具有高效降解效率的菌株(ADD3), 通过生理生化表征及16S rDNA序列同源性分析, 鉴定该菌株为Bacillus sp..在此基础上, 通过优化ADD3降解ADD的最佳外加碳源和浓度、温度及pH, 分析转化产物, 提出降解途径.以期为ADD的生物转化及去除提供参考.
2 材料与方法(Materials and methods) 2.1 仪器和材料试剂:ADD标样购自加拿大TRC公司, 甲醇、乙腈和乙酸乙酯购自德国默克(Merck)公司, 其它试剂购于天津大茂化学试剂厂和天津永大化学试剂有限公司, 水相尼龙滤膜(0.22 μm)购于上海安谱公司.
仪器:超高效液相色谱(1260Ⅱ, Agilent Technologies)、超高效液相色谱与质谱联用(1260Ⅱ, 6460A, Agilent Technologies)、超高效液相色谱与四极杆飞行时间高分辨率质谱仪(1290Ⅱ-6545, Agilent Technologies)和色谱柱均购于美国Agilent Technologies公司.
2.2 培养基MH肉汤培养基:称取本品21.0 g, 加热溶解于1000 mL蒸馏水中, 121 ℃高压灭菌15 min.无机盐培养基由大量元素、微量元素和维生素溶液组成(每升所含成分:KH2PO4 252 mg、K2HPO4 252.6 mg、NH4Cl 900 mg、CaCl2 67.7 mg、NaCl 35.1 mg、MgCl2 9.5 mg、KCl 305.7 mg, 1 mL微量金属元素, 1 mL维生素)(Healy et al., 1979).取1 mL微量元素储液加入到1 L大量元素溶液中, 灭菌后加入1 mL灭菌后的维生素储液, 维生素储液采用0.22 μm的水相滤膜过滤灭菌, 最终调节pH为7.
2.3 菌株的分离纯化从课题组已有菌株(35株分离自佛山某养殖场废水中可降解类固醇激素的菌株)中筛选出一株ADD高效降解菌株.在38支20 mL玻璃试管中加入10 mL高压湿热灭菌后的MH肉汤, 加入ADD使其最终浓度为500 μg·L-1.其中, 前35支加入1 mL菌液(培养至对数期的35种单菌)作为实验组, 另外3支不添加菌液作为对照组.将全部试管用活塞封口并用锡纸包裹, 放入恒温振荡培养箱(30 ℃, 160 r·min-1)避光培养.分别于0、6、12和24 h取样后提取上机检测, 对比MH肉汤中ADD残留量, 筛选出最佳降解菌株, 将其溶于30% LB甘油, 并于-80 ℃冰箱保藏.
2.4 菌株ADD3的鉴定菌株形态及生理生化特性分析参照《常见细菌鉴定手册》(东秀珠等, 2001).采用TIANamp Soil DNA Kit(TIANGEN, 中国)试剂盒提取细菌基因组DNA, 实验步骤按说明书进行.细菌16S引物序列为27f:5′-AGAGTTTGATCMTGGCTCAG-3′和1492R:5′-TACGGYTACCTTGTTACGACTT-3′.PCR反应体系为:H2O 17.8 μL、Buffer 3 μL、d NTP 2 μL、Primer1及Primer2各3 μL、DNA模板1 μL、酶0.2 μL, 总体积为30 μL.PCR反应程序为:95 ℃预变性5 min;95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸60 s, 共35个循环;72 ℃延伸10 min, 12 ℃保存.PCR产物送往北京六合华大基因科技有限公司测序, 测得序列经过美国国家生物信息中心(NCBI)https://www.ncbi.nlm.nih.gov/BLAST序列比对.获得相似性较高的菌株, 采用MEGA7.0软件以neighbor-joining聚类方式绘制系统发育树, bootstrap次数设为1000次.
2.5 菌株ADD3生长曲线测定将保藏于-80 ℃冻存管中的菌株ADD3按梯度温度(-80、-20、4 ℃和室温)解冻, 间隔30 min, 然后在MH肉汤中复活3次, 在2.3节培养条件下绘制生长曲线.
2.6 ADD的提取、检测及产物鉴定 2.6.1 ADD的提取与检测动力学曲线样品采用液液萃取法, 取1 mL样品于1.5 mL离心管中, 分别用400、400和300 μL乙酸乙酯萃取3次, 提取液在室温下氮吹后溶于1 mL的甲醇, 经0.22 μm的有机相针式滤膜过滤后保存于2 mL棕色进样小瓶中待测(Liu et al., 2013).降解产物样品采用过膜法, 取1 mL样品于1.5 mL离心管中, 10000 r·min-1下离心3 min, 经0.22 μm的水相针式滤膜过滤后转至2 mL棕色进样小瓶内待测.
液相色谱条件:安捷伦Eclipse XDB C18柱(150×4.6 mm, 5 μm), 检测波长为245 nm, 进样体积为20 μL, 溶剂∶流动相(ACN∶H2O=55∶45, V/V), 流速为0.6 mL·min-1, 检测温度为30 ℃, 保留时间为5.3 min.
2.6.2 菌株ADD3对ADD的降解特性将菌株ADD3按2.5节的方法复苏后, 取部分菌液到MH肉汤中培养, 活化3代.第3代培养5 h至对数期, OD600值约为0.5, 取1 mL菌液于6500 r·min-1下离心10 min, 弃上清液重复3次, 重新溶于1 mL无机盐培养基待用.
在装有100 mL无机盐培养基的250 mL锥形瓶中加入ADD储备液(1000 mg·L-1), 使其最终浓度为500 μg·L-1, 加入1 mL菌悬液.对照组中加入1 mL已灭活的菌液和叠氮化钠(最终浓度为0.5%).研究不同环境条件下菌株ADD3对ADD降解效率的影响, 具体包括:培养基(MH肉汤和无机盐培养基)、外加碳源(葡萄糖、蔗糖、乙酸钠和淀粉)、外加碳源浓度(1、5、10、50、100、500、1000和2000 mg·L-1)、温度(20、30和40 ℃)及pH(5、7和9).每个处理设置3个平行, 实验在摇床中(160 r·min-1, 30 ℃)进行, 取样前用力摇匀, 所有操作均在超净工作台中完成, 实验中所有锥形瓶采用锡纸包裹以避免光降解.
2.7 降解转化产物鉴定降解产物采用高效液相色谱与质谱联用技术(UPLC-MS/MS)和高效液相色谱与四级杆飞行时间高分辨率质谱联用技术(UPLC-QTof-MS)进行鉴定.UPLC-MS/MS检测条件参考杨雷等(2019b)的研究.UPLC-QTof-MS鉴定ADD仪器参数为:电喷雾电离源(Dual AJS ESI), 反相色谱柱Agilent Eclipse Plus C18(2.1 mm×150 mm, 1.8 mm), 梯度洗脱程序使用两个流动相(A:0.05%甲酸水+5 mmol·L-1乙酸钠;B:乙腈), 梯度程序为:流速为0.4 mL·min-1, 初始为40% A;0~11 min内A相比例由40%降至30%, 总时长为11 min.质谱参数为:干燥气温度为325 ℃, 干燥气流速为8 L·min-1, 鞘气温度为350 ℃, 鞘气流速为11 mL·min-1, 雾化器压力为45 psi, 毛细管电压分别为3500 V(+)和4000 V(-), 喷嘴电压为250 V, 八极杆DC1为65 V, 八极杆RF为750 V, 碎裂电压为120 V.其中, scan模式的质荷比扫描范围为50~400, 扫描速率为3 spectra·s-1, target MS/MS模式下质荷比扫描范围为50~400, 碰撞电压为10、20和40 V.转化产物采用安捷伦系列软件如Mass Hunter PCDL Manager、profinder、Agilent Workflow、Nagivator、Molecular Structure Correlator和QuantAnalysis进行分析.
3 结果与讨论(Results and discussion) 3.1 降解菌ADD3的鉴定经过驯化筛选, 选定降解效果最佳的菌株, 将其命名为ADD3, 系统发育树见图 1.菌株ADD3在鉴定培养基(MH琼脂培养基)纯培养条件下, 菌落呈圆形, 中部凸起, 边缘呈微小锯齿状, 存在晕环, 较光滑, 有粘性, 易挑起, 菌落颜色淡黄色, 正反颜色一致, 革兰氏阳性菌.生理生化表征结果见表 1.
 |
| 图 1 Bacillus sp. ADD3的系统发育树 Fig. 1 Phylogenetic tree of Bacillus sp. ADD3 |
| 表 1 Bacillus sp. ADD3的生理生化表征参数 Table 1 Physiological and biochemical characterization parameters of Bacillus sp. ADD3 |
得到16S rDNA序列后, 登录GenBank进行Blast同源比对, 经比对发现菌株ADD3与Bacillus sp. C44的同源性达到99%.结合生理生化信息, 初步鉴定菌株ADD3为Bacillus sp..
3.3 菌株ADD3的生长曲线如图 2所示, 菌株ADD3在MH培养基中0~1.5 h为生长初期, 1.5 h左右进入对数生长期, 该阶段菌株ADD3代谢旺盛, 适于制备菌株种子液, 5 h左右进入稳定期, 整体生长速率较快.
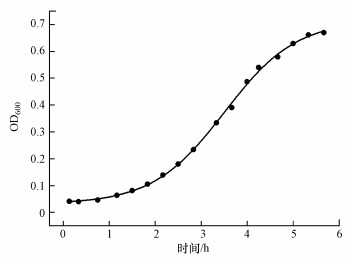 |
| 图 2 Bacillus sp. ADD3的生长曲线 Fig. 2 Growth curve of Bacillus sp. ADD3 |
如图 3所示, 对照组中ADD未见减少, 表明在有氧条件下实验组中ADD的减少主要归因于微生物降解, 非生物降解的贡献可忽略.动力学参数包括速率常数(k)和半衰期(t1/2)见表 2.对于ADD, 其好氧微生物降解遵循零级反应动力学(图 3), 半衰期为3.6 h, 这与刘双双等(2019)的研究结果一致.张晋娜(2019)利用筛选出的菌株Solibacillus silvestris MPA3在无机盐培养基中降解34种类固醇激素物质, 发现6 h内ADD的去除率为-131.5%, 这可能是因为其它类固醇激素转化生成了ADD, 导致去除率为负.
 |
| 图 3 ADD在MH培养基中的降解曲线 Fig. 3 Degradation curve of ADD in Mueller-Hinton Broth |
| 表 2 好氧条件下ADD的理化性质和动力学参数 Table 2 Physicochemical properties and kinetic parameters of ADD under aerobic conditions |
碳源作为微生物生长繁殖的能量来源, 外加碳源对微生物降解有机污染物有着重要作用(石洲旗等, 2020).本研究通过添加不同碳源, 探究了菌株对ADD降解的影响.培养基中ADD的初始浓度为500 μg·L-1, 外加碳源初始浓度为5 mg·L-1.由图 4可知, 实验组和对照组中的ADD浓度在20 d内基本保持不变, 表明菌株ADD3不能以ADD为唯一生长碳源.葡萄糖、乙酸钠、蔗糖和淀粉对菌株ADD3降解ADD均有一定的促进作用, 其中淀粉的促进作用最大, 20 d内ADD去除率达38.97%.而去除率普遍较低的原因可能是外加碳源投加量较少, 导致该菌株无法获得生长代谢所需要的物质和能量, 抑制了相关酶的合成.
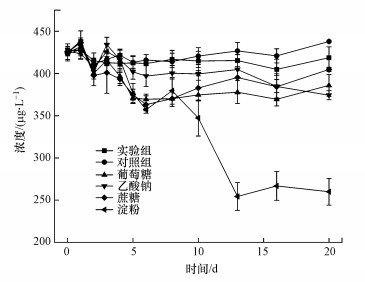 |
| 图 4 不同碳源对Bacillus sp. ADD3降解ADD的影响 Fig. 4 Effects of different external carbon sources degradation of ADD by Bacillus sp. ADD3 |
据报道, 外加碳源浓度可以显著影响菌株降解目标物质的效率(董怡华等, 2011; 郭静波等, 2014; 石洲旗等, 2020).通过添加不同初始浓度的淀粉, 研究其对菌株ADD3降解ADD效率的影响.如图 5所示, 淀粉浓度为0~1000 mg·L-1时, ADD的降解率随着淀粉浓度的升高而显著升高, 这是因为更高的生长基质浓度可以为菌株提供更多的能量以合成更多非特异性降解酶.当外加淀粉进一步提高至2000 mg·L-1时, ADD降解率没有明显提高, 这是因为当生长基质相对于非生长基质的浓度比过高时, 降解非生长基质相关的酶会出现功能上的退化或降低相关酶与非生长基质的结合概率, 导致降解效率下降(郭静波等, 2014).当淀粉浓度为1000 mg·L-1时, 菌株ADD3可在2.75 d内完全降解ADD(图 5和图 6).
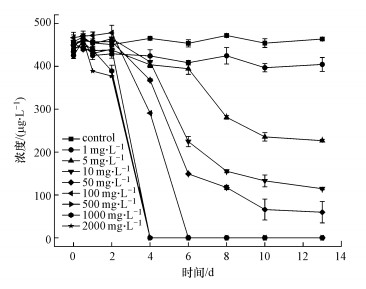 |
| 图 5 不同初始浓度淀粉对Bacillus sp. ADD3降解ADD的影响 Fig. 5 Effects of different initial concentrations of starch degradation of ADD by Bacillus sp. ADD3 |
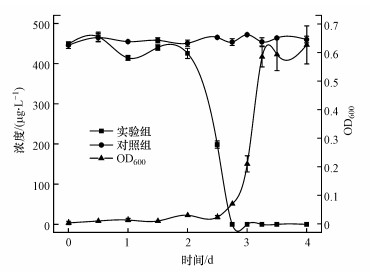 |
| 图 6 ADD的降解曲线和Bacillus sp. ADD3的生长曲线 Fig. 6 Degradation curve of ADD and growth curve of Bacillus sp. ADD3 |
据以往研究报道, 在含有40 g·L-1葡萄糖的培养基中, 菌株Mycobacterium sp. Et1完全降解0.87 mmol·L-1 ADD需要4 d, 底物浓度过高会对菌株共代谢产生抑制作用(Egorova et al., 2009).对于另一种天然雄激素AED, 在含有葡萄糖的肉汤培养基中, 真菌Mucor racemosus完全降解1 g·L-1 AED需要7 d(Faramarzi et al., 2008a), 降解速率与另外一份报道类似, 真菌Neurospora crassa FGSC 4335完全降解3.5 mmol·L-1 AED需要6 d (Faramarzi et al., 2008b).结合3.4节, 与前人研究相比, 当外加碳源充足时, 菌株ADD3可以快速生长繁殖并合成大量的非特异性降解酶, 以共代谢方式快速降解ADD.
3.5.3 最佳pH和温度筛选温度和pH会影响微生物的降解效率(Wang et al., 2013; 杨雷等, 2019a).本研究基于实际环境温度范围及细菌适宜生长的温度, 选取20、30和40 ℃作为实验温度.如图 7所示, 在较宽的pH和温度范围内菌株ADD3可有效降解ADD, 最佳pH和温度分别为7.0和40 ℃.除上述因素外, 目标物初始浓度、重金属离子浓度和NaCl等均会影响微生物的降解转化效率(Wang et al., 2013; 李容榛等, 2019).因此, 有待深入研究影响其降解的因素, 便于应用到实际环境修复中.
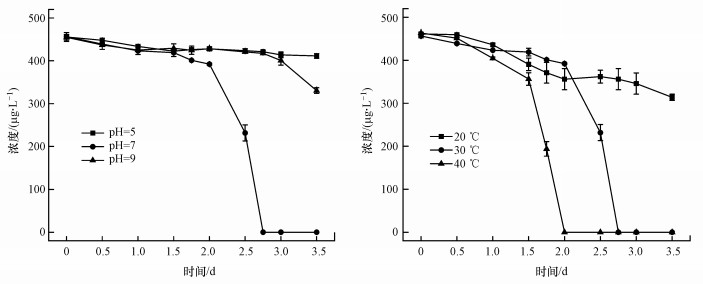 |
| 图 7 不同温度和pH条件下Bacillus sp. ADD3对ADD的降解 Fig. 7 Degradation of ADD under different temperature and pH conditions by Bacillus sp. ADD3 |
分别取外加淀粉浓度为1000 mg·L-1、pH=7和温度为30 ℃条件下的降解样品, 采用UPLC-QTof-MS扫描其降解产物, 结合UPLC-MS/MS技术(杨雷等, 2019b), 共推测出5种可能的转化产物, 其基本信息如图 8和表 3所示, 编号分别为TP1~TP5, 其中, TP5(17β-勃地酮, 17β-BOL)仅在UPLC-MS/MS中发现.
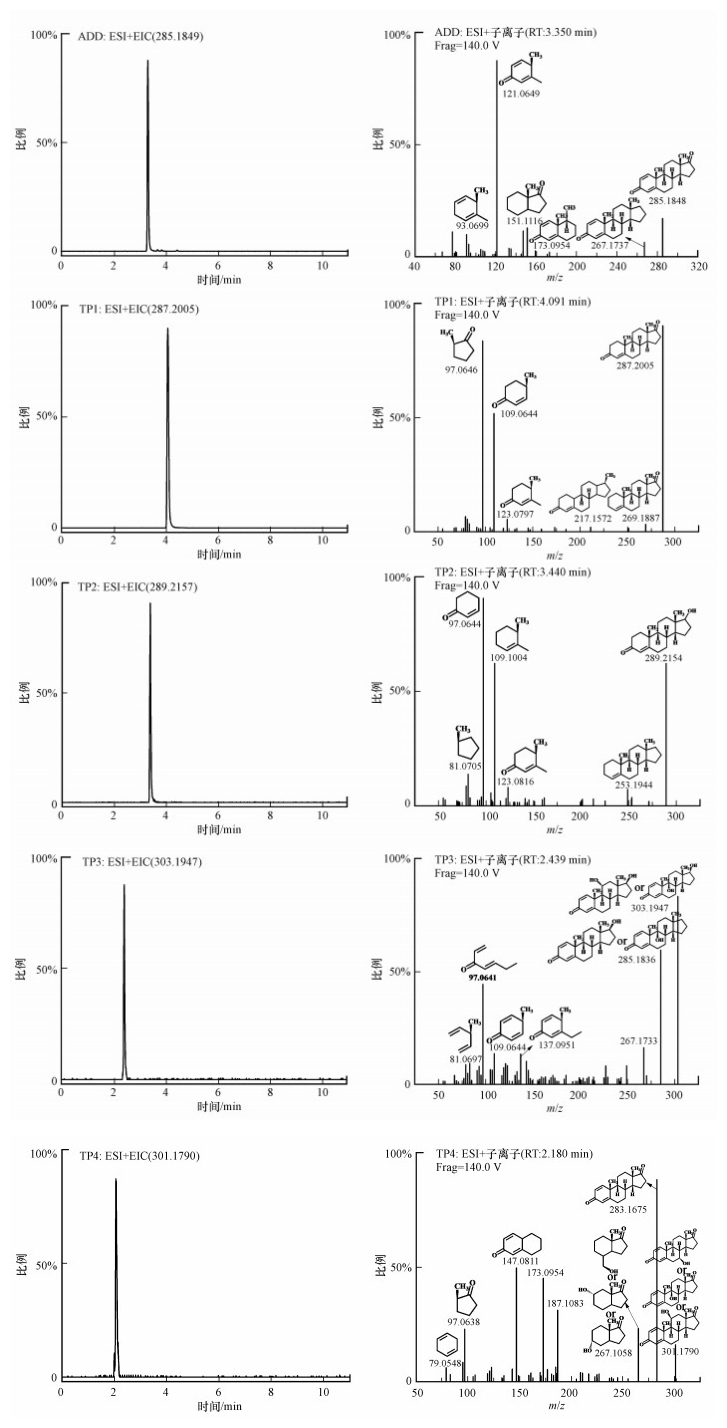 |
| 图 8 ADD及其转化产物的提取色谱图及二级质谱图 Fig. 8 Extracted ion chromatograms and MS/MS spectra abtained from UPLC-QTof-MS for ADD and its proposed transformation products |
| 表 3 ADD生物降解产物的基本结构信息 Table 3 Information of the ADD biodegradation products by Bacillus sp. ADD3 |
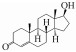
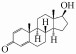
根据鉴定的转化产物, 提出了ADD可能的3条生物转化途径, 转化机理主要包括加氢还原、脱氢氧化和羟基化(图 9).第1条转化途径为在1(2)氢化酶作用下在C1~C2位置发生加氢还原反应生成产物TP1(雄烯二酮, AED), 然后在C17位置17β-羟基脱氢酶作用下发生羟基化反应生成TP2(睾酮, TTR), TP1和TP2可能相互转化, 该降解途径在一些文献中也有报道(Arioli et al., 2008; Vyacheslav et al., 2020), 目前已有研究人员在R. erythropolis SQ1中发现了2种1(2)-脱氢同工酶(命名为KSD1和KSD2)及编码2种酶的ksD基因(van der Geize et al., 2000).第2条转化途径为在C17位置发生羟基化生成TP5, 在C1~C2位置发生加氢还原, 然后与TP2可能发生相互转化;此外, TP5在羟化酶作用下在C9或C11位点插入羟基生成TP3, 但本研究目前还无法准确判断引入羟基的位置.Choudhary等(2002)利用真菌Cephalosporium aphidicola降解ADD, 同样发现生成了TP3.第3条降解途径则是在羟化酶作用下生成TP4, 但因信息有限, 本研究无法判断在ADD基础结构上羟基的引入位置, 应采用核磁共振光谱(NMR)等技术鉴定出产物的具体结构, 该降解途径同样已在文献中报道(Choudhary et al., 2002).羟基化是类固醇激素功能化最重要的反应之一, Donova等(2007; 2012)详细综述了放线菌在类固醇激素母核结构中的不同位置引入羟基, 研究较多的是9α-羟基化反应, 已从Nocardia sp. M117中分离出9α-羟化酶, 包括黄素蛋白还原酶和2种铁氧还蛋白, 在Arthrobacter oxydans 317中发现9α-羟化酶由质粒编码, 目前尚未研究编码9α-羟化酶的核酸序列, 值得人们深入研究.
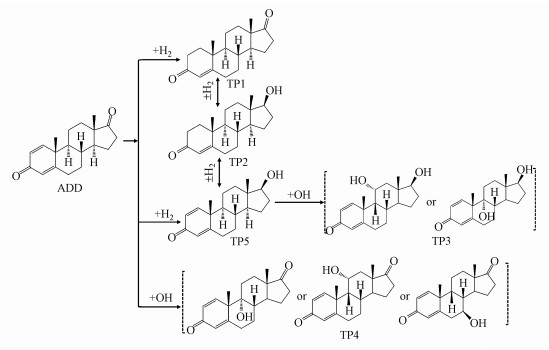 |
| 图 9 好氧条件下ADD可能的降解途径 (产物TP3和TP4分别是虚括号产物中的一种) Fig. 9 Proposed degradation pathways of ADD under aerobic conditions |
目前, 关于单株细菌直接转化ADD的报道较少, 同以往报道类似(Choudhary et al., 2002; Arioli et al., 2008; Vyacheslav et al., 2020), 在本研究中未检测出开环产物, 这可能是因为各环境介质所含成分复杂, 加上ADD的浓度较低, 难以作为唯一碳源和能源被微生物利用, 需添加额外碳源, 以共代谢方式降解转化ADD.据报道, 不同种类真菌转化AED时, 可以在C6、C7、C11、C14和C17等位点引入羟基, 这表明ADD和AED具有类似的转化途径, 产物主要在母体化合物上羟基等官能团加成(Yildirim et al., 2017; Heidary et al., 2020).
通过UPLC-MS/MS加标法检测降解过程中3种产物(TP1、TP2和TP5)的浓度变化, 发现浓度先随着时间变化而升高, 在第2 d达到最高值, 然后保持相对不变(图 10).其中, 产物TP1为主要的转化产物, 转化率最高达55.50%, 说明ADD易被微生物转化且大部分ADD转化生成TP1, 产物TP2和TP5的转化率相对较低, 均低于1.0%.通过查阅文献(Liu et al., 2017; Zhang et al., 2018), 仅得知ADD、AED和TTR的预测无效应浓度(Predicted No Effect Concentration, PNEC)分别为100、14和100 ng·L-1, 因缺乏其它产物的PNEC值, 所以应更加全面地评估转化产物的毒性, 进而评估菌株ADD3是否可以降低ADD对水生环境构成的生态风险.
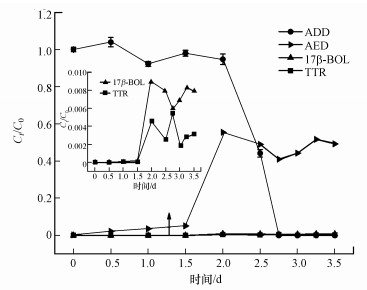 |
| 图 10 好氧条件下ADD降解过程中各产物产率变化 Fig. 10 The present rate of ADD and the estimated yield of its products by Bacillus sp. ADD3 |
1) 从佛山养殖废水中筛选出一株ADD高效降解菌株, 经16S rDNA测定后命名为Bacillus sp. ADD3.
2) 对菌株ADD3进行降解特性研究, 结果表明, 菌株ADD3无法以ADD为唯一碳源, 在培养基中以共代谢的方式转化ADD, 在生长基质(MH肉汤)充足时, 可以快速降解ADD, 降解动力学符合零级动力学方程, 半衰期仅为3.6 h;葡萄糖、乙酸钠、蔗糖和淀粉等外加碳源对菌株ADD3降解ADD均有一定的促进作用, 其中, 最优外加碳源为淀粉, 其最佳外加浓度为1000 mg·L-1;最佳pH和温度分别为7和40 ℃.
3) 共鉴定出5种降解产物, 推断出3条降解途径, 转化方式包括羟基化、加氢还原和去氢氧化, 未发现开环产物, 表明菌株ADD3不能使ADD完全矿化.3种降解产物中TP1(AED)为主要转化产物, 转化率最高达55.5%, 其它2种产物转化率较低, 均低于1.0%.
Arioli F, Gavinelli M P, Fracchiolla M L, et al. 2008. Evaluation of boldenone formation and related steroids transformations in veal faeces by liquid chromatography/tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 22(2): 217-223. DOI:10.1002/rcm.3361 |
Bradley P M, Barber L B, Chapelle F H, et al. 2009. Biodegradation of 17 beta-Estradiol, estrone and testosterone in stream sediments[J]. Environmental Science & Technology, 43(6): 1902-1910. |
Chang H, Wan Y, Wu S, et al. 2011. Occurrence of androgens and progestogens in wastewater treatment plants and receiving river waters: comparison to estrogens[J]. Water Research, 45(2): 732-740. DOI:10.1016/j.watres.2010.08.046 |
Choudhary M I, Musharraf S G, Shaheen F, et al. 2002. Microbial transformation of (+)-androsta-1, 4-diene-3, 17-dione by Cephalosporium aphidicola[J]. Natural Product Letters, 16(6): 377-382. DOI:10.1080/10575630290033132 |
Combalbert S, Hernandez R G. 2010. Occurrence, fate, and biodegradation of estrogens in sewage and manure[J]. Applied Microbiology and Biotechnology, 86(6): 1671-1692. DOI:10.1007/s00253-010-2547-x |
东秀珠, 蔡妙英. 2001. 常见细菌鉴定手册[M]. 北京: 科学出版社, 1-418.
|
董怡华, 胡筱敏, 和英滇, 等. 2011. 共代谢条件下光合细菌对2-氯苯酚的生物降解[J]. 应用生态学报, 22(5): 1280-1286. |
Donova M V. 2007. Transformation of steroids by actinobacteria: A review[J]. Applied Microbiology and Biotechnology, 43(1): 1-14. |
Donova M V, Egorova O V. 2012. Microbial steroid transformations: current state and prospects[J]. Applied Microbiology and Biotechnology, 94(6): 1423-1447. DOI:10.1007/s00253-012-4078-0 |
Egorova O V, Nikolayeva V M, Sukhodolskaya G V, et al. 2009. Transformation of C-19-steroids and testosterone production by sterol-transforming strains of Mycobacterium spp[J]. Journal of Molecular Catalysis B: Enzymatic, 57(1/4): 198-203. |
Faramarzi M A, Badiee M, Yazdi M T, et al. 2008a. Formation of hydroxysteroid derivatives from androst-4-en-3, 17-dione by the filamentous fungus Mucor racemosus[J]. Journal of Molecular Catalysis B: Enzymatic, 50(1): 7-12. DOI:10.1016/j.molcatb.2007.09.017 |
Faramarzi M A, Agheinejad M, Yazdi M T, et al. 2008b. Metabolism of androst-4-en-3, 17-dione by the filamentous fungus Neurospora crassa[J]. Steroids, 73(1): 13-18. DOI:10.1016/j.steroids.2007.06.008 |
郭静波, 陈微, 马放, 等. 2014. 环境污染治理中难降解有机污染物的生物共代谢[J]. 安全与环境学报, 14(6): 223-227. |
Healy J, Young L. 1979. Anaerobic degradation of eleven aromatic compounds to methane[J]. Applied and Environmental Microbiology, 38: 84-89. DOI:10.1128/AEM.38.1.84-89.1979 |
Heidary M, Ghasemi S, Habibi Z, et al. 2020. Biotransformation of androst-4-ene-3, 17-dione and nandrolone decanoate by genera of Aspergillus and Fusarium[J]. Biotechnology Letters, 42(9): 1767-1775. DOI:10.1007/s10529-020-02902-4 |
Hou L P, Xie Y P, Ying G G, et al. 2011. Developmental and reproductive characteristics of western mosquitofish(Gambusia affinis) exposed to paper mill effluent in the Dengcun River, Sihui, South China[J]. Aquatic toxicology, 103(3): 140-149. |
李容榛, 李成, 赵暹, 等. 2019. 一株高效邻苯二甲酸二丁酯降解菌的筛选、鉴定及其降解特性研究[J]. 环境化学, 38(10): 2274-2282. |
Liu S, Chen H, Zhou G J, et al. 2015. Occurrence, source analysis and risk assessment of androgens, glucocorticoids and progestagens in the Hailing Bay region, South China Sea[J]. Science of the Total Environment, 536: 99-107. DOI:10.1016/j.scitotenv.2015.07.028 |
Liu S, Ying G G, Liu Y S, et al. 2013. Degradation of norgestrel by bacteria from activated sludge: comparison to progesterone[J]. Environmental Science & Technology, 47(18): 10266-10276. |
Liu S, Ying G G, Zhao J L, et al. 2012a. Occurrence and fate of androgens, estrogens, glucocorticoids and progestagens in two different types of municipal wastewater treatment plants[J]. Journal of Environmental Monitoring, 14(2): 482-491. DOI:10.1039/C1EM10783F |
Liu S, Ying G G, Zhou L J, et al. 2012b. Steroids in a typical swine farm and their release into the environment[J]. Water Research, 46(12): 3754-3768. DOI:10.1016/j.watres.2012.04.006 |
Liu S, Ying G G, Zhang R Q, et al. 2012c. Fate and occurrence of steroids in swine and dairy cattle farms with different farming scales and wastes disposal systems[J]. Environmental Pollution, 170: 190-201. DOI:10.1016/j.envpol.2012.07.016 |
刘珊. 2013. 城市污水处理厂和畜牧养殖环境中类固醇激素物质的污染特征与环境行为研究[D]. 广州: 中国科学院广州地球化学研究所. 8-139
|
Liu S S, Chen J, Zhang J N, et al. 2020. Microbial transformation of progesterone and dydrogesterone by bacteria from swine wastewater: Degradation kinetics and products identification[J]. Science of the Total Environment, 701: 8. |
刘双双, 应光国, 陈军, 等. 2019. 一株去氢孕酮降解菌及其应用[P]. 中国, CN201710495742. X. 2019-10-08
|
Liu S, Chen H, Xu X R, et al. 2017. Three classes of steroids in typical freshwater aquaculture farms: Comparison to marine aquaculture farms[J]. Science of the Total Environment, 609: 942-950. DOI:10.1016/j.scitotenv.2017.07.207 |
Liu Z H, Lu G N, Yin H, et al. 2015b. Removal of natural estrogens and their conjugates in municipal wastewater treatment plants: a critical review[J]. Environmental Science & Technology, 49(9): 5288-5300. |
马栋栋, 蒋宇霞, 杨雷, 等. 2020. 雄激素1, 4-雄烯二酮和雄烯二酮对斑马鱼胚胎昼夜节律和下丘脑-垂体-性腺轴通路中基因转录表达的影响[J]. 生态毒理学报, 15(2): 29-38. |
Viljanto M, Kicman A T, Walker C J, et al. 2020. Bioformation of boldenone and related precursors/metabolites in equine feces and urine, with relevance to doping control[J]. Drug Testing and Analysis, 12(2): 215-229. DOI:10.1002/dta.2706 |
石洲旗, 刘有胜, 蔡稳稳, 等. 2020. 菌株Pseudomonas.BTs降解转化3种苯并三唑类化合物[J]. 华南师范大学学报(自然科学版), 52(1): 36-43. |
Shih C J, Chen Y L, Wang C H, et al. 2017. Biochemical mechanisms and microorganisms involved in anaerobic testosterone metabolism in estuarine sediments[J]. Frontiers in Microbiology, 8: 15. |
Streck G. 2009. Chemical and biological analysis of estrogenic, progestagenic and androgenic steroids in the environment[J]. Trac-Trends in Analytical Chemistry, 28(6): 635-652. DOI:10.1016/j.trac.2009.03.006 |
van der Geize R, Hessels G I, van Gerwen R, et al. 2000. Targeted disruption of the kstD gene encoding a 3-ketosteroid Delta(1)-dehydrogenase isoenzyme of Rhodococcus erythropolis strain SQ1[J]. Applied and Environmental Microbiology, 66(5): 2029-2036. DOI:10.1128/AEM.66.5.2029-2036.2000 |
Vyacheslav K, Andrei S, Alexey K, et al. 2020. Biotransformation of androstenedione and androstadienedione by selected Ascomycota and Zygomycota fungal strains[J]. Phytochemistry: 169. DOI:10.1016/j.phytochem.2019.112160 |
Wang G L, Yue W L, Liu Y, et al. 2013. Biodegradation of the neonicotinoid insecticide acetamiprid by bacterium Pigmentiphaga sp strain AAP-1 isolated from soil[J]. Bioresource Technology, 138: 359-368. DOI:10.1016/j.biortech.2013.03.193 |
Wei Z, Li X, Yates S R, et al. 2012. Anaerobic transformation kinetics and mechanism of steroid estrogenic hormones in dairy lagoon water[J]. Environmental Science & Technology, 46(10): 5471. |
Yang Y Y, Borch T, Young R B, et al. 2010. Degradation kinetics of testosterone by Manure-Borne bacteria: influence of temperature, pH, glucose amendments, and dissolved oxygen[J]. Journal of Environmental Quality, 39(4): 1153-1160. DOI:10.2134/jeq2009.0112 |
杨雷, 张晋娜, 史文俊, 等. 2019a. 类固醇激素在环境中的污染现状及归趋[J]. 生态毒理学报, 14(5): 1-21. |
杨雷, 张晋娜, 徐敏, 等. 2019b. 中国南海流沙湾中雄激素、糖皮质激素和孕激素的污染特征及其生态风险评价[J]. 环境科学, 40(11): 4879-4888. |
Yildirim K, Kuru A, Keskin E, et al. 2017. Biotransformation of androst-4-ene-3, 17-dione by some fungi[J]. Journal of Chemical Research, (10): 594-597. |
Yu Q M, Geng J J, Huo H L, et al. 2018. Bioaugmentated activated sludge degradation of progesterone: Kinetics and mechanism[J]. Chemical Engineering Journal, 352: 214-224. DOI:10.1016/j.cej.2018.06.159 |
Zhang J N, Ying G G, Yang Y Y, et al. 2018. Occurrence, fate and risk assessment of androgens in ten wastewater treatment plants and receiving rivers of South China[J]. Chemosphere, 201: 644-654. DOI:10.1016/j.chemosphere.2018.02.144 |
张晋娜. 2019. 类固醇雄激素、孕激素和糖皮质激素的环境污染特征及其生物降解转化规律[D]. 广州: 中国科学院广州地球化学研究所. 182-228
|
 2021, Vol. 41
2021, Vol. 41