2. 中国科学院生态环境研究中心, 北京 100089
2. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100089
铀(U)是一种广泛存在的金属, 天然存在于岩石、土壤和水体中, 地下水中铀含量与含水层性质有关, 通常为0.1~10.0 ppb.铀矿开采和核工业会导致铀污染, 其化学毒性和放射性对环境和人类健康构成严重威胁(Yan et al., 2015).由于铀的释放是一个长期的过程, 铀矿废料堆积和矿井会严重污染周边土壤及含水层, 即使在已废弃铀尾矿井中也是如此(Yin et al., 2019).铀有一系列的氧化状态, 其中铀(Ⅳ)和铀(Ⅵ)是最常见的两种价态, 铀(Ⅳ)在水中溶解性低, 形态稳定, 而铀(Ⅵ)则溶解性较高, 通常以络合态形式存在于水中, 具有更高的迁移性与危害性(Suzuki et al., 2004).
从受污染的地下水中去除放射性铀是饮用水处理值得关注的问题.铀在水溶液中的去除与修复比较困难, 主要是因为铀的形态和迁移受到铀的氧化状态和复杂的生物化学反应影响(Aly et al., 2013).近年来研究探索了多种方法去除铀, 如吸附、膜技术(El-Maghrabi et al., 2016; Kong et al., 2016; Sun et al., 2016)、离子交换(Kim et al., 2015; Khayambashi et al., 2016; Zeng et al., 2017)、光催化还原(Salomone et al., 2015; Li et al., 2017)以及微生物修复技术(李鑫等, 2016)等.然而, 考虑到技术可行性、成本效益和自动化操作, 从较大水量中去除低放射性铀还需环境相容性、高效实用的方法.膜组合工艺因其具有运行成本低、处理效率高和易自动化的优点, 近年来广泛研究并应用于放射性污染水处理(Sancho et al., 2005; Sancho et al., 2006;孔劲松等, 2012;王建龙等, 2013), 但目前关于膜组合工艺处理实际含铀地下水的研究鲜有报道.此外, 以往研究对于处理过程中微生物结构变化关注较少, 而探究铀耐受/转化微生物对铀含量变化的响应有助于人们了解在铀处理过程中的微观生态变化.本研究以某处受持续铀污染地下水源开展的膜组合工艺工程应用为对象, 考察了工程应用过程中各工艺段对铀的去除作用以及对微生物群落分布的影响, 研究不同工艺段出水中铀浓度与微生物群落之间的关系, 为膜组合工艺去除含铀地下水相关研究提供理论与数据支持.
2 材料与方法(Materials and methods) 2.1 工程概况与水样采集水处理工程位于我国某地下水源地, 根据多次检测显示该区域地下水中总α放射性、总β放射性超标现象, 多次抽样检测总α、总β放射性平均值为5.0、1.6 Bq·L-1, 分别超标9倍、0.6倍.核素分析显示铀是造成放射性强度超标的主要元素, WHO规定的饮用水中铀的安全限值为30 ppb (Edition, 2011), 故在此地建设膜组合工艺水处理工程, 产水规模为100 t·L-1.采用工艺方法为混凝沉淀、超滤与反渗透双膜系统.所用混凝剂为硫酸铝, 投加量为10 mg·L-1(以铝计).超滤膜材质为PVDF, 单根膜面积为4.1 m2, 共计12根;反渗透膜材质为聚酰胺复合膜, 单根膜面积为8.4 m2, 共计8根.工程总运行时间为6个月, 每月定期4次检测各工艺段出水水质.在工艺启动运行3个月后, 于2019年9月进行3次水样采集, 每次采集原水、混凝沉淀出水、超滤出水、反渗透出水与浓水5份水样, 共采集15份样本.采集水样经0.45 μm滤膜过滤后将滤膜放置于收集管中置于低温环境运送至实验室提取DNA, 同时采集3份反渗透浓水处生物膜样本提取DNA.
2.2 水质参数分析利用便携式水质仪测量各工艺段出水水温、pH、电导率(Cond)与总溶解性固体(TDS), 利用浊度仪测量浊度;采用紫外/可见光分光光度计法测量水中硝酸盐含量;使用总有机碳分析仪测量溶解性总有机碳(TOC);将水样过0.45 μm滤膜并加入2%硝酸酸化, 采用等离子体质谱仪(ICP-MS)测定水中铀含量.
2.3 水样及生物膜DNA提取实验室进行水样DNA样品提取, 提取方法按照水体DNA提取试剂盒(DNeasy Power Water Kit, QIAGEN, Hilden, North Rhine-Westphalia, Germany)说明书进行, 生物膜DNA提取采用土壤DNA提取试剂盒(DNeasy Power Soil Kit, Hilden, North Rhine-Westphalia, Germany).提取总DNA后, 采用浓度为1%的琼脂糖进行琼脂糖凝胶电泳对DNA片段质量进行鉴定, 出现了清晰明亮的条带, 表示DNA提取成功(其中反渗透出水DNA浓度过低未取得有效样品), 提取出来的DNA均置于-80 ℃冰箱中保存.
2.4 测序与数据处理将提取的DNA样品送至华大基因公司, 基于Illumina HiSeq 2500测序平台, 采用通用引物515F和806R(Caporaso et al., 2012)对16S rRNA基因V4区域进行扩增子测序.测序完成后的原始下机数据经过去杂、去引物、去接头及过滤低质量reads, 得到高质量的clean data, 利用QIIME2(Thuronyi et al., 2019)软件对clean data数据合并双端数据、去嵌合体和去冗余生成扩增子序列变异(amplicon sequence variants, ASVs), 并基于Greengenge 13_8(99% OTUs)数据库进行物种注释, 使用QIIME2中的qiime diversity core-metrics-phylogenetic脚本分析样品的多样性.
2.5 统计与分析方法根据所有样本物种注释的结果, 对平均相对丰度前10的门水平微生物和ASVs进行了分析.在R中使用vegan(Dixon, 2003)进行非参数多元方差分析(Adonis)比较不同工艺段出水样品微生物差异, 并用ggplot2包绘图;微生物群落结构差异和环境因子相关分析利用CANOCO 4.5软件进行(Šmilauer, 2005), 为选择合适的模型对群落数据与环境因子的相关性进行分析, 首先需进行除趋势对应分析(DCA)选择合适模型, 基于DCA分析得到的排序轴的梯度长度最大值均不超过4, 因此采用RDA分析, 经蒙特卡洛检验筛选确定对微生物的结构具有显著影响的环境因素;微生物相对丰度与环境因子相关性统计分析通过IBM SPSS Statistics软件进行, 对于显著性检验结果, *代表p < 0.05, **代表p < 0.01.
3 结果与分析(Results and discussion) 3.1 工艺段水质指标与除铀效果工程运行时长为6个月, 每月监测取得24组不同工艺出水数据, 如图 1a~1f所示, 处理水源为地下水, 温度相对偏低, 在处理过程中温度受地表温度影响逐渐上升.pH进水在6.7~7.1之间, 经过混凝加药、超滤处理呈小幅下降, 总体变化不大, 反渗透由于影响水解平衡而显著降低出水pH.电导率与硝酸盐趋势类似, 混凝沉淀与超滤对电导率与硝酸盐基本无去除效果, 唯独反渗透去除率很高.各工艺对水中TOC与浊度都具有一定的去除效果, 出水保持较低水平.
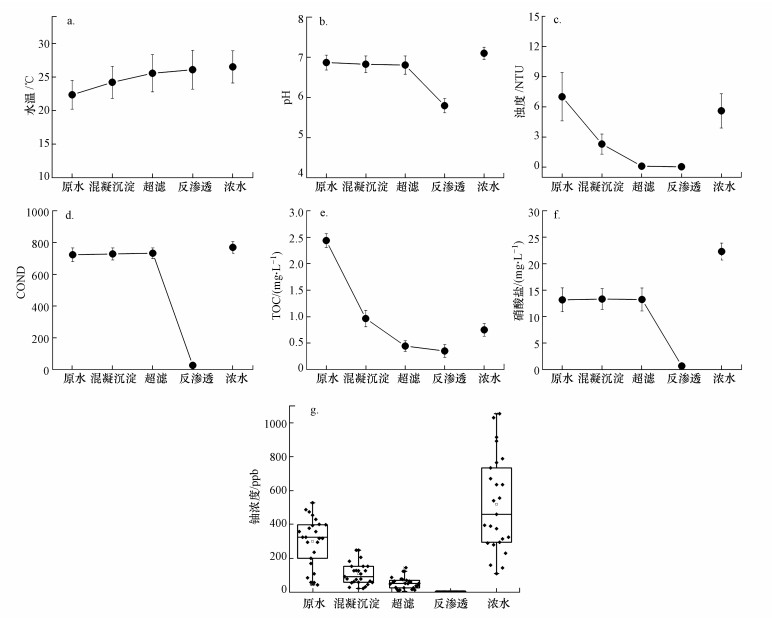 |
| 图 1 不同工艺段出水水质参数(a.水温, b.pH, c.浊度, d.电导率, e.总有机碳, f.硝酸盐, g.铀浓度) Fig. 1 Variation of water quality parameters in different process |
原水中铀浓度存在较大波动, 如图 1g经过混凝沉淀处理平均可以达到65%左右去除率, 混凝过程对污染物的类型和性质、混浊程度、混凝剂的类型和pH等因素都很敏感(Elvis et al., 2015), 工程所用混凝剂为硫酸铝.超滤平均去除率仅为15%, 超滤膜孔尺寸较大(约为50 nm), 无法拦截溶解态的铀酰离子(Semião et al., 2010);反渗透出水铀浓度极低, 研究表明反渗透因为具有极小孔径使得反渗透工艺脱盐率高于95% (McGovern et al., 2014), 可以去除预处理无法去除的铀酰离子.浓水来源于超滤与反渗透的浓水排放, 出水指标显著高于超滤与反渗透产水.各工艺段出水结果表明本组合工艺具有高效且稳定的铀处理效果, 最终出水铀含量低于安全限值.
3.2 微生物多样性分析用4种α多样性指数, 系统发育多样性(PD)、香农指数(Shannon diversity)、Observed OTUs和Pielou均匀度指数来反映物种的丰富度和均匀度(Wang et al., 2017; Grehs et al., 2019), 如表 1所示, 整体来看各工艺段出水α多样性存在较大差异且呈下降趋势, 原水中微生物群落丰富度与均匀度均最高, 其中Observed OTUs和香农指数分别为748±12和5.66±0.01, 而到了浓水中他们则分别减少至155±9和3.09±0.12, 说明经过混凝沉淀及后续超滤处理后微生物无论丰富度还是均匀度均呈下降趋势, 整体工艺可以显著降低微生物多样性, 并通过改变水质环境影响微生物分布.浓水与生物膜中的4种α多样性指数相似, 具有较低的微生物丰富度与均匀度.
| 表 1 不同工艺段微生物群落α多样性指数 Table 1 Alpha diversity index of microbial communities in different process |
β多样性是衡量群落中微生物多样性的另一个指标(Grehs et al., 2019), 可以更好呈现和探究不同样本间微生物群落组成的差异性, 基于Unweighted Unifrac(Lozupone et al., 2005)距离矩阵对各工艺段出水及反渗透生物膜微生物群落进行主坐标轴排序分析(PCoA)(图 3), 解释了约74.41%微生物群落组成变化(第一和第二维度分别为50.67%和23.74%).结果表明水体与生物膜微生物群落具有显著差异, 不同工艺段出水微生物群落之间也具有显著差异.同时也存在小范围聚集情况, 进水与混凝沉淀出水中微生物群落差异性较小, 说明经过混凝沉淀处理后微生物群落组成变化并不显著, 混凝沉淀对水体微生物群落扰动作用较小;超滤出水与浓水中微生物群落差异性小, 原因可能是本工艺中浓水主要来源于超滤的浓水排放, 使得超滤出水与浓水微生物群落近似.
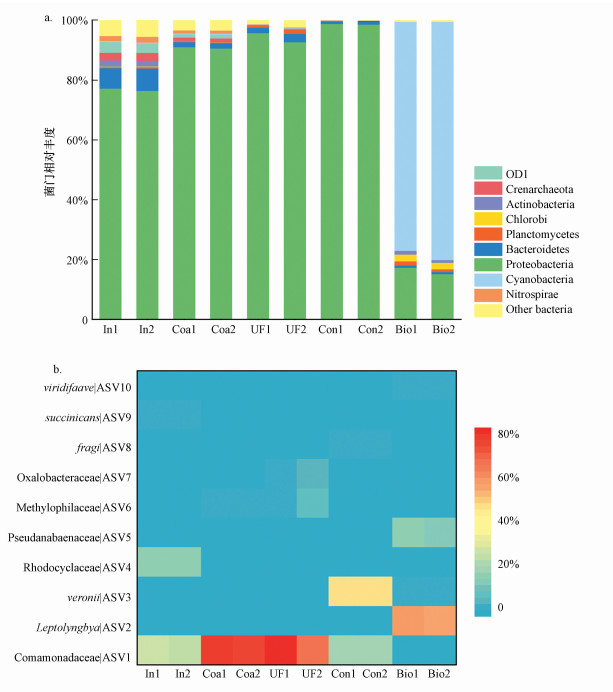 |
| 图 3 微生物群落相对丰度(a.门水平结构组成;b.相对丰度前10 (>0.1%)的ASV heatmap图)(其中In、Coa、UF、Con、Bio分别代表原水, 混凝沉淀出水, 超滤出水, 浓水, 生物膜) Fig. 3 Relative abundance of microbial communities(a. Relative abundance at the phylum level, b. The heatmap of the top 10 abundant ASV in different sampling sites) |
为了解不同工艺段出水中微生物组成情况, 对各工艺段出水进行了16S rRNA测序分析, 测序数据经处理后分析微生物群落组成.在所有水样与生物膜样品中, 发现34个门类, 取相对丰度前10的门类进行分析, 如图 2a所示.整体来看各工艺段出水样本中门水平微生物组成呈现一定差异, 水样与生物膜中门水平微生物组成差异显著.原水中优势菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、泉古菌门(Crenarchaeota)和放线菌门(Actinobacteria), 平均丰度占比分别为76.69%、7.51%、2.57%和1.98%.其中变形菌门为水样样本中优势菌属且在后续工艺段出水相对丰度占比上升, 在浓水中丰度达98.56%, 而在生物膜中则只占比16.13%.经混凝沉淀与超滤处理后, 出水样品中变形菌门相对丰度增加而其余菌门占比减少, 不过变化程度较小.反渗透浓水生物膜中蓝藻门(Cyanobacteria)为优势菌门, 平均丰度占比为78.05%, 铀浓度可能是使其成为优势菌门的原因, 唐东山(唐东山等, 2012)研究显示蓝藻对铀具有耐受性, 在铀较低浓度下(1 mg·L-1)反而会促进蓝藻的生长.
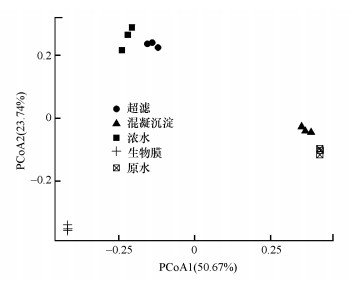 |
| 图 2 微生物群落不同采样点PCoA分析 Fig. 2 PCoA analysis of microbial community at different sampling sites |
分析微生物群落中相对丰度排名前10的ASVs, 如图 2b发现不同工艺段出水中优势菌种不同, 可能由于不同的环境因素导致.丰度较高的物种属于几个特定菌种, 占比较高的主要有丛毛单胞菌科(Comamonadaceae)、鞘丝藻属(Leptolyngbya)、维罗尼种(veronii).其中丛毛单胞菌科在混凝与超滤出水中为优势菌属, 对应于门水平的变形菌门;veronii(属于假单胞菌Pseudomonas)主要存在于浓水中(56%), 并少量存在于生物膜中(8%), 其余水样中丰度极低, 可能与铀含量有关, 有文献报道假单胞菌属于耐铀性较强菌属(Hazen et al., 2005), 可以在较高铀浓度下存活成为优势菌属.
3.4 环境因素对微生物群落影响主成分分析显示微生物群落按不同工艺形成明显聚类, 这可能与环境因素差异有关, 进一步利用RDA分析影响不同工艺段细菌分布差异的环境因素, 如图 4所示量化了环境参数pH、硝酸盐(Nitrate)、电导率(Cond)、温度(Temp)、铀浓度(U)、浊度(Tur)、总有机碳(TOC)对不同工艺出水中微生物群落分布差异的影响, 结果表明, 第一轴和第二轴的解释权重分别为47.4%和26.3%, 7种环境因素共解释了菌种变异的93%, 表明筛选的环境变量对微生物群落分布有显著影响.
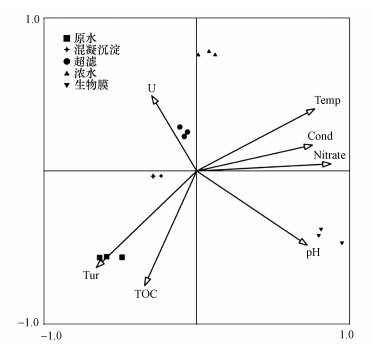 |
| 图 4 微生物群落与环境因素的冗余分析 Fig. 4 RDA analysis between microbial community and environmental factors |
RDA图表明硝酸盐、pH和温度对微生物组成和差异影响较大, 它们解释权重分别为40.5%、16.8%和11%, 微生物群落分布受pH影响较大(Wang et al., 2012; Kuang et al., 2013), 任何pH的变化都会对单细胞生物施加压力, 因为大多数微生物的细胞内pH值通常在一个中性pH范围(Fierer et al., 2006), pH同样影响其它化学性质, 如pH变化可以改变水中重金属的络合状态进而影响水体环境影响微生物组成与分布.混凝过程能够改变水质环境进而影响微生物的分布, 原水经混凝和膜处理后浊度逐渐下降, 有研究显示混凝后的浊度与电导率是微生物群落差异的影响因素(Grehs et al., 2019).另外, 虽然本次研究地下水中放射性元素铀浓度较低, 但仍会影响微生物群落分布(Radeva et al., 2013), 铀的化学性质与放射性对微生物产生毒性压力.图 4中发现从原水到超滤阶段的样品在第二轴方向明显分区, 结合(图 1)中原水到超滤出水铀浓度有较大幅度降低, 说明铀浓度可能是影响不同阶段微生物群落差异的原因之一, 同时水中铀酰离子也因pH或硝酸盐(Geissler et al., 2009)等环境因子影响产生不同程度毒性作用, 因此不同工艺段水体与生物膜中微生物群落分布与差异是由多种环境因素共同影响所致.
3.5 微生物丰度与环境因素关系基于Pearson相关性分析, 整体分析各工艺段出水与生物膜中环境参数变化与相对丰度前15科/属级微生物的关联, 如图 5所示, 丛毛单胞菌科(Comamonadaceae)与硝酸盐、电导率、pH呈显著负相关(p < 0.01), 黄杆菌属(Flavobacterium)、枝动杆菌属(Mycoplana)和披毛菌属(Gallionella)与TOC和浊度呈显著正相关, 与温度和硝酸盐呈显著负相关(p < 0.01), 铀浓度与假单胞菌(Pseudomonas), 紫色杆菌属(Janthinobacterium), 沃格斯菌属(Vogesella)和希瓦氏菌(Shewanella)的分布呈显著正相关(p < 0.01).
 |
| 图 5 Pearson相关分析不同环境因子与属水平微生物相对丰度(热图的对应值是Pearson相关系数, 相关系数当r值介于-1与1之间, r < 0为负相关, r>0为正相关, *为显着性检验p < 0.05, **为显着性检验p < 0.01) Fig. 5 Heatmap of Pearson′s correlation coefficients analysis between the different environmental factors and the relative abundances of bacterial genera. The corresponding value of heatmap is Pearson correlation coefficient where "r" value is between -1 and 1, r < 0 is negative correlation, r>0 is positive correlation, marked * indicates significance test p < 0.05, marked ** indicates significance test p < 0.01 |
整体来看, TOC和温度与大部分微生物存在显著相关性, 因为有机营养与温度对微生物生长至关重要.微生物在环境中的分布受到多种环境因素制约, 本研究地下水存在持续铀污染, 水体中的铀主要以高溶解性与高迁移性UO2+离子态形式存在, 对水体中微生物群落有着显著影响, He等(2018)利用功能基因分析被铀污染的地下水微生物群落, 与本研究结果类似, 地下水中的功能丰富度与多样性随铀浓度的增加而降低, 但特定的功能菌群相对丰度显著增加.以往研究(Cardenas et al., 2008)表明假单胞菌对铀具有高耐受性, 可以在高浓度铀环境中存活, Renninger等(2004)研究了假单胞菌利用自身特性分泌细胞产生磷酸盐在细胞壁上固定磷酸铀酰从而抵抗较高铀浓度影响.本研究浓水样本存在相对丰度较高的希瓦氏菌, 希瓦氏菌因为能够还原多种重金属的特点, 使其具有特殊的生态修复潜力, 近年来在铀还原治理方面成为研究的热点(De Windt et al., 2006; Payne et al., 2006; Hau et al., 2008; Yan et al., 2013), 它可将U(Ⅵ)还原为U(Ⅳ)固定化从而降低其迁移性.另外, 研究发现隶属于变形菌门中的Vogesella菌属与铀呈现明显正相关性, 目前尚未看到有关该菌属与铀相关报道, 有可能是潜在的铀耐受/还原转化菌属.
4 结论(Conclusions)1) 本研究膜组合工艺对地下水中铀具有很高去除效果, 可以保证最终出水低于饮用水标准限值, 混凝沉淀平均除铀率为86%, 超滤平均除铀率为15%, 最终经反渗透除铀率高于99%.
2) 不同的处理工艺出水中微生物群落分布差异较大, 经统计分析显示微生物群落的分布与组成受环境因素与放射性铀共同影响.
3) 不同的工艺段出水中发现特定耐铀或者铀还原功能菌属, 与铀浓度呈显著正相关关系, 假单胞菌(Pseudomonas), 紫杆菌属(Janthinobacterium), 沃格斯菌属(Vogesella)和希瓦氏菌(Shewanella)的平均相对丰度随铀浓度减少而减少, 揭示了在膜组合工艺处理中铀含量变化对水中微生物群落结构的影响.
Aly M M, Hamza M F. 2013. A review:Studies on uranium removal using different techniques. Overview[J]. Journal of Dispersion Science and Technology, 34(2): 182-213. DOI:10.1080/01932691.2012.657954 |
Caporaso J G, Lauber C L, Walters W A, et al. 2012. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J]. Isme Journal, 6(8): 1621-1624. DOI:10.1038/ismej.2012.8 |
Cardenas E, Wu W M, Leigh M B, et al. 2008. Microbial communities in contaminated sediments, associated with bioremediation of uranium to submicromolar levels[J]. Applied and Environmental Microbiology, 74(12): 3718-3729. DOI:10.1128/AEM.02308-07 |
De Windt W, Boon N, Van den Bulcke J, et al. 2006. Biological control of the size and reactivity of catalytic Pd(0) produced by Shewanella oneidensis[J]. Antonie Van Leeuwenhoek, 90(4): 377-389. DOI:10.1007/s10482-006-9088-4 |
Dixon P. 2003. VEGAN, a package of R functions for community ecology[J]. Journal of Vegetation Science, 14(6): 927-930. DOI:10.1111/j.1654-1103.2003.tb02228.x |
Edition F. 2011. Guidelines for drinking-water quality[J]. WHO Chronicle, 38(3): 104-108. |
El-Maghrabi H H, Abdelmaged S M, Nada A A, et al. 2017. Magnetic graphene based nanocomposite for uranium scavenging[J]. Journal of Hazardous Materials, 322: 370-379. DOI:10.1016/j.jhazmat.2016.10.007 |
Elvis C, Jorge R. 2015. Polymer-bridging flocculation performance using turbulent pipe flow[J]. Minerals Engineering
|
Fierer N, Jackson R B. 2006. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Ences of the United States of America, 103(3): 626-631. |
Geissler A, Merroun M, Geipel G, et al. 2009. Biogeochemical changes induced in uranium mining waste pile samples by uranyl nitrate treatments under anaerobic conditions[J]. Geobiology, 7(3): 282-294. DOI:10.1111/j.1472-4669.2009.00199.x |
Grehs B W N, Lopes A R, Moreira N F F, et al. 2019. Removal of microorganisms and antibiotic resistance genes from treated urban wastewater:A comparison between aluminium sulphate and tannin coagulants[J]. Water Research, 166(115056): 115056. |
Hau H H, Gilbert A, Coursolle D, et al. 2008. Mechanism and consequences of anaerobic respiration of cobalt by shewanella oneidensis strain MR-1[J]. Applied and Environmental Microbiology, 74(22): 6880-6886. DOI:10.1128/AEM.00840-08 |
Hazen T C, Tabak H H. 2005. Developments in bioremediation of soils and sediments polluted with metals and radionuclides:2.Field research on bioremediation of metals and radionuclides[J]. Reviews in Environmental Science and Bio/Technology, 4(3): 157-183. DOI:10.1007/s11157-005-2170-y |
He Z, Zhang P, Wu L, et al. 2018. Microbial functional gene diversity predicts groundwater contamination and ecosystem functioning[J]. Mbio, 9(1): e02435-17. |
Khayambashi A, Wang X, Wei Y. 2016. Solid phase extraction of uranium (Ⅵ) from phosphoric acid medium using macroporous silica-based D2EHPA-TOPO impregnated polymeric adsorbent[J]. Hydrometallurgy, 164: 90-96. DOI:10.1016/j.hydromet.2016.05.013 |
Kim Y K, Lee S, Ryu J, et al. 2015. Solar conversion of seawater uranium (Ⅵ) using TiO2 electrodes[J]. Applied Catalysis B:Environmental, 163: 584-590. DOI:10.1016/j.apcatb.2014.08.041 |
Kong L, Zhu Y, Wang M, et al. 2016. Simultaneous reduction and adsorption for immobilization of uranium from aqueous solution by nano-flake Fe-SC[J]. Journal of Hazardous Materials, 320: 435-441. DOI:10.1016/j.jhazmat.2016.08.060 |
Kuang J, Huang L, Chen L, et al. 2013. Contemporary environmental variation determines microbial diversity patterns in acid mine drainage[J]. The ISME Journal, 7(5): 1038-1050. DOI:10.1038/ismej.2012.139 |
孔劲松, 王晓伟. 2012. 超滤预处理模拟放射性废水的实验研究[J]. 核动力工程, 33(1): 98-100. DOI:10.3969/j.issn.0258-0926.2012.01.020 |
李鑫, 胡洪营. 2016. 放射性废水处理中吸附铀的优势藻种筛选[J]. 环境科学, 37(5): 1858-1863. |
Li Z, Huang Z, Guo W, et al. 2017. Enhanced photocatalytic removal of Uranium(Ⅵ) from aqueous solution by magnetic TiO2/Fe3O4 and its graphene composite[J]. Environmental Science & Technology, 51(10): 5666-5674. |
Lozupone C, Knight R. 2005. UniFrac:A new phylogenetic method for comparing microbial communities[J]. Applied and Environmental Microbiology, 71(12): 8228-8235. DOI:10.1128/AEM.71.12.8228-8235.2005 |
Mcgovern R K, Lienhard V J H. 2014. On the potential of forward osmosis to energetically outperform reverse osmosis desalination[J]. Journal of Membrane Science, 469: 245-250. DOI:10.1016/j.memsci.2014.05.061 |
Payne A N, Dichristina T J. 2006. A rapid mutant screening technique for detection of technetium[Tc(VⅡ)] reduction-deficient mutants of Shewanella oneidensis MR-1[J]. FEMS Microbiol Lett, 259(2): 282-287. DOI:10.1111/j.1574-6968.2006.00278.x |
Radeva G, Kenarova A, Bachvarova V, et al. 2013. Bacterial diversity at abandoned uranium mining and milling sites in bulgaria as revealed by 16S rRNA genetic diversity study[J]. Water, Air, & Soil Pollution, 224(11): 1748. DOI:10.1007/s11270-013-1748-1 |
Renninger N, Knopp R, Nitsche H, et al. 2004. Uranyl precipitation by pseudomonas aeruginosa via controlled polyphosphate metabolism[J]. Applied and Environmental Microbiology, 70(12): 7404-7412. DOI:10.1128/AEM.70.12.7404-7412.2004 |
Salomone V N, Meichtry J M, Zampieri G, et al. 2015. New insights in the heterogeneous photocatalytic removal of U(Ⅵ) in aqueous solution in the presence of 2-propanol[J]. Chemical Engineering Journal, 261: 27-35. DOI:10.1016/j.cej.2014.06.001 |
Sancho M, Arnal J M, Verdu G, et al. 2006. Ultrafiltration and reverse osmosis performance in the treatment of radioimmunoassay liquid wastes[J]. Desalination, 201(1/3): 207-215. |
Sancho M, Arnal J M, Villaescusa J I, et al. 2005. Declassification of radioactive liquid wastes generated in radio immune adday (RIA) laboratories[J]. Radiation Protection Dosimetry, 116(1/4): 518-520. |
Semião A J C, Rossiter H M A, Schäfer A I. 2010. Impact of organic matter and speciation on the behaviour of uranium in submerged ultrafiltration[J]. Journal of Membrane Science, 348(1/2): 174-180. |
šmilauer L. 2005. Multivariate analysis of ecological data using CANOCO[J]. Bulletin of the American Mathematical Society, 201(86): 201. |
Sun Y, Wu Z, Wang X, et al. 2016. Macroscopic and microscopic investigation of U(Ⅵ) and Eu(Ⅲ) adsorption on carbonaceous nanofibers[J]. Environmental Science & Technology, 50(8): 4459-4467. |
Suzuki Y, Banfield J F. 2004. Resistance to, and accumulation of, uranium by bacteria from a uranium-contaminated site[J]. Geomicrobiology, 21(2): 113-121. DOI:10.1080/01490450490266361 |
Thuronyi B W, Koblan L W, Levy J M, et al. 2019. Publisher correction:Continuous evolution of base editors with expanded target compatibility and improved activity[J]. Nature Biotechnology, 37(9): 1091-1091. |
唐东山, 张容芳. 2012. 铀胁迫对两种蓝藻生长及抗氧化酶活性的影响[J]. 生态毒理学报, 7(6): 609-614. |
Wang X, Hu M, Xia Y, et al. 2012. Pyrosequencing analysis of bacterial diversity in 14 wastewater treatment systems in China[J]. Applied and Environmental Microbiology, 78(19): 7042-7047. DOI:10.1128/AEM.01617-12 |
Wang Y, Cao P, Wang L, et al. 2017. Bacterial community diversity associated with different levels of dietary nutrition in the rumen of sheep[J]. Applied Microbiology and Biotechnology, 101(9): 3717-3728. DOI:10.1007/s00253-017-8144-5 |
王建龙, 刘海洋. 2013. 放射性废水的膜处理技术研究进展[J]. 环境科学学报, 33(10): 2639-2656. |
Yan F, Wu C, Cheng Y, et al. 2013. Carbon nanotubes promote Cr(Ⅵ) reduction by alginate-immobilized Shewanella oneidensis MR-1[J]. Biochemical Engineering Journal, 77: 183-189. DOI:10.1016/j.bej.2013.06.009 |
Yan X, Luo X. 2015. Radionuclides distribution, properties, and microbial diversity of soils in uranium mill tailings from southeastern China[J]. Journal of Environmental Radioactivity, 139: 85-90. DOI:10.1016/j.jenvrad.2014.09.019 |
Yan X, Luo X, Zhao M. 2016. Metagenomic analysis of microbial community in uranium-contaminated soil[J]. Applied Microbiology and Biotechnology, 100(1): 299-310. DOI:10.1007/s00253-015-7003-5 |
Yin M, Sun J, Chen Y, et al. 2019. Mechanism of uranium release from uranium mill tailings under long-term exposure to simulated acid rain:Geochemical evidence and environmental implication[J]. Environmental Pollution, 244: 174-181. DOI:10.1016/j.envpol.2018.10.018 |
Zeng J, Zhang H, Sui Y, et al. 2017. New amidoxime-based material TMP-g-AO for uranium adsorption under seawater conditions[J]. Industrial & Engineering Chemistry Research, 56(17): 5021-5032. |
 2021, Vol. 41
2021, Vol. 41


