2. 宁波华研节能环保安全设计研究有限公司, 宁波 315800;
3. 浙江海洋大学石油化工与环境学院, 舟山 316022
2. Ningbo Huayan Energy Efficiency Environmental Protection Safety Design and Research Co., Ltd, Ningbo 315800;
3. College of Petrochemical and Environment, Zhejiang Ocean University, Zhoushan 316022
二氯甲烷(Dichloromethane, DCM)在常温下是一种无色透明液体, 微溶于水, 易挥发.由于其具有良好的溶解能力, 并且回收时稳定性较好, 被广泛运用于氯乙烯纤维、灭火剂、冷冻剂、油漆清除剂及金属去油剂等方面(徐艳丹, 2019).作为挥发性有机物的一种, DCM不仅会对人体的呼吸系统和中枢神经系统造成损伤, 还能在土壤、水环境中不断蓄积, 对生态环境造成一定的污染, 因此, 多次被我国生态环保部列入有毒有害污染物名录中(黄开莲, 1996).
DCM的传统处理方法主要包括:冷凝法、吸收法、吸附法、催化燃烧法及生物法(席劲瑛等, 2012;Chiang et al., 2012;李静等, 2016;刘永杰等, 2019).固定化细胞技术是生物处理法的一种, 主要采用物理或化学手段将游离细胞固定在某种包埋剂内部, 使其保持活性并且加以反复利用.对比传统的废气处理手段, 固定化细胞技术具有细胞密度高、稳定性好、能够重复使用等优点(李雪松等, 2009;Kureel et al., 2017).在固定化技术中, 常见的包埋剂主要有琼脂、海藻酸钠(Sodium alginate, SA)、聚丙烯酰胺、聚乙烯醇(Polyvinyl alcohol, PVA)等.PVA-SA作为一种复合载体, 近年来被广泛应用在各类挥发性有机物(Volatile organic compounds, VOCs)处理过程.但PVA-SA固定化存在生物活性低、机械强度弱、受水力冲击影响大等问题(徐颖超等, 2016).活性炭(Activated carbon, AC)作为吸附剂的一种, 具有较大的比表面积及发达的微孔结构(Castañon et al., 2019).目前, 固定化技术在处理氯代烃类有机物方面存在降解效率低、机械强度弱、稳定性较差等缺点, 在PVA-SA载体中加入活性炭后, 不仅能够通过固定化载体对难溶性有机物的吸附作用来强化底物的传质, 而且提高了载体本身的机械强度(宋蕾等, 2015;杜青平等, 2017).目前, 国内外有关采用固定化细胞技术处理DCM的研究较少.
因此, 本文以分离纯化出的DCM高效降解菌为目标菌, 构建PVA-SA-AC复合载体, 分析对比活性炭的添加对固定化小球降解性能及机械强度的影响.同时, 优化固定化小球的制备条件, 考察包埋剂浓度、交联剂浓度、活性炭浓度、包菌量及钙化时间对固定化小球去除DCM的影响, 并对比固定化细胞和游离细胞的储存稳定性、重复使用性、对环境条件的耐受性.最后, 采用Langmuir和Freundlich模型对复合固定化小球对DCM的吸附等温线进行拟合, 以期为DCM的生物处理提供参考.
2 材料与方法(Materials and methods) 2.1 试验材料 2.1.1 菌株本实验所采用的菌株是从浙江台州某制药企业活性污泥中筛选出的DCM高效降解菌Methylobacterium rhodesianum H13(刘洪霞等, 2013).
2.1.2 培养基采用无机盐(MSM)培养基进行菌体培养:CaCl2 0.023 g·L-1、MgSO4 0.2 g·L-1、(NH4)2SO4 2.5 g·L-1、KH2PO4 1 g·L-1、Na2HPO4·12H2O 4.5 g·L-1、微量元素1 mL·L-1, 110 ℃下高压灭菌40 min.
采用贫瘠(PNS)培养基进行生物降解实验:CaCl2 0.0023 g·L-1、MgSO4 0.02 g·L-1、(NH4)2SO4 0.25 g·L-1、KH2PO4 0.1 g·L-1、Na2HPO4·12H2O 0.45 g·L-1、微量元素0.1 ml·L-1, 110 ℃下高压灭菌40 min.
采用固体R2A培养基进行菌体培养:酵母粉0.5 g·L-1、蛋白胨0.5 g·L-1、葡萄糖0.5 g·L-1、淀粉0.5 g·L-1、丙酮酸钠0.3 g·L-1、K2HPO4 0.45 g·L-1、MgSO4 0.05 g·L-1、琼脂粉20 g·L-1.
2.1.3 固定化试剂海藻酸钠购自阿拉丁试剂有限公司;0.2 mol·L-1 Tris-HCl缓冲液;聚乙烯醇购自麦克林试剂公司;粉末状活性炭, 外观为黑色粉末, 粒度为200目.
2.2 实验方法 2.2.1 固定化小球的制备将保藏的H13菌种接入试管R2A斜面培养基中进行活化, 将活化后的菌种接入R2A平板培养基, 然后接种至MSM培养基中, 待菌体培养至干重为45 mg·L-1(OD600为0.15)时, 将菌液在11000 r·min -1、4 ℃条件下离心10 min, 洗涤并重悬于50 mL浓度为0.2 mol·L -1的Tris-HCl缓冲液中.
将5%的SA与8%的PVA加入到去离子水中, 恒温水浴加热至90 ℃并搅拌待其完全溶解后, 冷却至常温后加入1%的活性炭粉末, 并将细胞悬浮液与PVA-SA-AC混合液以1:1的体积比混合均匀, 用蠕动泵缓缓滴至饱和硼酸与CaCl2的混合溶液中, 在40 ℃下恒温静置使其充分钙化成球.待小球完全成型后取出并用生理盐水洗涤, 用滤纸吸干表面水分, 在4 ℃下储存备用.
2.2.2 DCM检测方法将固定化小球以10%的添加量加入到含200 mg·L-1 DCM的PNS培养基中, 密封, 置于转速为160 r·min-1的摇床中(30 ℃), 通过气相色谱法检测液相中DCM的残留量.以下实验均在体积为330 mL的摇瓶内进行.
采用安捷伦GC6890气相色谱(GC, HPInnowax硅胶毛细管柱, 30 m×0.32 mm×0.5 μm, USA)对DCM的液相浓度进行定量分析, 检测条件:汽化室温度为250 ℃, 检测器(FID)温度为300 ℃, 柱温为80 ℃, 载气流速为1 mL·min-1, 分流比为20:1, 进样量为0.8 mL.
采用顶空进样法测定DCM在气相中的浓度Cg, 按式(1)计算在30 ℃时, 摇瓶内气液平衡比K转化为DCM在液相中的浓度CL.
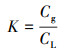
|
(1) |
另外, 本实验中DCM降解速率均指平均降解速率, 计算公式见式(2).
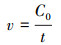
|
(2) |
式中, C0为液相中DCM的初始浓度, 通常为200 mg·L-1;t为完全降解DCM所需时间.
2.2.3 Cl-浓度检测方法采用Dionex ICS-2100离心色谱仪定量分析液相中Cl-浓度;Chromeleon色谱工作站:Dionex ionPac AS18(250 mm×4 mm)分离柱, ionPac AG18(50 mm×4 mm)保护柱.根据Cl-浓度表征DCM在液相中的生物降解情况.
2.2.4 PVA-SA-AC固定化条件的优化① PVA浓度优化:设定SA浓度4.5%, CaCl2浓度2%, 活性炭浓度1%, 包菌量0.75 g, 钙化时间8 h, 考察不同PVA浓度(6%、8%、10%、12%)制备的固定化小球对DCM降解的影响.
② SA浓度优化:设定PVA浓度8%, CaCl2浓度2%, 活性炭浓度1%, 包菌量0.75 g, 钙化时间8 h, 考察不同SA浓度(4%、4.5%、5%、5.5%)制备的固定化小球对DCM降解的影响.
③ CaCl2浓度优化:设定PVA浓度8%, SA浓度5%, 活性炭浓度1%, 包菌量0.75 g, 钙化时间8 h, 考察不同CaCl2浓度(1%、1.5%、2%、2.5%)制备的固定化小球对DCM降解的影响.
④ 活性炭浓度优化:设定PVA浓度8%, SA浓度5%, CaCl2浓度2%, 包菌量0.75 g, 钙化时间8 h, 考察不同活性炭浓度(0.5%、1%、1.5%、2%)制备的固定化小球对DCM降解的影响.
⑤ 包菌量优化:设定PVA浓度8%, SA浓度5%, CaCl2浓度2%, 活性炭浓度1%, 钙化时间8 h, 考察不同包菌量(0.3、0.45、0.6、0.75 g)制备的固定化小球对DCM降解的影响.
⑥ 钙化时间优化:设定PVA浓度8%, SA浓度5%, CaCl2浓度2%, 包菌量0.6 g, 活性炭浓度1%, 考察不同钙化时间(6、8、10、12 h)制备的固定化小球对DCM降解的影响.
上述条件优化实验每组设置3个平行样, 各条件下重复测定2次, 来确定结果.
2.2.5 固定化小球机械强度的测定本实验采用固定化小球的破碎率来表征固定化小球的机械强度, 方法如下:将100颗固定化小球与同等数目、直径(约为4 mm)的玻璃珠置于含有100 mL蒸馏水的锥形瓶中, 在30 ℃、300 r·min -1条件下恒温搅拌, 每隔一段时间取出小球并记录破碎数目, 计算出破碎率, 以此定量表征小球的机械强度.
2.2.6 固定化小球的储存稳定性将相同生物量的固定化细胞和游离细胞置于30 ℃的生理盐水中, 每隔一段时间取出降解200 mg·L-1 DCM, 在30 ℃、160 r·min -1的摇床条件中振荡培养, 检测液相中DCM的残留量, 以20 h内DCM的去除率来表征固定化细胞的储存稳定性.
2.2.7 固定化小球的重复使用性将干重为45 mg·L-1(OD600为0.15)的固定化细胞置于含有200 mg·L-1 DCM的PNS培养基中, 在上述摇床条件中培养, 检测液相中DCM的剩余浓度.待第一批DCM被完全降解后, 将固定化小球取出, 用生理盐水冲洗, 并用滤纸吸干表面水分再转入新鲜的培养基中, 重复数次, 记录固定化细胞对DCM的重复降解情况.
由于DCM生物降解时产生含氯离子的副产物, 培养基中氯离子的蓄积会对DCM降解产生抑制作用(刘红霞等, 2013).因此, 批次实验需要将固定化细胞转入新鲜培养基中进行.
2.2.8 固定化小球对环境条件的耐受性将含相同生物量的固定化细胞和游离细胞置于含有200 mg·L-1 DCM的PNS培养基中, 密封培养, 摇床转速为160 r·min-1, 温度分别为24、27、30、35、40 ℃;利用盐酸和氢氧化钠溶液调节培养基的初始pH为5.0、6.0、6.5、7.0、7.5、8.0、9.0, 进行单一变量实验, 振荡培养, 检测液相中DCM的残留量.记录两种细胞在一个降解周期内对DCM的平均降解速率以表征其在短期内对温度及pH条件的耐受性.
2.3 吸附等温线制备PVA-SA及PVA-SA-AC无菌固定化小球, 置于含有50 mL PNS培养基的摇瓶中, 在液相中吸附浓度为50、100、150、200 mg·L-1的DCM废气.将摇瓶置于摇床中充分振荡以去除外扩散的影响, 每隔一段时间记录液相中小球对DCM的吸附量.采用Langmuir和Freundlich等吸附温线方程, 描述固定化小球对DCM废气在液相中的吸附等温线过程(王海荣等, 2016).
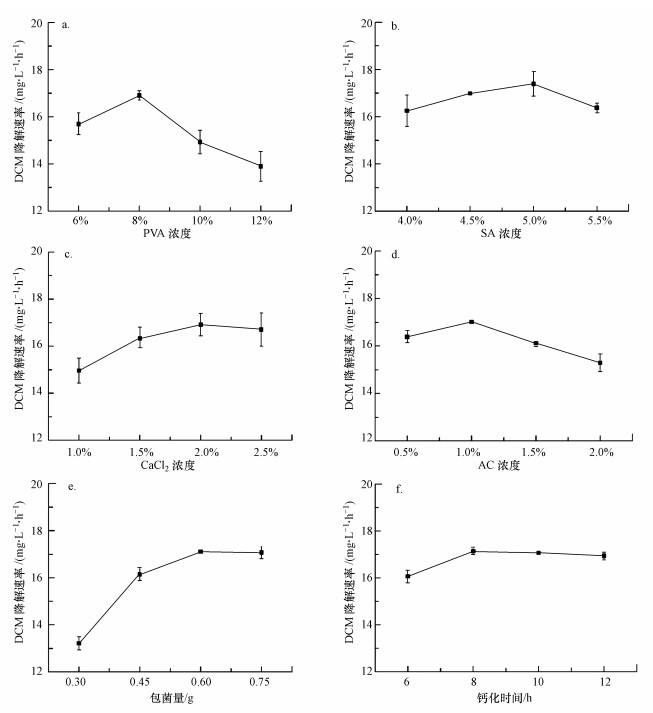
3 结果与讨论(Results and discussion) 3.1 PVA-SA-AC复合载体固定化条件的优化 3.1.1 PVA浓度对固定化细胞降解DCM的影响由图 1a可知, PVA浓度对固定化细胞降解DCM的速率影响较大, 总体呈先上升后下降的趋势.当PVA浓度为8%时, 固定化小球对DCM的处理效果最好, 降解速率达到17.12 mg·L-1·h-1.PVA浓度过高会导致小球内部结构过于紧密, 不利于传质过程进行, 并且细胞容易凝结(Liu et al., 2018).PVA浓度过低时, 固定化细胞的成球性较弱且载体交联效果差, 菌体容易溢出影响底物去除率.研究表明(茆云汉等, 2013;龙华等, 2019;李菡等, 2019), 在固定化过程中, PVA浓度为8%~12.5%时, 小球的稳定性和机械强度较高, 不易黏连.故选择8%为PVA的最适投加浓度.
 |
| 图 1 PVA-SA-AC固定化条件优化(a.PVA浓度, b.SA浓度, c.CaCl2浓度, d.活性炭浓度, e.包菌量, f.钙化时间) Fig. 1 Optimization of the immobilization conditions of PVA-SA-AC |
如图 1b所示, SA浓度不同, DCM降解效果有所差异.SA最佳浓度为5%, 在该浓度下, DCM降解速率为17.08 mg·L-1·h-1.当SA浓度超过5%时, 固定化细胞的降解活性明显降低, 并且小球在制备过程中发生拖尾现象.相反, 过低的SA浓度也会导致小球的降解活性及机械强度下降, 在采用4%SA浓度的实验组中发现, 小球在48 h后破损, 培养液变浑浊, 菌体从凝胶中泄露.这与徐阳等(2019)的结论一致.
3.1.3 CaCl2浓度对固定化细胞降解DCM的影响如图 1c所示, CaCl2的最适浓度为2%, 在该浓度下, 固定化细胞对DCM的降解速率最快, 达到16.98 mg·L-1·h-1.当CaCl2的浓度小于2%时, 小球的机械强度降低, Ca2+浓度的缺失导致制得的小球结构松散, 极易溶解, 导致DCM的降解速率降低.但过量(>2%) CaCl2可能会使凝胶内部孔隙减小, 影响底物扩散, 从而影响底物降解(Xue et al., 2019;Wang et al., 2019).
3.1.4 活性炭浓度对固定化细胞降解DCM的影响如图 1d所示, 固定化细胞对DCM的降解速率随着活性炭浓度增加呈先上升后下降趋势, 当活性炭浓度为1%时, 降解速率最高可达到17.13 mg·L-1·h-1.吸附剂活性炭浓度较小时, 复合载体对DCM的吸附性能较弱;而当活性炭浓度高于一定值时, 会增大DCM的传质阻力(Olivo-Alanis et al., 2018).杜青平等(2017)综合活性炭对PVA-SA小球各个方面的影响, 认为PVA-SA小球中加入1%的活性炭时微污染物去除效率最高.本实验结论与之相似.
3.1.5 包菌量对固定化细胞降解DCM的影响包埋菌体量也是影响固定化细胞降解DCM的因素之一.图 1e为不同包埋菌体量下固定化细胞对DCM降解的情况.由图可知, 当包埋菌体量为0.6 g时, DCM的降解速率达到17.02 mg·L-1·h-1, 表明在该包菌量下, 固定化细胞具有良好的降解活性.而当包菌量增加到0.75 g后, DCM的降解速率变化不大.值得注意的是, 包菌量为0.75 g的固定化小球, 在长期运行8 h后发生破损现象.这是因为底物降解导致凝胶中包埋的菌体量提高, 生物量的过量积累影响了海藻酸钙凝胶的稳定性(刘少敏等, 2014).因此, 0.6 g为固定化小球的最佳包菌量.
3.1.6 钙化时间对固定化细胞降解DCM的影响如图 1f所示, 当钙化时间为8 h时, 固定化细胞对DCM的降解速率为17.22 mg·L-1·h-1, 说明该实验的最佳钙化时间在8 h左右.当钙化时间大于8 h时, DCM的降解速率随钙化时间增加不断降低, 这是因为Ca2+与海藻酸钠胶体中的Na+置换时间太长, 导致材料交联程度过高, 底物扩散阻力增加, 固定化细胞活性就会相对降低(姜立春等, 2018).而钙化时间为6 h的固定化小球在运行一段时间后, 凝胶开始溶解, 部分菌体渗出.因此, 本实验中最佳钙化时间为8 h.
本研究固定化细胞的最佳制备条件为:PVA浓度为8%, SA浓度为5%, CaCl2浓度为2%, 活性炭浓度为1%, 包菌量为0.6 g, 钙化时间为8 h.在该条件下进行实验, DCM的平均降解速率达到18.21 mg·L-1·h-1, 高于其他实验组别.因此, 采用该配比制备固定化小球进行后续相关实验.
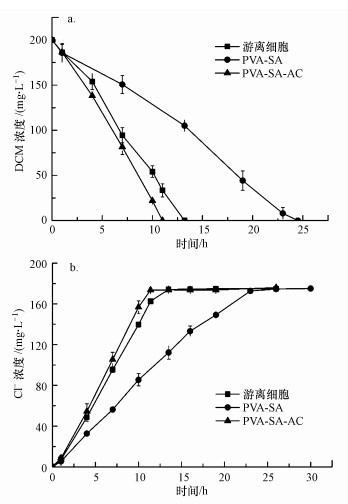
3.2 活性炭对固定化小球机械强度及DCM降解性能的影响 3.2.1 活性炭对固定化小球降解DCM的影响将浓度为1%的活性炭用于制备固定化小球, 形貌如图 2所示.同时, 测定游离细菌、PVA-SA小球及PVA-SA-AC小球对200 mg·L-1 DCM的生物降解情况, 具体如图 3所示.结果表明, PVA-SA小球对DCM的生物降解速率最低, 这可能是包埋剂产生的传质阻力及PVA对菌体降解活性的抑制作用所导致(黄修行等, 2017).而采用PVA-SA-AC为复合载体时, 固定化细胞对DCM具有最高的降解活性, 在11 h左右可以完全降解200 mg·L-1 DCM废气, 相较于游离细胞, DCM降解速率提高了18%.
 |
| 图 2 PVA-SA-AC复合固定化小球 Fig. 2 PVA-SA-AC immobilized beads |
 |
| 图 3 活性炭对固定化小球降解DCM的影响 Fig. 3 The influence of activated carbon on the DCM removal by immobilized beads |
为了进一步探究固定化细胞对DCM降解性能增强的原因, 在同一实验里对液相中Cl-浓度进行测定.根据图 3b可知, 随着DCM的降解, 各组液相中Cl-不断积累, PVA-SA-AC固定化细胞的Cl-生成速率最快, 在11.8 h可以达到175 mg·L-1, 而后保持稳定, 表示液相中的DCM已被微生物完全降解;游离细胞组中Cl-浓度需要13.2 h可达到稳定.值得注意的是, PVA-SA-AC固定化细胞的Cl-生成速率相对于游离细胞仅提高了12%, 而DCM的降解速率却提高了18%, 由此猜测, 加入活性炭后DCM降解性能的增强主要有两个原因:活性炭本身的吸附作用导致DCM的宏观降解速率提高;活性炭的吸附作用有助于DCM从液相到小球内部的传质, 在一定程度上增强了其降解速率.杜青平等(2017)提出, 在PVA-SA中添加1%的活性炭, 小球对氯苯的降解能力大大加强, 在144 h内对氯苯的去除率高达90%以上.这是因为加入活性炭粉末后, 增强了PVA-SA小球对DCM的吸附性能, 有利于材料将DCM吸附到小球表面从而进入复合载体内部, 加速了菌体对难溶性污染物DCM的降解.
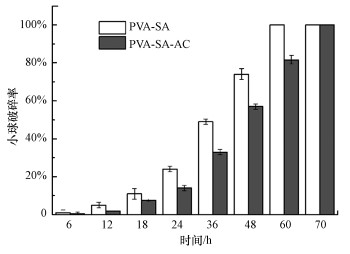
3.2.2 活性炭对固定化小球机械强度的影响固定化细胞技术在实际应用中容易受到水力冲击的影响(徐炎, 2016).对PVA-SA和PVA-SA-AC两种固定化小球的机械强度进行测定, 结果如图 4所示.由图可知, PVA-SA小球的机械强度一般, 振荡36 h后, 小球的破碎率为49%±1%;而在60 h后, 加入的小球几乎完全破碎.加入1%的活性炭后, 固定化小球的机械强度有所提高, 36 h时的破碎率仅为33%±1%, 而全部小球完全破碎所需时间提高到70 h.姜天翔等(2019)发现, 在固定化生物质小球中加入粉末活性炭, 小球的致密性及机械强度均有所提高.由此可见, 在一定浓度下, 活性炭能够增强固定化小球的机械强度, 使其结构更加稳定(Muangchinda et al., 2018).
 |
| 图 4 活性炭对固定化小球机械强度的影响 Fig. 4 The influence of activated carbon on the mechanical strength of immobilized beads |
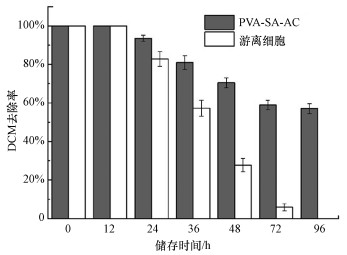
对固定化细胞与游离细胞储存稳定性的实验结果如图 5所示.由图可知, PVA-SA-AC固定化细胞在储存12 h后对DCM的生物降解性能较游离细胞有较大提高, 两者在储存12 h内均能完全降解200 mg·L-1 DCM;而在储存24 h后, 游离细胞的降解活性开始大幅度降低;当储存时间为36 h时, DCM去除率在20 h内仅为57%;而在储存96 h后, 细胞基本失去对DCM的降解活性, 并且有个别组出现霉菌滋生的情况.相比之下, PVA-SA-AC小球在96 h的储存时间下, 对DCM的去除率在20 h时仍然保持在56%以上.游离细胞由于对生长环境要求较高、易于染菌等问题, 无法在长期储存后使用;固定化复合载体为菌体提供了一个稳定的生长区域, 在长期储存后依然具备良好的降解性能.
 |
| 图 5 不同储存时间对固定化小球和游离细胞降解DCM的影响 Fig. 5 Effect of different preservation time on degradation of DCM by immobilized beads and free cells |
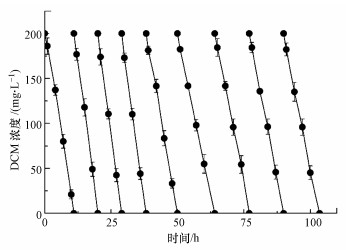
用PVA-SA-AC固定化小球对DCM进行连续降解试验, 结果如图 6所示.由图可知, PVA-SA-AC小球可以连续降解9批以上的DCM废气, 并且每批废气的降解速率均保持在13.25 mg·L-1·h-1以上.值得注意的是, 小球在第2~4批次中对DCM的降解速率明显提高, 最高可以达到23.2 mg·L-1·h-1, 相较于第1批时提高了约42%.这是由于随着底物被不断降解, 小球内部的菌体生物量提高, 从而提高了降解速率.但从第5批开始, 小球对DCM的降解速率开始呈下降趋势, 第7批时已经下降到14.3 mg·L-1·h-1, 低于首批的降解速率.Silva等(2019)将ATCC 750菌体固定在果渣上对苯酚连续降解, 发现第3批的降解时间相较于第1批减少了66.67%, 而从第4批开始, 苯酚的降解速率下降.这是因为DCM降解的同时, 珠内的生物质不断增多, 导致海藻酸钙凝胶和生物质之间结构更加紧密, 增加了传质阻力.尽管如此, 固定化细胞在连续运行处理9批DCM废气后, 降解速率仍然保持在13.4 mg·L-1·h-1以上, 并且在实验中未发现珠子破裂、细胞溶出等现象, 这表明固定化小球在处理DCM废气上具有较好的重复使用性.
 |
| 图 6 固定化小球对DCM的连续降解能力 Fig. 6 Continuous degradation performance of immobilized beads on DCM |
固定化细胞和游离细胞在不同pH下对DCM的降解速率如图 7a所示.随着pH不断升高, 两种状态下菌体对DCM的降解速率呈先上升后下降的趋势, 当pH为7.0时, 菌体对DCM具有最高的降解活性, 但在pH变化的过程中, 游离细胞的降解速率随pH变化波动较大, 特别是在pH小于6.5后DCM降解速率大幅降低, 当pH为5时仅为9.2 mg·L-1·h-1, 而在相同条件下固定化细胞对DCM降解速率仍保持在14.4 mg·L-1·h-1以上.这是因为细胞与载体的多位点结合使固定化细胞的内部结构更加稳定, 降低了外部溶液对固定化细胞分子结构的影响, 而且细胞缓冲液中具有的氨基和羟基减少了外部溶液对酶蛋白及活性基团的破坏(许可等, 2019).因此, PVA-SA-AC小球与游离菌株相比, 在短期内具有更宽的pH适应范围, 实际应用性更加广泛.
 |
| 图 7 不同初始pH(a)及温度(b)对固定化细胞和游离细胞降解DCM的影响 Fig. 7 Effect of initial pH(a) and temperature(b) on DCM removal by immobilized cells and free cells |
固定化细胞和游离细胞在不同温度下对DCM的降解速率如图 7b所示, 并观察到与上述实验相似的现象:固定化细胞和游离细胞在30 ℃时表现出最高的DCM降解活性, 降解速率分别达到16.8和15.5 mg·L-1·h-1.随着温度的改变, 游离细胞的降解活性受到较大的影响, 特别是在24和40 ℃时, 降解速率仅为11.3和12.5 mg·L-1·h-1, 而复合固定化细胞在该温度范围内的降解速率均能维持在15.1 mg·L-1·h-1以上.这是因为经固定化后, 复合载体交联形成的稳定区域在一定程度上增加了细胞的热稳定性(Chen et al., 2013).
3.6 复合固定化小球对DCM的液相吸附动力学采用PVA-SA及PVA-SA-AC无菌固定化小球在液相中吸附不同初始浓度的DCM, 吸附量随时间的变化见图 8.由图可知, PVA-SA小球在吸附实验开始的15 min内, DCM吸附量迅速提高, 达到了平衡吸附量的80%左右, 而后吸附速度逐渐减慢, 60 min后, 吸附基本达到平衡.对于PVA-SA-AC小球, DCM吸附量在12 min左右就能够达到平衡吸附量的80%, 并且吸附在40 min左右达到平衡.
 |
| 图 8 PVA-SA(a)和PVA-SA-AC(b)小球对不同浓度DCM的吸附动力学拟合 Fig. 8 Biosorption kinetics of DCM onto immobilized beads(a.PVA-SA, b.PVA-SA-AC) |
可见, 活性炭的吸附作用不仅增大了小球对DCM的吸附量, 而且减弱了复合载体对底物传质的影响, 使小球对DCM的吸附能在更短的时间内达到平衡.
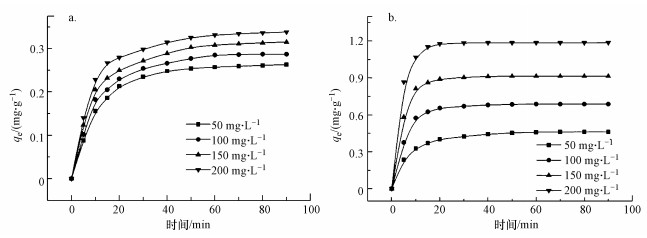
采用准二级动力学方程(式(2))来描述小球对DCM的吸附过程, 并用方程式(2)对数据进行非线性拟合, 得到各动力学参数(表 1).
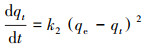
|
(2) |
| 表 1 准二级动力学参数 Table 1 Pseudo-second-order kinetic parameters for the biosorption |
式中, k2为二级吸附速率常数(g·mg -1·min -1), qe为平衡时吸附量(mg·g-1), qt为t时刻的吸附量(mg·g-1).
从表 1可以看出, 准二级动力学模型符合本次试验结果(R2>0.99), 并且随着DCM初始浓度增加, 平衡吸附量qe也逐渐增大, PVA-SA-AC复合载体中由于加入了活性炭, 从而增强了对DCM的吸附性能, 具有更高的qe值.另外, 在相同C0下, PVA-SA-AC较PVA-SA载体具有更高的k2值, 说明PVA-SA-AC载体对液相中DCM的吸附速率更快, 达到吸附平衡的时间更短.
3.7 复合固定化小球对DCM的液相吸附等温线研究通过Langmuir和Freundlich吸附等温方程来研究PVA-SA及PVA-SA-AC两种复合固定化小球对DCM的吸附性能差异.Langmuir及Freundlich吸附等温方程分别表示为式(3)及式(4)(Langmuir, 1918; Freundlich, 1926).
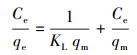
|
(3) |
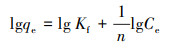
|
(4) |
式中, qm为小球最大吸附量(mg·g-1);qe为平衡吸附量(mg·g-1);Ce为DCM的平衡浓度(mg·L-1);KL为Langmuir吸附常数(L·mg-1), 与吸附剂、吸附质的性质有关;Kf为Freundlich吸附系数(L·g-1);n为Freundlich常数.
DCM在两种复合载体上的吸附等温线如图 9所示.从图中可以看出, 随着溶液中DCM平衡浓度的增大, 小球对DCM的吸附容量也逐渐增大.用Langmuir、Freundlich吸附等温式对实验数据进行拟合, 所得的平衡常数列于表 2.结果表明, Langmuir和Freundlich等温线模型都能较好地拟合PVA-SA和PVA-SA-AC小球对DCM的吸附, 而Langmuir等温线能够获得更好的拟合结果.PVA-SA-AC复合载体的qm达到1.432 mg·g-1, 而PVA-SA仅为0.354 mg·g-1, 说明在PVA-SA载体中加入1%的活性炭, 可以增强固定化小球对底物DCM的吸附作用, 也表明PVA-SA-AC是一种具有发展前景的吸附性复合载体.在Freundlich吸附等温式中, 两种复合载体的n值均大于1, 表明该DCM吸附行为在固定化小球中易于实现(Newcombe et al., 1997).
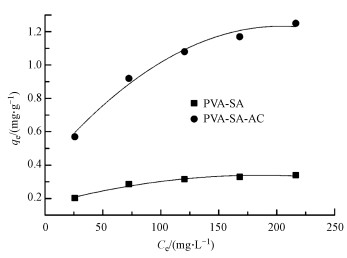 |
| 图 9 PVA-SA与PVA-SA-AC复合载体的吸附等温线 Fig. 9 Isotherm of DCM on PVA-SA and PVA-SA-AC |
| 表 2 吸附等温线相关参数 Table 2 Langmuir and Freundlich isotherm constants |
1) 本研究在PVA-SA载体的基础上加入吸附剂活性炭构成新型复合固定化载体, 并与高效降解菌Methylobacterium rhodesianum H13制备成固定化小球来降解DCM.同时, 优化了PVA-SA-AC的固定化体系, 确定了小球的最佳制备条件:PVA浓度为8%, SA浓度为5%, CaCl2浓度为2%, 活性炭浓度为1%, 包菌量为0.6 g, 钙化时间为8 h.在该体系下, 固定化细胞对DCM的最大降解速率达到18.21 mg·L-1·h-1.PVA-SA-AC固定化小球的机械强度及对DCM的降解性能相较于PVA-SA小球均有显著提高.
2) 针对不同环境条件下固定化细胞和游离细胞之间降解性能差异的研究结果表明, 固定化细胞在短期内具有更宽的pH适应范围及热稳定性.同时, 对其储存稳定性和重复利用性进行考察, 结果显示, 固定化小球在储存96 h后, 对DCM的去除率在20 h内仍然保持在56%以上;小球可重复利用9次以上, 同时DCM的降解速率保持在13.4 mg·L-1·h-1, 表明构建的复合固定化体系具有良好的实用性.
3) 针对复合固定化小球中添加活性炭对DCM吸附性能改变的研究结果表明, 在PVA-SA小球中加入1%的活性炭后, 复合载体对液相中DCM的吸附速率更快, 而且吸附能在更短的时间内达到平衡, 吸附动力学符合准二级反应动力学方程.DCM在固定化小球上的吸附遵循Langmuir吸附模式(R2>0.99).
Castañon D, Alvarez L H, Peña K, et al. 2019. Azo dye biotransformation mediated by AQS immobilized on activated carbon cloth in the presence of microbial inhibitors[J]. Environmental Pollution, 252: 1163-1169. DOI:10.1016/j.envpol.2019.06.050 |
Chen D Z, Fang J Y, Shao Q, et al. 2013. Biodegradation of tetrahydrofuran by Pseudomonas oleovorans DT4 immobilized in calcium alginate beads impregnated with activated carbon fiber:mass transfer effect and continuous treatment[J]. Bioresource Technology, 139: 87-93. DOI:10.1016/j.biortech.2013.04.037 |
陈雪松, 季文标, 陈水荣, 等. 2009. 固定化优势菌种处理有机废气的试验研究[J]. 能源环境保护, 23(4): 15-18. DOI:10.3969/j.issn.1006-8759.2009.04.005 |
Chiang C Y, Liu Y Y, Chen Y S, et al. 2012. Absorption of hydrophobic volatile organic compounds by a rotating packed bed[J]. Industrial & Engineering Chemistry Research, 51(27): 9441-9445. |
杜青平, 陈展明, 李彦旭, 等. 2017. 活性炭含量对PVA-SA固定化小球处理氯苯微污染废水的影响[J]. 广东工业大学学报, 34(4): 22-26. DOI:10.12052/gdutxb.160142 |
Freundlich H. 1926. Colloid and Capillary Chemistry[M]. London: Methuen.
|
黄开莲. 1996. 二氯甲烷对人危害研究进展[J]. 铁道劳动安全卫生与环保, 3: 56-58. |
黄修行, 李惠. 2017. 固定化生物活性炭处理氯苯废水的试验研究[J]. 化工技术与开发, 46(7): 49-53. DOI:10.3969/j.issn.1671-9905.2017.07.013 |
姜立春, 赵莉, 杨苹, 等. 2018. 海藻酸钠固定化菌株JY03及其降酚特性分析[J]. 绵阳师范学院学报, 37(8): 5-11. |
姜天翔, 张爱君, 王文华, 等. 2019. 海洋石油降解菌固定化小球的制备及其对含油海水的降解特性[J]. 化学工业与工程, 36(3): 35-41. |
Kureel M K, Geed S R, Giri B S, et al. 2017. Biodegradation and kinetic study of benzene in bioreactor packed with PUF and alginate beads and immobilized with Bacillus sp.M3[J]. Bioresource Technology, 242: 92-100. DOI:10.1016/j.biortech.2017.03.167 |
Langmuir I. 1918. The adsorption of gases on plane surface of glass, mica and platinum[J]. Journal of the Chemical Society, 40(9): 1361-1403. DOI:10.1021/ja02242a004 |
李菡, 毕江涛. 2019. PVA-SA固定化小球性能和生物脱氮特性研究[J]. 广州化工, 47(9): 64-67. |
李静, 左兰兰, 董浩浩, 等. 2016. 氯甲烷有机废气处理工艺研究[J]. 精细与专用化学品, 24(4): 38-40. DOI:10.3969/j.issn.1008-1100.2016.04.010 |
刘洪霞, 朱润晔, 欧阳杜娟, 等. 2013. 二氯甲烷降解菌Methylobacterium rhodesianum H13的分离鉴定及降解特性研究[J]. 环境科学, 34(9): 3613-3619. |
Liu J W, Pan D D, Wu X W, et al. 2018. Enhanced degradation of prometryn and other s-triazine herbicides in pure cultures and wastewater by polyvinyl alcohol-sodium alginate immobilized Leucobacter sp.JW-1[J]. Science of the Total Environment, 615: 78-86. DOI:10.1016/j.scitotenv.2017.09.208 |
刘少敏, 储磊, 朱敬林. 2014. 固定化硝化细菌去除生活污水中的氨氮[J]. 环境工程学报, 8(10): 4261-4266. |
刘永杰, 杨帆, 刘利军, 等. 2019. 生物法净化恶臭气体研究进展[J]. 山东化工, 48(1): 49-52. |
龙华, 龚劲松, 刘清华, 等. 2019. 壳聚糖-聚乙烯醇固定化细胞在生物转化合成烟酸中的应用[J]. 化工进展, 38(5): 2413-2420. |
茆云汉, 王建龙. 2013. 聚乙烯醇固定化微生物新方法的研究[J]. 环境科学学报, 33(2): 370-376. |
Muangchinda C, Chamcheun C, Sawatsing R, et al. 2018. Diesel oil removal by Serratia sp.W4-01 immobilized in chitosan-activated carbon beads[J]. Environmental science and pollution research international, 25(27): 26927-26938. DOI:10.1007/s11356-018-2742-3 |
Newcombe G, Drikas M, Hayes R, et al. 1997. Influence of characterized natural organic material on activated carbon adsorption:Ⅱ.Effect on pore volume distribution and adsorption of 2- methylisoborneol[J]. Water Research, 31(5): 1065-1073. DOI:10.1016/S0043-1354(96)00325-9 |
Olivo-Alanis D, Garcia-Reyes R B, Alvarez L H, et al. 2018. Mechanism of anaerobic bioreduction of azo dye assisted with lawsone-immobilized activated carbon[J]. Journal of Hazardous Materials, 347: 423-430. DOI:10.1016/j.jhazmat.2018.01.019 |
Silva N C G, Macedo A C, Pinheiro A D T, et al. 2019. Phenol biodegradation by Candida tropicalis ATCC 750 immobilized on cashew apple bagasse[J]. Journal of Environmental Chemical Engineering, 7(3): 103076. DOI:10.1016/j.jece.2019.103076 |
宋蕾, 邢丽. 2015. 活性炭-微生物对土壤中1, 2, 4-三氯苯的吸附降解[J]. 农业环境科学学报, 34(8): 1535-1541. |
Wang B, Xu X Y, Yao X W, et al. 2019. Degradation of phenanthrene and fluoranthene in a slurry bioreactor using free and Ca-alginate-immobilized Sphingomonas pseudosanguinis and Pseudomonas stutzeri bacteria[J]. Journal of Environmental Management, 249: 109388. DOI:10.1016/j.jenvman.2019.109388 |
王海荣, 杨光瑞. 2016. 物理化学[M]. 上海: 同济大学出版社.
|
席劲瑛, 武俊良, 胡洪营, 等. 2012. 工业VOCs气体处理技术应用状况调查分析[J]. 中国环境科学, 32(11): 1955-1960. DOI:10.3969/j.issn.1000-6923.2012.11.005 |
徐艳丹. 2019. 二氯甲烷中有关物质的检测方法及方法确认[J]. 化工设计通讯, 45(12): 116-117. |
许可, 曾丹林, 吴洁, 等. 2019. 磁性壳聚糖微球的制备及其固定化乳糖酶的研究[J]. 应用化工, 48(11): 2550-2554. DOI:10.3969/j.issn.1671-3206.2019.11.005 |
徐炎. 2016. 固定化细胞技术的优势与应用领域[J]. 科技展望, 26(27): 143. |
徐阳, 陈中, 刘秉杰. 2019. 海藻酸钙固定化鼠李糖乳杆菌LR-D的条件优化[J]. 食品科技, 44(11): 1-8. |
徐颖超, 刘畅, 常晓杰. 2016. 聚乙烯醇-海藻酸钠-活性炭固定化大肠杆菌在不同水体中的毒性检测[J]. 陕西师范大学学报(自然科学版), 44(3): 85-90. |
Xue J L, Wu Y N, Shi K, et al. 2019. Study on the degradation performance and kinetics of immobilized cells in straw-alginate beads in marine environment[J]. Bioresource Technology, 280: 88-94. |
 2021, Vol. 41
2021, Vol. 41


