2. 西安建筑科技大学, 西北水资源与环境生态教育部重点实验室, 西安 710055
2. Shaanxi Key Laboratory of Environmental Engineering, Xi'an University of Architecture and Technology, Xi'an 710055
近年来印染废水排放量逐年增加, 严重影响生态环境.其中罗丹明B是一种人工合成染料, 被广泛应用于印染行业(Martínez-Huitle et al., 2009).印染类废水的可生化性差, 普通的生物处理难以满足环境保护和可持续发展的要求.而高级氧化法因其具有很强的化学氧化能力, 能够实现污染物的高效降解, 在处理可生化性差的废水领域中受到越来越多的关注(李海涛等, 2011;陈禹彤等, 2017;夏文君等, 2018).
芬顿(Fenton)法是高级氧化法中最常见的一种, 利用Fe2+与过氧化氢(H2O2)产生活性羟基自由基, 从而达到降解污染物的目的.H2O2是传统Fenton法处理过程中的必不可少的反应物之一, 但H2O2因其易爆的特点, 在运输和储存过程中其安全性问题制约了传统Fenton法在实际废水处理过程中的应用.因此, 寻求一种原位在线产生H2O2的装置, 从而克服传统Fenton法的缺点, 是一种值得探究的思路(Moreira et al., 2017).在众多改良的Fenton法中, 电化学协助Fenton法是一种简单易行的方法之一, 其特点是通过在电极表面发生化学反应, 产生Fenton反应中所需的H2O2.而H2O2的产量直接制约了Fenton的应用效果, 因此, 开发一种高效稳定的活性电极在线生成H2O2是电芬顿研究中的持续关注热点.
蒽醌及其衍生物可以催化还原分子氧, 在酸性条件下进一步生成过氧化氢而备受关注(张国权等, 2007;Zhou et al., 2018), 但存在导电性差以及在反应过程催化剂难回收易流失等缺点, 限制了其在电芬顿中应用.作为典型的导电聚合物, 聚苯胺(PANI)具有良好的导电性和稳定性等特点(王宏智等, 2013).本实验以市售碳毡(CF)为基体, 利用电化学沉积法将阴离子蒽醌磺酸盐(AQS)掺杂于导电性聚合物PANI中, 成功得到修饰后的碳毡电极(AQS/PANI/CF), 并且实验结果证明其稳定性和电化学活性均得到显著的提升.实验进一步将该修饰电极作为阴极应用于电芬顿反应中, 以罗丹明B为模式染料污染物, 探究了该电芬顿反应过程中降解罗丹明B的影响因素, 同时通过淬灭实验和顺磁共振(EPR)检测手段, 阐明了该AQS/PANI/CF阴极在线产H2O2的机制, 为以蒽醌类分子氧还原催化剂在电芬顿中的实际应用提供理论依据.
2 材料与分析方法(Materials and methods) 2.1 仪器与试剂试剂:高纯碳毡购置于北京晶龙特碳石墨厂.蒽醌二磺酸钠(AQS, 梯系爱(上海)化成工业发展有限公司, 分析纯), 苯胺(上海科丰实业有限公司, 分析纯), 罗丹明B(RhB, 天津市科密欧化学试剂有限公司, 分析纯).其它化学试剂均为分析纯, 实验中所用溶液均为去离子水配制.仪器:电化学工作站(CHI660E, 上海辰华仪器有限公司), 紫外可见分光光度计(UV1780, 岛津有限公司, 日本), 电子顺磁共振(EPR)光谱仪(ZMXMicro-6/1, 布鲁克, 德国).
2.2 实验装置本次实验均在容量为100 mL的电解池中进行, 电解液为50 mmol·L-1硫酸钠, 并加入不同浓度的硫酸来确定电解液的pH值.降解实验中罗丹明B的初始浓度为20 μmol·L-1.本次实验以铂电极为对电极, Ag/AgCl为参比电极, 修饰前后的碳毡电极为工作电极.用电化学工作站连接该三电极体系, 设置相应的电位开始实验(本实验中的电位均相对于Ag/AgCl参比电极).实验过程中向电解池中持续通入空气以保证电解液空气饱和(无氧条件下为持续通入氮气).
2.3 碳毡电极基体预处理及AQS/PANI/CF阴极制备将碳毡分切为小块(2 cm×2 cm), 分别浸没于丙酮1 h和1 mol·L-1硫酸1 h, 然后用去离子水煮沸1 h, 每次更换溶液前再超声5 min, 最后用蒸馏水冲洗数次, 在烘箱中60 ℃烘干2 h.掺杂AQS的聚苯胺阴极(AQS/PANI/CF)在三电极体系中采用循环伏安电沉积法制备, 以预处理的碳毡为工作电极, 铂片电极为对电极, Ag/AgCl电极为参比电极.添加苯胺前向溶液中充氮气20 min, 以保证反应体系无氧状态, 分别进行下述实验步骤:
① 电解质溶液为50 mmol· L-1AQS和0.1 mol· L-1 H2SO4, 保持电解液氮气饱和状态, 在-0.2~+0.75 V的电位范围循环20个周期, 扫速为10 mV·s-1, 得到AQS/CF电极.
② 电解质溶液为0.1 mol· L-1苯胺和0.1 mol· L-1 H2SO4, 在-0.2~+0.9 V的电位范围内循环进行第1个周期和第2个周期, 扫速为2 mV· s-1.在-0.2~ +0.7 V的电位范围内再循环18个周期, 扫速为10 mV·s-1, 得到PANI/CF电极.实验过程一直保持电解液氮气饱和状态.
③ 将上述制备的PANI/CF电极在-0.2 V的恒电位的条件下脱掺杂处理40 min, 然后在室温条件下在0.1 mol· L-1 NH4OH溶液和冰冷蒸馏水中分别浸泡2 h, 除去掺杂或物理吸附的硫酸根阴离子.
④ 将脱掺杂后的PANI/CF电极, 在-0.2~+0.75 V的电位范围内循环20个周期, 得到AQS/PANI/CF电极, 扫速为10 mV· s-1.电解质溶液为0.1 mol· L-1 H2SO4和5 mmol· L-1 AQS, 实验过程中保证电解液为氮气饱和状态.修饰后的电极用蒸馏水冲洗干净, 烘干备用.
2.4 分析与表征采用循环伏安法(CV)、线性扫描伏安法(LSV)和电化学交流阻抗图谱(EIS)来表征所制备电极的电化学性能, 均在三电极体系中进行.CV测试的电位扫描范围为-0.8~0.8 V, 扫描速率为10 mV· s-1, LSV测试电位的范围为-0.8~0.2 V, 扫描速率为10 mV· s-1, EIS测试频率范围100 kHz~10 mHz, 交流振幅:10 mV.电解质为空气饱和的50 mmol·L-1 Na2SO4和5 mmol·L-1H2SO4溶液.
过氧化氢含量测定采用钛-硫酸钛法.紫外可见光分光光度计测定554 nm处罗丹明B的吸光度, 根据其浓度与吸光度的关系, 得出其在反应体系中的含量.在使用电子顺磁共振(EPR)仪来确认所产生的自由基的类别时, 所采用的测量参数如下, 磁场强度:3507 mT;功率:2 mW;调制频率:100 kHz;调制幅度:1.0 g;扫描时间:5.24 min.
3 结果与讨论(Results and discussion) 3.1 制备电极的电化学表征由CV曲线测试结果表明, AQS/PANI/CF电极的电容得到显著增加(图 1a), 约是未修饰碳毡电极的80倍, LSV测试结果表明, AQS/PANI/CF电极的电流响应值显著高于其它电极(图 1b), 这主要是聚苯胺可以提高碳毡电极的导电性, 同时掺杂在其中的AQS可以进一步催化氧分子的还原, 因此, PANI/CF电极的电化学性能较裸碳毡电极有较大的提升.即通过电化学沉积法将阴离子蒽醌磺酸盐(AQS)掺杂于导电性聚合物PANI来修饰碳毡电极, 在避免催化剂AQS流失同时也降低了碳毡电极的电阻.
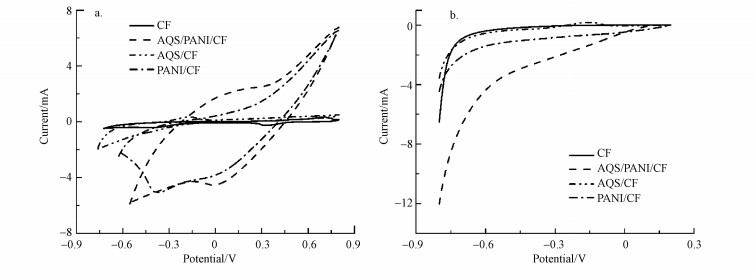 |
| 图 1 不同电极的CV曲线(a)和LSV曲线(b) Fig. 1 CV curves for different electrodes (a) and LSV curves(b) for different electrodes |
基于图 2所示的等效电路模型, 采用ZSim软件对EIS测量结果进行拟合.图 2a中高频区的半弧曲线直径大小表示了电极的电子传递内阻(Rct), 直接反映了电极的电化学活性及电极表面电子传递的难易程度(Manohar et al., 2008).由图 2b可知, 未修饰裸碳毡电极的Rct高达35310.23 Ω, 经PANI和AQS修饰后的碳毡电极的Rct分别为63.47 Ω和255.73 Ω, 而经电沉积将AQS掺杂于PANI复合修饰后的电极(AQS/PANI/CF)的Rct进一步降低至42.39 Ω.AQS/PANI/CF电极Rct的显著降低, 表明其电化学性能得到显著提升, 这在CV和LSV测试中也得到进一步的证明(图 1).由电沉积形成的附着在碳毡表面的PANI膜, 不仅固定了掺杂于其中的AQS, 同时也克服了AQS作为分子氧催化剂在电Fenton应用中的导电性差的缺点.因此为AQS/PANI/CF阴极应用于电Fenton反应中的催化活性和稳定性提供了保证.
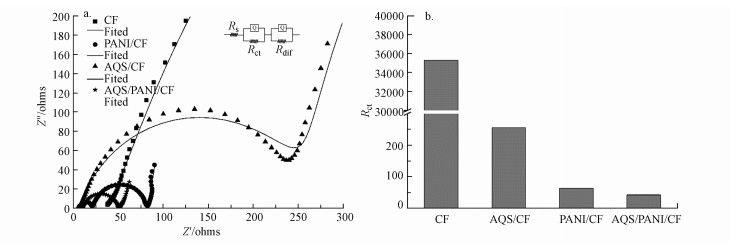 |
| 图 2 不同电极的EIS阻抗谱(a)和Rct值(b) Fig. 2 EIS tests of different electrodes (a) and Rct values (b) |
在Fenton系统中, H2O2是生成羟基自由基的前驱体, 直接影响Fenton反应的效能.外加电压对于阴极产生过氧化氢有着直接的影响.当AQS/PANI/CF阴极外加电位为-0.5 V时, 生成的H2O2含量达到最大值(图 3a), 因此本芬顿体系中的最佳外加电位为-0.5 V.当外加电位继续增加至-0.7 V时, 生成的H2O2含量出现减小趋势, 这主要是在高电位的条件下, 发生了一系列的副反应, 如H2O2分解, 电解水和析氢反应等产生, 从而影响H2O2的产量(Xia et al., 2015; Babaei-Sati et al., 2017).当AQS/PANI/CF阴极电位为-0.5 V时, H2O2产量在1小时内可达83.30 μmol·L-1, 约是未修饰碳毡阴极的4倍(图 3b), 这主要是修饰后阴极的Rct减小(图 2b), 在电催化活性得到增强的AQS/PANI/CF阴极表面所发生的蒽醌催化还原O2生成H2O2的反应速率得以提升.
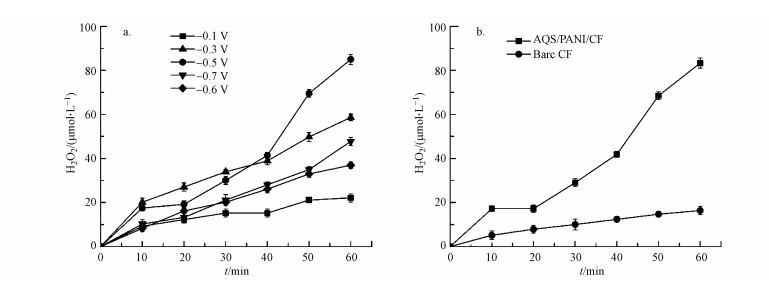 |
| 图 3 AQS/PANI/CF阴极在不同外加电位条件下产H2O2的含量(a)及AQS/PANI/CF电极和未修饰碳毡(CF)在施加-0.5 V条件下产H2O2的含量(b) Fig. 3 The concentration of the electro-generated H2O2 with the AQS/PANI/CF cathode poised at different voltages (a) and the concentration of the electro-generated H2O2 with cathodes of AQS/PANI/CF and bare carbon felt cathode poised at -0.5 V(b) |
在电芬顿体系中, pH对于电芬顿降解污染物的效率有着重要的影响.不同pH条件下实验结果表明, 当pH=2时, 罗丹明B在1 h内的去除率可达96.46%, 反应速率常数为0.070 min-1, 显著高于其它pH条件下的相应值, 因此本实验芬顿体系的最适pH值为2.在合适的酸性pH值条件下, H+与因蒽醌催化还原分子氧生成的·O2-(反应(1))结合, 从而促进H2O2的产生(反应(2)), 提升了Fenton效能(Zhang et al., 2017).当pH继续降低时, 较高浓度的H+可与阴极产生的H2O2反应生成H2O, 从而导致体系中生成的Fenton反应所必须的H2O2含量的减少(反应(3)).另一方面, 高浓度H+可促进反应(3)和(4)向正向进行, 使得Fenton反应中产生的·OH与前驱体·O2-相互淬灭作用得以增强, 从而使得体系中具有氧化性能的自由基的数量减少(Misra, 1974), 相应的减弱了Fenton效能.当体系中pH值升高时, Fe2+因易发生水解沉淀, 造成Fenton反应中亚铁离子的缺失, 导致Fenton降解效能的降低.
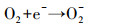
|
(1) |
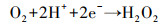
|
(2) |
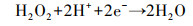
|
(3) |
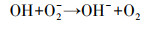
|
(4) |
电芬顿过程对有机污染物的降解能力不仅受阴极表面产生的H2O2的含量制约, 而且也受溶液中Fe2+浓度的控制.Fe2+与体系中即时产生的H2O2反应产生羟基自由基, 从而实现污染物的降解.如图 5a所示, Fe2+浓度为0.1 mmol·L-1时, 电芬顿的效能最佳, 罗丹明B的降解率达到96.46%.显著高于未添加Fe2+的体系中罗丹明B的降解率.当Fe2+浓度继续增加至0.4 mmol·L-1时, 罗丹明B的降解率则随之降低, 反应速率常数减小至0.029 min-1.这主要是过量的Fe2+与体系中的羟基自由基反应, 导致体系中活性自由基减少, 进而使得Fenton反应的效能受到抑制(Ai et al. 2019).因此本实验芬顿体系中亚铁离子的最佳浓度为0.1 mmol·L-1.
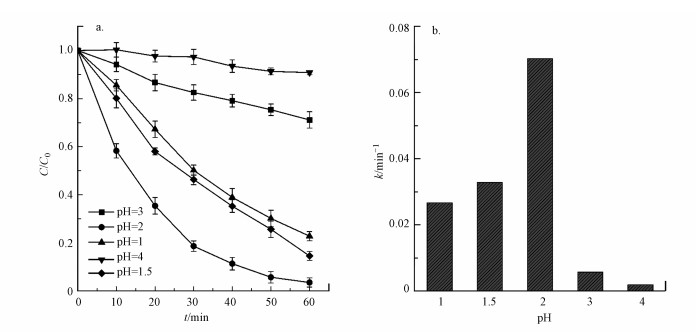 |
| 图 4 pH值对罗丹明B降解率(a)及其反应速率常数(b)的影响 Fig. 4 Effect of pH values on degradation efficiency of RhB (a) and reaction rate constants(b) |
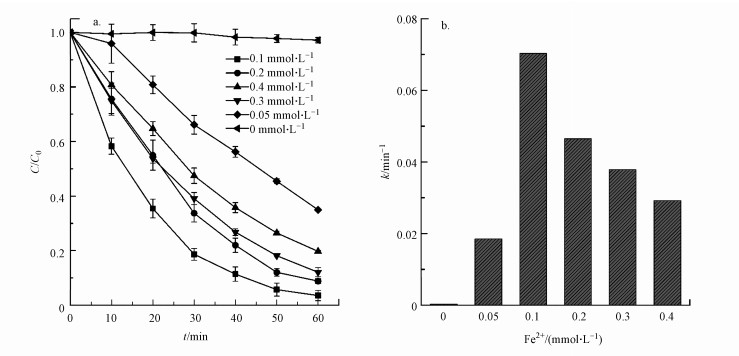 |
| 图 5 Fe2+含量对罗丹明B降解率(a)及其反应速率常数(b)的影响 Fig. 5 Effect of Fe2+ concentrations on degradation efficiency of RhB (a) and reaction rate constants(b) |
阴极材料对于电芬顿体系的氧化降解效能有着至关重要的作用.图 6a为不同电极应用于电芬顿体系中对于罗丹明B的降解率的影响.结果显示, 当未修饰的碳毡(CF)作为阴极, 罗丹明B的降解率仅为24.57%左右.经PANI修饰后的碳毡(PANI/CF)作为阴极, 罗丹明B的降解率提升至72.97%, 这主要是PANI具有较高的导电性, 从而使得PANI/CF阴极的电子转移电阻Rct得到降低, 电化学活性也相应得到增强.虽然AQS作为还原分子氧的催化剂, 但由于其本身的较低导电性, 使得AQS/CF阴极的电化学活性受到抑制, 其电芬顿体系中罗丹明B的降解率低于PANI/CF阴极体系.当AQS/PANI/CF作为阴极, 体系中罗丹明的降解反应速率常数0.070 min-1.这主要是经蒽醌(AQS)和聚苯胺(PANI)修饰后的碳毡阴极, 不仅Rct得到降低, 其表面所发生的蒽醌催化还原O2生成H2O2的反应速率得以提升, 为Fenton反应提供了充足H2O2, 从而使得AQS/PANI/CF作为阴极的电Fenton体系效能得到显著增加.
 |
| 图 6 不同阴极的电-Fenton体系中罗丹明B的降解率(a)及其反应速率常数(b) Fig. 6 The degradation efficiency of RhB (a) and reaction rate constants(b) in electro-Fenton systems containing different cathodes |
如图 7a所示, 在体系中氮气饱和的情况下, 罗丹明B几乎不发生降解.而在相同实验条件下, 反应体系维持溶解氧饱和条件下(持续通入空气), 罗丹明B的降解率显著增加至96.46%.如前所述, AQS/PANI/CF阴极电具有很强的催化还原氧分子的能力, 但在N2饱和溶液中, 由于缺乏分子氧, 体系中产生H2O2的过程被抑制(反应(1)和(2)), 而过氧化氢含量对电芬顿的性能起着直接的制约作用.
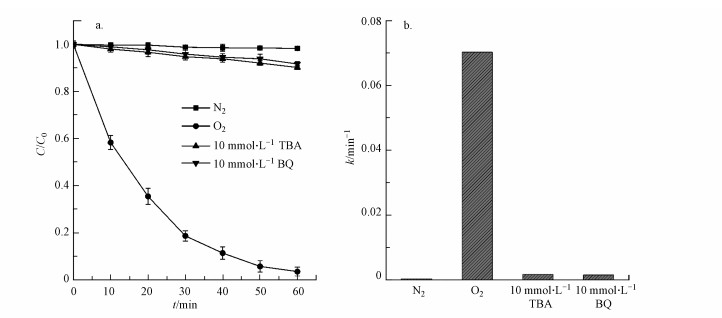 |
| 图 7 不同淬灭剂及N2/O2存在条件下电Fenton反应效能影响(a)及其反应速率常数(b) Fig. 7 Effects of different quencher and the presence of N2/O2 on degradation efficiency (a) and reaction rate constants(b) |
当体系中分别加入10 mmol·L-1的·O2-淬灭剂对苯醌(BQ)和·OH的淬灭剂异丙醇(TBA)后, 以AQS/PANI/CF为阴极的电芬顿反应体系中罗丹明B的降解率均显著下降, 反应速率常数分别由不含淬灭试剂体系的0.070 min-1降至0.002 min-1和0.001 min-1(图 7b).以上结果表明, AQS/PANI/CF作为阴极的电芬顿反应体系中, ·O2-和·OH两种自由基对电芬顿反应的降解效能起着重要作用.
3.7 EPR实验为阐明AQS/PANI/CF作为阴极的电Fenton反应体系的机制, 在淬灭实验的基础上, 开展了电子顺磁共振(EPR)实验, 以5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO)为自由基捕获剂.结果表明电Fenton反应体系的EPR谱显示了DMPO-HO·加合物的典型的4线特征峰(图 8b), 其强度比为1:2:2:1, 证明了体系中·OH的存在, 且其强度远高于未修饰CF阴极体系(图 8a)以及在N2饱和条件下的AQS/PANI/CF阴极体系中谱峰的强度(图 8f).DMPO相对于·O2-更容易与·OH结合, 即捕获·OH的速度更快, 并且·O2-在水溶液中不稳定极易进一步反应生成·OH, 并且DMPO/·O2-不稳定也极易转变成DMPO/·OH(Ordonez et al., 1992;Ai et al., 2019), 所以当加入·OH淬灭剂(TBA)后, DMPO-HO·谱峰强度虽得到明显降低, 但仍能检测出DMPO-HO·谱峰强度(图 8c), 而加入·O2-淬灭剂(BQ)的反应体系中, DMPO-HO·谱峰强度则不再被检出(图 8d).当同时加入TBA和BQ后, 反应体系的EPR谱峰特征与只加入BQ类似(图 8e), 即体系中几乎无·OH的存在, 显著区别于只加TBA的反应体系.以上结果表明, ·O2-的存在与否直接调控了以AQS/PANI/CF作为阴极的电芬顿反应体系中·OH的产生, 即·O2-是生成·OH的重要前驱体.综上所述, 本实验体系中主要是AQS/PANI/CF电极材料表面蒽醌分子催化分子氧还原成超氧自由基, 而超氧自由基在酸性条件下生成过氧化氢和羟基自由基, 因此超氧自由基在电Fenton体系中起重要作用.
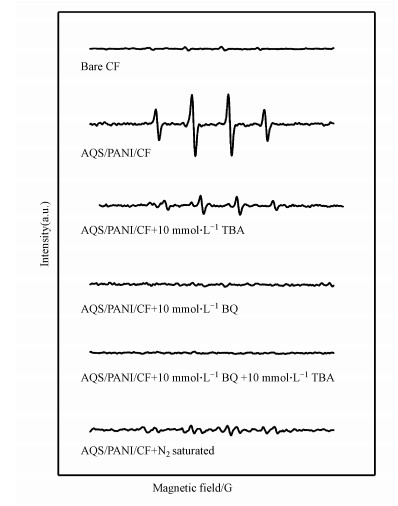 |
| 图 8 不同电-Fenton反应体系中的EPR检测结果 Fig. 8 EPR characterization for radials in different electro-Fenton systems |
电极材料的稳定性对于其在在环境工程中的应用前景具有重要意义.本次实验进行6次重复性实验来验证AQS/PANI/CF电极材料的稳定性, 实验条件为前面探索的最佳实验条件, 即以AQS/PANI/CF为阴极, 外加电位为-0.5 V, 亚铁离子浓度为0.1 mmol·L-1, 体系pH值为2, 体系为空气所饱和.由图 9所示, 在连续6次的重复实验中, 罗丹明B 60 min内的降解率基本没有差异, 最后一次实验罗丹明B的降解率依然能达到98.16%, 较第一次实验无明显差异, 说明该电极材料在较高使用频率的条件下, 电极材料的表面依然可以保持稳定, 故AQS/PANI/CF电极材料的重复性能较好.
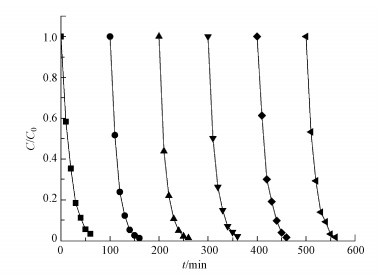 |
| 图 9 AQS/PANI/CF电极降解罗丹明B的重复性实验 Fig. 9 Repeatability experiments of AQS/PANI/CF electrode to degrade rhodamine B |
基于上述各实验结论, 以AQS/PANI/CF和CF分别作为阴极的电芬顿反应体系中降解罗丹明的机理如图 10所示.首先, 以未修饰的裸碳毡为阴极的反应体系中, O2被CF阴极还原为·O2-.同时, 溶液中的超氧自由基继续接受来自阴极的电子形成过氧化氢或转化为羟基自由基(反应路径b).然而, 这一单纯的阴极还原过程的反应速率极其缓慢(王珊琳等, 2019).然而对于AQS/PANI/CF改性炭毡, 蒽醌类物质先被阴极还原为半醌基团(SQ*), 半醌基团又可以催化氧还原为超氧自由基(Zhang et al., 2017;Tatsumi et al., 1998;Moreira et al., 2019) (反应路径a).由于蒽醌催化剂的存在, 反应路径a比路径b更加迅速, 由修饰后电极过氧化氢产量远大于裸碳毡也可以说明(图 3b).在此过程中产生过氧化氢与溶液中的亚铁离子发生Fenton反应产生活性羟基自由基(图 8b), 从而有效降解污染物.
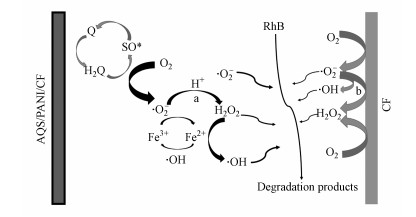 |
| 图 10 修饰前后碳毡电极降解罗丹明B的反应机理图 Fig. 10 The proposed mechanism of electro-Fenton with AQS/PANI/CF cathode and CF cathode |
1) 将AQS/PANI电沉积到碳毡电极上, 增强了电极的电催化活性.这不仅减小了电极的电子转移内阻, 并且修饰后电极表面的蒽醌分子可以催化加速溶解氧还原反应的进行, 因此在相同的实验条件下修饰后电极的电生成过氧化氢的量有了大幅度的增长, 罗丹明B的降解率也大幅度提升.
2) 在最佳实验条件下即:体系pH值为2、亚铁离子含量为0.1 mmol·L-1、外加电位为-0.5 V、电解液空气饱和, 以AQS/PANI/CF电极为阴极的电芬顿体系罗丹明B的降解率最高可达96.46%, 显著高于裸碳毡为阴极的体系中罗丹明B的降解率.并且在6次连续降解实验中, 罗丹明B的降解率无较大变化, 说明AQS/PANI/CF电极稳定性较好.
3) 淬灭实验和EPR实验结果证明本实验体系中AQS/PANI/CF电极表面的蒽醌分子可以催化溶解氧还原产生超氧自由基, 超氧自由基进一步转化为过氧化氢并与亚铁离子发生芬顿反应产生羟基自由基, 从而实现污染物的高效降解.
Ai J, Zhang W, Liao G, et al. 2019. A novel waste activated sludge multistage utilization strategy for preparing carbon-based Fenton-like catalysts:Catalytic performance assessment and micro-interfacial mechanisms[J]. Water Research, 150: 473-487. |
Babaei-Sati R, Basiri Parsa J. 2017. Electrogeneration of H2O2 using graphite cathode modified with electrochemically synthesized polypyrrole/MWCNT nanocomposite for electro-Fenton process[J]. Journal of Industrial and Engineering Chemistry, 52: 270-276. DOI:10.1016/j.jiec.2017.03.056 |
陈禹彤, 张秀芳, 田世超, 等. 2017. 阴极原位产H2O2强化光电催化降解水中EDTA的研究[J]. 环境科学学报, 37(3): 971-976. |
李海涛, 李玉平, 张安洋, 等. 2011. 新型非均相电-Fenton技术深度处理焦化废水[J]. 环境科学, 32(1): 171-178. |
Manohar A K, Bretschger O, Nealson K H, et al. 2008. The use of electrochemical impedance spectroscopy (EIS) in the evaluation of the electrochemical properties of a microbial fuel cell[J]. Bioelectrochemistry (Amsterdam, Netherlands), 72(2): 149-154. DOI:10.1016/j.bioelechem.2008.01.004 |
Martínez-Huitle C A, Brillas E. 2009. Decontamination of wastewaters containing synthetic organic dyes by electrochemical methods:A general review[J]. Applied Catalysis B:Environmental, 87(3): 105-145. |
Misra H P. 1974. Generation of superoxide free radical during the autoxidation of thiols[J]. The Journal of Biological Chemistry, 249(7): 2151-2155. |
Moreira F C, Boaventura R A R, Brillas E, et al. 2017. Electrochemical advanced oxidation processes:A review on their application to synthetic and real wastewaters[J]. Applied Catalysis B:Environmental, 202: 217-261. DOI:10.1016/j.apcatb.2016.08.037 |
Moreira J, Lima V B, Goulart L A, et al. 2019. Electrosynthesis of hydrogen peroxide using modified gas diffusion electrodes (MGDE) for environmental applications:Quinones and azo compounds employed as redox modifiers[J]. Applied Catalysis B-Environmental, 248: 95-107. DOI:10.1016/j.apcatb.2019.01.071 |
Ordonez I, Cadenas E. 1992. Thiol oxidation coupled to DT-diaphorase-catalysed reduction of diaziquone[J]. Reductive and Oxidative Pathways of Diaziquone Semiquinone Modulated by Glutathione and Superoxide Dismutase, 286(Pt 2): 481-490. |
Tatsumi H, Nakase H, Kano K, et al. 1998. Mechanistic study of the autoxidation of reduced flavin and quinone compounds[J]. Journal of Electroanalytical Chemistry, 443(2): 236-242. |
王珊琳, 朱维晃, 郑飞, 等. 2019. AQS/PPy修饰石墨板阴极应用于罗丹明B的降解[J]. 环境化学, 38(9): 2093-2100. |
王宏智, 高翠侠, 张鹏, 等. 2013. 石墨烯/聚苯胺复合材料的制备及其电化学性能[J]. 物理化学学报, 29(1): 117-122. |
Xia G, Lu Y, Xu H. 2015. Electrogeneration of hydrogen peroxide for electro-Fenton via oxygen reduction using polyacrylonitrile-based carbon fiber brush cathode[J]. Electrochimica Acta, 158: 390-396. DOI:10.1016/j.electacta.2015.01.102 |
夏文君, 刘锋, 郝尚斌, 等. 2018. 石墨烯负载铁锰氧化物活化过一硫酸盐降解金橙g[J]. 环境科学, 39(5): 2202-2210. |
Zhou Y, Lu H, Wang J, et al. 2018. Catalytic performance of quinone and graphene-modified polyurethane foam on the decolorization of azo dye Acid Red 18 by Shewanella sp. RQs-106[J]. Journal of Hazardous Materials, 356: 82-90. |
张国权, 杨凤林. 2007. 蒽醌/聚吡咯复合膜修饰电极的电化学行为和电催化活性[J]. 催化学报, (6): 504-508. |
Zhang Y, Li J, Bai J, et al. 2017. Dramatic enhancement of organics degradation and electricity generation via strengthening superoxide radical by using a novel 3D AQS/PPy-GF cathode[J]. Water Research, 125: 259-269. DOI:10.1016/j.watres.2017.08.054 |
 2020, Vol. 40
2020, Vol. 40


