印染废水是指棉、毛、化纤等纺织产品在预处理、染色、印花和整理过中所排放的废水.该类废水成分复杂、色度高、浓度大、难降解且大多具有高生物毒性和“三致”性能(致癌、致畸、致突变), 现已成为我国各大水域的重要污染源(Xiao et al., 2017;胡潇等, 2018;闫国伦, 2018).目前, 处理印染废水的主要方法包括物理法(如吸附法、膜分离法、萃取法等)(王婷, 2018;胡茂华, 2019;张新旺, 2019)、化学法(如化学氧化法、化学混凝法、电化学法、光催化氧化法等)(Eseoghene et al., 2017;刘国等, 2017;徐凤云, 2017)、生物法(如水解酸化法、高效菌处理法、酶技术等)(刘岩, 2016;于存, 2017), 以及它们的联合处理方法.与其他方法相比, 电化学法在降解染料废水时因具有成本低、能效高、降解污染物彻底及用途多样性等特点而备受广大学者关注(瓮青松等, 2016;吕进锋, 2016;宋萌等, 2018;张俊等, 2018).但近年来, 有关电化学降解有机物的研究主要集中于阳极过程方面, 对阴极材料的研究较少, 因为电化学阴极材料在降解过程中存在H2O2产量少, 以及析氢副反应抑制了阴极的还原反应导致电流效率低等缺点, 所以开发高效的电化学阴极材料, 提高溶解氧还原为H2O2的产率具有重大意义.
目前, 已有学者将制备的阴极复合材料应用于电化学体系中来降解有机污染物, 并且取得了比较显著的效果.例如, Yue等(2014)将醌类试剂涂刷在裸铂片电极上制成醌改性阴极电极, 研究其在酸性橙Ⅱ废水中的电化学降解效果及行为途径, 发现在最优降解条件下降解时间达到120 min后酸性橙Ⅱ废水的脱色率可达96.0%;除此之外, 研究表明, 两极的电位差可导致阴极表面产生醌自由基催化O2还原为H2O2, 从而提高染料的脱色率.陶虎春等(2017)以褐铁矿粉为铁源, 用聚乙烯亚胺/多壁碳纳米管(PEI/MWCNT)修饰石墨毡为外层, 制备了含铁电芬顿阴极并将其应用于降解橙Ⅱ染料废水的研究中, 结果表明, 当橙Ⅱ染料初始浓度为20 mg·L-1, 初始pH为6~7时, 其降解60 min后脱色率达到96.8%;这是因为PEI/MWCNT层改善了溶液与阴极间的氧气传质速率从而提高了H2O2的产率.综上所述, 制备具有还原氧催化特性的阴极材料或者制备能提高与溶解氧接触面积的阴极材料, 是目前提高阴极H2O2产率的关键技术.
膨胀石墨(EG)作为一种具有优异电导率、大比表面积、低廉价格、无毒且析氢活性不高等优点的新型碳材料(He et al., 2020), 在电化学领域被广泛应用(奚瑞等, 2015;Zhao et al., 2018;Wu et al., 2018;An et al., 2018).纳米级二氧化锰(MnO2)因其表面具有独特的电催化活性及良好的还原氧的特性, 现已被作为O2还原催化剂加以研究(Lee et al., 2015;Aveiro et al., 2018).基于此, 本文采用电沉积法制备二氧化锰/膨胀石墨复合基(MnO2/EGM)电极材料, 并在多因素参数条件下探究MnO2/EGM电极对罗丹明B(RHB)的脱色效果.
2 实验部分(Materials and methods) 2.1 实验材料与仪器试剂:天然鳞片石墨(80目, 纯度99%)购于山东青岛天和达石墨有限公司;高氯酸(HClO4, 质量分数70%~72%, AR)、乙炔黑和聚四氟乙烯乳液(PTFE, 质量分数60%)购于天津市东方化工厂;高锰酸钾(KMnO4, AR)购于天津化学试剂厂;硝酸铵(NH4NO3, AR)、无水乙醇(C2H6O, AR)、罗丹明B(C28H31ClN2O3, AR)购于天津市凯通化学试剂有限公司;四水乙酸锰(C4H6O4Mn·4H2O, AR)和草酸钛钾(C6K2O12Ti, AR)购于上海阿拉丁试剂有限公司;无水硫酸钠(Na2SO4·5H2O, AR)购于天津市科密欧化学试剂有限公司;实验用水均为去离子水.
仪器:AR1140型电子分析天平(梅特勒-托利多仪器有限公司)、DF-101S型集热式恒温加热磁力搅拌器(上海邦西仪器科技有限公司)、PHS-3C型智能酸度计(江苏江分电分析仪器有限公司)、DH-101型电热恒温鼓风干燥箱(天津市中环有限公司)、SX2-4-10型马弗炉(上海右一仪器有限公司)、FW-4A型粉末压片机(天津市拓普仪器有限公司)、SP-725型紫外可见分光光度计(上海光谱仪器有限公司)、d-max-2500/PC型X射线衍射仪(日本理学株式会社)、S4800型电子显微镜(日本HITACHI)、722SP15040可见分光光度计(上海棱光技术有限公司)、HJ-5型多功能搅拌器(江苏金坛市环宇科学仪器厂)、HHS-24型电热恒温水浴锅(上海东星建材试验设备有限公司)、WYK-6010型直流稳压电源(青岛东方嘉仪电子科技有限公司).
2.2 材料制备 2.2.1 膨胀石墨的制备本实验采用化学氧化法制备无硫膨胀石墨.首先, 将5 g的80目天然鳞片石墨、2.25 g KMnO4和0.6 g NH4NO3添加到洁净的烧杯中并使其充分混合, 然后将40 mL的HClO4缓慢倒入上述混合物中.之后, 将装有混合物的烧杯用保鲜膜密封, 然后在温度为30 ℃的恒温水浴中放置1 h, 在此期间持续搅拌混合物.待氧化插层反应结束后, 将产物用蒸馏水洗涤并进行抽滤, 然后在65 ℃下干燥12 h以获得可膨胀石墨(GIC)样品.最后, 将GIC样品放入石英烧杯中, 并将其放在950 ℃的马弗炉中膨化3~5 s, 等不再膨化后取出石英烧杯冷却至室温, 然后获得膨胀石墨样品.
2.2.2 膨胀石墨复合基的制备首先, 将150 mL无水乙醇缓慢倒入装有1 g自制膨胀石墨和0.1 g乙炔黑的洁净烧杯中, 再将烧杯放在磁力搅拌器上, 在室温下搅拌30 min.然后将5 mL PTFE溶液逐滴加入到混合物中, 并搅拌1 h以便混合物完全混合.之后, 将混合物置于预先加热至90 ℃的恒温水浴中使其中的无水乙醇挥发掉, 再将膨胀石墨混合物在65 ℃下干燥24 h.最后, 将干燥的膨胀石墨混合物粉末取出并置于粉末压片机的模具中进行压片.模具直径为50 mm, 压制压力和时间分别设置为8 t和15 min.压制完成后, 从模具中取出直径为50 mm、厚度为1 mm的压制件, 并在马弗炉中于375 ℃下烧结2 h.最后, 将烧结件切成20 mm×20 mm的正方形作为膨胀石墨复合基(EGM)样品.
2.2.3 MnO2/EGM电极的制备首先, 称取12.25 g四水乙酸锰溶于100 mL去离子水中配制成0.5 mol·L-1的乙酸锰沉积液.然后以20 mm×20 mm的自制膨胀石墨复合基为阳极, 同等大小纯石墨片为阴极, 设置电流密度为5 mA·cm-2, 在WYK-6010直流稳压电源上电沉积120 min.待电沉积结束后, 用去离子水反复冲洗镀有MnO2的EGM基体片, 并于65 ℃下干燥24 h, 最终得到MnO2/EGM电极复合材料.实验方法原理可用式(1)表示.
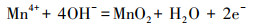
|
(1) |
采用S-4800型扫描电子显微镜(SEM, 日本东京日立公司)观察所制备电极的表面形貌, 并通过与之连接的X射线能谱分析(EDS)测量电极的组成成分.采用d-max-2500/PC型X射线衍射仪(XRD, 日本理学株式会社)研究样品的结构.
2.4 催化材料降解RHB的研究方法 2.4.1 MnO2/EGM电极降解RHB的研究以购买的纯石墨电极片(有效工作面积:2 cm×2 cm)为阳极, 自制的MnO2/EGM复合材料为阴极(有效工作面积:2 cm×2 cm), NaSO4溶液为电解质, RHB溶液为电解液, 电解时电解液的体积均为200 mL, 间隔一定时间取样测定降解过程中RHB的浓度.在本实验中, RHB浓度直接采用分光光度法测定, 其在可见光波段最大吸收波长554 nm处测得的标准曲线如式(2)所示.降解过程中RHB的脱色率R计算如式(3)所示.

|
(2) |
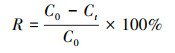
|
(3) |
式中, y为RHB在554 nm峰处的吸光度值;x为RHB的浓度(mg·L-1);C0和Ct分别为反应前和反应时间t(min)后罗丹明B浓度平均值(mg·L-1).
2.4.2 MnO2/EGM的循环伏安曲线分析采用MnO2/EGM为工作电极, 铂电极为辅助电极, 饱和Ag/AgCl电极为参比电极, 连接上海辰华CHI650C电化学工作站进行测试来研究MnO2/EGM电极上的电化学行为.采用10 g·L-1的NaSO4溶液作为支持电解质, 扫描速度为50 mV·s-1, 电压设置为-2.6~1.2 V.
2.4.3 H2O2浓度的测定本实验中, 采用草酸钛钾分光光度法来测定最优电解条件下H2O2的生成量.实验过程中, 取2 mL待测水样, 加入2 mL的0.05 mol·L-1草酸钛钾标准溶液, 加去离子水定容到10 mL.最后在400 nm波长下测定该水样的吸光度.被测水样中H2O2的浓度计算公式如式(4)所示.

|
(4) |
式中, C为H2O2浓度(mol·L-1);ΔA为扣除空白后溶液吸光度;V为定容体积(mL);L为比色皿行程长度(cm);Vx为样品体积(mL);ε为摩尔吸光系数, 取值为935 L·moL-1·cm-1.
2.4.4 RHB降解实验采用自制的二维电极反应器为电解槽, 以购买的纯石墨电极片(有效工作面积:2 cm×2 cm)为阳极, 自制的MnO2/EGM电极材料为阴极(有效工作面积:2 cm×2 cm), 分别探究不同溶液初始pH(2~13)、电流密度(10~50 mA·cm-2)、电解质浓度(0.03~0.2 mol·L-1)、RHB初始浓度(8~40 mg·L-1)及反应体系温度(15~55 ℃)对RHB脱色效果的影响.
3 结果与讨论(Results and discussion) 3.1 表征分析 3.1.1 SEM和EDS分析样品的SEM和EDS表征结果分别如图 1和图 2所示.相对空白EGM的SEM图像(图 1a), 从50倍放大倍数下的MnO2/EGM复合材料的SEM图像中可以看出, EGM上被成功镀上了均匀一致的二氧化锰(图 1b).10000倍放大倍数下的MnO2/EGM复合材料的SEM图像显示, 通过电沉积方法制备出的二氧化锰为星型网状结构, 且相互交织在一起, 表现出较高的比表面积(图 1c).从图 2可以看出, MnO2/EGM样品中存在C、O、Mn 3种元素, 并且O元素与Mn元素的原子比大约为2:1, 这与MnO2的元素组成特征相匹配.
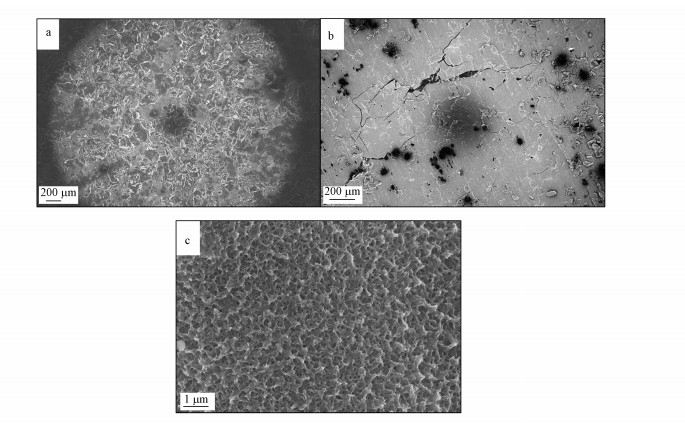 |
| 图 1 空白EGM(a)和MnO2/EGM复合材料不同放大倍数(b.50倍, c.10000倍)下的SEM图 Fig. 1 SEM images of blank EGM(a) and MnO2/EGM composites at different magnifications (b.50×, c.10000×) |
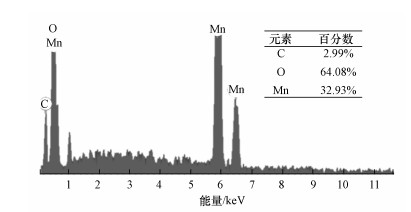 |
| 图 2 MnO2/EGM复合材料的EDS图 Fig. 2 EDS diagram of MnO2/EGM composite |
图 3所示为空白EGM和MnO2/EGM复合材料的XRD图.由图可知, 空白EGM的图谱曲线有两个主要的特征峰, 分别出现在2θ=26.66°和54.78°处, 这两个峰都具有较高的衍射强度和尖锐的形状, 表明EGM的结晶度较高, 内部颗粒排列良好.MnO2/EGM复合材料的XRD图谱显示, 在2θ=32.14°、37.20°、和66.00°处出现了3个较弱的衍射峰, 这3个峰分别对应于二氧化锰的3种晶型.除此之外, 在2θ=41.60°处有一个小峰, 表现为γ-MnO2的特征峰.在MnO2/EGM复合材料的XRD图谱中除了MnO2的特征峰外, 还出现了与空白EGM对应的两个特征峰, 说明在空白EGM上成功地沉积上了MnO2.从XRD图谱中还可以看出, 应用电沉积方法制备生成的MnO2结晶性能不好, 这有可能是因为MnO2晶体结构中包含着软锰矿隧道与斜方锰矿隧道晶胞的不规则交替生长, 形成基本的双链与单链的交替沿C轴的链块.而正是由于这种不规则交替生长, 使所合成的MnO2晶体结构中存在大量的缺陷和空位等, 所在在水溶液电解液中具有良好的性能.
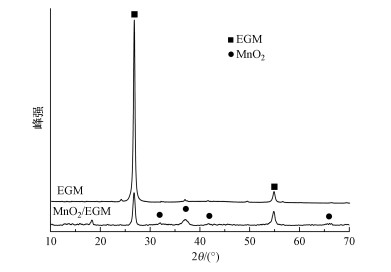 |
| 图 3 空白EGM和MnO2/EGM复合材料的XRD图 Fig. 3 XRD patterns of blank EGM and MnO2/EGM composite |
为研究不同初始pH值对RHB脱色效果的影响, 在其他条件相同的情况下, 测试不同初始pH值下(2、4、7、10和13)RHB的脱色效果, 结果如图 4a所示.由图可知, 初始pH为4、7和13时, 电解120 min后罗丹明B的脱色率分别为60.26%、92.75%和37.5%.初始pH为10时, 电解100 min后罗丹明B的脱色率达到平衡为95.14%.而初始pH为2时, 电解80 min后罗丹明B的脱色率就已经达到平衡为94.57%.在选定的不同初始pH值条件下, 初始pH为2时罗丹明B的脱色时间不仅最短, 而且达到平衡时的脱色效果也比较好.罗丹明B在酸性条件下之所以能达到良好的脱色效果, 主要是因为电极反应产生的H能与染料的有机物和无机物组分发生氧化还原反应, 从而破坏染料的发色基团, 达到脱色的目的.除此之外, 在酸性条件下更有利于H2O2的生成.所以在本实验中选取最佳初始pH值为2.
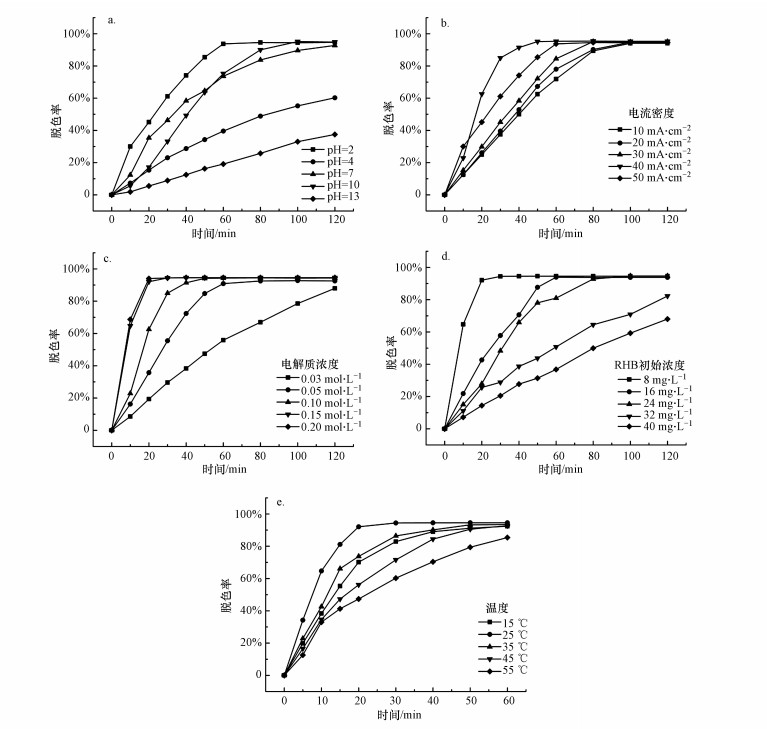 |
| 图 4 初始pH值(a)、电流密度(b)、电解质浓度(c)、RHB初始浓度(d)及反应温度(e)对RHB脱色效果的影响 Fig. 4 Effect of initial pH value(a), current density (b), electrolyte concentration(c), initial concentration of RHB(d) and reaction temperature(e) on RHB decolorization |
为研究不同电流密度对RHB脱色效果的影响, 在其他条件相同的情况下, 测试不同初始电流密度下(10、20、30、40和50 mA·cm-2)RHB的脱色效果, 结果如图 4b所示.从图中可以看出, 随着电流密度的上升, 罗丹明B的脱色率先呈上升趋势, 但当电流密度增大到一定程度时, 罗丹明B的脱色率出现下降趋势.电流密度的增大代表电极表面的电子传输速率增大, 从而提高了电极反应速率, 所以罗丹明B的脱色率随之增大.电流密度分别为10 mA·cm-2和20 mA·cm-2时, 电解100 min后罗丹明B的脱色率达到平衡, 分别为94.04%和94.75%.当电流密度为30 mA·cm-2和50 mA·cm-2时, 罗丹明B的脱色率在电解80 min后即达到平衡, 分别为95.13%和94.57%.而当电流密度为40 mA·cm-2时, 罗丹明B只需电解50 min即可使其脱色率达到平衡, 平衡时的脱色率为95.14%.电流密度对罗丹明B的脱色效果影响主要有两个方面:①电流密度的增大使电极反应速率增加, 有利于罗丹明B电催化还原反应的进行;②过大的电流密度加剧了阳极副反应析氧反应的发生, 从而减弱了罗丹明B的脱色效果.综合从罗丹明B的脱色效果及能耗方面考虑, 本实验中电流密度选择为40 mA·cm-2.
3.2.3 电解质浓度对RHB脱色效果的影响为研究不同电解质浓度对RHB脱色效果的影响, 在其他条件相同的情况下, 测试不同电解质浓度下(0.03、0.05、0.1、0.15和0.2 mol·L-1)RHB的脱色效果, 结果如图 4c所示.从图中可以看出, 随着电解质浓度的增加, 罗丹明B的脱色率也随之增加.电解质浓度为0.03 mol·L-1, 电解时间为120 min时, 罗丹明B的脱色率为87.97%.当电解质浓度为0.05 mol·L-1, 电解时间为80 min时, 罗丹明B的脱色率达到平衡为92.5%.电解质浓度为0.1 mol·L-1, 电解50 min后罗丹明B的脱色率达到平衡为94.14%.电解质浓度为0.15 mol·L-1和0.2 mol·L-1时, 电解30 min后罗丹明B的脱色率达到平衡, 分别为94.43%和94.4%.电解质浓度增加而导致罗丹明B脱色率增大有可能是因为硫酸钠浓度增大, 电解液的导电能力增强, 使电子的传导速率增加, 从而加快了罗丹明B色度的去除.综合考虑罗丹明B的脱色率、能耗及电解质的用量等因素, 本实验中选择最佳电解质浓度为0.15 mol·L-1.
3.2.4 RHB初始浓度对其脱色效果的影响为研究不同RHB浓度对其脱色效果的影响, 在其他条件相同的情况下, 测试了不同RHB初始浓度下(8、16、24、32和40 mg·L-1)RHB的脱色效果, 结果如图 4d所示.从图中可以看出, 随着罗丹明B初始浓度的增加, 其脱色率逐渐降低.当罗丹明B初始浓度为8 mg·L-1时, 其脱色率只需电解30 min即可达到平衡, 此时罗丹明B的脱色率为94.43%.罗丹明B初始浓度为32 mg·L-1和40 mg·L-1时, 电解120 min后的脱色率分别为82.27%和67.99%.当罗丹明B初始浓度为16 mg·L-1时, 电解60 min后其脱色率达到平衡为93.93%.当罗丹明B初始浓度为24 mg·L-1时, 电解100 min后其脱色率达到平衡为94.7%.造成这种现象的原因有可能是当罗丹明B初始浓度较高时, 在电解反应过程中生成的一系列产物的反应有可能与电解还原罗丹明B的反应形成一种竞争关系, 即所发生的电极反应是以形成的中间产物的反应为主, 从而削弱了罗丹明B的脱色反应, 进而使其脱色率随着初始浓度的增加而降低.所以在本实验中选择罗丹明B最佳初始浓度为8 mg·L-1.
3.2.5 反应温度对RHB脱色效果的影响为研究不同反应温度对RHB脱色效果的影响, 在其他条件相同的情况下, 测试不同温度下(15、25、35、45和55 ℃)RHB的脱色效果, 结果如图 4e所示.由于在3.2.4节中的优化条件下RHB降解30 min即可达到平衡, 所以在温度影响试验的研究中, 该反应体系的降解时间设置为60 min.
从图中可以看出, 随着反应温度的升高, 罗丹明B的脱色率呈现增大的趋势.当反应温度为15 ℃时, 电解50 min后罗丹明B的脱色率达到平衡为91.2%.反应温度为25 ℃时, 电解30 min后罗丹明B的脱色率为94.43%.当反应温度为35 ℃时, 电解50 min后罗丹明B的脱色率为93.29%.水温升高导致水的粘度减小, 水中溶解氧的浓度也会减小, 从而使阴极能利用的溶解氧也随之减少, 最终导致生成的过氧化氢量减少.除此之外, 温度升高, 反应体系中生成的过氧化氢受热分解, 这样就导致电解液中的过氧化氢产量减少, 从而削弱了罗丹明B的脱色反应, 使其脱色率随着反应温度的升高而降低.综合罗丹明B的脱色率和能耗等因素, 本实验选择最佳反应温度为25 ℃.
3.3 RHB降解动力学分析本实验在最优降解条件下, 即反应体系初始pH为2, 电流密度为40 mA·cm-2, 电解质Na2SO4浓度为0.15 mol·L-1, 罗丹明B初始浓度为8 mg·L-1, 反应体系温度为25 ℃时, 对RHB进行相关动力学分析, 相关参数见表 1.从表中可以看出, MnO2/EGM电极对RHB的降解行为更符合一级反应动力学.
| 表 1 MnO2/EGM降解RHB动力学参数 Table 1 Kinetic parameters of degradation of RHB by MnO2/EGM |
循环伏安分析不仅可以判断电极反应的可逆性, 而且可推断催化反应的氧化还原特性, 是探讨电催化机理最有效的方法之一.图 5为MnO2/EGM电极的循环伏安曲线图.由图 5可以看出, 空白EGM和MnO2/EGM电极曲线上都出现了氧化还原峰, 曲线上方代表电流氧化峰, 曲线下方代表电流还原峰.空白EGM的CV曲线上电流峰响应较低, 而MnO2/EGM电极CV曲线的下方曲线上出现了两个明显的电流峰, 其中, A点表示O2在阴极还原为H2O2的电流峰, B点是H+还原为H2的还原峰.由此可推测, MnO2/EGM电极作为阴极时其表面发生了有O2参与的电化学反应, 即MnO2/EGM电极利用电解液中的溶解氧使其还原为具有强氧化活性的H2O2.
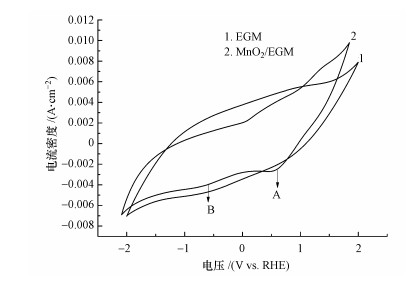 |
| 图 5 空白EGM和MnO2/EGM电极的循环伏安曲线图 (扫速:50 mV·s-1) Fig. 5 Cyclic voltammetry curves of blank EGM and MnO2/EGM electrode (scan rate: 50 mV·s-1) |
为了探索RHB在降解过程中中间产物的变化情况, 本研究采用紫外可见光谱扫描对RHB降解前及在最优条件下降解后的产物进行分析, RHB降解前后紫外可见扫描光谱如图 6所示.由图 6可以看出RHB在降解前后最大吸收峰的变化情况, 在降解前, RHB的最大吸收波长为554 nm, 并且在190~400 nm之间有一些小峰, 但在经过电化学处理过后, 最大吸收峰基本消失, 从色度上观察基本呈无色.除此之外, 其他波长下的吸收峰也出现降低.说明在RHB染料分子中以脱乙基、苯环开环为主的发色基团被破坏, 生成二氧化碳和水, 从而达到降解脱色的目的.
 |
| 图 6 RHB降解前后紫外可见扫描光谱图 Fig. 6 Ultraviolet and visible scanning spectra before and after RHB degradation |
在本实验中, 以MnO2/EGM为阴极, 空气中的氧气(O2 (g))首先进入电解液中, 然后进入电解液中的O2 (aq)转化为吸附状态下的溶解氧(O2 (ads)).一方面, 溶解氧中的活性氧分子与阴极电极表面进行电子交换, 与溶液中的H+反应, 生成具有强氧化性的H2O2, 具体反应历程如式(5)~(7)所示.另一方面, 溶解氧在二氧化锰的催化作用下转化成O2-和HO2-, 最终生成具有强氧化性的H2O2(曹余良等, 2003;冬连红等, 2009;Yue et al., 2014), 具体反应历程如式(8)~(12)所示.强氧化性的H2O2可以与电解液中的有机物及降解过程中生成的中间产物发生反应, 破坏罗丹明B的发色基团, 把大分子物质氧化掉变成小分子物质, 进而氧化生成CO2和H2O, 此过程中, 电解液的颜色逐渐褪去, 且不会产生二次污染, 如此便达到降解罗丹明B染料的目的.

|
(5) |
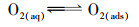
|
(6) |
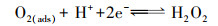
|
(7) |

|
(8) |
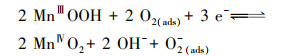
|
(9) |

|
(10) |
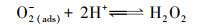
|
(11) |

|
(12) |
本实验在最优电解条件下对该体系中H2O2的浓度变化进行了跟踪分析.图 7所示为MnO2/EGM作为阴极电极随着电解时间还原溶解氧生成H2O2的浓度变化曲线.从图中可以看出, 随着电解时间延长, H2O2的浓度逐渐增大, 前30 min H2O2的积累速率较快, 30 min后曲线趋于平缓, 有可能是因为受周围环境影响及当H2O2的浓度达到一定值时H2O2被分解.通过实验证实在本研究电解体系中, MnO2/EGM作为阴极电极能够利用溶解氧发生还原反应产生H2O2, 从而能够利用阴极电解后产物的氧化性, 达到降解RHB染料的目的.
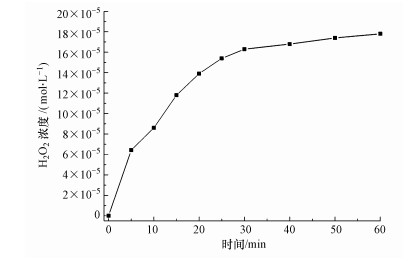 |
| 图 7 最优降解条件下H2O2浓度随时间的变化曲线 Fig. 7 Curve of H2O2 concentration with time under optimal degradation conditions |
1) 本研究通过电沉积法成功制备出了MnO2/EGM电极材料, 且在EGM表层负载的MnO2均匀致密.
2) 在二维电极体系中, 当反应体系中初始pH值为2, 电流密度为40 mA·cm-2, 电解质Na2SO4浓度为0.15 mol·L-1, 罗丹明B初始浓度为8 mg·L-1, 反应体系温度为25 ℃时, RHB在电解30 min后达到最大脱色率为94.43%, 且MnO2/EGM电极对RHB的降解符合一级反应动力学.
3) MnO2/EGM电极对RHB具有良好的脱色效果是因为其利用电解液中的溶解氧发生还原反应生成具有强氧化性质的H2O2, 破坏了罗丹明B的发色基团, 从而使罗丹明B达到脱色目的.
An Y L, Fei H F, Zeng G F, et al. 2018. Commercial expanded graphite as a low-cost, long-cycling life anode for potassium-ion batteries with conventional carbonate electrolyte[J]. Journal of Power Sources, 37: 66-72. |
Aveiro L R, Silva A G M D, Candido E G, et al. 2018. Application and stability of cathodes with manganese dioxide nanoflowers supported on vulcan by Fenton systems for the degradation of RB5 azo dye[J]. Chemosphere, 208: 131-138. DOI:10.1016/j.chemosphere.2018.05.107 |
曹余良, 杨汉西, 艾新平, 等. 2003. MnO2电极上氧还原的电催化机理[J]. 电化学, 9(3): 336-343. |
冬连红, 蔡晓华, 程富民, 等. 2009. 二氧化锰/多壁碳纳米管复合材料对氧还原(ORR)催化作用的初步研究[J]. 河北科技大学学报, 30(1): 30-34. |
He J, Chen S Q, Yang S Q, et al. 2020. Fabrication of MoS2 loaded on expanded graphite matrix for high-efficiency pH universal hydrogen evolution reaction[J]. Journal of Alloys and Compounds, 828: 154370. |
胡茂华. 2019. 膜技术在印染废水回用中的应用[J]. 低碳世界, (1): 8-10. |
胡潇, 梁虎南, 于大禹. 2018. 硅藻土处理染料废水的研究进展[J]. 硅酸盐通报, 37(1): 160-165. |
Lee K, Ahmed M S, Jeon S, et al. 2015. Electrochemical deposition of silver on manganese dioxide coated reduced graphene oxide for enhanced oxygen reduction reaction[J]. Journal of Power Sources, 288: 261-269. |
刘国, 刘家豪, 余雯雯, 等. 2017. BiOCl/ZnMgAl-HTLCs复合材料光催化去除水中的甲基橙[J]. 环境科学学报, 37(11): 4071-4077. |
刘岩. 2016. LACCLR2细菌漆酶性质及其脱色作用的研究[J]. 安徽农学通报, (18): 29-31. |
卢涛, 刘国, 李春雪, 等. 2019. BiOCl/SiO2/Fe3O4复合材料可见光催化去除水中亚甲基蓝[J]. 环境科学学报, 39(2): 352-358. |
吕进锋. 2016. ACF阴极电催化处理染料废水实验研究[J]. 环境保护前沿, 6(4): 54-60. |
宋萌, 何忠洲, 江涛. 2018. 电化学技术处理难降解废水的应用综述[J]. 安徽农学通报, 24(2): 68-70. |
陶虎春, 石刚, 于太安, 等. 2017. PEI/MWCNT修饰含铁电芬顿电极处理印染废水的研究[J]. 北京大学学报, 53(5): 982-988. |
Umukoro E H, Peleyeju M G, Ngila J C, et al. 2017. Towards wastewater treatment:Photo-assisted electrochemical degradation of 2-nitrophenol and orange II dye at a tungsten trioxide-exfoliated graphite composite electrode[J]. Chemical Engineering Journal, 317: 290-301. |
王婷. 2018. 改性煤矸石吸附染料废水中甲基橙性能的研究[J]. 皮革与化工, 35(6): 16-20. |
瓮青松, 杨富国, 阮善. 2016. 电化学法处理分散红染料废水的研究[J]. 广东化工, 43(10): 173-174. |
Wu Y, Pan Q C, Zheng F G, et al. 2018. Sb@C/expanded graphite as high-performance anode material for lithium ion batteries[J]. Journal of Alloys and Compounds, 744: 481-486. DOI:10.1016/j.jallcom.2018.02.049 |
奚瑞, 王树林, 李生娟, 等. 2015. 膨胀石墨/纳米氧化锌/锌复合电极材料的超级电容器性能[J]. 功能材料, 46(11): 11060-11064. |
Xiao H, Zhao T, Li C H, et al. 2017. Eco-friendly approaches for dyeing multiple type of fabrics with cationic reactive dyes[J]. Journal of Cleaner Production, 165: 1499-1507. DOI:10.1016/j.jclepro.2017.07.174 |
徐凤云.2017.3D刺球状TiO2/rGO复合材料制备及光催化降解阳离子染料的研究[D].天津: 天津大学
|
闫国伦. 2018. 纳米CDS的制备及其在印染废水处理上的探索[J]. 四川化工, 21(1): 1-12. |
于存. 2017. 变色栓菌对直接大红染料的脱色研究[J]. 环境科学学报, 37(12): 4617-4622. |
Yue L, Guo J B, Yang J L, et al. 2014. Studies on the electrochemical degradation of Acid Orange II wastewater with cathodes modified by quinones[J]. Journal of Industrial and Engineering Chemistry, 20: 752-758. DOI:10.1016/j.jiec.2013.06.003 |
张俊, 杨德庆. 2018. 电化学技术在印染生产废水处理中的应用[J]. 资源节约与环保, (4): 7. |
张新旺. 2019. 餐厨垃圾生物质炭制备及其吸附水中亚甲基蓝性能[J]. 农业资源与环境学报, 36(1): 115-120. |
Zhao S J, Li P, Adkins J, et al. 2018. Carboxyl grafted sulfur-expanded graphite composites as cathodes for lithium-sulfur batteries[J]. Journal of Electroanalytical Chemistry, 823: 422-428. DOI:10.1016/j.jelechem.2018.06.044 |
 2020, Vol. 40
2020, Vol. 40


