2. 西安工程大学城市规划与市政工程学院, 西安 710048
2. School of City Planning and Municipal Engineering, Xi'an Polytechnic University, Xi'an 710048
活性污泥法是目前使用最广泛的一种生物处理方法(Guo et al., 2017).众所周知, 活性污泥的核心是絮体(David et al., 2003; 阮晓东等, 2013), 细菌又是形成活性污泥絮体的主要个体(Thomsen et al., 2004), 其中, 细菌数量可占活性污泥细菌总量的95%以上.在活性污泥法中细菌常常以聚集体—菌胶团的形式存在, 这种存在形式有利于泥水混合液在沉淀池中分离, 除此之外也能够使多种细菌协同降解各种污染物, 并且共同抵抗外界环境的变化(李志华等, 2010).
研究表明, 活性污泥絮体层级和菌胶团层级的聚合力有所不同(常青等, 2010).目前, 大多数关于活性污泥絮凝效果的研究更关注絮体层级可控外界环境因素的影响, 如控制进水负荷(李亚峰等, 2018)、碳氮比(孙洪伟等, 2018)、溶解氧(Fan et al., 2017)、pH值(Wei et al., 2019)、污泥龄(詹咏等, 2017)、曝气时间(郭旋等, 2016; 胡小兵等, 2016)及水力剪切力(Feng et al., 2020)等促使活性污泥系统中菌胶团的进一步絮凝.而对于污水中菌胶团层级的游离菌如何凝聚成絮体, 以及碳源种类对游离菌凝聚初期的影响却鲜见报道.目前解释细菌凝聚作用的理论主要有:胞外聚合物(EPS)架桥学说(Shi et al., 2017)和XDLVO(The extended Derjaguin-Landau-Verwey-Overbeek)学说(Yuan et al., 2018).EPS架桥学说认为, 二价阳离子(如Ca2+、Mg2+等)可以在EPS之间形成架桥连接, 从而促进活性污泥的絮凝(Akshaykumar et al., 2018); XDLVO学说认为细菌表面的物理性质(亲疏水性和带电性)对絮体的形成过程有重要影响.在以上两种学说中, EPS在活性污泥絮凝中都起着重要作用(Wilén et al., 2000).
Higgins和Novak等(1997)发现EPS中蛋白质的去除将导致活性污泥的解体.Wilén等(2003)发现EPS中蛋白质的增加或腐殖质的降低能使活性污泥的絮凝性能提升.另外, EPS的结构和组成及活性污泥絮体的表面性状和内部结构都与细菌生长所用的碳源种类密切相关(Ye et al., 2011; Wang et al., 2014).在污水中存在着不同种类的有机物, 按分子量大小可将其分为小分子有机物和大分子有机物, 碳源种类的不同将直接影响着生活在其中的细菌, 不同性质的有机物作为碳源时不仅导致细菌表面胞外聚合物的总量有很大差异, 更对胞外聚合物的组成及多糖和蛋白质的含量有很大影响.因此, 通过研究不同种类碳源对游离菌初期凝聚过程的影响, 有助于探究活性污泥絮体的形成机制.
本研究以4种典型有机物(乙酸钠、葡萄糖、蛋白胨和可溶性淀粉)作为碳源模拟生活污水, 在好氧批式培养条件下, 探索不同种类碳源对游离菌初期凝聚过程的影响, 主要考察絮体粒径、形态及表面形貌、接触角、Zeta电位和EPS等特征的变化规律, 以期为揭示细菌凝聚机理及进一步促进活性污泥颗粒化提供理论基础.
2 材料与方法(Materials and methods) 2.1 实验装置及运行方式同时运行4个完全相同的2 L玻璃烧杯构成的反应器, 每种碳源的培养体系均为2 L, 接种相同浓度菌悬液200 mL.反应器采用底部曝气, 由玻璃转子流量计控制曝气量.由于单纯曝气易引起培养体系中细菌与碳源接触不均匀, 所以在培养过程中利用四联磁力搅拌器(T09-1S)增加水平机械搅拌.水力剪切力由机械搅拌与曝气共同提供.培养温度为室温20~25 ℃, 每种碳源的培养周期为3~4 d(72~96 h).只在培养开始时加入满足细菌正常生命活动所需的有机物及氮、磷等物质, 并在培养过程中保证持续曝气和搅拌.4个反应器中溶解氧均控制在1.0~2.5 mg·L-1, 搅拌速度控制在(350±5) r·min-1.反应器起始有机物、氮和磷的浓度一致.
2.2 菌悬液的制备和进水水质菌悬液为从活性污泥中分离出的游离菌.将西安市第四污水处理厂生物池的回流污泥混合液自然沉淀30 min后取其上清液200 mL, 采用超声波细胞破碎仪(TL96-11)进行预处理(功率为10 W, 工作3 s, 间歇2 s, 超声24次), 从而使细菌分散.经流式细胞计数仪(BD Accuri C6 Plus)测量所得细菌悬液的细菌浓度为1×106个·mL-1.利用Zeta电位测定仪(马尔文ZS90)测量最终制得的菌悬液均值粒径为0.5 μm左右(图 1).
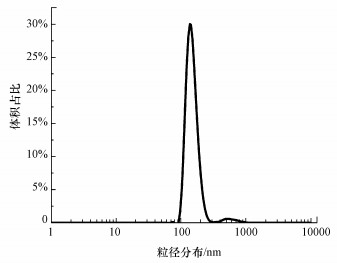 |
| 图 1 菌悬液中颗粒的粒径分布 Fig. 1 Particle size distribution in bacterial suspension |
根据Jorand等(1995)和Scuras等(1998)提出的絮体结构模型, 可以认为菌悬液中的细菌处于游离状态.模拟污水中COD为500 mg·L-1, 4个反应器的碳源分别由乙酸钠、葡萄糖、蛋白胨和可溶性淀粉提供.其中, 乙酸钠代表污水中有机物的发酵产物有机酸, 葡萄糖代表污水中糖类的水解产物, 蛋白胨和可溶性淀粉分别代表污水中的蛋白质类和糖类大分子有机物.氮源由NH4Cl提供, 浓度54 mg·L-1, 磷源由KH2PO4提供, 浓度12 mg·L-1.
2.3 分析指标及测定方法 2.3.1 常规水质分析与检测COD、混合液悬浮固体浓度MLSS、混合液挥发性悬浮固体浓度MLVSS、溶解氧DO、浊度及pH测定采用标准方法(国家环保局, 2002).
2.3.2 污泥絮体接触角的测定污泥的相对疏水性采用接触角表征.接触角由接触角测量仪(SL200A, SOLON TECH)测定, 所使用的测试液体为水、1-溴代萘和甲酰胺.首先将一定量的细菌菌体抽滤到0.45 μm醋酸纤维素膜上, 用蒸馏水洗涤两次, 再放到1%琼脂板上保持污泥水分.测定污泥接触角前, 将粘附有细菌的膜剪下合适宽度, 再用双面胶贴到载玻片的边沿处, 之后放入干燥皿中干燥10 min.然后采用静滴技术(Sharma et al., 2002), 将0.1 mL水滴到膜片上, 采用CCD将液滴的形状拍摄下来, 最后用CAST3.0软件分析计算污泥的接触角.对每一个样品, 每一种液体都至少测定10~15次, 取平均值.
2.3.3 Zeta电位测定Zeta电位通过Zeta电位测定仪(马尔文ZS90)测定, 将温度保持在20 ℃, 使菌体重新分散在0.01 mol·L-1的NaCl溶液中, pH为7.0±0.1.通过Smoluchowski方程计算得到电泳迁移率, 可得到菌液所对应的Zeta电位.
2.3.4 胞外聚合物的提取及主要组分测定胞外聚合物(Extracellular Polymeric Substances, EPS)通过加热法提取(Xiao et al., 2019), 取30 mL泥水混合物, 在4 ℃、5000 r·min-1下离心5 min, 去掉上清液, 加入30 mL 0.5 g·L-1的NaCl溶液, 在60 ℃下消解30 min后, 在4 ℃、5000 r·min-1下离心15 min, 取上清液过0.45 μm滤膜后即为EPS.
蛋白质的测定采用Lowry法, 以牛血清蛋白作为标准物质, 具体步骤参照文献(Simon et al., 2019); 多糖的测定采用苯酚-硫酸法, 以无水葡萄糖作为标准物质, 具体步骤参照文献(Gessesse et al., 2003).
2.3.5 污泥絮体大小的测量和形态的观察污泥絮体的粒径分布及粒径范围:采用Zeta电位测定仪(马尔文ZS90)测定游离菌的均值粒径及粒径分布, 测定范围为0.001~3 μm;利用激光粒度仪(LS230/SVM, Beckman, USA)测定污泥絮体的均值粒径及粒径分布, 测定范围为0~2000 μm.在测定污泥絮体粒径前需将污泥浓度大于1000 mg·L-1的污泥絮体用磷酸盐缓冲液冲洗3遍, 之后重悬倒入仪器测定.
污泥絮体的显微镜观察:采用光学显微镜(Nikon ECLIPSE 90i, Japan)观察污泥絮体的形态变化过程.
污泥絮体表面形貌的扫描电镜观察:污泥样品经2.5%的戊二醛固定、乙醇梯度脱水, 在临界点干燥、喷金后用扫描电镜(Scanning Electron Microscope, SEM, JSM-6510LV)观察污泥的表面形貌和微观结构(李宗义, 1997).
2.4 相关性分析采用SPSS 22.0分别对接触角、Zeta电位绝对值与EPS中PN/PS进行相关性分析, 本实验采用皮尔逊相关系数来衡量计算结果, 标准结果之间的误差皮尔逊相关系数可以用于反映两个变量之间的相关程度, 其值通过两个变量与其离差的积来计算.当皮尔逊相关系数的值大于0时, 表示两变量正相关; 小于0时, 表示两变量负相关; 当皮尔逊相关系数的绝对值在0.8~1.0之间时, 表示两变量为极强相关; 在0.6~0.8之间时, 表示两变量为强相关; 在0.4~0.6之间时, 表示两变量为中等程度相关; 在0.4以下时, 表示两变量为极弱相关或无相关.具体计算过程见式(1).
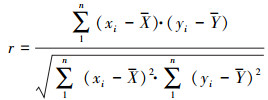
|
(1) |
式中, r为皮尔逊相关系数, xi、yi分别为第i个试验值, X、Y分别为对应的n个试验值的均值.
另外, 还需对相关系数r进行显著性差异的判别, 公式见式(2).当相关系数检验的t统计量的显著性概率p < 0.05时, 说明两个变量间相关性显著; 当p < 0.01时, 说明两个变量间相关性非常显著; 当p>0.05时, 说明两个变量间没有显著的相关关系, 只显示概率值.
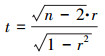
|
(2) |
反应器活性污泥絮体的形成过程一般经历4个阶段:细菌增殖阶段、絮状体形成阶段、絮状体聚合阶段、凝絮体形成阶段(李培睿等, 2007).在本次实验中发现, 游离的细菌在还未发生凝聚行为之前, 其浊度与MLSS呈正相关, 故采用浊度来间接表征细菌的生长情况.
分别以4种有机物作碳源时, 系统的浊度在整个培养过程呈先上升后下降的趋势(图 2).采用乙酸钠和葡萄糖这类小分子有机物作为碳源时, 污泥絮体粒径的增长规律遵循:浊度先升高后下降, 均值粒径先增加后小幅度下降, 最终基本保持不变, 该过程中伴随着细菌的凝聚行为(均值粒径≥13 μm).以乙酸钠为例(图 2a), 在培养36 h时, 浊度达到最大值26.27 NTU, 继续培养至第48 h时, 浊度下降至12.85 NTU, 污泥絮体的粒径从36 h时的11.11 μm增加到48 h时的33.3 μm.以葡萄糖为碳源时的变化规律与乙酸钠相似(图 2b).但当碳源为蛋白胨和可溶性淀粉这类大分子有机物时, 污泥絮体的粒径随浊度的上升而增大.以蛋白胨为碳源时(图 2c), 污泥絮体的粒径在培养的第12 h时迅速从初始的0.34 μm上升到44.78 μm, 同时培养体系的浊度从0.55 NTU上升至8.23 NTU, 此时浊度还未达到最大值.以可溶性淀粉为碳源时也发生了类似的变化(图 2d).可见, 当碳源为大分子有机物时, 细菌的聚集过程是游离细菌的繁殖和絮体粒径共同增大的过程, 且细菌的凝聚速度明显大于以小分子有机物为碳源时的速度.而在4种碳源的继续培养下浊度最终会趋于稳定, 均值粒径随着培养时间的延续稳定在60~80 μm.由于细菌发生凝聚的拐点在72 h以内, 且足够说明培养污泥絮体的整个变化趋势, 因此, 将72 h后的数据舍弃, 后文中与此类似.
 |
| 图 2 不同碳源条件下浊度、均值粒径、COD及MLSS随培养时间的变化 (a.乙酸钠, b.葡萄糖, c.蛋白胨, d.可溶性淀粉) Fig. 2 Changes in turbidity, mean particle size, COD, and MLSS with culture time under different carbon source conditions |
Jorand等(1995)认为粒径 < 13 μm的污泥絮体为聚合菌群, 是污泥絮体的基本单位.小分子有机物(乙酸钠和葡萄糖)为碳源时(图 2a、2b), 当细菌数量增长至最大时(36 h)才出现粒径>13 μm的污泥絮体, 在此之前细菌的凝聚行为还未发生.与之相比, 大分子有机物(蛋白胨和可溶性淀粉)为碳源时(图 2c、2d), 当细菌数量增长至最大时(12 h)即出现粒径超过13 μm的污泥絮体, 而且随着培养时间的延续粒径快速增长.
不同碳源条件下污泥絮体形成过程中的粒径分布如图 3所示.当碳源为乙酸钠(图 3a)和葡萄糖(图 3b)时, 培养24 h时的均值粒径分别为8.247 μm和3.515 μm, 其中粒径≥100 μm的污泥絮体的体积分别仅占总污泥絮体体积的4.89%和0%, 而同时刻粒径≤10 μm的菌胶团的体积分别占总絮体粒径体积的49.23%和74.73%, 说明体系中处于未凝聚状态的细菌占大部分.然而, 蛋白胨(图 3c)和可溶性淀粉(图 3d)作为碳源时, 絮体的粒径快速增大, 并且在培养初期出现了凝聚现象.在培养24 h时, 污泥絮体的均值粒径分别增大至37.17 μm和29.84 μm, 其中, 粒径≥100 μm的污泥絮体的体积分别占总污泥絮体体积的33.02%和45.53%, 粒径≤10 μm的菌胶团分别占总污泥絮体体积的10.27%和23.72%, 说明接近1/3的细菌处于凝聚状态.
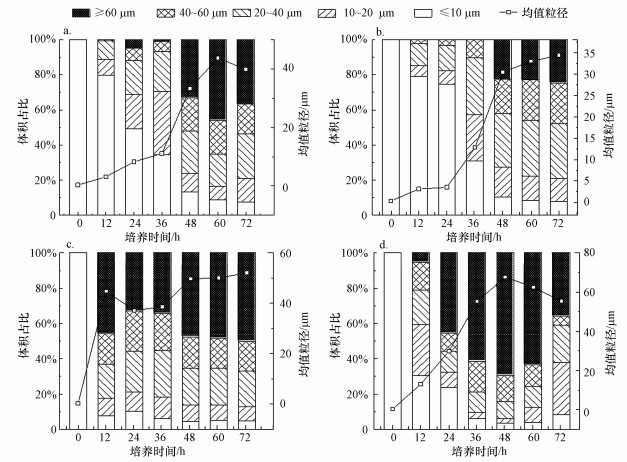 |
| 图 3 不同碳源条件下粒度分布随培养时间的变化 (a.乙酸钠, b.葡萄糖, c.蛋白胨, d.可溶性淀粉) Fig. 3 Particle size distribution changes with the number of days of culture |
由上可知, 小分子和大分子有机物作为碳源时其初期的凝聚过程有所不同, 推测与初期有机物在水中存在的状态有关.小分子有机物作为基质时, 游离菌的数量达到该培养过程的最大值, 细菌之间的距离足够近时, 细菌才有可能发生凝聚行为; 而大分子有机物作为碳源时, 培养过程中细菌的增殖和凝聚过程是同步进行的.在培养初期, 细菌的数量比较少, 细菌之间的距离比较远, 已有研究表明, 在中温条件下, 当污泥絮体间的距离较远时, 污泥存在明显的能量势垒(陈海蓉等, 2013); 随着培养时间的延续, 细菌不断增殖, 在培养体系体积不变的情况下, 细菌浓度增大, 其之间的碰撞和粘附几率也增大, 根据XDLVO理论(Xu et al., 2016)可知, 当细菌浓度增大, 菌体与菌体之间的距离缩短到足以克服最大斥力峰后就会发生集聚现象, 形成稳定的污泥絮体.
3.1.2 污泥絮体形态与表面形貌的观察细菌凝聚成活性污泥絮体的一般过程, 以及活性污泥3种不同尺寸的结构层级(单个细菌层级、菌胶团层级、活性污泥絮体层级) (Jorand et al., 1995; Scuras et al., 1998)如图 4所示.在培养初期(图 4a), 整个培养体系中主要为0.25~10 μm的游离细菌, 此时的细菌处于营养物质丰富和充足的富氧环境.随着细菌不断繁殖, 细菌之间的距离逐渐缩小, 从而增加了细菌之间的碰撞机会.至培养中期(图 4b), 在显微镜下开始出现粒径大于10 μm而小于40 μm的菌胶团, 之后菌胶团之间发生凝聚, 大部分菌胶团的粒径增大至40 μm以上, 同时也变得较之前更加密实, 活性污泥絮体逐渐形成.祝宁等(2016)研究亦证明此为活性污泥形成一般过程.王中玮(2011)在研究不同碳源对菌胶团进一步凝聚的影响时发现, 当碳源为乙酸钠和葡萄糖时系统内污泥较密实, 而碳源为淀粉时系统内的污泥疏松多孔.本研究发现在游离菌凝聚时亦呈现相似规律, 小分子有机物培养出的污泥絮体形态比较小但比较密实(图 4c), 而大分子有机物培养出的污泥絮体比前者大但比较疏松(图 4d).由于大分子有机物培养出的污泥絮体疏松多孔, 导致细菌集合体能很快地将细菌吸附在一起, 加快细菌的凝聚.
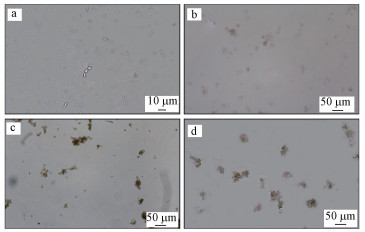 |
| 图 4 游离细菌培养成污泥絮体的显微镜观察 (a.体系中的游离菌, b.体系中的菌胶团, c.小分子有机物培养下的污泥絮体, d.大分子有机物培养下的污泥絮体) Fig. 4 Microscopic observation of free bacteria cultured into floc sludge |
污泥絮体的结构形式有两种, 一种是由高分子胞外聚合物对水中的细菌进行吸附架桥联接作用而形成的链式结构, 另一种是由丝状菌组成的基本网架(Burger et al., 2017).如图 5所示, 不同性质碳源培养出的污泥絮体其结构与细菌类型存在较大差别.由4种碳源培养出的污泥絮体均未发现大量的胞外聚合物, 这是由于细菌菌体活性较好, 基质和氧气传质的效率较高, 培养过程中形成的储能物质被很快地用于细菌的生长和能量的转化.碳源为乙酸钠(图 5a)和葡萄糖(图 5b)时培养出的污泥结构相似, 构成污泥絮体的主要细菌类型是杆菌, 细菌排列密集, 分布均匀有序, 这与孙飞云等(2007)利用乙酸钠和葡萄糖作为碳源时培养出的颗粒污泥结构相似.而碳源为蛋白胨(图 5c)和可溶性淀粉(图 5d)时培养出的污泥结构相似, 构成污泥絮体的主要细菌类型为杆菌和球菌, 除此之外还有少量丝状菌, 相比于小分子有机物作碳源时排列较松散.
 |
| 图 5 不同碳源培养出的污泥絮体的电镜图片 (a.乙酸钠, b.葡萄糖, c.蛋白胨, d.可溶性淀粉;×4000) Fig. 5 SEM images of sludge floc under different different carbon source conditions |
研究发现, 相对疏水性和表面电荷等污泥的表面性质显著地影响着细菌聚集体的形成和稳定性(Zhang et al., 2007).疏水性是细菌表面的重要性质, 它能促使细菌紧密聚集在一起, 疏水性越强, 细胞之间的亲和力也越强, 活性污泥絮凝性能越强.细菌表面一般带负电荷, 所以当污泥表面的负电荷减少时将降低污泥间的静电斥力, 有利于形成稳定的细菌聚集体(Li et al., 2019).本研究通过测量接触角表征细菌表面的相对疏水性, 接触角越大则相对疏水性越强; 通过测量Zeta电位表征细菌表面的静电斥力, Zeta电位的绝对值越小则静电斥力越弱.
如图 6所示, 接触角在整个培养过程中呈先增大后减小的趋势.当碳源为乙酸钠时, 接触角由起始的37.69°增加到第36 h时的最大值53.52°, 在培养72 h时又减少至19.97°, 其他3种碳源条件下接触角变化趋势与之相似.但碳源为大分子有机物时接触角最大值的出现早于小分子有机物.另外, 以蛋白胨和可溶性淀粉作为碳源时, 整个培养过程中的平均接触角分别为45.25°和47.05°, 大于以小分子有机物作碳源时的平均接触角.这说明以大分子有机物为碳源时细菌表面的疏水性较好.与接触角的变化相反, Zeta电位的绝对值在整个培养过程中呈先减小后增大的趋势.当碳源为乙酸钠时, Zeta电位的绝对值由起始的13.77 mV减少到第36 h时的最小值12.2 mV, 在培养72 h时又增加至13.56 mV, 其他3种碳源条件下Zeta电位绝对值的变化趋势与之相似.但碳源为大分子有机物时Zeta电位绝对值的最小值的出现早于小分子有机物.且以蛋白胨和可溶性淀粉作为碳源时, 整个培养过程中Zeta电位绝对值的平均值分别为11.53 mV和12.52 mV, 其均值小于小分子有机物条件下, 说明以大分子有机物为碳源时细菌表面的静电斥力较低.
 |
| 图 6 接触角和Zeta电位随培养时间的变化 Fig. 6 Change in contact angle and zeta potential with time of culture |
本研究中疏水性和静电斥力的变化过程与好氧颗粒污泥的形成过程非常相似(彭永臻等, 2010).增加细胞表面的疏水性将促进细胞与细胞的相互作用, 并进一步诱导污泥絮体从亲水性液相中脱出(Zhang et al., 2007).事实上, 细胞表面疏水性被认为是生物颗粒化的触发力(孙晓莹等, 2008).根据XDLVO理论, 当具有相同负电性的细菌粒子相互靠近到一定程度时, 会发生双电层的重叠, 产生静电斥力, 不利于细菌之间的凝聚, 而细菌表面Zeta电位绝对值的降低有利于细菌之间的凝聚.大分子有机物培养的污泥絮体疏松、孔隙大、可附着点多, 且能够使得细菌的表面疏水性增强、电位降低, 这些均会使接触角和Zeta电位比小分子有机物作为碳源时提前达到峰值.
3.2.2 EPS随培养时间的变化培养过程中胞外聚合物(EPS)含量和蛋白/多糖(PN/PS)随培养时间的变化如图 7所示, 胞外蛋白和多糖的总量在整个培养过程中呈先下降后上升的趋势.无论哪种碳源, PN/PS随培养时间的变化均呈先上升后下降的趋势, 峰值出现在实验中期.以乙酸钠和葡萄糖为碳源时(图 7a、7b), PN/PS在第36 h达到最大值(8.031和1.62);以蛋白胨和可溶性淀粉为碳源时(图 7c、7d), PN/PS在第24 h达到最大值(6.25和0.74).
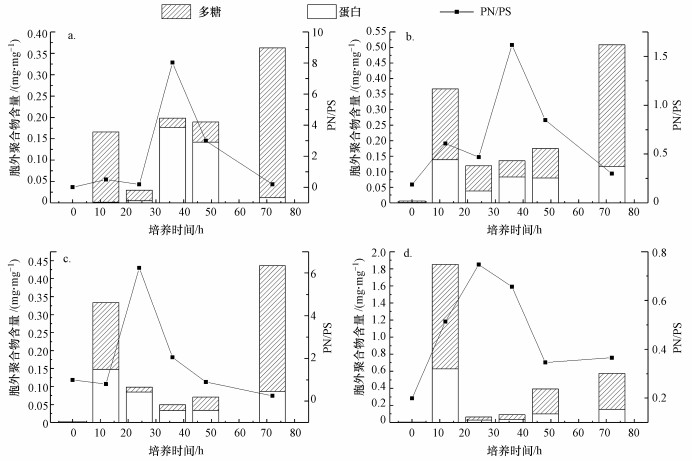 |
| 图 7 胞外聚合物含量和PN/PS随培养时间的变化 (a.乙酸钠, b.葡萄糖, c.蛋白胨, d.可溶性淀粉) Fig. 7 Extracellular polymer content and PN/PS changes with culture time |
实验结果表明, 乙酸钠作为碳源时PN/PS最大, 这是由于乙酸钠作为小分子溶解态有机物, 更容易被细菌吸收, 造成胞外蛋白和多糖比值的改变.碳源为大分子有机物时, 蛋白胨和可溶性淀粉系统均在第24 h时PN/PS达到最大值, 比小分子有机物提前达到最大值.由于蛋白质与多糖的比值能准确地表现污泥的疏水性, 可知在游离菌凝聚成活性污泥絮体的过程中, 疏水性也相应的先上升后减小, 结合图 3可知, 当疏水性达到最大值后, 细菌发生了凝聚行为.这可能是由于PN/PS的增加能够提高污泥的相对疏水性, 导致细菌表面的Gibbs自由能下降, 增加了细菌之间的亲和力, 有利于维持密实、稳定的结构(Mcswain et al., 2005).
3.3 污泥絮体培养过程中PN/PS与接触角、Zeta电位之间的关系由表 1可知, 4种有机物作为碳源时, 在游离细菌凝聚成团的过程中, 细菌EPS中PN/PS与细菌表面的接触角呈显著正相关(r>0.7, p < 0.05), 与Zeta电位的绝对值呈显著负相关(r < -0.89, p < 0.05).PN/PS与细菌表面的接触角呈正相关, 说明PN/PS的增加导致了细菌表面接触角的增大, 即细菌的疏水性增大, 这使细菌相互接触时更趋向于凝聚成团. PN/PS与细菌表面Zeta电位的绝对值呈负相关, 说明PN/PS的增加使细菌表面电位降低, 从而减少细胞之间的静电斥力, 进而有利于细菌的凝聚.与之相似, 王浩宇等(2012)在研究好氧污泥颗粒化的过程中也发现, 随着污泥颗粒化, EPS中PN/PS逐渐增大, 污泥表面Zeta电位的绝对值随之减小.因此, 在活性污泥絮体形成的初期, EPS中PN/PS的增加与细菌凝聚成团密切相关.
| 表 1 PN/PS与接触角和Zeta电位绝对值之间的相关性 Table 1 Correlation between PN / PS, contact angle and the absolute value of the zeta potential |
综上所述, 污水中具有凝聚性的游离细菌在培养一定时间后, 开始大量繁殖, 细菌间发生有效碰撞的机率增加.随着细菌的生长, 其EPS中的PN/PS增加, 增加了细菌表面的疏水性, 减少了细菌之间的静电斥力, 使菌胶团形成了初期形态—"团核"(粒径不大于13 μm), 随后团核上的细菌再繁殖后进一步增加了胶团的尺寸, 形成了菌胶团(粒径大于40 μm).在细菌生长繁殖的过程中, 细菌表面的理化性质随之变化.相较于小分子有机物, 大分子有机物作为碳源, 细菌EPS中PN/PS的峰值出现更早, 这导致细菌表面疏水性增加更快, 细菌之间的静电斥力降低更快, 从而使细菌之间相互碰撞时更易凝聚成团.
4 结论(Conclusions)1) 当以乙酸钠和葡萄糖等小分子有机物作为碳源时, 游离菌的初期凝聚一般发生在细菌数量增长至最多时.而以蛋白胨和可溶性淀粉等大分子有机物作为碳源时, 游离菌在增殖的同时便开始凝聚.说明大分子有机物为碳源时加快了游离细菌凝聚成絮体的过程.
2) 当以小分子有机物为碳源时培养出的絮体较小, 均值粒径为35~40 μm, 结构密实且排列规则.而以大分子有机物为碳源时培养出的絮体较大, 均值粒径为50~60 μm, 结构疏松且排列无序.
3) 相比于小分子有机物, 以大分子有机物为碳源时, 接触角较快达到最大值且其均值较大, Zeta电位的绝对值较快达到最小值且其均值较小, 说明以大分子有机物为碳源时细菌更有利于凝聚成絮体.
4) 当有机物分别以乙酸钠、葡萄糖、蛋白胨和可溶性淀粉作为碳源时, 细菌EPS中PN/PS与细菌表面的接触角呈显著正相关, 与Zeta电位的绝对值呈显著负相关.大分子有机物作为碳源时, 细菌EPS中PN/PS的峰值出现更早, 这导致细菌表面疏水性增加更快, 细菌之间的静电斥力降低更快, 因此, 以大分子有机物为碳源时, 细菌之间相互碰撞时更易凝聚成团.
Akshaykumar S, Ewa G P, Santosh P, et al. 2018. Understanding and optimization of the flocculation process in biological wastewater treatment processes:A review[J]. Chemosphere, 210: 401-416. |
Burger W, Krysiak-Baltyn K, Scales P J, et al. 2017. The influence of protruding filamentous bacteria on floc stability and solid-liquid separation in the activated sludge process[J]. Water Research, 123: 578-585. |
常青, 王彬斌, 彭党聪, 等. 2015. 基于粒度分布的活性污泥胞外聚合物提取及凝聚特性分析[J]. 环境工程学报, 9(5): 2284-2290. |
陈海蓉, 闻岳, 曹阿生, 等. 2013. 活性污泥中温与高温絮凝特性[J]. 环境工程学报, 7(10): 3821-3826. |
David J, Michael G R, Glen T D. 2003. Book Review:Manual on the causes and control of activated sludge bulking, foaming and other solids separation problems[J]. Crc Press, 31(4/5): 449-449. |
Fan H, Liu X, Wang H, et al. 2017. Oxygen transfer dynamics and activated sludge floc structure under different sludge retention times at low dissolved oxygen concentrations[J]. Chemosphere, 169: 586-595. |
Feng Q, Ge R, Sun Y Q, et al. 2020. Revealing hydrodynamic effects on flocculation performance and surface properties of sludge by comparing aeration and stirring systems via computational fluid dynamics aided calculation[J]. Water Research. DOI:10.1016/j.watres.2020.115500 |
郭旋, 刘俊新. 2016. 曝气时间对活性污泥絮体吸附和聚集性能的影响[J]. 工业用水与废水, (4): 22-28. |
国家环保局. 2002. 水和废水监测分析方法[M]. (第四版). 北京: 中国环境科学出版社, 105-107.
|
Gessesse A, Dueholm T, Petersen S B, et al. 2003. Lipase and protease extraction from activated sludge[J]. Water Research, 37: 3652-3657. |
Guo J, Ni B J, Han X, et al. 2017. Unraveling microbial structure and diversity of activated sludge in a full-scale simultaneous nitrogen and phosphorus removal plant using metagenomic sequencing[J]. Enzyme and Microbial Technology, 102: 16-25. |
胡小兵, 叶星, 饶强, 等. 2016. 纯氧曝气活性污泥培养过程中絮体结构变化[J]. 环境科学学报, 36(3): 907-913. |
Higgins M J, Novak J K. 1997. Characterization of Exocellular Protein and Its Role in Bioflocculations[J]. Water Research, 123(5): 479-485. |
Jorand F, Zartarian F, Thomas F, et al. 1995. Chemical and structural (2D) linkage between bacteria within activated sludge flocs[J]. Water Research, 29(7): 1639-1647. |
李培睿, 杨天佑, 李宗义, 等. 2007. 活性污泥凝絮体的形成过程研究[J]. 河南师范大学学报(自然版), 35(1): 150-152. |
李亚峰, 苏雷, 刁可心, 等. 2018. 进水负荷交替变化对好氧污泥颗粒化的促进[J]. 水处理技术, (1): 96-101. |
李志华, 刘芳, 王晓昌. 2010. 影响微生物聚集体的聚集度的因素分析[J]. 环境科学学报, 30(3): 456-462. |
李宗义. 1997. 微生物学实验技术[M]. 北京: 气象出版社.
|
Li H, Zhang J F, Shen L, et al. 2019. Production of polyhydroxyalkanoates by activated sludge:Correlation with extracellular polymeric substances and characteristics of activated sludge[J]. Chemical Engineering Joumal, 361: 219-226. |
Mcswain B S, Irvine R L, Hausner M, et al. 2005. Composition and distribution of extracellular pobmeric substances in aerobic flocs and granular sludge[J]. Applied and Environmental Microbiology, 71(2): 1051-1057. |
彭永臻, 吴蕾, 马勇, 等. 2010. 好氧颗粒污泥的形成机制、特性及应用研究进展[J]. 环境科学, 31(2): 3-11. |
阮晓东, 刘俊新. 2013. 活性污泥絮体的分形结构分析[J]. 环境科学, 34(4): 1457-1463. |
孙飞云, 杨成永, 李久义. 2007. SBR中不同基质对好氧颗粒污泥的性状影响研究[J]. 北京交通大学学报, 31(1): 106-110. |
孙洪伟, 陈翠忠, 高宇学, 等. 2018. 碳氮比对活性污泥胞外聚合物的长期影响[J]. 中国环境科学, 38(3): 950-958. |
孙晓莹, 施汉昌, 全向春, 等. 2008. 细菌细胞表面疏水性及在活性污泥中粘附率影响因素研究[J]. 环境科学, 29(10): 123-128. |
Scuras S, Daigger G T, Jr C P L G. 1998. Modeling the activated sludge floc microenvironment[J]. Water Science & Technology, 37(4): 243-250. |
Sharma P K, Rao K H. 2002. Analysis of different approaches for evaluation of surface energy of microbial cells by contact angle goniometry[J]. Advances in Colloid and Interface Science, 98(3): 341-463. |
Shi Y, Huang J, Zeng G, et al. 2017. Exploiting extracellular polymeric substances (EPS) controlling strategies for performance enhancement of biological wastewater treatments:An overview[J]. Chemosphere, 180: 396-411. |
Simon F, Pascalle V, Mark C M, et al. 2019. Chemical characterization methods for the analysis of structural extracellular polymeric substances (EPS)[J]. Water Research, 157: 201-208. |
Thomsen T R, Nielsen J L, Ramsing N B, et al. 2004. Micromanipulation and further identification of FISH-labelled microcolonies of a dominant denitrifying bacterium in activated sludge[J]. Environmental Microbiology, 6(5): 470-479. |
王浩宇, 苏本生, 黄丹, 等. 2012. 好氧污泥颗粒化过程中Zeta电位与EPS的变化特性[J]. 环境科学, 33(5): 1614-1620. |
王中玮.2011.菌胶团菌和丝状菌竞争影响因素研究[D].北京: 北京工业大学
|
Wang B B, Peng D C, Hou Y P, et al. 2014. A new classification paradigm of extracellular polymeric substances (EPS) in activated sludge:Separation and characterization of exopolymers between floc level and microcolony level[J]. Water Research, 58: 1-8. |
Wei H, Tang Y, Li A, et al. 2019. Insights into the effects of acidification on sewage sludge dewaterability through pH repeated adjustment[J]. Chemosphere, 227: 269-276. |
Wilén B M, Keiding K, Nielsen P H. 2000. Anaerobic deflocculation and aerobic reflocculation of activated sludge[J]. Water Research, 34(16): 3933-3942. |
Wilén B M, Jin B, Lant P. 2003. The influence of key chemical constituents in activated sludge on surface and flocculating properties[J]. Water research, 37(9): 2127-2139. |
Xiao B Y, Liu Y, Luo M, et al. 2019. Evaluation of the secondary structures of protein in the extracellular polymeric substances extracted from activated sludge by different methods[J]. Journal of Environmental Sciences (China), 80: 128-136. |
Xu J, Yu H Q, Li X Y. 2016. Probing the contribution of extracellular polymeric substance fractions to activated-sludge bioflocculation using particle image velocimetry in combination with extended DLVO analysis[J]. Chemical Engineering Journal, 303: 627-635. |
Ye X F, Peng G, Li Y. 2011. Influences of influent carbon source on extracellular polymeric substances (EPS) and physicochemical properties of activated sludge[J]. Chemosphere, 84(9): 1250-1255. |
Yuan S S, Gao M M, Ma H, et al. 2018. Qualitatively and quantitatively assessing the aggregation ability of sludge during aerobic granulation process combined XDLVO theory with physicochemical properties[J]. Journal of Environmental Sciences, 67(5): 157-163. |
詹咏, 张焕焕, 冯青青, 等. 2017. 不同泥龄对活性污泥絮凝特性的影响[J]. 环境工程学报, 11(11): 56-62. |
祝宁.2016.环境条件对微生物聚集行为的影响研究[D].合肥: 合肥工业大学
|
Zhang L, Feng X, Zhu N, et al. 2007. Role of extracellular protein in the formation and stability of aerobic granules[J]. Enzyme and Microbial Technology, 41(5): 551-557. |
 2020, Vol. 40
2020, Vol. 40


