2. 稻米品质安全控制湖南省工程实验室, 长沙 410004;
3. 湖南省水利水电勘测设计研究总院, 长沙 410004
2. Hunan Engineering Laboratory for Control of Rice Quality and Safety, Changsha 410004;
3. Hunan Hydro & Power Design Institution, Changsha 410004
砷(As)在地壳中是第20位最常见的微量元素, 分布广泛且具有致癌性, 被认为是世界上最危险的化学物质之一(Singh et al., 2015).由于现今As污染日趋严重并对人类健康和生态系统造成了不利影响, 因此, As污染已成为世界上最受关注的环境污染问题之一.环境中的As来源于天然存在、工业和农业, 如矿产资源的开发利用和高砷煤的燃烧等人类活动(余天红等, 2014; 邱丽娟等, 2018).据统计, 我国年产砷渣50万t, 约有2000万人生活在砷污染高风险区(Rodríguez-Lado et al., 2013; Su, 2014). Li等(2017)研究发现, 淮河流域17%的村庄和59%的县区居民生活用水砷含量超标.
由于As的溶解度很高, 导致As污染治理比较困难.氧化还原、化学沉淀、过滤等传统方法因成本高、易造成二次污染等原因在实际应用中受到限制(Sun et al., 2015; Abdul et al., 2015).而微生物修复因具备成本低、对环境友好等优势受到人们的普遍关注(吴佳等, 2011; 杨婷婷等, 2016).作为自然界中最大的一类生物群体, 微生物可以通过生物吸附和富集、氧化还原等作用来影响水体中重金属的毒性, 因此, 可以利用微生物来修复水体的重金属污染.目前应用微生物处理含砷水体大多仍处于实验室研究阶段, 耐As微生物的获取是利用微生物修复进行As污染治理的必要前提, 因此, 进行耐As菌株的选育及其相关特性研究具有重要意义.目前报道较多的耐砷微生物有芽孢杆菌属、假单胞菌属、红球菌属、苍白杆菌属、节细菌属、放线菌属、微杆菌属等(吴丹等, 2017).
水体中三价砷的毒性是五价砷的60多倍, 并且附着能力强, 移动性弱, 较难去除.一些微生物能够氧化高毒性的三价砷成为毒性较低的五价砷, 如嗜酸氧化亚铁硫杆菌、粪产碱杆菌、根癌土壤杆菌等(陈朋等, 2014).微生物细胞表面的活性基团对砷的吸附具有关键作用. Mohd Bahari等(2013)从金矿中分离获得一株超耐受砷细菌蜡状芽孢杆菌SZ2, FTIR分析显示细菌表面吸附的主要功能基团为—OH和—NH. Prasad等(2013)研究发现, 节细菌属抗砷细菌对水溶液中砷酸盐与亚砷酸盐的生物吸附主要与—OH、—CO和—NH有关.此外, Patel等(2007)应用X-射线吸收光谱检测了假单胞菌As-1体内砷的分布, 结果表明, 65%、30%的砷分别以As3+、As5+的形式存在于细胞体内, 5%的砷则以As—S键的形式与硫基相结合.吕常江等(2012)在光照厌氧条件下研究沼泽红假单胞菌吸附砷的抗性机制时发现, As3+和As5+在全细胞、细胞膜、细胞质中的相对占比分别为16.3%、12.1%、83.7%和87.9%、83.5%、16.5%.目前国内外有关芽孢杆菌属(Bacillus)去除水体中重金属的研究主要集中于Cr、Cd等元素, 而关于该菌属去除水体砷的研究鲜有报道.因此, 本研究从湖南某矿区筛选分离得到一株高耐砷菌株, 利用16S rDNA基因测序分析对其进行鉴定.同时, 采用单因素试验研究耐性菌吸附As3+的影响因素及规律, 通过研究等温吸附属性、吸附动力学和热力学属性, 分析亚细胞赋存特性, 并结合扫描电镜(SEM)、傅里叶红外光谱(FTIR)等技术手段, 初步探讨吸附发生的可能机理.
2 材料与方法(Materials and methods) 2.1 材料与培养基土壤样品采自湖南某矿区砷污染土壤.采样点去除5~10 cm表层土壤, 按S形随机多点混合采样法采集土样, 混匀后于4 ℃冰箱保存待用.土壤基本理化性质为:pH为5.34, 有机质为2.78 g·kg-1, 总砷含量为209 mg·kg-1.
牛肉膏蛋白胨固体培养基:牛肉膏5 g、蛋白胨10 g、NaCl 5 g、琼脂20 g、去离子水1000 mL, pH=7.0~7.2.
牛肉膏蛋白胨液体培养基:牛肉膏5 g、蛋白胨10 g、NaCl 5 g、去离子水1000 mL, pH=7.0~7.2.
筛选培养基:牛肉膏5 g、蛋白胨10 g、NaCl 5 g、琼脂20 g、亚砷酸钠(根据筛选程度添加)、超纯水1000 mL, pH为7.0左右, 121 ℃下灭菌20 min.
2.2 耐As菌株的分离称取10.0 g土样放入100 mL锥形瓶中并加入100 mL无菌水, 120 r·min-1振荡2 h, 取出静置15 min.用移液枪吸取200 μL上清液, 采用稀释涂布法接种在As3+浓度为100 mg·L-1的牛肉膏蛋白胨固体培养基上, 于28 ℃恒温培养箱培养48 h.挑选形态不同的单菌落进行分离划线, 纯化后逐步递增固体平板浓度, 筛选出高耐As菌株.
2.3 耐As菌株的分子鉴定采用Ezup柱式细菌基因组DNA抽提试剂盒(购自生工生物工程股份有限公司)提取优选菌株的总基因组DNA, 以此为模板扩增优选菌株的16S rDNA序列, 扩增产物为27F:5′-AGAGTTTGATC CTGGCTCAG-3′和1492R:5′-TACGGTTACCTTGTT ACGACTT-3′. PCR反应体系为:0.5 μL Template、2.5 μL 10×Buffer、1 μL dNTP、0.2 μL酶、0.5 μL F、0.5 μL R, 总反应体系为25 μL. PCR条件为:94 ℃预变性4 min;94 ℃变性45 s, 55 ℃退火45 s, 72 ℃延伸1 min, 共30个循环;72 ℃修复延伸10 min, 4 ℃终止反应.回收PCR扩增产物, 由生工生物工程(上海)股份有限公司完成耐As菌株的分子生物学鉴定.鉴定结果在NCBI中进行BlAST分析, 用MEGA7.0软件系统构建系统发育树.
2.4 耐As菌株生长条件优化耐As菌株生长曲线:配置200 mL牛肉膏蛋白胨液体培养基于250 mL锥形瓶中, 将培育至对数生长期的菌株以2%(V/V)的接种量接入锥形瓶中, 培养48 h, 每2 h取样用紫外可见分光光度计测定其OD600值, 以空白液体培养基为对照.
不同生长因素对耐砷菌株的影响:配置200 mL牛肉膏蛋白胨液体培养基于250 mL锥形瓶中, 将培育至对数生长期的菌株以2%(V/V)的接种量接入锥形瓶中;pH影响实验中, 控制pH分别为5.0、6.0、7.0、8.0、9.0;转速影响实验中, 控制转速分别为90、120、150、180、210 r·min-1;温度影响实验中, 控制温度分别为20、25、30、35、40 ℃;无机盐影响实验中, 控制无机盐浓度分别为0、2.5、5.0、7.5、10 g·L-1.每个处理3个重复, 培养24 h, 用紫外分光光度计测定其OD600值, 以空白液体培养基为对照.
2.5 耐As菌株对As3+的吸附特性分析 2.5.1 不同条件下耐As菌株湿菌体对As3+的吸附能力配置100 mL牛肉膏蛋白胨液体培养基于250 mL锥形瓶中, 接种已活化24 h的菌株AsT4以120 r·min-1培养. pH影响实验中, 控制溶液初始pH值分别为5.0、6.0、7.0、8.0、9.0;温度影响实验中, 控制溶液温度分别为20、25、30、35、40 ℃;培养时间影响实验中, 控制培养时间分别为6、12、24、36、48、60 h;As3+初始浓度影响实验中, 控制As3+初始浓度分别为10、50、100、150、200 mg·L-1;菌量影响实验中, 控制菌量分别为0.5%、1.0%、1.5%、2.0%、2.5%.每个处理3个重复, 离心取上清液过滤, 以空白液体培养基为对照.用原子荧光光度计测定滤液中As3+浓度.As3+的吸附率R和吸附量qe计算分别见式(1)和式(2).
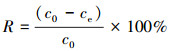
|
(1) |
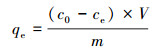
|
(2) |
式中, c0为处理前水中原有As3+浓度(mg·L-1);ce为处理后水中剩余As3+浓度(mg·L-1);V为溶液体积(mL);m为菌体质量(g).
2.5.2 不同条件下耐As菌株干菌体对As3+的吸附能力在牛肉膏蛋白胨液体培养基中分别接种高耐As菌株AsT4, 培养48 h后离心取湿菌体于80 ℃烘干至恒重, 再研磨磨细成菌粉待用.控制培养时间分别为15、30、45、60、90、120、180、300 min;干菌体投加量分别为0.1、0.2、0.5、1.0、2.0 g·L-1.温度、pH与As3+初始浓度设定同2.5.1节.若无特别说明, As3+初始浓度为100 mg·L-1, 将一定量菌体(湿菌体以菌量1%计, 干菌体以投加量0.01 g计)于自然pH、30 ℃下振荡一定时间(湿菌体为24 h, 干菌体为120 min).
2.6 耐As菌株对As的赋存特性配置一定的牛肉膏蛋白胨液体培养基, 接种已活化24 h的菌株AsT4培养48 h, 在4000 r·min-1下离心5 min收集菌株AsT4的湿菌体, 用超纯水清洗菌体再次离心.采用差速离心法分离不同的菌株细胞组分.称取菌体0.5 g, 加入20 mL提取液(0.25 mol·L-1蔗糖+50 mmol·L-1 Tris-HCl缓冲液(pH=7.5)+1 mmol·L-1二硫赤鲜糖醇), 加入液氮将其低温研磨匀浆, 匀浆后溶液于冷冻离心机于2000 r·min-1下离心1 min, 沉淀为菌株细胞壁(A1);上清液在8000 r·min-1下离心30 min, 沉淀为菌株细胞器(A2);上清液为菌株可溶组分(A3), 包括细胞质、无机离子和核糖体等.全部操作在4 ℃下进行. A1和A2转移至50 mL锥形瓶中, 每瓶分别加入5 mL硝酸并盖上弯颈小漏斗于电热板上静置过夜.次日将电热板调至160 ℃, 逐渐升温至红棕气体飘完.取出50 mL锥形瓶冷却至室温, 加入2 mL高氯酸置于电热板上.再次升温直至飘出白烟, 锥形瓶中液体变澄清, 取出锥形瓶冷却.将液体和F3转移用超纯水定容至50 mL容量瓶中, 于4 ℃冰箱冷藏待测.
2.7 吸附前后菌粉表征分析分别采用带能谱的扫描电镜(JSM-6380LV, 日本岛津仪器公司)和红外光谱(FTIR-650, 上海精密仪器仪表公司)分析吸附前后菌体微观结构、元素构成、官能团组成的变化.
3 结果与讨论(Results and discussion) 3.1 耐As菌株的分离与鉴定采用微生物纯培养方法从砷污染土样中筛选出23种耐砷能力强的菌株, 通过进一步As胁迫定向培养获得一株耐砷能力非常强的菌株, 将其命名为AsT4, 其固体平板的最小抑菌浓度为40 mmol·L-1.
在琼脂固体培养基上耐砷菌株AsT4菌落表面为红橙色、圆形、边缘整齐、表面湿润光滑, 为革兰氏阳性菌, 菌株部分生理生化特征见表 1.耐砷菌株AsT4的分子鉴定委托生工生物工程(上海)股份有限公司进行, 将所得序列在NCBI网站进行序列同源性比较, 并采用MAGE X软件构建系统发育树.如图 1所示, 耐砷菌株AsT4与多株芽孢杆菌属(Bacillus)的序列相似性达到99%, 可确定耐As菌株为芽孢杆菌属Bacillus.
| 表 1 菌株AsT4的生理生化性质 Table 1 Physiological and biochemical properties of AsT4 |
 |
| 图 1 耐砷菌株AsT4的16S rRNA系统发育树 Fig. 1 Phylogenetic tree of arsenic resistant strain AsT4 |
菌株AsT4的生长曲线见图 2.由图可知, 0~10 h为菌株AsT4生长的迟缓期, 10~24 h为生长对数期, 24~42 h为稳定期, 42 h后进入衰亡期.
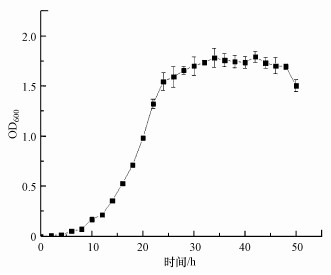 |
| 图 2 菌株AsT4生长曲线 Fig. 2 Growth curve of AsT4 |
图 3为温度、pH值、转速和NaCl浓度对菌株AsT4生长的影响.图 3a表明, 菌株AsT4在温度为20~40 ℃时皆能生长, 35 ℃时生物量最大.微生物胞内酶促反应、胞内物质电离性、细胞膜通透性等会受到pH的影响(周赓等, 2016).由图 3b可知, 菌株AsT4的最适生长pH值为7.0, 说明该菌株适宜于中性条件下生长.随着转速的增加, 菌株的生物量呈先上升后下降趋势, 转速为180 r·min-1时生物量最大(图 3c).这是因为在一定程度上增加转速可以提高培养基内的含氧量, 促进细菌生长;但过高的转速会产生较大的剪切作用从而抑制细菌生长, 同时会增加设备的损耗(郦金龙等, 2016).图 3d显示, 当NaCl浓度低于5 g·L-1时, 菌株AsT4的生长良好;而当NaCl浓度高于5 g·L-1时, 菌株生物量急剧下降.这可能是由于过高的NaCl浓度会影响微生物细胞渗透压, 造成细胞失水收缩, 不利于细菌生长.综上所述, 耐砷菌株AsT4的最适生长条件为:温度为35 ℃, pH为7.0, 转速为180 r·min-1, NaCl浓度为5 g·L-1.
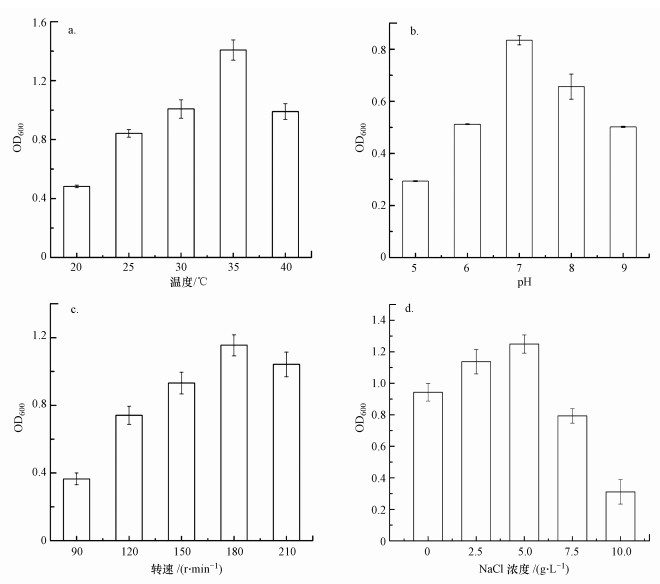 |
| 图 3 不同条件下菌株AsT4的OD600值(a.温度, b.pH, c.转速, d.NaCl浓度) Fig. 3 OD600 of AsT4 under different conditions(a.temperature, b.pH, c.rotational speed, d.NaCl concentration) |
图 4a显示, 随着时间的延长, As3+吸附率呈先增加后下降趋势, 在36 h时达到最大值48.2%.一方面细胞活性和代谢能力会随着培养时间的延长而下降;另一方面, 长时间的摇床振荡会使得与细胞表面结合的部分As3+或者细胞内的As3+被重新释放到溶液中, 从而导致吸附率降低, 这与Huang等(2014)的试验结果一致.
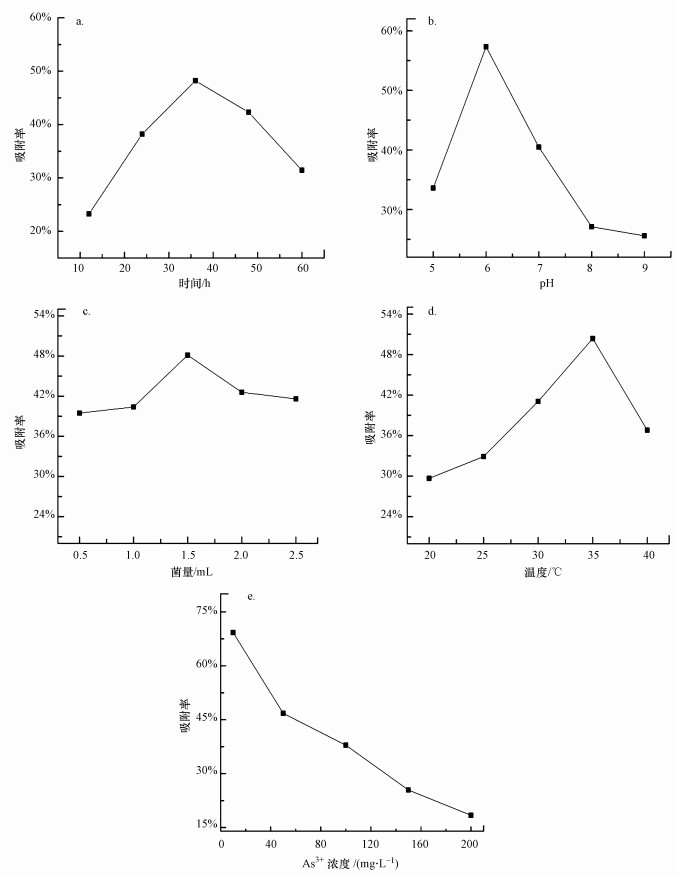 |
| 图 4 不同条件下AsT4湿菌体对As3+的吸附率(a.时间, b.pH, c.菌量, d.温度, e. As3+浓度) Fig. 4 The As3+ adsorption rate of wet strain AsT4 under different conditions(a.time, b.pH, c.dosage, d.temperature, e.As3+ concentration) |
图 4b中湿菌体吸附As3+的最适pH为6.0, 菌株AsT4对As3+的去除率达到最大值57.3%, 随着pH的进一步升高吸收量反而下降.pH值较低时, 细胞壁配体与水合氢离子结合, 形成正离子体排斥金属离子接近, 所以对砷的去除效果较差(Sharma et al., 2009);随着pH的升高, 中性物质H3AsO3与细胞壁上未质子化的氨基酸相互作用(Chaidir et al., 2015), 羧基、氨基等带负电荷的配体被暴露, 菌体表面负电荷增加, 菌体表面活性基团的N、O原子活性增强, 能吸引带正电的金属离子至细胞表面(杨亮等, 2012; 郭盾, 2015);碱性环境下, 菌株生长及其细胞活性会受到一定抑制, As3+主要为H2AsO-形式, 并呈现较强的负电性.菌体及生长底物表面所携带的羟基及其他弱酸官能团会使H2AsO-发生电离, 同时, 菌体表面所携带的负电荷对H2AsO-会产生一定的排斥作用, 溶液体系中的OH-也会与H2AsO-竞争吸收点位(Sharma et al., 2009; Prasad et al., 2013).此外, 在碱性条件下容易生成沉淀覆盖在细胞表面, 不利于吸附进行.
从图 4c可以看出, 当菌量从0.5 mL升至1.5 mL时, As3+吸附率显著提升, 当菌量超过1.5 mL时, As3+吸附率下降.吸附初期, 当AsT4菌株菌量较低时, 随着菌量的增加, 生物吸附位点数量增加, 比表面积增大, 有利于吸附进行(Mondal et al., 2007).当菌量过多时, 菌体的部分聚集会导致活性位点的重叠和有效表面积的减少, 在细胞壁表面产生一种“屏幕效应”, 致使吸附率降低(Yan et al., 2010; Giri et al., 2013).
图 4d显示, 菌株吸附As3+的最适温度为35 ℃, 此时吸附率为50.4%, 进一步升高温度吸收率急剧下降.这可能是由多种原因造成的:温度升高使得溶液粘度发生变化, As3+从菌体到溶液中的回避倾向相对增加(Meena et al., 2005; Nouri et al., 2014);升高温度会影响细菌生长及其新陈代谢, 甚至是菌体破裂从而使其表面失活或者一些活性位点被破坏(Romero-Gonzalez et al., 2005; Fan et al., 2014);由于As3+与菌体的活性位点之间的生物吸收减弱, 以及吸收过程中相邻的吸收性分子在高温下或以更高的速度运动, 从而降低了菌体活性位点的相互作用时间(Roy et al., 2014).
图 4e表明, AsT4菌株对As3+的吸附率随着As3+浓度的增加而减小, 当As3+浓度为10 mg·L-1时吸附率达到最大值69.3%.活菌对重金属的吸附包括胞内结合和胞外吸附, 当细菌的胞内结合作用达到饱和, 大量As3+被吸附在菌体表面, 同时由于相对高浓度的As3+的存在抑制了菌体的生长, 因此, As3+吸附率迅速下降;另一方面, 当胞外吸附作用也达到饱和, 此时菌体生长也严重受到抑制, 菌体对As3+的吸附率也随As3+浓度的增加而逐渐降低.
综上所述, 当菌量为1.5 mL, 溶液pH为6.0, 溶液温度为35 ℃, 培养时间为36 h, As3+初始浓度为10 mg·L-1时, 菌株AsT4对As3+的去除率最大, 可达69.3%.
3.4.2 耐砷菌株AsT4干菌体对As3+的吸附研究发现, 死细胞通常不受环境体系中有毒物质的限制, 不需要营养物质, 受环境因子影响相对较小, 就吸附某些金属而言, 死细胞对它们的吸附量比活细胞更高、更稳定.图 5为不同条件下芽孢杆菌AsT4干菌体对As3+吸附的影响, 总体趋势与湿菌体吸附As3+相同.图 5a显示, 在吸附时间为100 min时, 干菌体对As3+的吸附率最大, 此时生物吸附剂表面的活性位点几乎已经完全饱和;若进一步延长时间, 脱附作用开始显现, 吸附率开始下降.由图 5b可知, 随着pH的增大, 菌粉对As3+的吸附率呈先升高后降低趋势, 当pH为7.0时吸附率达到最大值46.5%.pH值较低时, 溶液中的H+会与—COOH、—OH等活性基团结合, 使得可以吸附As3+的活性位点减少;pH较高时, 有可能产生氢氧化物沉淀, 降低吸附效果(郭盾, 2015).图 5c结果表明, 干菌体投加量较低时吸附率与投加量成正比, 这可解释为有效吸附位点的增加导致吸附率的提升;当投加量为0.5 g·L-1时, 吸附率为55.6%, 此后吸附率随投加量的增加而递减, 这可能是因为高剂量的吸附剂会导致结合位点之间的相互干扰.温度一般通过影响吸附剂的稳定性从而改变吸附剂和离子之间的相互作用, 图 5d中AsT4菌粉适宜的吸附温度为35 ℃, 吸附率达60.8%.由图 5e可知, 菌粉对As3+的吸附率随着As3+初始浓度的增加呈下降趋势.当浓度为10 mg·L-1时吸附率达到72.8%, 吸附量为72.8 mg·g-1.综上所述, 外界环境因素对芽孢杆菌AsT4干菌粉吸附As3+的影响相对较小, 说明可能主要通过影响细胞表面组分和性质来影响对重金属的吸附效果.芽孢杆菌AsT4干菌粉吸附As3+的适宜条件为:吸附时间90 min, pH=7.0, 投加量0.5 g·L-1, 温度35 ℃, As3+初始浓度为10 mg·L-1, 此条件下的吸附率为72.8%.
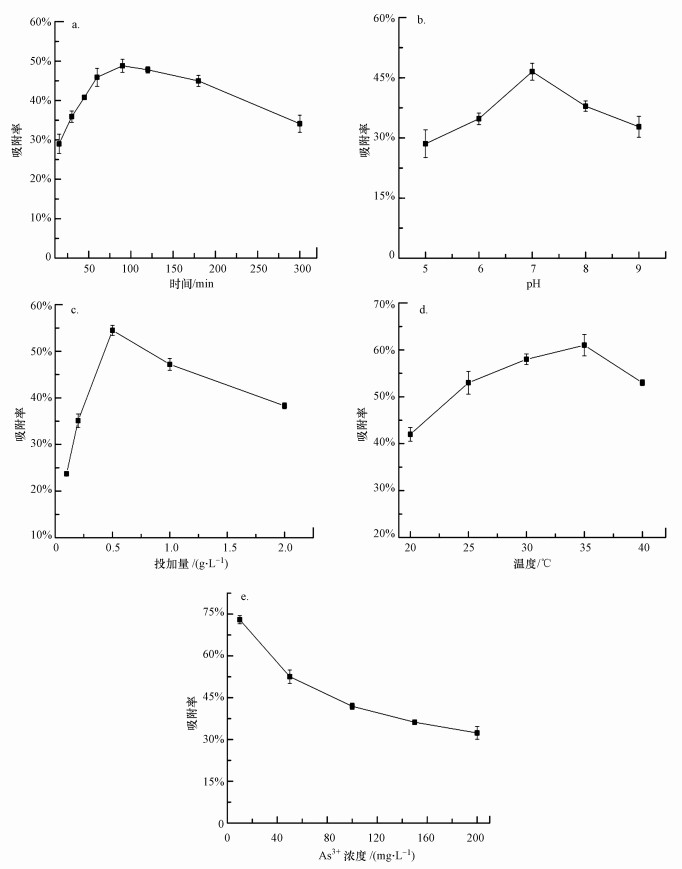 |
| 图 5 不同条件下AsT4干菌体对As3+的吸附率(a.时间, b.pH, c.菌量, d.温度, e.As3+浓度) Fig. 5 The As3+ adsorption rate of dry strain AsT4 under different conditions(a.time, b.pH, c.dosage, d.temperature, e.As3+ concentration) |
本文分别对芽孢杆菌AsT4湿菌体和干菌体吸附As3+的能力进行了研究, 发现时间、pH、温度、As3+浓度和投加量这5个因素对两者的影响都十分明显, 但与湿菌体相较而言, 前4个因素对干菌体的影响相对较弱.湿菌体吸附As3+的最适pH为6.0, 在弱酸条件下吸附率为33.6%~57.3%;干菌体吸附As3+的最适pH为7.0, 在中性或碱性条件下吸附效果均较好, 吸附率可达32.8%~46.5%.当pH由6.0增至9.0时, 干、湿菌体对As3+的吸附率分别变化了29.5%和55.3%.干、湿菌体吸附As3+的最适温度均为35 ℃, 此时吸附率分别为60.8%和50.4%, 当温度升高至40 ℃时, 吸附率分别降低了13.1%和40.9%.芽孢杆菌AsT4干菌体和湿菌体均适合处理低浓度含As3+废水, 当As3+浓度为10~100 mg·L-1, 吸附率分别可达41.2%~72.8%、37.9%~69.3%, 当As3+浓度为200 mg·L-1时, 吸附率分别降低了62.4%和84.4%.总体而言, 干菌体对As3+的吸附受环境因素的影响较小, 更适用于实际应用.表 2为不同耐砷菌对As3+的吸附性能比较.由表 2可知, 本文筛选得到的耐砷芽孢杆菌能够适应较高的温度, 且对砷的去除效果较好.
| 表 2 不同耐砷菌对As3+的吸附性能比较 Table 2 Comparison of As3+ adsorption properties of different arsenic-resistant bacteria |
用Langmuir(式(3))与Freundlich(式(4))等温吸附模型, 对30 ℃、不同As3+浓度下芽孢杆菌AsT4湿菌体和干菌体对As3+的吸附数据进行拟合.拟合曲线如图 6所示, 拟合等温吸附参数见表 3.
 |
| 图 6 耐As菌株AsT4对As3+的吸附等温模型(a.Langmuir, b.Freundlich) Fig. 6 Langmuir(a) and Freundlich(b) adsorption model on the As3+ adsorption of strain AsT4 |
| 表 3 菌株AsT4吸附As3+的吸附等温参数(30 ℃) Table 3 Biosorption isotherm parameters for As3+ onto strain AsT4 |
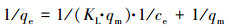
|
(3) |
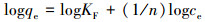
|
(4) |
式中, qe为芽孢杆菌AsT4对As3+的平衡吸附量(mg·g-1);ce为吸附平衡溶液中As3+浓度(mg·L-1);KL为Langmuir等温方程常数;qm为理论最大吸附量(mg·g-1);KF与n均为Freundlich等温方程常数.
从表 3可以看出, Langmuir和Freundlich这两种等温吸附模型对芽孢杆菌AsT4湿菌体吸附As3+的R2值分别为0.9964和0.9357, 对干菌体吸附As3+的R2值分别为0.9949和0.9454.因此, 无论是湿菌体还是干菌体, Langmuir等温吸附模型更适合描述菌株AsT4对As3+的等温吸附过程.
通常可以根据Freundlich吸附模型中吸附常数n值的大小判断吸附过程的难易程度(Chen et al., 2010), n值越大, 表明吸附性能越好.一般认为n < 0.5, 不利于吸附;n >1, 优惠吸附;2<n < 10, 有利吸附.此外, 也可通过计算RL值(RL=1/(1+KLc0))来判断吸附的难易程度, 一般认为RL=0, 吸附过程不可逆;0<RL<1, 吸附容易进行;RL=1, 吸附反应呈线性关系;RL>1, 吸附过程很难进行.由表 3可知, 无论是湿菌体还是干菌体, n值均大于1;通过计算可知, 30 ℃时不同浓度下湿菌体的RL值为0.07~0.61, 干菌体的RL值为0.08~0.64, 均在0~1范围内, 这说明耐砷菌株AsT4对As3+的吸附容易进行, 且随着As3+浓度的增加RL逐渐减小, 说明提高初始As3+浓度更有利于吸附, 这与砷离子浓度增加, 菌株的吸附容量增加的实验结果一致.通过Langmuir等温模型拟合计算可知, 干、湿菌株对As3+的吸附容量分别为555.6 mg·g-1和10.9 mg·g-1, 与真实测得的546.8 mg·g-1和10.1 mg·g-1较为接近.
3.5.2 菌株AsT4对As3+的吸附动力学特性研究为进一步了解耐砷菌株AsT4对As3+的吸附行为, 采用拟一级动力学(式(5))、拟二级动力学(式(6))、Elovich方程(式(7))及颗粒内扩散方程((式(8))(操艳兰等, 2016), 对30 ℃、不同吸附时间(湿菌体:12、24、28、32、36、40 h;干菌体:15、30、45、60、90、120 min)下菌株AsT4吸附As3+的试验数据进行拟合, 所得参数结果列于表 4.
| 表 4 菌株AsT4吸附As3+的动力学参数(30 ℃) Table 4 Kinetic parameters for As3+ adsorption onto strain AsT4 |
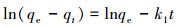
|
(5) |

|
(6) |
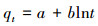
|
(7) |
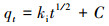
|
(8) |
式中, qt为某一时刻下对As3+的吸附量(mg·g-1);qe为反应平衡时的平衡吸附量(mg·g-1);t为时间(min);k1、k2分别是拟一级吸附反应速率常数(min-1)、拟二级吸附反应速率常数(g·mg-1·min-1);ki为颗粒内扩散方程常数(mg·g-1·min-1/2);C为方程截距, 无量纲.
由表 4可知, 拟二级动力学方程能够较好地描述耐砷菌株AsT4对As3+的吸附, 干、湿菌体的拟合度R2分别为0.9981和0.9951.实际测定的吸附容量(qe湿=12.2 mg·g-1;qe干=489.1 mg·g-1)与理论吸附容量(qe湿=19.9 mg·g-1;qe干=526.3 mg·g-1)较为接近, 且理论值高于实测值.外扩散、内扩散及吸附物与活性位点相互作用会影响大多数吸附过程.从颗粒内扩散方程参数可见, 方程截距C>0, 表明qt-t1/2图不会经过原点, 这说明内扩散不是决定吸附速率的关键步骤.本次吸附试验是在摇床振荡条件下进行的, 由此可以排除外扩散对吸附速率的影响.因此, As3+与微生物表面吸附位点之间的相互作用或许是影响吸附的关键步骤.
3.5.3 菌株AsT4对As3+的热力学特征吸附热力学参数的计算方法较多, 本研究通过ln(qe/ce)对qe做图获取热力学平衡常数kd(L·g-1), 计算可得ΔGo, 再以ln kd对1/T作图, 通过斜率和截距计算ΔHo和ΔSo, 具体方程见式(9)~(10)(周利民等, 2006).
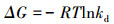
|
(9) |
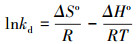
|
(10) |
式中, R为热力学常数, 取8.314 J·mol-1·K-1;T为绝对温度(K);ΔGo为吸附标准自由能(kJ·mol-1);ΔHo为吸附标准焓变(kJ·mol-1);ΔSo为吸附的标准熵变(J·mol-1·K-1).
由表 5可见, 无论是湿菌体还是干菌体, 不同温度条件下的ΔGo均为负值, 这说明耐砷菌株AsT4对As3+的吸附是自发进行的, 且随着温度的升高, ΔGo的绝对值增大, 自发性增强, 说明升温对整个吸附过程有利.不同温度下的吸附自由能在-20~0 kJ·mol-1的范围内, 表明静电作用在吸附过程中起主要作用(Ji et al., 2011). ΔHo>0说明菌株AsT4对As3+的吸附过程是吸热反应, ΔSo>0表明微生物与溶液界面的自由能增加.
| 表 5 菌株AsT4吸附As3+的热力学参数(20~35 ℃) Table 5 Thermodynamic parameters for As3+ adsorption onto strain AsT4 |
不同培养时间和不同As3+浓度胁迫下As在菌株AsT4亚细胞组分中的含量及分配如图 7所示.AsT4各亚细胞组分对As赋存能力排序为:可溶性组分>细胞壁>细胞器, 这说明耐性菌AsT4对As3+的生物吸附和累积以胞内累积和细胞壁富集为主.随着As3+浓度的增加, 胞内吸收也随之增加, 而当时间递增时, 胞内吸收反而下降.活细胞吸收重金属通常通过细胞表面结合、胞外积累和胞内积累3种途径.基于细胞的新陈代谢, 表面结合活细胞和死细胞均可能发生, 但胞外和胞内积累只存在于活细胞中, 所以培养时间增加时, 细胞内的As3+含量会变少.此外, 细胞死亡所导致的细胞内容物外溢也可能是胞内As3+含量减少的原因之一.不同As3+浓度对各亚细胞组分赋存As的影响不大, As3+浓度增加时细胞器和可溶性组分的As3+含量有所增长, 有可能是由于As3+浓度变高时菌株细胞壁的吸附位点趋于饱和从而将As3+运输到细胞内以实现金属分区(Sun et al., 2015).不同于As5+, As3+目前进入细胞内的渠道较少, 可通过水甘油通道蛋白GlpF(Aquaglyceroporins)进入细胞内(吕常江等, 2012).GlpF属于水通道蛋白, 其可以转运多种营养物质如甘油等, 是一个多功能转运蛋白.由于菌株间活性的差异或菌株间扩散、吸附、螯合、络合及微沉淀机制的输入机制的差异(Li et al., 2019), 不同菌株细胞As3+赋存能力有所差异, 尚需进一步试验验证.
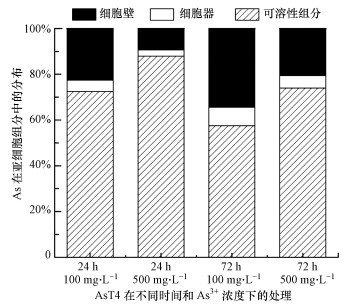 |
| 图 7 菌株AsT4亚细胞组分在不同时间和As3+浓度下的As分布 Fig. 7 The As content distribution of bacterial strain AsT4 subcellular fraction under different time and As3+ concentration |
由图 8a和图 8b可知, 未吸附As3+时, 菌粉表面较为光滑, 吸附As3+后, 菌粉表面褶皱增多, 团粒变大.此外, 通过能谱分析可知, 在无As处理中AsT4菌粉表面存在C、O、Na、K、Cl、P峰, 各元素的原子百分比分别为69.87%、26.90%、1.55%、0.72%、0.62%、0.34%, 而在含As处理中的菌粉存在C、O、Na、As峰, 各元素的原子百分比分别为66.21%、31.31%、2.15%和0.34%, 说明As替换了菌粉表面原有的K, 并可能与P元素大量螯合, 这与红外光谱分析结果一致.AsT4菌粉的活性基团FTIR表征分析结果见图 9.由图可知, —OH的最大峰峰型变窄, AsT4菌粉的峰值由3296.78 cm-1转移至3300.13 cm-1, 这体现了As3+与—OH的络合作用, 而—CHO(2927.21 cm-1和2960.48 cm-1)与—COOH(1654.93 cm-1和1647.99 cm-1)功能团峰强则均有所增加;AsT4菌粉的峰值1542.61、1452.53 cm-1处为细胞蛋白质酰胺带, 受—CN伸展振动与—NH弯曲振动影响显著, 菌粉吸附As3+后, 峰强分别转移至1543.26、1452.80 cm-1;在峰值1057.67 cm-1处, 菌粉吸附As3+后峰值转移至1061.33 cm-1, 这可能与As与细胞壁中多糖组分中的C—O—C的结合有关;此外, 菌粉的两个弱吸收峰强分别从659.42 cm-1和544.31 cm-1转移至615.35 cm-1和533.02 cm-1, 对应多糖的O—P—O的剪接振动.因此, 以上的光谱变化可能是As3+与菌粉上的—OH、—COOH、—NH与酰胺等基团相互作用的结果.
 |
| 图 8 菌株AsT4菌粉吸附As3+前后的扫描电镜与能谱图(a.吸附前, b.吸附后) Fig. 8 SEM-EDX images of the bacteria powder of the strain AsT4(a.without sorption of As3+; b.sorption of As3+) |
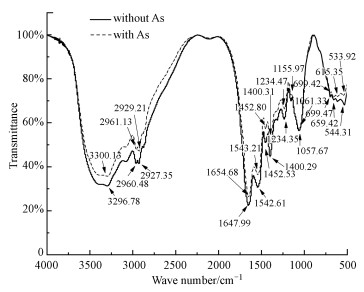 |
| 图 9 菌株AsT4菌粉吸附As3+前后的红外光谱图 Fig. 9 FTIR spectra of the bacteria powder of the strain AsT4 before and after sorption of As3+ |
1) 本研究从富As土壤中分离筛选出一株能够耐受40 mmol·L-1 As3+的细菌, 经过形态学、生理生化和分子鉴定, 该菌株被鉴定为芽孢杆菌属(Bacillus sp.), 命名为Bacillus sp. AsT4.
2) 耐砷芽孢杆菌AsT4的优化培养条件为:温度为35 ℃, pH为7, 转速为180 r·min-1, NaCl浓度为5 g·L-1.
3) 芽孢杆菌湿菌体吸附As3+的优化条件为:菌量1.5 mL, 溶液pH=6, 温度35 ℃, 培养时间36 h, As3+初始浓度10 mg·L-1, 此条件下的去除率为69.3%.干菌体吸附As3+的优化条件为:吸附时间90 min, pH=7.0, 投加量0.5 g·L-1, 温度35 ℃, As3+初始浓度10 mg·L-1, 此条件下的吸附率为72.8%.说明芽孢杆菌AsT4具有较高的除砷性能, 在砷的废水处理中具有重要的应用价值.
4) 30 ℃时, 无论是湿菌体还是干菌体, Langmuir等温吸附模型和拟二级动力学方程均能更好地描述耐砷芽孢杆菌AsT4对As3+的吸附过程;且吸附容易进行, 是自发、墒增的吸热过程.赋存特性研究表明, 湿菌体对As3+的生物吸附和累积以胞内累积和细胞壁富集为主.表征结果显示, 干菌体表面的羧基、羟基、胺基等活性基团可能在吸附过程中起主要作用.
Abdul K S, Jayasinghe S S, Chandana E P, et al. 2015. Arsenic and human health effects:A review[J]. Environmental Toxicology and Pharmacology, 40(3): 828-46. DOI:10.1016/j.etap.2015.09.016 |
Aguilar N C, Faria M C S, Pedron T, et al. 2020. Isolation and characterization of bacteria from a brazilian gold mining area with a capacity of arsenic bioaccumulation[J]. Chemosphere, 240: 124871. DOI:10.1016/j.chemosphere.2019.124871 |
Battaglia-Brunet F, Joulian C, Garrido F, et al. 2006. Oxidation of arsenite by Thiomonas strains and characterization of Thiomonas arsenivorans sp.nov[J]. Antonie Van Leeuwenhoek, 89(1): 99-108. DOI:10.1007/s10482-005-9013-2 |
操艳兰, 朱能武, 石超宏, 等. 2016. 鲍希瓦氏菌吸附Au3+的影响因素及机理研究[J]. 环境科学学报, 36(6): 1962-1970. |
Chaidir Z, Jesica S, Zein R, et al. 2015. Biosorption of Cadmium(Ⅱ) Ion from aqueous solution using living cell and non-living cell microalga scenedesmus dimorphus[J]. Resarch Journal of Pharmaceutical Biological and Chemical Sciences, 6(2): 1972-1980. |
Chen H, Dai G, Zhao J, et al. 2010. Removal of copper(Ⅱ) ions by a biosorbent-Cinnamomum camphora leaves powder[J]. Journal of Hazardous Materials, 177(1/3): 228-236. |
陈朋, 王宁波, 李素岳, 等. 2014. 砷的生物吸附研究进展[J]. 生物技术进展, 4(3): 177-181. DOI:10.3969/j.issn.2095-2341.2014.03.05 |
Dey U, Chatterjee S, Mondal N K. 2016. Isolation and characterization of arsenic-resistant bacteria and possible application in bioremediation[J]. Biotechnology Reports, 10: 1-7. |
Fan J, Okyay T O, Rodrigues D F. 2014. The synergism of temperature, pH and growth phases on heavy metal biosorption by two environmental isolates[J]. Journal of Hazardous Materials, 279: 236-243. DOI:10.1016/j.jhazmat.2014.07.016 |
Giri A K, Patel R K, Mahapatra S S, et al. 2013. Biosorption of arsenic(Ⅲ) from aqueous solution by living cells of Bacillus cereus[J]. Environmental Science and Pollution Research, 20(3): 1281-1291. DOI:10.1007/s11356-012-1249-6 |
郭盾.2015.高耐砷菌株的筛选及其除砷性能初步研究[D].昆明: 云南大学
|
Huang F, Guo C L, Lu G N, et al. 2014. Bioaccumulation characterization of cadmium by growing Bacillus cereus RC-1 and its mechanism[J]. Chemosphere, 109: 134-142. DOI:10.1016/j.chemosphere.2014.01.066 |
Ji Y L, Gao H, Sun J S, et al. 2011. Experimental probation on the binding kinetics and thermodynamics of Au(Ⅲ) onto Bacillus subtilis[J]. Chemical Engineering Journal, 172(1): 122-128. DOI:10.1016/j.cej.2011.05.077 |
李宝花.2018.耐砷菌筛选及其胞外聚合物除砷的特性研究[D].湘潭: 湘潭大学
|
郦金龙, 朱运平, 滕超, 等. 2016. 解淀粉芽孢杆菌11568产柚苷酶发酵条件的优化[J]. 中国食品学报, 16(7): 80-89. |
Li J, Liu Y R, Zhang M L, et al. 2019. Sorption mechanism and distribution of cadmium by different microbial species[J]. Journal of Environmental Management, 237: 552-559. |
Li Y, Wang D, Liu Y, et al. 2017. A predictive risk model of groundwater arsenic contamination in China applied to the Huai River Basin, with a focus on the region's cluster of elevated cancer mortalities[J]. Applied Geochemistry, 77(2017): 178-183. |
吕常江, 赵春贵, 杨素萍, 等. 2012. 紫色非硫细菌的砷代谢机制[J]. 微生物学报, 52(12): 1497-1507. |
Meena A K, Mishra G K, Rai P K, et al. 2005. Removal of heavy metal ions from aqueous solutions using carbon aerogel as an adsorbent[J]. Journal of Hazardous Materials, 122(1/2): 161-170. |
Mohd Bahari Z, Ali Hamood Altowayti W, Ibrahim Z, et al. 2013. Biosorption of As(Ⅲ) by non-living biomass of an arsenichypertolerant Bacillus cereus strain SZ2 isolated from a gold mining environment:equilibrium and kinetic study[J]. Applied Biochemistry and Biotechnology, 171(8): 2247-2261. DOI:10.1007/s12010-013-0490-x |
Mondal P, Balomajumder C, Mohanty B. 2007. A laboratory study for the treatment of arsenic, iron, and manganese bearing ground water using Fe3+ impregnated activated carbon:effects of shaking time, pH and temperature[J]. Journal of Hazardous Materials, 144(1/2): 420-426. |
Nouri L, Ghodbane I, Hamdaoui O, et al. 2007. Batch sorption dynamics and equilibrium for the removal of cadmium ions from aqueous phase using wheat bran[J]. Journal of Hazardous Materials, 149(1): 115-125. DOI:10.1016/j.jhazmat.2007.03.055 |
Patel P C, Goulhen F, Boothman C, et al. 2007. Arsenic detoxification in a Pseudomonad hypertolerant to arsenic[J]. Archives of Microbiology, 187(3): 171-183. DOI:10.1007/s00203-006-0182-9 |
Podder M S, Majumder C B. 2017. Bioremediation of As(Ⅲ) and As(V) from wastewater using living cells of Bacillus arsenicus MTCC 4380[J]. Environmental Nanotechnology, Monitoring & Management, 8: 25-47. |
Prasad K S, Ramanathan A L, Paul J, et al. 2013. Biosorption of arsenite(As3+) and arsenate(As5+) from aqueous solution by Arthrobacter sp. biomass[J]. Environmental technology, 34(19): 2701-2708. DOI:10.1080/09593330.2013.786137 |
邱丽娟, 吴攀, 张翅鹏, 等. 2018. 高砷煤矿污染稻田水稻对砷的吸收与赋存特征研究[J]. 生态环境学报, 27(7): 1292-1297. |
Rodríguez-Lado L, Sun G, Berg M, et al. 2013. Groundwater arsenic contamination throughout China[J]. Science, 341(6148): 866-868. DOI:10.1126/science.1237484 |
Romero-Gonzalez J, Peralta-Videa J R, Rodrıguez E, et al. 2005. Determination of thermodynamic parameters of Cr(VI) adsorption from aqueous solution onto Agave lechuguilla biomass[J]. The Journal of chemical thermodynamics, 37(4): 343-347. DOI:10.1016/j.jct.2004.09.013 |
Roy P, Mondal N K, Das K. 2014. Modeling of the adsorptive removal of arsenic:A statistical approach[J]. Journal of Environmental Chemical Engineering, 2(1): 585-597. DOI:10.1016/j.jece.2013.10.014 |
Sharma V K, Sohn M. 2009. Aquatic arsenic:Toxicity, speciation, transformations, and remediation[J]. Environment International, 35(4): 743-759. DOI:10.1016/j.envint.2009.01.005 |
Singh R, Singh S, Parihar P, et al. 2015. Arsenic contamination, consequences and remediation techniques:A review[J]. Ecotoxicology and Environmental Safety, 112: 247-270. DOI:10.1016/j.ecoenv.2014.10.009 |
Su C. 2014. A review on heavy metal contamination in the soil worldwide:situation, impact and remediation techniques[J]. Environmental Skeptics and Critics, 3(2): 24. |
Sun J, Zou X, Xiao T, et al. 2015. Biosorption and bioaccumulation of thallium by thallium-tolerant fungal isolates[J]. Environmental Science and Pollution Research, 22(21): 16742-16748. DOI:10.1007/s11356-015-4859-y |
Teclu D, Tivchev G, Laing M, et al. 2008. Bioremoval of arsenic species from contaminated waters by sulphate-reducing bacteria[J]. Water Research, 42(19): 4885-93. DOI:10.1016/j.watres.2008.09.010 |
吴丹, 张志鹏, 马玉超. 2017. 铅锌矿区耐砷细菌的分离、鉴定及性质研究[J]. 生物技术通报, 33(5): 210-218. |
吴佳, 谢明吉, 杨倩, 等. 2011. 砷污染微生物修复的进展研究[J]. 环境科学, 32(3): 817-824. |
Yan L, Yin H, Zhang S, et al. 2010. Biosorption of inorganic and organic arsenic from aqueous solution by Acidithiobacillus ferrooxidans BY-3[J]. Journal of Hazardous Materials, 178(1/3): 209-217. |
杨亮, 郝瑞霞, 吴沣, 等. 2012. 耐受铅真菌的筛选及其对Pb2+吸附的初步研究[J]. 环境科学学报, 32(10): 2366-2374. |
杨婷婷, 柏耀辉, 梁金松, 等. 2016. 微生物对砷的氧化还原竞争[J]. 环境科学, 37(2): 609-614. |
余天红, 黎华寿. 2014. 砷污染土壤微生物修复机制及其研究进展[J]. 环境污染与防治, 36(12): 77-82. DOI:10.3969/j.issn.1001-3865.2014.12.017 |
Zakaria A.M. 2001. Removal of cadmium and manganese by a non-toxic strain of the freshwater cyanobacterium Gloeothece magna[J]. Water Research, 35(18): 4405-4409. DOI:10.1016/S0043-1354(01)00160-9 |
周赓, 邓成刚, 曹林友, 等. 2016. 一株耐镉细菌的筛选、鉴定与性质研究[J]. 化学与生物工程, 33(3): 43-47. DOI:10.3969/j.issn.1672-5425.2016.03.012 |
周利民, 王一平, 刘峙嵘. 2006. 羧甲基化壳聚糖-Fe3O4纳米粒子的制备及对Zn2+的吸附行为[J]. 物理化学学报, 22(11): 134-1346. |
 2020, Vol. 40
2020, Vol. 40


