2. 挥发性有机物污染治理技术与装备国家工程实验室, 广州 510006;
3. 广东省大气环境与污染控制重点实验室, 广州 510006;
4. 广东省环境风险防控与应急处置工程技术研究中心, 广州 510006
2. National Engineering Laboratory for VOCs Pollution Control Technology and Equipment, Guangzhou 510006;
3. Guangdong Provincial Key Laboratory of Atmospheric Environment and Pollution Control(SCUT), Guangzhou 510006;
4. Guangdong Provincial Engineering and Technology Research Centre for Environmental Risk Prevention and Emergency Disposal, Guangzhou 510006
随着大气中CO2浓度的逐年增加, 如何利用这些廉价且无毒的碳资源生产高能或高附加值化学品从而达到减排的目的引起了众多科学家的关注, 其中, 由CO2加氢合成甲醇(CO2+3H2= CH3OH+H2O)是目前被认为较有前景的CO2减排方法之一(Liu et al., 2003; Ma et al., 2009).该反应具有重要的工业意义, 产物甲醇既可以用于合成其它烃类和高附加值产品, 又可以直接用作甲醇燃料电池(DMFC)或内燃机的燃料, 从而提供了一种有效的能量存储方式(Olah et al., 2006).Cu-ZnO-Al2O3催化剂是合成气加氢制甲醇的商业催化剂, 用于CO2加氢制甲醇时, 其催化性能虽然明显优于已报道的其它类型催化剂, 但其甲醇最高产率仍然很低(Bando et al., 1997; Jamil et al., 2000; Posada-Pérez et al., 2016; Kattel et al., 2017).这种相对较好的催化性能主要是由于Cu-ZnO之间的强相互作用引起的协同效应, 因此, 选择合适的具有强金属载体相互作用的Cu基金属催化剂有可能进一步提高甲醇的产率(Graciani et al., 2014; Kattel et al., 2017).研究表明, 在负载量一定的情况下, 利用可还原性的金属氧化物作为载体(如ZnO、TiO2、CeO2等)表现出来的催化性能普遍优于惰性载体(如SiO2等)(Bando et al., 1997; Karelovic et al., 2015; Kattel et al., 2017; Wang et al., 2020), 如Cu/ZrO2和Cu/CeO2催化剂都表现出了良好的CO2活化和加氢能力(Graciani et al., 2014; Larmier et al., 2017).Bando等(1997)的研究结果也表明, 与Cu/Al2O3和Cu/SiO2相比, Cu/TiO2有更高的催化性能, 这主要是因为可还原性氧化物载体可以更加有效地吸附活化CO2且与金属的协同效应更强.此外, Liu等(2016b)的研究表明, 调变TiO2载体使其暴露出更多的{001}晶面则更有利于生成Ti3+, 载体对CO2的吸附能力会更强, 也更有利于CO2的转化.因此, 以高暴露{001}晶面的TiO2为载体负载Cu的催化剂表现出更好的CO2加氢制甲醇性能(Bao et al., 2018).综上所述, 选择能够有效吸附活化CO2的可还原性金属氧化物载体有利于提高CO2加氢制甲醇的产率.
但有关如何进一步提高Cu/TiO2催化剂催化CO2加氢制甲醇性能的研究仍然较少.目前, 仅有Liu等(2016a)在合成Cu/TiO2催化剂的过程中尝试引入MgO助剂来修饰TiO2, 结果发现, MgO的引入有效提高了载体上中强碱性活性位点的数量和甲醇产率.然而, 也有报道称金属Cu与可还原性金属氧化物载体间存在电子转移和相互作用(Barbera et al., 2008; Yao et al., 2014; Kattel et al., 2017; Wang et al., 2020), 这有利于提高金属与载体之间的协同效应, 增强二者界面上的活性位点数量(Arena et al., 2009; Lei et al., 2015; Karelovic et al., 2015; Wang et al., 2020);还可以增强碱性中心位点的碱性, 降低CO2加氢到甲醇的活化能, 从而达到提升催化性能的目的(Thomas et al., 2014).因此, 提高金属与可还原性金属氧化物载体间的强相互作用有望进一步提高Cu基催化剂活化CO2的能力和甲醇产率.而且Martin等(2015)研究发现, 向Cu基催化剂引入少量的贵金属Au, 由于Au的吸电子作用从而能增强Cu与载体间的电子转移和相互作用(Martin et al., 2015).Pt与Au都是贵金属, 因此, 向Cu/TiO2催化剂引入少量贵金属Pt也可能提高金属与载体间的相互作用, 从而进一步提高金属与载体界面上的活性位点数量以达到提升催化性能的目的.进一步文献调研发现,在TiO2载体上负载贵金属Pt,Pt与可还原性的载体产生强相互作用且电子由载体向Pt颗粒迁移(Colmenares et al., 2011);这可以促进载体表面缺陷位的生成(Peng et al., 2018);Pt与氧化物的缺陷活性位点之间存在的协同效应也有助于提高催化剂的催化性能(Kattel et al., 2016).此外, 对于Cu/TiO2催化剂, 表面氧空位多的载体在一定温度条件下也有利于Cu掺入TiO2中, 进而形成更多的Ti3+并进一步提高CO2的吸附活化和转化(Xu et al., 1998; Navas et al., 2014; Jia et al., 2017).
因此, 本文将Pt引入Cu/TiO2催化剂中, 在高暴露{001}晶面的TiO2上同时负载Cu和Pt, 并采用XRD、SEM、XPS、EPR、Raman、H2-TPR、CO2-TPD等表征手段来探究还原后催化剂中金属与载体间的相互作用及活性位点数量的变化情况, 进而揭示金属Pt的引入使Cu/TiO2催化剂对CO2吸附活化和催化性能有所改善的原因.
2 实验部分(Experiment) 2.1 化学试剂氢氟酸(HF40%, AR)、钛酸四丁酯(Ti(O-Bu)4, AR)、三水合硝酸铜(Cu(NO3)2 · 3H2O)、无水乙醇(CH3CH2OH)、硼氢化钠(NaBH4)、去离子水、四合氨硝酸铂(Pt(NH3)4(NO3)2).
2.2 催化剂的制备 2.2.1 纳米片TiO2{001}的制备用移液枪移取10 mL钛酸四丁酯放入100 mL聚四氟乙烯内衬中, 并取2 mL HF放入该内衬中, 然后密封于不锈钢釜体中, 置于180 ℃烘箱水热24 h, 最后用去离子水和无水乙醇洗涤, 所得白色固体80 ℃干燥12 h.
2.2.2 Pt-Cu/TiO2催化剂的制备称取一定量Cu(NO3)2 · 3H2O、Pt(NH3)4(NO3)2溶于去离子水中, 然后加入TiO2纳米片并充分搅拌分散;随后加入过量的NaBH4, 密封搅拌4 h、抽滤, 80 ℃下干燥黑色固体12 h;接着将干燥后的催化剂以2 ℃ · min-1的速率升至350 ℃干空焙烧4 h.用此方法制备负载量为0.5%的Pt催化剂(0.5P)、负载量为10%的Cu催化剂(10C), 以及Pt负载量为0.5%, Cu负载量分别为5%、10%、15%的催化剂, 并分别记为5CP、10CP、15CP.
2.3 催化剂的表征BET测定采用美国ASAP 2020N全自动比表面积及孔隙分析仪, 以N2为吸附质, 于-196 ℃条件下进行.XRD测试使用德国Bruker的X射线衍射仪, 扫描范围:2θ=20°~80°.SEM观察在德国Zeiss扫描电子显微镜上进行, 使用Nano Measurer1.2软件测量粒径.H2-TPR测试在美国Micromeritics化学吸附仪上进行, 用5%H2/Ar还原, 在线MS(Hiden Analytical, HPR 20)检测.XPS测试在美国Thermo Scientific EscaLab Xi+型X射线光电子能谱仪上进行.EPR分析在Bruker A300光谱仪上进行, 选择的微波频率为9.48 GHz, X波段, 调制频率为100 kHz.Raman表征在法国HYJ拉曼光谱仪上进行, 采用532 nm的单频率激发谱线.CO2-TPD分析在美国Micromeritics化学吸附仪上进行, 300 ℃下还原4 h, 降温至50 ℃, 在20%CO2/Ar中吸附1 h, 随后He吹扫并进行升温脱附, 利用在线MS检测.
2.4 催化剂活性评价CO2加氢反应在一个高压固定床连续流动反应器-气相色谱仪(岛津GC- 2014C)组合系统上进行.将0.5 g催化剂装填于不锈钢反应管的恒温区, 用石英砂填充其他空间并固定.5%H2/Ar气体流速为30 mL · min-1, 以2 ℃ · min-1的速率升至300 ℃还原4 h;降至常温后切换到反应气进行升压反应.反应条件为:WHSV=3600 mL · g-1 · h-1, V(H2):V(CO2):V(N2)=69:23:8, 气体流速为30 mL · min-1, 反应温度为200~300 ℃.CO2转化率用N2内标法得到, 产物选择性用“C基归一法”计算(黄春蕾等, 2019).
3 结果与讨论(Results and discussion) 3.1 催化剂的表征 3.1.1 BET、XRD和SEM表征利用N2吸脱附仪得出各催化剂还原后的比表面积和孔容, 由表 1可知, 各催化剂的比表面积相近且均在47 m2 · g-1左右.通过ICP所测催化剂的金属实际负载量与理论负载量如表 1所示, 其中, Pt的负载量大致相近.图 1所示为所有催化剂在经过氢气还原之后的XRD图, 各催化剂在2θ=25.3°、36.9°、37.8°、38.6°、48.0°、53.9°、55.1°、62.7°和70.3°处的衍射峰可归属为锐钛矿TiO2的衍射峰;谱图没有在2θ=40.7°、47.3°和69.3°处显示Pt-Cu合金的衍射峰, 也未在2θ=39.8°处显示Pt的衍射峰, 说明CP催化剂没有形成合金并且Pt高度分散.此外, 催化剂在2θ=43.3°、50.4°和74.1°处出现的衍射峰可归属于Cu(111)、(200)和(220)的衍射峰(Bao et al., 2018).与未添加Pt的催化剂(10C)相比, CP催化剂中Cu的衍射峰未发生明显位移, 这说明CP催化剂中Cu的晶格没有发生明显变化.利用谢乐公式以Cu(111)衍射峰计算了Cu晶粒的平均尺寸, 结果见表 1.随着Cu负载量的增加, 催化剂5CP、10CP、10C和15CP中Cu晶粒尺寸分别为11、12、13和19 nm, 计算所得Cu粒径与SEM图(图 2)中的统计结果一致.与单独负载Cu的10C催化剂相比, CP催化剂(10CP)中Cu的分散度得更高, 尺寸更小;但随着Cu负载量的提升, Cu颗粒开始增大.
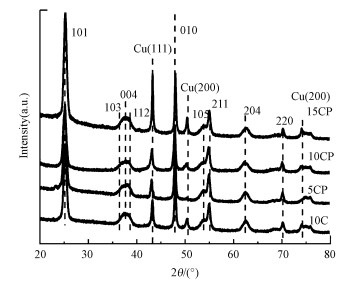 |
| 图 1 催化剂还原后的XRD图 Fig. 1 XRD patterns of all catalysts after reduction |
 |
| 图 2 催化剂还原后的SEM及Cu粒径分布图(a.5CP, b.10CP, c.10C, d.15CP) Fig. 2 SEM images and statistics of Cu particle size distribution of all catalysts after reduction (a.5CP, b.10CP, c.10C, d.15CP) |
| 表 1 催化剂的结构参数 Table 1 Structural parameters of all catalysts |
图 3为15CP、10CP、5CP、10C和0.5P催化剂的H2-TPR曲线.由图可知, 0.5P催化剂中Pt的还原峰在95 ℃左右, 10C催化剂中Cu的还原峰位于150 ℃左右, 这说明Pt优先于CuO被还原.而在CP催化剂中, 当Cu含量低于10%时, 起始还原温度和还原峰温度均向低温移动, 其中, 100~150 ℃左右的还原峰归属为与TiO2载体紧密接触的高分散CuO颗粒的还原;160 ℃左右的峰归属为TiO2表面大颗粒CuO的还原(Wang et al., 2016; Bao et al., 2018).但与催化剂10C相比, CP催化剂在100~150 ℃左右的峰明显更强并且还原温度更低, 尤其是5CP和10CP催化剂, 这说明其可能具有更多的与TiO2载体紧密接触的高分散CuO颗粒, 从而有利于低温还原;同时, Pt的引入也可能促进CuO颗粒的还原(Martin et al., 2015).但随着负载量的增加, 催化剂15CP在100~150 ℃左右的CuO的还原峰开始减弱并向高温偏移, 却仍然低于催化剂10C, 这也说明Pt的引入使CP催化剂中CuO的还原更容易.此外, 在CP催化剂的耗氢曲线中未见Pt的还原峰, 这可能是与高分散的CuO颗粒的还原峰重合了.
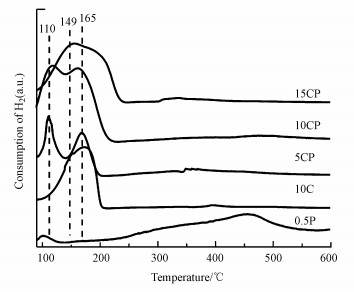 |
| 图 3 催化剂的H2-TPR曲线 Fig. 3 H2-TPR profiles of all catalysts |
图 4为催化剂还原后的XPS表征结果.从图 4可以看出, CP催化剂中Cu、Ti、O的结合能都向高结合能方向位移, CP催化剂中O的结合能为532.1 eV左右对应的表面缺陷(如氧空位)都明显大于10C和0.5P催化剂(图 4d).另外, 与单独负载Pt的催化剂0.5P相比, CP催化剂中Pt的结合能有轻微的蓝移, 这与电子由载体TiO2向Pt颗粒上迁移或者Pt与Cu之间存在着电子转移有关(图 4b)(Colmenares et al., 2011; Liu et al., 2018).同时, 有文献报道向Cu基催化剂引入少量的贵金属Au, 由于Au的吸电子作用增加了从ZnO到Cu的电子转移量, 进而降低了CuO的还原温度(Martin et al., 2015).结合TPR的结果, CP催化剂中CuO的还原温度降低, 也可能是因为Pt的电子促进作用, 即Pt优先于Cu被还原时Pt与载体间发生强相互作用, 电子从载体向Pt转移过程中促进了载体TiO2、Cu和Pt三者间的电子转移并且增加了电子转移量;CuO更容易得到电子从而被还原.而与单独负载的Cu、Pt催化剂10C和0.5P相比, CP催化剂中Cu、Pt结合能的位移可能与Cu、Pt和载体三者之间更多的电子转移引起金属电子密度的变化更大有关, 这也表明CP催化剂中金属与载体间拥有更强的相互作用(Huang et al., 2009;Colmenares et al., 2011; 鲍云锋, 2018).而载体TiO2与金属间的电子传递与相互作用会使载体产生表面缺陷(Peng et al., 2018; González et al., 2010), 图 4d也表明CP催化剂载体拥有更多的表面缺陷, 这也说明负载的金属与载体间可能存在更强的相互作用.此外, 表面缺陷引起的表面能带向下弯曲会导致催化剂中Ti、O的结合能升高(Huang et al., 2009), 且CP催化剂的表面缺陷更多, 所以Ti、O的结合能升高得更多(图 4c, 4d).然而, CP催化剂15CP中Cu的结合能位移和氧空位信号都相对较弱, 这可能由于随着负载量的继续增加, Cu颗粒容易团聚长大, 导致Cu与Pt和载体二者之间的电子转移量及载体上产生的缺陷相对较少.
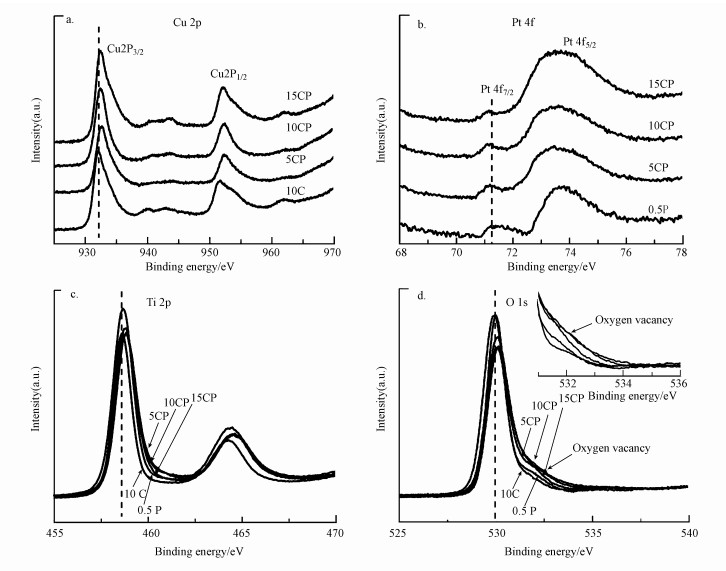 |
| 图 4 催化剂还原后的XPS信号(a.Cu 2p, b.Pt 4f, c.Ti 2p, d.O 1s) Fig. 4 XPS Spectra of all catalysts after reduction (a.Cu 2p, b.Pt 4f, c.Ti 2p, d.O 1s) |
图 5a为还原后各催化剂的EPR谱图, g=2.002处的自由电子顺磁共振信号归属为表面氧空位或Ti3+, g=1.954处的共振归属为体相Ti3+(Zhang et al., 2018).此外, g=2.4附近有4个小的共振信号, 归属为掺杂进入TiO2晶格中的Cu2+的共振峰.CP催化剂在g=2.002具有很强的信号, 其峰值明显大于单独负载的Cu或Pt催化剂, 尤其是10CP催化剂的峰最强, 这也与XPS的结果一致, 表明CP催化剂中负载的金属与载体的相互作用更强, 进而使载体产生更多的表面缺陷位(V0-或Ti3+), 从而有利于提高CO2的吸附活化(Ramesha et al., 2014; Lei et al., 2015; Wang et al., 2020).有文献报道Cu2+掺杂进入TiO2晶格时, Cu2+比Ti4+的O配位数少而形成氧空位, Ti4+可以得到氧空位的单电子从而形成Ti3+(Navas et al., 2014).因此, CP催化剂在g=1.954处的体相Ti3+峰值更明显可能是由于Cu与载体间结合的更紧密, 更多的Cu2+进入了TiO2的晶格中且CP催化剂的氧空位更多从而形成了更多的体相Ti3+.可见光拉曼也可用于表征催化剂缺陷, 催化剂的可见光拉曼散射谱如图 5b所示.由图可知, 各催化剂在-145、-396、-514和-637 cm-1处的振动峰分别归属为TiO2的B1g、A1g和Eg 3种振动模式;与10C和0.5P催化剂相比, CP催化剂中峰位的蓝移更明显, 也说明其载体中具有更多的体相Ti3+(Zhang et al., 2018), 进一步增强了载体的CO2活化能力(Jia et al., 2017; Ramesha et al., 2014).此外, 由A1g和Eg(145 cm-1)峰强比可近似估算{001}晶面的暴露比例, 在相同制备条件下, 各催化剂载体的{001}面暴露比例相近且均高于常规的锐钛矿TiO2, 而高暴露的{001}面也有助于活化CO2(Zhang et al., 2018; Bao et al., 2018).
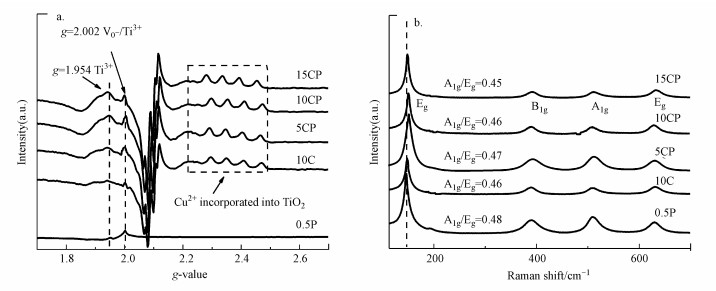 |
| 图 5 催化剂还原后的EPR图(a)和可见光Raman散射图(b) Fig. 5 EPR diagrams(a) and visible light Raman scattering patterns(b) of all catalysts after reduction |
图 6为还原后各催化剂的CO2-TPD图.由图可知, 各催化剂的CO2脱附曲线大概可以分为3类峰, 分别是α、β和γ峰.α峰对应脱附温度在100 ℃左右, 为弱碱性位点上吸附碳物种的脱附, β脱附峰归属为中等碱性位上吸附的碳物种的脱附, γ脱附峰归属为强碱性位上的吸附碳物种的脱附.有研究表明, 纯的TiO2纳米片本身只具有弱碱性(α)和强碱性(γ)吸附位点上对应吸附物种的脱附峰.因此, 中等碱性(β)吸附位点的物种脱附峰可能与金属和载体的界面相关, 即相互作用可能导致金属与载体界面上拥有更多吸附活化CO2的活性位点(Bao et al., 2018).由图 6可以明显看出, 催化剂0.5P和10C的β峰值都很弱.虽然Pt与载体间存在强相互作用, 也有一定的β峰脱附, 但负载量少, 所以活性位数量有限, 对CO2的活化能力也弱.而CP催化剂的β脱附峰峰值明显大于催化剂10C和0.5P的峰值, 尤其是催化剂10CP的峰值最大, 说明CP催化剂中金属与载体之间的相互作用更强, 形成的界面拥有更多的CO2吸附活化位点,从而对应更高的β脱附峰值, 显示更强的CO2活化能力.此外, Pt、Cu与载体之间的电子传递增强了界面碱性中心的碱性强度, 从而导致CP催化剂的β峰位置向高温区位移, 更有助于催化剂催化产甲醇(Barrault, 1997).
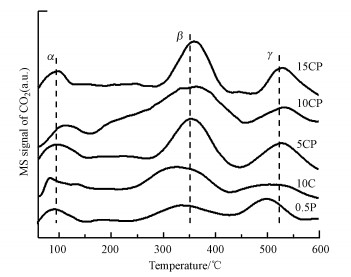 |
| 图 6 催化剂的CO2-TPD曲线 Fig. 6 CO2-TPD profiles of all catalysts after reduction |
图 7所示为本研究制备的催化剂的催化性能.由图 7a可知, 催化剂10CP上CO2的转化率高于0.5P和10C催化剂之和, 说明向Cu/TiO2中引入Pt, 不是简单的Cu/TiO2与Pt/TiO2性能的直接叠加.CP催化剂由于Pt的电子促进作用使负载的金属与载体之间的相互作用更强, 在金属与载体界面上拥有更多的活性位点, 进而使催化剂10CP表现出良好的甲醇收率(图 7b和7c).表 2对比了文献报道的代表性Cu基催化剂与10CP催化剂的催化性能, 10CP催化剂的甲醇收率高于文献报道的大部分催化剂, 如催化剂Cu/MgOTiO2、CuCeTiOx和Cu/Al2O3.此外, 由于Cu负载量继续增加, Cu颗粒容易团聚增大, 进而导致催化剂(15CP)上Cu与Pt和载体二者之间的电子转移量和载体的缺陷相对减少, 金属与载体界面上活性位数量变少, 催化性能下降.这说明CP催化剂可能具有最佳的Pt、Cu含量.
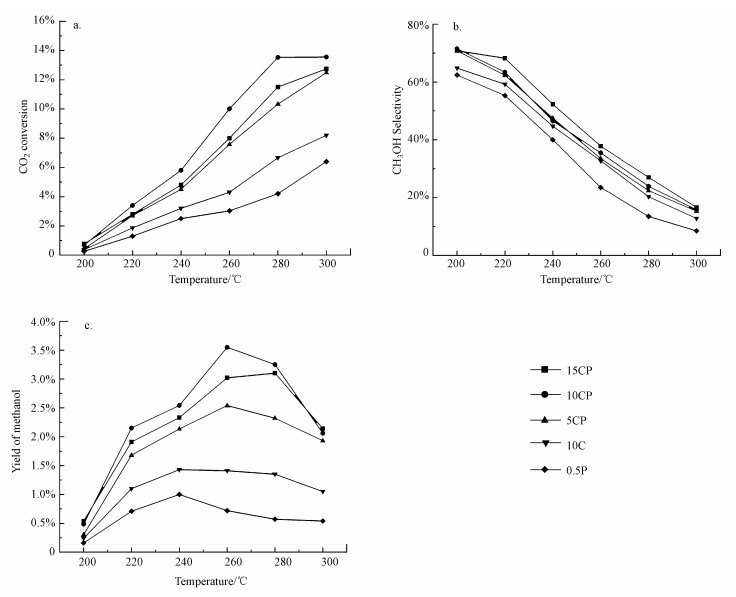 |
| 图 7 催化剂催化CO2加氢制甲醇的反应性能(a.CO2转化率, b.甲醇选择性, c.甲醇收率)(mcat=0.5 g, V(H2):V(CO2):V(N2)=69:23:8, T=200~300 ℃, P=3.0 MPa, WHSV=3600 mL · g · -1 · h-1) Fig. 7 The catalytic performance over all catalysts(a.CO2 conversion, b. methanol selectivity, c.methanol yield) |
| 表 2 Cu基催化剂催化性能对比 Table 2 Catalytic performance over the investigated catalysts and the reported Cu-based catalysts |
通过以上催化性能研究发现, CP催化剂的性能明显优于单独负载的Cu、Pt催化剂催化性能之和.XRD和SEM表征发现, CP催化剂中Cu在载体上分散度更高、尺寸更小;5CP、10CP、10C、15CP催化剂中的Cu颗粒尺寸分别为11、12、13、19 nm, 并且没有发现Pt-Cu合金的衍射峰.TPR研究发现, CP催化剂中CuO的还原温度更低, 可能是由于CP催化剂中有更多的与载体紧密结合的高分散的CuO颗粒, 并且与载体之间的相互作用更强, 进而促进了CuO的还原并使其还原温度降低(Liu et al., 2016a).与单独负载Pt的催化剂0.5P相比, CP催化剂Pt的结合能发生了蓝移, 表明Pt与载体间发生了强相互作用并且电子从载体向Pt转移(Colmenares et al., 2011), 该过程促进了载体TiO2、Cu和Pt三者间的电子转移并且转移量增加, 进而使CP催化剂中的CuO更容易得到电子而被还原;另一方面, 也可能是由于Pt的引入提高了CuO的分散度, 降低了CuO的还原温度.Martin等(2015)也发现引入少量贵金属Au, Au的吸电子作用能够增强从ZnO到Cu的电子转移量和相互作用, 进而降低CuO的还原温度.与此同时, 由于Pt的电子促进作用引起的金属电子密度的变化也表现在CP催化剂金属结合能的变化上, 即与单独负载Pt、Cu的催化剂0.5P和10C相比, CP催化剂中Cu、Pt的结合能均有明显的位移;同时, CP催化剂负载的金属与载体TiO2之间有更强的相互作用, 进而导致CP催化剂的载体拥有更多的表面缺陷.因此, 与催化剂10C相比, 催化剂10CP中的Cu颗粒尺寸更小, 可能是其金属与载体间更强的相互作用抑制了Cu颗粒聚集增大.此外, EPR表征也表明CP催化剂具有更多的表面缺陷及体相缺陷Ti3+和明显的Cu2+掺杂, 可见Raman谱也表明CP催化剂载体中有更多的体相缺陷位(Ti3+), 这些缺陷导致Ti和O的结合能向高处位移;同时, 氧空位和Ti3+均有利于吸附活化CO2.CO2-TPD图中β峰的强度增加和脱附温度升高也表明,CP催化剂中金属与载体界面上活性位点数量增加、碱性增强,从而表现出更强的CO2吸附活化能力.因此, CP催化剂中Pt的电子作用有利于增强金属与载体间的强相互作用, 进而稳定Cu颗粒尺寸并促进TiO2纳米片生成更多的缺陷, 所以催化剂中金属与载体界面上的活性位更多, 对应的β峰峰值更大, 更有利于CO2的吸附活化从而具有更优的催化性能, 而且催化剂10CP催化CO2加氢制甲醇的性能最好且超过10C和0.5Pt催化剂的催化性能.
4 结论(Conclusions)本文以高暴露面为{001}晶面的TiO2为载体负载Cu, 并引入少量的贵金属Pt, Pt的电子作用有利于增强Pt-Cu/TiO2{001}催化剂负载的金属与载体间的相互作用, 稳定了Cu的尺寸进而在载体上形成了更多的缺陷位(如氧空位、Ti3+).因此, 在Pt-Cu/TiO2{001}催化剂的金属-载体界面上形成了更多活性位点, 并表现出优异的CO2吸附活化能力和催化CO2加氢制甲醇的性能, 明显超过了单独负载相同量的Cu、Pt的催化剂的性能之和.
Arena F, Italiano G, Barbera K, et al. 2009. Basic evidences for methanol-synthesis catalyst design[J]. Catalysis Today, 143(1/2): 80-85. |
Bando K K, Sayama K, Kusama H, et al. 1997. In-situ FT-IR study on CO2 hydrogenation over Cu catalysts supported on SiO2, Al2O3, and TiO2[J]. Applied Catalysis A General, 165(s1/2): 391-409. |
Bansode A, Tidona B, von Rohr P R, et al. 2013. Impact of K and Ba promoters on CO2 hydrogenation over Cu/Al2O3 catalysts at high pressure[J]. Catalysis Science & Technology, 3(3): 767-778. |
Bao Y, Huang C, Chen L, et al. 2018. Highly efficient Cu/anatase TiO2{001}-nanosheets catalysts for methanol synthesis from CO2[J]. Journal of Energy Chemistry, 27(2): 381-388. |
Barbera K, Bordiga S. 2008. Solid-state interactions, adsorption sites and functionality of Cu-ZnO/ZrO2 catalysts in the CO2 hydrogenation to CH3OH[J]. Applied Catalysis A:General, 350(1): 16-23. DOI:10.1016/j.apcata.2008.07.028 |
鲍云锋.2018.二氧化钛纳米片负载铜催化剂用于CO2加氢制甲醇的催化性能与构效关系研究[D].广州: 华南理工大学 http://cdmd.cnki.com.cn/Article/CDMD-10561-1018873222.htm
|
Chang K, Wang T, Chen J G. 2017. Hydrogenation of CO2 to methanol over CuCeTiOx catalysts[J]. Applied Catalysis B:Environmental, 206: 704-711. DOI:10.1016/j.apcatb.2017.01.076 |
Colmenares J C, Magdziarz A, Aramendia M A, et al. 2011. Influence of the strong metal support interaction effect (SMSI) of Pt/TiO2 and Pd/TiO2 systems in the photocatalytic biohydrogen production from glucose solution[J]. Catalysis Communications, 16(1): 1-6. |
González I D, Navarro R M, Wen W, et al. 2010. A comparative study of the water gas shift reaction over platinum catalysts supported on CeO2, TiO2 and Ce-modified TiO2[J]. Catalysis Today, 149(3/4): 372-379. |
Graciani J, Mudiyanselage K, Xu F, et al. 2014. Highly active copper-ceria and copper-ceria-titania catalysts for methanol synthesis from CO2[J]. Science, 345(6196): 546-550. DOI:10.1126/science.1253057 |
Huang L, Peng F, Ohuchi F S. 2009. "In situ" XPS study of band structures at Cu2O/TiO2 heterojunctions interface[J]. Surface Science, 603(17): 2825-2834. DOI:10.1016/j.susc.2009.07.030 |
黄春蕾, 钟雯, 文进军, 等. 2019. Cu/盘状ZnO模型催化剂催化CO2加氢反应中生成CO的活性位研究[J]. 环境科学学报, 39(6): 1942-1951. |
Jia J, Qian C, Dong Y, et al. 2017. Heterogeneous catalytic hydrogenation of CO2 by metal oxides:defect engineering-perfecting imperfection[J]. Chem Soc Rev, 46(15): 4631-4644. DOI:10.1039/C7CS00026J |
Karelovic A, Ruiz P. 2015. The role of copper particle size in low pressure methanol synthesis via CO2 hydrogenation over Cu/ZnO catalysts[J]. Catalysis Science & Technology, 5(2): 869-881. |
Kattel S, Liu P, Chen J G. 2017. Tuning selectivity of CO2 hydrogenation reactions at the metal/oxide interface[J]. J Am Chem Society, 139(29): 9739-9754. DOI:10.1021/jacs.7b05362 |
Kattel S, Yan B, Chen J G. 2016. CO2 hydrogenation on Pt, Pt/SiO2 and Pt/TiO2:Importance of synergy between Pt and oxide support[J]. Journal of Catalysis, 343: 115-126. |
Kattel S, Ramirez P J, Chen J G, et al. 2017. Active sites for CO2 hydrogenation to methanol on Cu/ZnO catalysts[J]. Science, 355(6331): 1296-1299. DOI:10.1126/science.aal3573 |
Kondrat S A, Smith P J, Wells P P, et al. 2016. Stable amorphous georgeite as a precursor to a high-activity catalyst[J]. Nature, 531(7592): 83-87. DOI:10.1038/nature16935 |
Larmier K, Liao W C, Tada S, et al. 2017. CO2-to-methanol hydrogenation on zirconia-supported copper nanoparticles:Reaction intermediates and the role of the metal-support interface[J]. Angew Chem Int Ed Engl, 56(9): 2318-2323. DOI:10.1002/anie.201610166 |
Lei H, Nie R, Wu G, et al. 2015. Hydrogenation of CO2 to CH3OH over Cu/ZnO catalysts with different ZnO morphology[J]. Fuel, 154: 161-166. DOI:10.1016/j.fuel.2015.03.052 |
Liu C, Guo X, Guo Q, et al. 2016a. Methanol synthesis from CO2 hydrogenation over copper catalysts supported on MgO-modified TiO2[J]. Journal of Molecular Catalysis A:Chemical, 425: 86-93. DOI:10.1016/j.molcata.2016.09.032 |
Liu L, Jiang Y, Zhao H, et al. 2016b. Engineering Co-exposed {001} and {101} facets in oxygen-deficient TiO2 nanocrystals for enhanced CO2 photo reduction under visible light[J]. ACS Catalysis, 6(2): 1097-1108. DOI:10.1021/acscatal.5b02098 |
Liu T, Li C, Yuan Q. 2018. Facile synthesis of PtCu alloy/graphene oxide hybrids as improved electrocatalysts for alkaline fuel cells[J]. ACS Omega, 3(8): 8724-8732. DOI:10.1021/acsomega.8b01347 |
Liu X M, Lu G Q, Yan Z-F, et al.Recent advances in catalysts for methanol synthesis via hydrogenation of CO and CO2[J].Industrial & Engineering Chemistry Research, 42(25): 6518-6530
|
Ma J, Sun N, Zhang X, et al. 2009. A short review of catalysis for CO2 conversion[J]. Catalysis Today, 148(3/4): 221-231. |
Martin O, Mondelli C, Curulla-Ferré D, et al. 2015. Zinc-rich copper catalysts promoted by gold for methanol synthesis[J]. ACS Catalysis, 5(9): 5607-5616. DOI:10.1021/acscatal.5b00877 |
Navas J, Sanchez-Coronilla A, Aguilar T, et al. 2014. Experimental and theoretical study of the electronic properties of Cu-doped anatase TiO2[J]. Phys Chem Chem Phys, 16(8): 3835-3845. DOI:10.1039/c3cp54273d |
Olah G A, Goeppert A, Prakash G K S.2009.Beyond Oil and Gas: The Methanol Economy[M].Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA
|
Peng R, Li S, Sun X, et al.2018.Size effect of Pt nanoparticles on the catalytic oxidation of toluene over Pt/CeO2 catalysts[J].Applied Catalysis B: Environmental, 220: 462-470
|
Posada-Pérez S, Ramírez P J, Gutiérrez R A, et al. 2016. The conversion of CO2 to methanol on orthorhombic β-Mo2C and Cu/β-Mo2C catalysts:mechanism for admetal induced change in the selectivity and activity[J]. Catalysis Science & Technology, 6(18): 6766-6777. |
Ramesha G K, Brennecke J F, Kamat P V. 2014. Origin of catalytic effect in the reduction of CO2 at nanostructured TiO2 films[J]. ACS Catalysis, 4(9): 3249-3254. DOI:10.1021/cs500730w |
Thomas J M, Thomas W J.2014.Principles and Practice of Heterogeneous Catalysis[M].John Wiley & Sons
|
Toyir J, PR de la Piscina P R, Fierro J L G, et al. 2001. Highly effective conversion of CO2 to methanol over supported and promoted copper-based catalysts:influence of support and promoter[J]. Applied Catalysis B:Environmental, 29: 207-215. DOI:10.1016/S0926-3373(00)00205-8 |
Xu B, Lin D, Yi C. 1998. Influence of CuO loading on dispersion and reduction behavior of CuO/TiO2 (anatase) system[J]. Journal of the Chemical Society Faraday Transactions, 94: 1905-1909. DOI:10.1039/a801603h |
Wang Z, Brouri D, Casale S, et al. 2016. Exploration of the preparation of Cu/TiO2 catalysts by deposition-precip-itation with urea for selective hydrogenation of unsaturated hydrocarbons[J]. Journal of Catalysis, 340: 95-106. DOI:10.1016/j.jcat.2016.05.011 |
Wang W, Qu Z, Song L, et al. 2020. CO2 hydrogenation to methanol over Cu/CeO2 and Cu/ZrO2 catalysts:Tuning methanol selectivity via metal-support interaction[J]. Journal of Energy Chemistry, 40: 22-30. DOI:10.1016/j.jechem.2019.03.001 |
Yao S, Mudiyanselage K, Xu W, et al. 2014. Unraveling the dynamic nature of a CuO/CeO2 catalyst for CO oxidation in operando:A combined study of XANES (Fluorescence) and DRIFTS[J]. ACS Catalysis, 4(6): 1650-1661. DOI:10.1021/cs500148e |
Zhang H, Cai J, Wang Y, et al. 2018. Insights into the effects of surface/bulk defects on photocatalytic hydrogen evolution over TiO2 with exposed {001}facets[J]. Applied Catalysis B:Environmental, 220: 126-136. DOI:10.1016/j.apcatb.2017.08.046 |
 2020, Vol. 40
2020, Vol. 40


