2. 挥发性有机物污染治理技术与装备国家工程实验室, 广州 510006;
3. 广东省大气环境与污染控制重点实验室, 广州 510006
2. National Engineering Laboratory for VOCs Pollution Control Technology and Equipment, Guangzhou 510006;
3. Guangdong Provincial Key Laboratory of Atmospheric Environment and Pollution Control(SCUT), Guangzhou 510006
挥发性有机物(VOCs)是形成臭氧和PM2.5的关键前驱体, 严重影响大气环境质量, 而且部分VOCs对人体有直接危害, 近年来VOCs污染治理受到国家的高度重视和公众的广泛关注.臭氧催化氧化技术可在温和条件下高效氧化VOCs, 同时能高效去除污染物O3, 达到两种污染物的同时降解(Xiao et al., 2018), 不仅可用于工业低浓度有机废气净化, 也可用于室内空气净化, 是非常有潜力的VOCs控制技术.目前, 臭氧协同催化氧化VOCs的研究中普遍采用MnOx(Einaga et al., 2013; Fang et al., 2019)、CoOx(Konova et al., 2006)、FeOx(Einaga et al., 2004)、NiO(Huang et al., 2015)、CuO(Einaga et al., 2015)等金属氧化物催化剂, 表现出良好的效果.但该技术仍存在VOCs矿化率低(Einaga et al., 2009)、臭氧残留的问题, 极大地阻碍了该技术的实际应用.因此, 非常有必要研发具有高矿化率、高臭氧分解效率的高效催化剂.
最近研究表明MnOx等催化剂协同臭氧催化氧化VOCs的机理是臭氧在氧空位上分解产生活性氧物种, 然后活性氧物种与吸附的甲苯分子反应, 并将其氧化(Hu et al., 2017; Zhu et al., 2017; Wang et al., 2019).一般而言, 催化剂的臭氧分解性能越好, 产生的活性氧物种越多, 越有利于其催化氧化VOCs(Jia et al., 2017; Yang et al., 2018; Zhang et al., 2019).
稀土氧化物CeO2具有可逆的+3/+4变价能力, 蕴含丰富的氧空位, 广泛应用于多相催化领域(Zhou et al., 2005; Rodriguez et al., 2007).这一特性与臭氧催化氧化VOCs的反应原理契合, 但到目前为止, CeO2应用于臭氧催化氧化VOCs的相关研究非常有限.本课题组前期对CeO2开展了一些研究, 发现CeO2上氧空位的含量对其臭氧分解性能有重要影响(王雪青等, 2019), 还研究了负载型的Pt-CeO2/BEA催化剂, 初步发现Pt和CeO2二者之间存在强相互作用, 贵金属Pt可促进CeO2上氧空位生成, Pt-CeO2/BEA展现出了优异的臭氧分解和甲苯降解性能(Xiao et al., 2018).上述研究表明, 通过一定的方式可以有效增加CeO2的氧空位, 进一步提高其臭氧分解以及臭氧催化氧化性能.
本研究通过铂颗粒吸附法制备得到Pt/CeO2催化剂, 考察CeO2和Pt/CeO2催化剂在臭氧分解以及臭氧催化氧化甲苯反应中的活性, 并且采用XRD、BET、TEM、(原位)Raman、XPS以及O2-TPD等表征手段来研究负载Pt对CeO2氧空位的影响, 探究氧空位的变化与催化性能提升之间的内在联系.
2 实验部分(Experimental) 2.1 催化剂的制备Pt纳米颗粒的制备:采用乙二醇还原法(Mo et al., 2019)制备了大小均一的Pt纳米颗粒, 将适量氯铂酸溶液和聚乙烯吡咯烷酮(PVP, k29~32, Mw=58000)溶解在一定量的乙二醇溶液中, 得到黄色溶液;在磁性搅拌下将黄色溶液加热至120 ℃保持1 h, 至黄色溶液变为深褐色溶液;将60 mL丙酮加入深褐色溶液中, 冷却至室温后通过离心(6000 r · min-1, 5 min)收集Pt颗粒;所得的Pt颗粒经正己烷多次洗涤后分散到水中.
载体的制备:以六水硝酸铈(Ce(NO3)3 · 6H2O)为铈源, 在马弗炉中550 ℃焙烧5 h得到CeO2;在考察不同载体影响的实验中选用商业二氧化硅SiO2(天津市福晨化学试剂厂, 分析纯)作为对比载体.
Pt/CeO2和Pt/SiO2的制备:将适量CeO2或SiO2粉末置于含一定量Pt颗粒的水溶液中, 超声处理1 h后, 置于烘箱中干燥, 然后将样品在干燥空气中350 ℃焙烧5 h, 最终得到对应的催化剂.
2.2 催化剂的表征XRD测试使用德国Bruker D8 Advance X衍射仪, 扫描范围:2θ = 10°~90°.催化剂的Pt负载量采用美国Perkin-Elmer plasma 8000型电感耦合等离子体原子吸收分析仪(ICP-OES)测定.BET使用美国Micromeritics公司的ASAP 202 M全自动表面分析仪, 样品测试前在250 ℃下脱气处理5 h.TEM使用日本JEOL JEM-2100HR型透射电子显微镜进行观察得到.拉曼光谱分析(Raman)使用法国HYJ公司的LabRAM Aramis型拉曼光谱仪进行测定, 激发光源波长为532 nm(可见)和325 nm(紫外), 扫描范围为200~1400 cm-1.H2-TPR测试使用美国Micromeritics AutoChem 2920全自动程序升温化学吸附仪, 测试前将样品在氩气气氛下, 250 ℃吹扫1 h, 降温至50 ℃, 然后气路切换为5% H2/Ar, 从50 ℃升温至800 ℃进行还原, 升温速率为10 ℃ · min-1.XPS使用美国Thermo Scientific EscaLab 250Xi型X射线光电子能谱仪进行测定, C1s校准结合能为284.8 eV.O2-TPD测试使用美国Micromeritics AutoChem 2920全自动程序升温化学吸附仪, 测试前将样品在He气氛下, 250 ℃吹扫1 h, 降温至60 ℃, 在20% O2/He中吸附1 h, 再用He气流吹扫进行升温脱附.
2.3 催化剂活性评价臭氧分解性能实验:将25 mg 40~60目的催化剂装入内径为8 mm的石英管内, 实验前, 先用N2吹扫催化剂, 在120 ℃下预处理30 min除去催化剂中的水分, 降温后, 通入臭氧和氮气混合气进行反应(臭氧浓度为4907 mg · m-3, 流量为100 mL · min-1, 重时空速为240 L · g-1 · h-1, 反应温度30 ℃).反应管进出口臭氧浓度由臭氧分析仪(2B, 106-M, 美国)进行检测.臭氧转化率(XO3)计算公式如下:
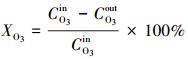
|
(1) |
催化剂协同臭氧催化氧化甲苯的实验:将50 mg 40~60目的催化剂装入内径为8 mm的石英管内, 实验前, 用N2吹扫将催化剂在120 ℃下预处理30 min除去催化剂中的水分, 冷却至室温后, 通入甲苯、臭氧和氮气混合气进行反应(甲苯浓度为940 mg · m-3, 臭氧浓度为4907 mg · m-3, 流量100 mL · min-1, 重时空速120 L · g-1 · h-1, 反应温度30~110 ℃).反应器前后的甲苯、一氧化碳和二氧化碳气体浓度由气相色谱(GC-9560, 中国)进行检测, 臭氧由臭氧分析仪进行检测.甲苯转化率(Xtoluene)、CO2产率(YCO2)计算公式如下:
|
(2) |

|
(3) |
同时还进行了热催化氧化甲苯实验以排除热催化的影响, 实验条件与臭氧催化氧化实验一致, 区别在于混合气中无臭氧.
2.4 催化剂表面氧物种研究由于过氧物种O22-和超氧物种O2-中O O键的共价性导致它们的伸缩振动在可见拉曼光谱中有很高的响应, 可以用其来表征O22-和O2-.可见激发光源波长为532 nm, 扫描范围为700~1400 cm-1.
原位可见光拉曼实验过程如下:为了脱除催化剂表面吸附水, 样品首先在N2气氛下150 ℃预处理1 h.①降温至30 ℃后采集样品在N2气氛中的初始拉曼信号;②切换为21% O2/N2进行O2吸附, 持续通入30 min后采集信号;③切换为4907 mg · m-3的O3/(O2+N2)反应30 min后采集信号;④切换为N2气氛以脱除表面吸附较弱的氧物种, 持续通入30 min后采集信号;⑤切换为940 mg · m-3甲苯/N2, 持续通入30 min后采集信号.
3 结果与讨论(Results and discussion) 3.1 材料表征各样品的Pt负载量、比表面积和平均孔径如表 1所示.Pt/CeO2和Pt/SiO2的Pt负载量接近, 分别为0.43%和0.42%.CeO2催化剂负载Pt颗粒后, 平均孔径未发生明显变化(12.1 nm), 比表面积略微增加, 从64.8 m2 · g-1增加到69.9 m2 · g-1, 可能是由于部分Pt颗粒负载在催化剂表面导致比表面积增大.
| 表 1 催化剂的Pt负载量、比表面积和平均孔径 Table 1 Pt loading, specific surface area and average pore of catalysts |
图 1a为催化剂的N2-吸附/脱附等温线图.从图中可以看出, 两个等温曲线均为含H3型滞后环的Ⅳ型等温线, 滞后环均位于p/p0=0.8~1, 表明两个催化剂均为介孔材料, 且Pt颗粒的引入并没有破坏载体的孔道结构.
 |
| 图 1 CeO2和Pt/CeO2的N2-吸附/脱附等温线图(a)和XRD谱图(b) Fig. 1 N2-adsorption/desorption isotherm(a) and XRD patterns(b) of CeO2 and Pt/CeO2 |
CeO2和Pt/CeO2的XRD图谱如图 1b所示.从图中可以看到, 两种催化剂在28.6°、33.1°、47.5°、56.3°、59.1°、69.4°、76.7°、79.1°、88.4°和95.4°均出现了CeO2立方萤石结构的特征衍射峰, 特征峰位与标准卡片(JCP 34-0394)吻合, 表明Pt的加入没有破坏CeO2的晶体结构.此外, 两个样品在20°~90°范围内均未出现与Pt或者PtOx相关的衍射峰(33°, 44°), 这可能是由于Pt/CeO2中Pt的负载量较低, 或者Pt颗粒以较小的尺寸存在并较好地分散在载体CeO2表面.
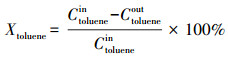
图 2为Pt/CeO2和Pt/SiO2的TEM图和Pt颗粒尺寸分布情况.从图 2a和2d可看到, Pt颗粒在CeO2和SiO2两种载体上均匀分布, 尺寸相对均一.高分辨电镜图 2b和2e显示, Pt颗粒晶格条纹间距为0.21 nm, 对应Pt的(111)晶面.通过对Pt颗粒的粒径统计, 得到了Pt/CeO2和Pt/SiO2的Pt纳米颗粒的尺寸分布, 如图 3c和3f所示, Pt颗粒的大小为3~4 nm, 平均粒径分别为(3.6±0.36) nm和(3.4±0.37) nm, 表明Pt/CeO2和Pt/SiO2催化剂中Pt颗粒尺寸相近.这可能是由于两个原因所致, 一是Pt负载量较低, 仅为0.4%, 即使载体的比表面积较小, Pt可以良好的分散;二是采用了预先制备Pt颗粒的制备方法, 先制备出大小均一、粒径约为3.5 nm的Pt颗粒, 再将Pt颗粒经过焙烧后负载于载体上.类似的, 在其它采用相同方法制备Pt基催化剂的文献中, Pt颗粒负载在不同载体上大小也是接近的(Chen et al., 2015; Peng et al., 2018).
 |
| 图 2 Pt/CeO2和Pt/SiO2的TEM图和Pt尺寸统计情况(a~c. Pt/CeO2, d~e. Pt/SiO2) Fig. 2 TEM images of the catalysts and distribution of Pt nanoparticle diameter Pt/CeO2 (a~c) and Pt/SiO2 (d~f) |
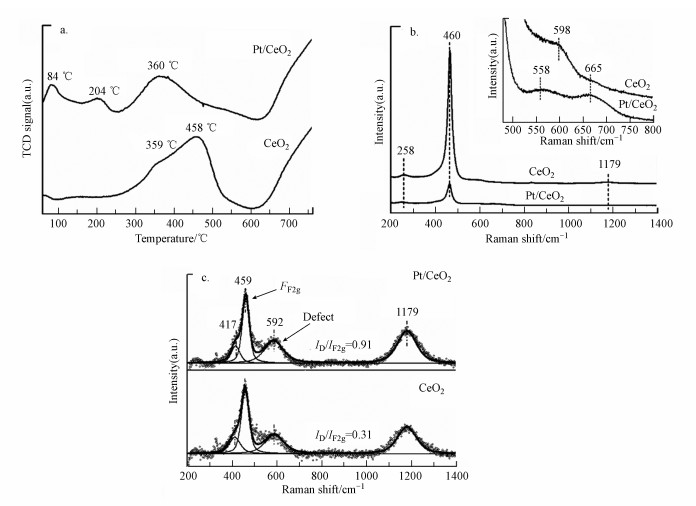 |
| 图 3 CeO2和Pt/CeO2的H2-TPR谱图(a)、可见光Raman谱图(λ=532 nm)(b)和UV Raman谱图(λ=325 nm)(c) Fig. 3 H2-TPR profiles(a), visible Raman patterns(λ=532 nm)(b) and UV Raman patterns(λ=325 nm)(c) of CeO2 and Pt/CeO2 |
H2-TPR可以用来研究Pt与CeO2之间的相互作用, 图 3a展示了CeO2和Pt/CeO2的H2-TPR谱图.根据文献可知(Natile et al., 2005; López et al., 2015), CeO2的还原通常可分为3个温度区间:250~400、400~600和600~1000 ℃, 分别代表CeO2上表面氧、次表面氧和体相晶格氧的还原.从图中可以看到, CeO2在359 ℃和458 ℃处出现了两个峰, 分别代表CeO2表面氧和次表面氧的还原.而负载Pt纳米颗粒后, Pt/CeO2在84 ℃处出现新的还原峰, 该峰可归属于表面PtOx的还原(Reyes et al., 1997), 但此峰对应的耗氢量为29.9 μmol · g-1, 大于该催化剂上Pt物种的理论耗氢量22.1 μmol · g-1(根据ICP结果计算, 并且假设Pt/CeO2中的Pt物种均为PtO), 这可能是由于Pt的存在, 有助于氢的活化和溢出, 导致与Pt颗粒相邻的Ce4+被还原(Dutta et al., 2007; Liu et al., 2014).同时, 与CeO2相比, Pt/CeO2表面氧和次表面氧的还原峰向低温段(204 ℃和360 ℃)发生较大偏移, 表明Pt与CeO2间存在相互作用, 降低了CeO2的还原温度(Rui et al., 2008; Huang et al., 2014).
通过可见光拉曼光谱分析可以得到样品的表面结构信息, 图 3b展示了CeO2和Pt/CeO2的可见光拉曼谱图.从图中可以看出, CeO2和Pt/CeO2均表现出典型的立方萤石结构的特征, 在258、460、598和1179 cm-1处出现拉曼峰, 分别归属于CeO2二阶横向声学振动峰(2TA)(Wu et al., 2010), CeO2立方萤石结构的对称伸缩振动特征峰(F2g)(Weber et al., 1993), 缺陷诱导(D)模式的频带(McBride et al., 1994)和CeO2二阶纵向光学振动峰(2LO)(Wu et al., 2010).而Pt/CeO2样品还在558 cm-1处和665 cm-1出现了新的峰, 分别归属于Pt—O—Ce键和Pt—O键(Lin et al., 2008; Tong et al., 2018), 结合H2-TPR结果, 可以推论:由于Pt与CeO2之间存在强相互作用, 形成了Pt—O—Ce键, 具有更低的CeO2表面氧空位形成能, 促进了氧空位的生成(Pal et al., 2015; Yang et al., 2007a; 2007b).
催化剂表面氧空位在臭氧催化氧化反应中起关键作用, 采用对氧缺陷较为敏感的紫外拉曼检测催化剂表面的氧空位.图 3c为CeO2和Pt/CeO2的紫外拉曼谱图, 可以看出, 两种催化剂均在417、459、592和1179 cm-1 4处有明显的峰出现, 其中, 459、592和1179 cm-1 3处拉曼峰的归属与可见光拉曼一致, 为伸缩振动特征峰(F2g)、缺陷诱导(D)模式和二阶纵向光学振动峰(2LO)的频带, 417 cm-1处的特征峰在其他CeO2样品的拉曼图谱中也有出现, 但其归属暂不明确(Agarwal et al., 2014).D峰和F2g峰的强度比值(ID/IF2g)可作为衡量CeO2氧空位浓度的指标(Lee et al., 2011; Peng et al., 2016).其计算结果如表 2所示, 从表中可以看出, 负载Pt颗粒后, 催化剂氧空位浓度增加, 说明Pt的存在能促进CeO2上氧空位的生成.
| 表 2 催化剂的UV Raman和XPS分析结果 Table 2 UV Raman and XPS analysis of catalysts |
采用XPS分析可以获得CeO2和Pt/CeO2样品表面Ce元素和O元素的化学状态信息.图 4a为两个催化剂的Ce 3d的XPS谱图, CeO2中Ce主要存在两种价态, 即Ce3+和Ce4+.根据文献报道(Romeo et al., 1993; Anandan et al., 2013; Peng et al., 2018), U'''(916.1 eV)、V'''(897.6 eV)、U(900.3 eV)、V(881.9 eV)、U″(906.9 eV)和V″(888.5 eV)6个峰对应Ce4+物种, U′(901.9 eV)、U0(898.6 eV)、V′(883.9 eV)和V0(880.6 eV)则归属于Ce3+物种.由表 2可知, CeO2和Pt/CeO2样品中Ce3+/(Ce3+ + Ce4+)比例分别为36.5%和40.6%, Pt/CeO2具有更高的Ce3+浓度.通常认为, Ce3+浓度越高, CeO2的氧空位含量越多(Trovarelli, 1996; Nolan et al., 2005; Peng et al., 2018).Ce 3d谱图的分析结果说明, 负载Pt后, CeO2中表面氧空位含量显著提高.图 4b为催化剂的O 1s XPS谱图, 从图中可以看出, 两种催化剂O 1s谱图均可分解为3个结合能峰, 其中528.7~528.9 eV的特征峰归属于晶格氧OLat(O2-), 位于530.5~530.7 eV的特征峰归属为表面氧OSur(O22-, O2-), 位于533.5~533.7 eV的特征峰归属于其他可能的吸附氧OAds(CO32-, —OH)(Hu et al., 2016; Yu et al., 2018).其中, OSur包含的O22-和O2-物种是氧空位上产生的活性氧物种, 因此, OSur/OLat也可以用来评估氧空位的浓度(Chen et al., 2018).通过对峰面积进行积分处理, 得到CeO2和Pt/CeO2样品的OSur/OLat比值分别为77.3%和86.9%, 这表明Pt/CeO2具有更高的氧空位浓度.
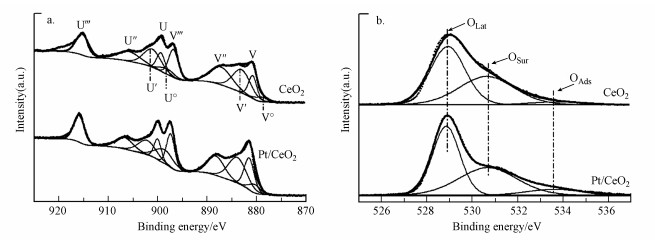 |
| 图 4 CeO2和Pt/CeO2催化剂Ce 3d(a)和O 1s(b)的XPS谱图 Fig. 4 XPS spectra of Ce 3d (a) and O 1s (b) for CeO2 and Pt/CeO2 samples |
还可以通过O2-TPD对催化剂在不同温度下脱附的氧物种进行分析, 侧面得到关于氧空位的信息, 其结果如图 5所示.CeO2和Pt/CeO2样品在60~700 ℃范围内出现了4个明显的脱附峰, 120 ℃处的脱附峰归属于物理吸附氧物种(Lin et al., 2002; Chen et al., 2018), 180~500 ℃之间的3个脱附峰归属于吸附在氧空位上的表面氧物种(如O2-和O22-)(Zhao et al., 1996; Huang et al., 2014; Hu et al., 2016).从图 5可以看到, CeO2负载Pt后, 属于表面氧物种的脱附峰都有所增强, 其中378 ℃处的峰增强最为显著.表面氧物种的数量在一定程度上可以反映样品氧空位的含量(Zhang et al., 2013; Yang et al., 2015), 通过对曲线进行积分计算表面氧物种的脱附量, 发现Pt/CeO2具有更高的表面氧含量, 说明Pt/CeO2中氧空位含量更丰富.该结果与拉曼和XPS的结果相一致.
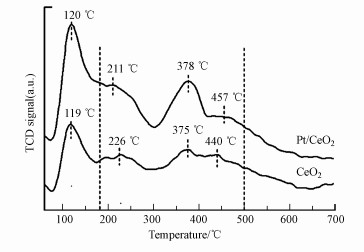 |
| 图 5 CeO2和Pt/CeO2的O2-TPD谱图 Fig. 5 O2-TPD profiles of CeO2 and Pt/CeO2 catalysts |
催化剂的臭氧分解实验结果如图 6所示.可以看出, CeO2和Pt/CeO2催化剂对臭氧分解率都随时间增加而稍有下降, 在反应150 min时分别为90.7%和79.3%.Pt/CeO2具有更好的臭氧分解性能.根据Raman、O2-TPD和XPS的结果可知, Pt/CeO2催化剂具有更高的氧空位浓度, 能提供更多的O3分解活性位点, 从而表现出更好的臭氧分解性能.
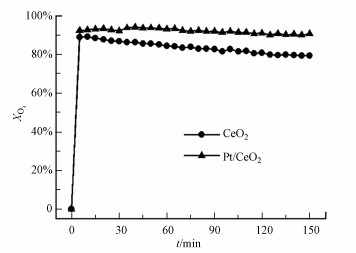 |
| 图 6 催化剂的臭氧分解率(30 ℃, 催化剂25 mg, 气体流量100 mL · min-1, 臭氧浓度4907 mg · m-3) Fig. 6 Ozone decomposition performance of the catalysts (30 ℃, 25 mg of catalyst, flow rate of simulated dry air = 100 mL · min-1, O3 concentration = 4907 mg · m-3) |
图 7为不同温度下3种催化剂CeO2、Pt/CeO2和Pt/SiO2协同臭氧催化氧化甲苯的甲苯转化率、CO2产率和臭氧降解率.首先, 为了排除热催化的影响, 进行了CeO2和Pt/CeO2的热催化氧化甲苯实验, 分别对应图 7a中的CeO2-T、Pt/CeO2-T曲线.当进气中没有臭氧且温度低于110 ℃时, 催化剂CeO2和Pt/CeO2对甲苯的降解率均低于3%, 表明在本研究的评价温度范围(30~110 ℃)内, 催化剂热催化作用的贡献很小.当加入臭氧后, CeO2和Pt/CeO2对甲苯的催化降解性能显著提高, 表明臭氧的加入是催化性能提高的主要因素.在80 ℃时甲苯降解率、CO2产率和臭氧分解率分别达到92.3%、92.1%和99.9%, 展现出优良的催化性能.
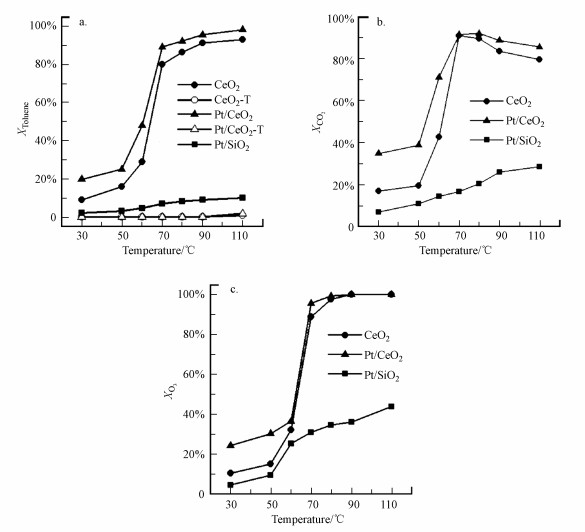 |
| 图 7 不同温度下催化剂协同臭氧催化氧化甲苯的性能 (a.甲苯降解率, b.CO2产率, c.臭氧分解率)(催化剂50 mg, 气体流量100 mL · min-1, 甲苯浓度940 mg · m-3, 臭氧浓度4907 mg · m-3) Fig. 7 The performance of catalysts for toluene oxidation with ozone at various temperatures (a. toluene conversion, b.CO2 yield, c. ozone conversion) (50 mg of catalyst, flow rate of simulated dry air = 100 mL · min-1, toluene concentration = 940 mg · m-3, O3 concentration = 4907 mg · m-3) |
对比CeO2和Pt/CeO2催化剂的臭氧协同催化性能结果, 可以发现, Pt/CeO2对甲苯降解率、CO2产率和O3分解率均明显高于CeO2, 表明在CeO2中引入Pt提升了CeO2的臭氧催化氧化性能.为了探究Pt/CeO2催化剂相比CeO2性能提升是Pt颗粒的作用, 还是Pt与CeO2相互作用所导致的结果, 本研究对比了Pt/CeO2、Pt/SiO2和SiO2的性能, 其中Pt/SiO2的Pt负载量和Pt颗粒大小均与Pt/CeO2接近(表 1和图 2).由于SiO2在臭氧催化氧化实验中反应活性低(甲苯降解率和臭氧分解率均低于5%, 结果未在图中显示), 因此, Pt/SiO2展示出的臭氧催化氧化性能可粗略视为单独Pt颗粒的催化性能.从图 7中可以看出, Pt/SiO2具有一定的催化活性, 表明Pt是臭氧分解和甲苯氧化的活性位点之一.同时, 对比Pt/CeO2和Pt/SiO2的性能可知, Pt/CeO2明显高于Pt/SiO2.负载Pt的CeO2有更好的性能, 可见Pt与CeO2有更强的相互作用.结合前文表征结果和臭氧分解的结果, 可知Pt的负载增加了CeO2催化剂上氧空位的含量, 增强了对臭氧的分解性能, 从而提高了其臭氧催化氧化甲苯的性能.
3.3 原位拉曼实验为了证实催化剂臭氧分解性能与臭氧催化氧化性能之间的内在联系, 采用原位拉曼进行了有无甲苯存在下臭氧分解产生的氧物种研究.文献报道(Zeng et al., 2015; Wu et al., 2017; Wang et al., 2019)过氧(O22-)和超氧(O2-)物种是O3在催化剂上分解的中间产物, 利用拉曼表征手段可以区分缺陷位上的表面氧(O22-和O2-).反之, 过氧和超氧物种也可以用来探测缺陷位点的存在(Daniel et al., 2012).
3.3.1 催化剂表面氧物种差异图 8中initial谱图代表预处理后的拉曼谱图, 在700~1400 cm-1范围内, CeO2和Pt/CeO2均出现了3个峰, 分别位于1179、1050和833 cm-1.其中, 位于1179 cm-1处的峰归属于CeO2的二阶纵向光学(2LO)振动峰, 位于1050 cm-1处的峰是由于CeO2中微量硝酸盐或磷酸盐物种引起的拉曼峰(Wu et al., 2010).接着向样品通入O2, 从标记为O2的谱图可以看到两个样品在833 cm-1处的峰均明显增强, 并且在860 cm-1处有弱的肩峰出现.然后向样品通入O3, 从标记为O3的谱图可以发现, CeO2和Pt/CeO2样品在833 cm-1和860 cm-1处的峰进一步增强, 而且均在1139 cm-1处出现了新的肩峰, Pt/CeO2样品还在890 cm-1处出现新的肩峰.
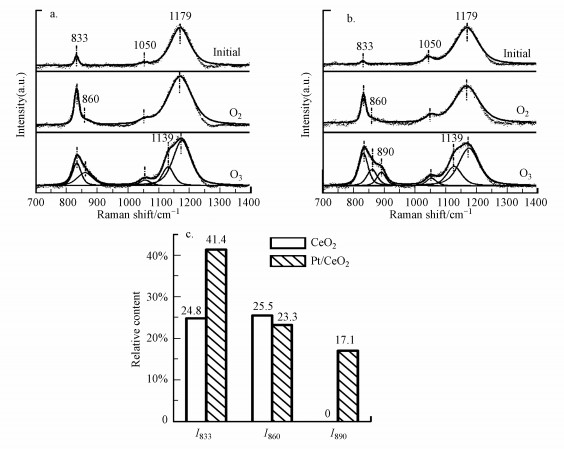 |
| 图 8 CeO2(a)和Pt/CeO2 (b)在O2和O3气流中的拉曼谱图以及在O3气流中的过氧物种的相对含量(c) Fig. 8 In-situ Raman spectroscopy of CeO2 (a) and Pt/CeO2 (b) catalysts and relative content of peroxide on CeO2 and Pt/CeO2 catalysts in O2 or O3 flow (c) |
1139 cm-1处的峰归属于吸附的超氧物种, 890、860和833 cm-1处的峰归属于吸附在聚集程度不同的缺陷位上的过氧物种.其中, 833 cm-1附近的峰代表吸附在孤立的双电子缺陷位点上的过氧物种(Li et al., 1989; Li et al., 1990; Guzman et al., 2005), 860 cm-1和890 cm-1附近的峰代表吸附在由多个点缺陷聚集在一起形成的缺陷簇上的过氧物种(Pushkarev et al., 2004; Choi et al., 2006).由于吸附的过氧物种之间的偶极-偶极耦合效应, 拉曼波数越大, 表示缺陷位越聚集.
通入O3气流的实验结果表明, O3在两个催化剂上分解产生了过氧和超氧物种, 并且Pt/CeO2上存在着比CeO2上聚集程度更大的缺陷簇.为了比较两个样品在O3气流中产生过氧物种的含量, 对CeO2和Pt/CeO2样品的拉曼谱图进行分峰拟合, 以2LO振动峰(1179 cm-1)的峰面积作为基准对各峰进行归一化处理(Pushkarev et al., 2004), 可以得到过氧物种的相对含量, 结果如图 8c所示.Pt/CeO2样品中3种过氧化物显著高于CeO2样品, 表明在Pt/CeO2中有更多的臭氧分解产生过氧物种.同时, 更高的过氧物种含量代表更多的缺陷位含量, 这与表征结果一致.
3.3.2 氧物种在甲苯氧化过程中的作用经过O3处理后的CeO2和Pt/CeO2样品中通入氮气以除去弱吸附的氧物种, 再通入甲苯, 得到的拉曼谱图如图 9所示.氮气吹扫后, 1139 cm-1处对应超氧物种的峰消失, 833、860和890 cm-1处对应的过氧物种峰强度降低, 表明催化剂表面过氧物种的稳定性高于超氧物种.再通入甲苯后, 在822、1005、1155和1290 cm-1处出现了甲苯吸附峰, 860 cm-1和890 cm-1处的峰消失, 说明过氧物种参与甲苯的氧化过程.类似的, Mao等(2018)认为臭氧在催化剂表面分解形成的过氧物种是VOCs催化氧化的重要反应物种.
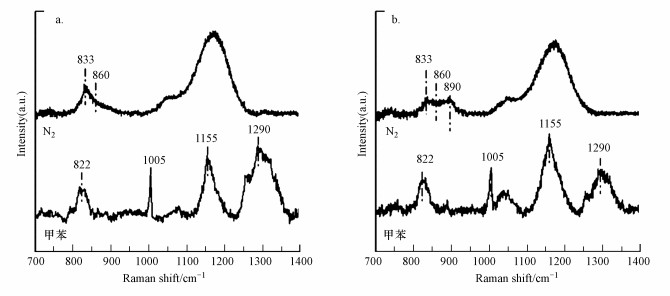 |
| 图 9 CeO2(a)和Pt/CeO2(b)经氮气吹扫和甲苯吸附后的拉曼谱图 Fig. 9 Raman spectroscopy of CeO2 (a) and Pt/CeO2 (b) catalysts after N2 flow and toluene flow |
与CeO2相比, Pt/CeO2上具有更高的缺陷位含量, 可供更多臭氧分解形成O22-物种, 从而表现出更好的臭氧分解性能, 同时, 生成更多的过氧物种有利于甲苯的氧化, 从而增强其臭氧催化氧化甲苯性能.
4 结论(Conclusions)1) 采用铂颗粒吸附法制备的Pt负载量约为0.4%的Pt/CeO2催化剂, 由于Pt与CeO2间存在强相互作用, 具有比CeO2更高的氧空位含量, 展现出了更好的臭氧分解性能和臭氧催化氧化甲苯的性能.
2) CeO2负载贵金属Pt颗粒后能提供更多的活性位点分解臭氧产生较稳定的过氧物种, 而过氧物种是氧化甲苯的重要活性物种之一.更多的过氧物种生成有助于甲苯氧化, 最终增强Pt/CeO2催化臭氧氧化甲苯性能.
Agarwal S, Zhu X, Hensen E J M, et al. 2014. Defect Chemistry of Ceria Nanorods[J]. The Journal of Physical Chemistry C, 118(8): 4131-4142. DOI:10.1021/jp409989y |
Anandan C, Bera P. 2013. XPS studies on the interaction of CeO2 with silicon in magnetron sputtered CeO2 thin films on Si and Si3N4 substrates[J]. Applied Surface Science, 283: 297-303. DOI:10.1016/j.apsusc.2013.06.104 |
Chen C Y, Chen F, Zhang L, et al. 2015. Importance of platinum particle size for complete oxidation of toluene over Pt/ZSM-5 catalysts[J]. Chemical Communications, 51(27): 5936-5938. DOI:10.1039/C4CC09383F |
Chen X, Chen X, Yu E Q, et al. 2018. In situ pyrolysis of Ce-MOF to prepare CeO2 catalyst with obviously improved catalytic performance for toluene combustion[J]. Chemical Engineering Journal, 344: 469-479. DOI:10.1016/j.cej.2018.03.091 |
Choi Y M, Abernathy H, Chen H T, et al. 2006. Characterization of O2-CeO2 Interactions Using In Situ Raman Spectroscopy and First-Principle Calculations[J]. Chem Phys Chem, 7(9): 1957-1963. DOI:10.1002/cphc.200600190 |
Daniel M, Loridant S. 2012. Probing reoxidation sites by in situ Raman spectroscopy:differences between reduced CeO2 and Pt/CeO2[J]. Journal of Raman Spectroscopy, 43(9): 1312-1319. DOI:10.1002/jrs.4030 |
Dutta G, Waghmare U V, Baidya T, et al. 2007. Hydrogen Spillover on CeO2/Pt:Enhanced Storage of Active Hydrogen[J]. Chemistry of Materials, 19(26): 6430-6436. DOI:10.1021/cm071330m |
Einaga H, Futamura S. 2004. Comparative study on the catalytic activities of alumina-supported metal oxides for oxidation of benzene and cyclohexane with ozone[J]. Reaction Kinetics and Catalysis Letters, 81(1): 121-128. |
Einaga H, Maeda N, Teraoka Y. 2013. Effect of catalyst composition and preparation conditions on catalytic properties of unsupported manganese oxides for benzene oxidation with ozone[J]. Applied Catalysis B:Environmental, 142-143: 406-413. DOI:10.1016/j.apcatb.2013.05.041 |
Einaga H, Maeda N, Yamamoto S, et al. 2015. Catalytic properties of copper-manganese mixed oxides supported on SiO2 for benzene oxidation with ozone[J]. Catalysis Today, 245: 22-27. DOI:10.1016/j.cattod.2014.09.018 |
Einaga H, Ogata A. 2009. Benzene oxidation with ozone over supported manganese oxide catalysts:effect of catalyst support and reaction conditions[J]. J Hazardous Materials, 164(2/3): 1236-1241. |
Fang R M, Huang W J, Huang H B, et al. 2019. Efficient MnOx/SiO2@AC catalyst for ozone-catalytic oxidation of gaseous benzene at ambient temperature[J]. Applied Surface Science, 470: 439-447. DOI:10.1016/j.apsusc.2018.11.146 |
Guzman J, Carrettin S, Corma A. 2005. Spectroscopic evidence for the supply of reactive oxygen during CO oxidation catalyzed by gold supported on nanocrystalline CeO2[J]. Journal of the American Chemical Society, 127(10): 3286-3287. DOI:10.1021/ja043752s |
Hu M C, Yao Z H, Hui K N, et al. 2017. Novel mechanistic view of catalytic ozonation of gaseous toluene by dual-site kinetic modelling[J]. Chemical Engineering Journal, 308: 710-718. DOI:10.1016/j.cej.2016.09.086 |
Hu Z, Liu X F, Meng D M, et al. 2016. Effect of ceria crystal plane on the physicochemical and catalytic properties of Pd/Ceria for CO and propane oxidation[J]. ACS Catalysis, 6(4): 2265-2279. |
Huang H, Dai Q G, Wang X Y. 2014. Morphology effect of Ru/CeO2 catalysts for the catalytic combustion of chlorobenzene[J]. Applied Catalysis B:Environmental, 158-159: 96-105. DOI:10.1016/j.apcatb.2014.01.062 |
Huang H B, Huang W J, Xu Y, et al. 2015. Catalytic oxidation of gaseous benzene with ozone over zeolite-supported metal oxide nanoparticles at room temperature[J]. Catalysis Today, 258: 627-633. DOI:10.1016/j.cattod.2015.01.006 |
Jia J B, Yang W J, Zhang P Y, et al. 2017. Facile synthesis of Fe-modified manganese oxide with high content of oxygen vacancies for efficient airborne ozone destruction[J]. Applied Catalysis A:General, 546: 79-86. DOI:10.1016/j.apcata.2017.08.013 |
Konova P, Stoyanova M, Naydenov A, et al. 2006. Catalytic oxidation of VOCs and CO by ozone over alumina supported cobalt oxide[J]. Applied Catalysis A:General, 298: 109-114. DOI:10.1016/j.apcata.2005.09.027 |
López J M, Gilbank A L, García T, et al. 2015. The prevalence of surface oxygen vacancies over the mobility of bulk oxygen in nanostructured ceria for the total toluene oxidation[J]. Applied Catalysis B:Environmental, 174-175: 403-412. DOI:10.1016/j.apcatb.2015.03.017 |
Lee Y J, He G H, Akey A J, et al. 2011. Raman analysis of mode softening in nanoparticle CeO2-δ and Au-CeO2-δ during CO oxidation[J]. Journal of the American Chemical Society, 133(33): 12952-12955. DOI:10.1021/ja204479j |
Li C, Domen K, Maruya K, et al. 1989. Dioxygen adsorption on well-outgassed and partially reduced cerium oxide studied by FT-IR[J]. Journal of the American Chemical Society, 111(20): 7683-7687. DOI:10.1021/ja00202a003 |
Li C, Domen K, Maruya K, et al. 1990. Oxygen exchange reactions over cerium oxide:An FT-IR study[J]. Journal of Catalysis, 123(2): 436-442. |
Lin S S, Chen C L, Chang D J, et al. 2002. Catalytic wet air oxidation of phenol by various CeO2 catalysts[J]. Water Research, 36(12): 3009-3014. DOI:10.1016/S0043-1354(01)00539-5 |
Lin W Y, Herzing A A, Kiely C J, et al. 2008. Probing metal-support interactions under oxidizing and reducing conditions:in situ Raman and infrared spectroscopic and scanning transmission electron microscopic-X-ray energy-dispersive spectroscopic investigation of supported platinum catalysts[J]. The Journal of Physical Chemistry C, 112(15): 5942-5951. DOI:10.1021/jp710591m |
Liu H H, Wang Y, Jia A P, et al. 2014. Oxygen vacancy promoted CO oxidation over Pt/CeO2 catalysts:A reaction at Pt-CeO2 interface[J]. Applied Surface Science, 314: 725-734. DOI:10.1016/j.apsusc.2014.06.196 |
Mao L G, Chen Z Z, Wu X Y, et al. 2018. Plasma-catalyst hybrid reactor with CeO2/γ-Al2O3 for benzene decomposition with synergetic effect and nano particle by-product reduction[J]. Journal of Hazardous Materials, 347: 150-159. DOI:10.1016/j.jhazmat.2017.12.064 |
McBride J R, Hass K C, Poindexter B D, et al. 1994. Raman and x-ray studies of Ce1-xRExO2-y, where RE=La, Pr, Nd, Eu, Gd, and Tb[J]. Journal of Applied Physics, 76(4): 2435-2441. DOI:10.1063/1.357593 |
Mo S P, Zhang Q, Zhang M Y, et al. 2019. Elucidating the special role of strong metal-support interactions in Pt/MnO2 catalysts for total toluene oxidation[J]. Nanoscale Horizons, 4(6): 1425-1433. DOI:10.1039/C9NH00303G |
Natile M M, Boccaletti G, Glisenti A. 2005. Properties and reactivity of nanostructured CeO2 powders:Comparison among two synthesis procedures[J]. Chemistry of Materials, 17(25): 6272-6286. DOI:10.1021/cm051352d |
Nolan M, Parker S C, Watson G W. 2005. The electronic structure of oxygen vacancy defects at the low index surfaces of ceria[J]. Surface Science, 595(1): 223-232. |
Pal P, Singha R K, Saha A, et al. 2015. Defect-induced efficient partial oxidation of methane over nonstoichiometric Ni/CeO2 nanocrystals[J]. The Journal of Physical Chemistry C, 119(24): 13610-13618. DOI:10.1021/acs.jpcc.5b01724 |
Peng R S, Li S J, Sun X B, et al. 2018. Size effect of Pt nanoparticles on the catalytic oxidation of toluene over Pt/CeO2 catalysts[J]. Applied Catalysis B:Environmental, 220: 462-470. DOI:10.1016/j.apcatb.2017.07.048 |
Peng R S, Sun X B, Li S J, et al. 2016. Shape effect of Pt/CeO2 catalysts on the catalytic oxidation of toluene[J]. Chemical Engineering Journal, 306: 1234-1246. DOI:10.1016/j.cej.2016.08.056 |
Pushkarev V V, Kovalchuk V I, d'Itri J L. 2004. Probing Defect Sites on the CeO2 Surface with Dioxygen[J]. The Journal of Physical Chemistry B, 108(17): 5341-5348. DOI:10.1021/jp0311254 |
Reyes P, Pecchi G, Morales M, et al. 1997. The nature of the support and the metal precursor on the resistance to sulphur poisoning of Pt supported catalysts[J]. Applied Catalysis A:General, 163(1): 145-152. |
Rodriguez J A, Liu P, Hrbek J, et al. 2007. Water gas shift reaction on Cu and Au nanoparticles supported on CeO2 (111) and ZnO (0001-):Intrinsic activity and importance of support interactions[J]. Angewandte Chemie International Edition, 46(8): 1329-1332. DOI:10.1002/anie.200603931 |
Romeo M, Bak K, El Fallah J, et al. 1993. XPS Study of the reduction of cerium dioxide[J]. Surface and Interface Analysis, 20(6): 508-512. DOI:10.1002/sia.740200604 |
Si R, Flytzani Stephanopoulos M. 2008. Shape and crystal-plane effects of nanoscale ceria on the activity of Au-CeO2 catalysts for the water-gas shift reaction[J]. Angewandte Chemie International Edition, 47(15): 2884-2887. DOI:10.1002/anie.200705828 |
Tong T, Liu X H, Guo Y, et al. 2018. The critical role of CeO2 crystal-plane in controlling Pt chemical states on the hydrogenolysis of furfuryl alcohol to 1, 2-pentanediol[J]. Journal of catalysis, 365: 420-428. DOI:10.1016/j.jcat.2018.07.023 |
Trovarelli A. 1996. Catalytic properties of ceria and CeO2-containing materials[J]. Catalysis Reviews, 38(4): 439-520. DOI:10.1080/01614949608006464 |
Wang X Q, Wu J L, Wang J L, et al. 2019. Methanol plasma-catalytic oxidation over CeO2 catalysts:Effect of ceria morphology and reaction mechanism[J]. Chemical Engineering Journal, 369: 233-244. DOI:10.1016/j.cej.2019.03.067 |
Weber W H, Hass K C, McBride J R. 1993. Raman study of CeO2:second-order scattering, lattice dynamics, and particle-size effects[J]. Physical Review B, 48(1): 178. DOI:10.1103/PhysRevB.48.178 |
Wu J F, Su T M, Jiang Y X, et al. 2017. In situ DRIFTS study of O3 adsorption on CaO, γ-Al2O3, CuO, α-Fe2O3 and ZnO at room temperature for the catalytic ozonation of cinnamaldehyde[J]. Applied Surface Science, 412: 290-305. DOI:10.1016/j.apsusc.2017.03.237 |
王雪青, 黎欢毅, 王邦芬, 等. 2019. 等离子体场内CeO2催化降解甲醇的表面活性氧物种来源与作用研究[J]. 环境科学学报, 39(8): 2725-2734. |
Wu Z L, Li M J, Howe J, et al. 2010. Probing defect sites on CeO2 nanocrystals with well-defined surface planes by Raman spectroscopy and O2 adsorption[J]. Langmuir, 26(21): 16595-606. DOI:10.1021/la101723w |
Xiao H L, Wu J L, Wang X Q, et al. 2018. Ozone-enhanced deep catalytic oxidation of toluene over a platinum-ceria-supported BEA zeolite catalyst[J]. Molecular Catalysis, 460: 7-15. DOI:10.1016/j.mcat.2018.09.005 |
Yang Y, Zhang S Z, Wang S W, et al. 2015. Ball milling synthesized MnOx as highly active catalyst for gaseous POPs removal:significance of mechanochemically induced oxygen vacancies[J]. Environmental Science & Technology, 49(7): 4473-4480. |
Yang Y J, Jia J B, Liu Y, et al. 2018. The effect of tungsten doping on the catalytic activity of α-MnO2 nanomaterial for ozone decomposition under humid condition[J]. Applied Catalysis A:General, 562: 132-141. DOI:10.1016/j.apcata.2018.06.006 |
Yang Z X, Lu Z S, Luo G X. 2007a. First-principles study of the Pt/CeO2 (111) interface[J]. Physical Review B, 76(7): 075421. DOI:10.1103/PhysRevB.76.075421 |
Yang Z X, Lu Z S, Luo G X, et al. 2007b. Oxygen vacancy formation energy at the Pd/CeO2 (111) interface[J]. Physics Letters A, 369(1/2): 132-139. |
Yu L, Peng R S, Chen L M, et al. 2018. Ag supported on CeO2 with different morphologies for the catalytic oxidation of HCHO[J]. Chemical Engineering Journal, 334: 2480-2487. DOI:10.1016/j.cej.2017.11.121 |
Zeng J L, Liu X L, Wang J, et al. 2015. Catalytic oxidation of benzene over MnOx/TiO2 catalysts and the mechanism study[J]. Journal of Molecular Catalysis A:Chemical, 408: 221-227. DOI:10.1016/j.molcata.2015.07.024 |
Zhang C H, Wang C, Zhan W C, et al. 2013. Catalytic oxidation of vinyl chloride emission over LaMnO3 and LaB0.2Mn0.8O3 (B=Co, Ni, Fe) catalysts[J]. Applied Catalysis B:Environmental, 129: 509-516. DOI:10.1016/j.apcatb.2012.09.056 |
Zhang Y, Chen M X, Zhang Z X, et al. 2019. Simultaneously catalytic decomposition of formaldehyde and ozone over manganese cerium oxides at room temperature:Promotional effect of relative humidity on the MnCeOx solid solution[J]. Catalysis Today, 327: 323-333. DOI:10.1016/j.cattod.2018.04.027 |
Zhao Z, Yang X G, Wu Y. 1996. Comparative study of Nickel-based perovskite-like mixed oxide catalysts for direct decomposition of NO[J]. Applied Catalysis B:Environmental, 8(3): 281-297. DOI:10.1016/0926-3373(95)00067-4 |
Zhou K, Wang X, Sun X, et al. 2005. Enhanced catalytic activity of ceria nanorods from well-defined reactive crystal planes[J]. Journal of Catalysis, 229(1): 206-212. |
Zhu G X, Zhu J G, Jiang W J, et al. 2017. Surface oxygen vacancy induced α-MnO2 nanofiber for highly efficient ozone elimination[J]. Applied Catalysis B:Environmental, 209: 729-737. DOI:10.1016/j.apcatb.2017.02.068 |
 2020, Vol. 40
2020, Vol. 40


