2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049
随着工业化和城镇化的快速发展, 人类活动带来了重金属污染问题.在我国某些矿区如广东大宝山矿区、湖南郴州柿竹园矿区等区域, 矿产开采和金属冶炼等人为活动造成了有害重金属污染, 而且多种重金属以复合形式存在, 其中以镉、砷复合污染较为普遍(单宇等, 2017).矿产开采和冶炼过程中释放到土壤和水体中的镉、砷由于其生物不可降解性, 会在生态系统中永久存在和累积(Li et al., 2018);并且可通过食物链进入人体, 而镉、砷作为人体非必需元素, 过量的镉、砷会带来严重的健康问题(Tan et al., 2016;Nawab et al., 2018).因此, 土壤和水体重金属复合污染修复已逐渐成为环境领域的一个研究热点.
目前, 化学沉淀法、离子交换法、吸附法和电动法等方法常用于重金属污染的治理(朱丹丹等, 2018;Zhao et al., 2019).其中, 吸附法是一种常用、高效、快速的修复手段.常用的吸附剂有生物炭、纳米材料和蒙脱石等(Asere et al., 2019;Liu et al., 2019;Wang et al., 2019;Awad et al., 2019).蒙脱石作为2:1型膨润性粘土矿物, 是一种环境友好且广泛应用的修复材料(Almasri et al., 2018).天然的蒙脱石以钙基蒙脱石为主, 产量高、成本低(Bhattacharyya等(2008)).同时, 蒙脱石表面带负电荷, 具有较高的阳离子交换量, 因而对重金属阳离子表现出较高的吸附能力.如Bhattacharyya等(2008)研究表明, 蒙脱石对Cd(Ⅱ)的吸附量高于高岭石、膨润土和赤泥等.类似地, 也有其他学者研究发现蒙脱石对Cd(Ⅱ)的吸附量要高于高岭石、针铁矿和海泡石(李丽等, 2017;Yadav et al., 2019).蒙脱石由于对金属阴离子亲和力低, 与其他材料相容性较好, 因而常被制成复合材料.研究发现, 在去除水体中As(Ⅴ)的材料中以含铁材料的去除效果最佳(吴和秋等, 2018).因此, 本课题组假设蒙脱石和含铁材料的复合有利于实现Cd(Ⅱ)和As(Ⅴ)的同步去除.目前, 已有研究发现铁改性的蒙脱石对单一的Cd(Ⅱ)和As(Ⅴ)均具有去除作用.例如, Wu等(2009)制备的铁柱撑改性蒙脱石增加了对Cd(Ⅱ)的亲和力, 但最大吸附量低于原矿蒙脱石.Franco等(2016)研究表明, 铁改性蒙脱石对单一Cd(Ⅱ)和As(Ⅴ)的吸附性能高于蒙脱石, 但吸附量均较低.Luengo等(2011)采用三价铁改性的钠基蒙脱石对As(Ⅴ)的吸附量为52 μmol·g-1, 低于水铁矿(700 μmol·g-1)和针铁矿(192~200 μmol·g-1).以往的研究主要集中在吸附剂对单一金属的吸附能力和机理上, 忽略了多种重金属在天然水体和土壤环境中的相互作用.因此, 本研究选择Cd(Ⅱ)和As(Ⅴ)模拟水体重金属复合污染, 探讨镉、砷相互作用对羟基铁柱撑改性后蒙脱石吸附性能的影响, 并探索其对镉、砷的吸附机理, 以期为其应用于镉、砷复合污染农田土壤提供理论依据.
2 材料与方法(Materials and methods) 2.1 主要实验材料钙基蒙脱石购自河南巩义市元亨净水材料厂(200目), 成分为:蒙脱石62%、石英8%、方英石16%和长石14%, 阳离子交换能力(CEC)为58.7 cmol·kg-1.
含单一Cd(Ⅱ)、As(Ⅴ)及复合Cd(Ⅱ)和As(Ⅴ)模拟废水制备:准确称取2.75 g Cd(NO3)2·4H2O(分析纯, 国药集团化学试剂有限公司)和4.16 g Na2HAsO4·7H2O(分析纯, 上海化学试剂厂), 分别用去离子水完全溶解后转移至1000 mL容量瓶中, 定容, 混匀, 配制成质量浓度为1000 mg·L-1的Cd(Ⅱ)和As(Ⅴ)贮备溶液.批实验前用10 mmol·L-1的MES(分析纯, BIOSHARP)缓冲溶液调节体系初始pH分别为5.5和6.5, 10 mmol·L-1的NaNO3(分析纯, 南京化学试剂股份有限公司)为支持电解质, 配制成不同质量浓度的单一Cd(Ⅱ)、As(Ⅴ)及Cd(Ⅱ)-As(Ⅴ)复合工作溶液.
2.2 羟基铁柱撑蒙脱石的制备参考已有研究(Ren et al., 2014;Hu et al., 2010)的方法制备羟基铁柱撑蒙脱石.具体步骤为:称取2020 g固体Fe(NO3)3·9H2O(分析纯, 国药集团化学试剂有限公司)溶于1 L去离子水中制备成5.0 mol·L-1 Fe3+溶液;然后向溶液中加入200 g NaOH(分析纯, 南京化学试剂股份有限公司)固体, 保证溶液中氢氧根与铁离子的物质的量比为1:1, 置于60 ℃恒温水浴锅中搅拌2 h, 25 ℃黑暗条件下老化48 h, 即得到羟基铁柱撑液(雷明婧等, 2017).称取500 g蒙脱石于烧杯中, 加入5 L去离子水, 配制成质量分数为10%的蒙脱石悬浮液;再将烧杯置于磁力搅拌器上, 边搅拌边缓慢加入羟基铁柱撑液, 使Fe3+与蒙脱石的摩尔质量比为10 mmol·g-1(雷明婧等, 2017);然后60 ℃下恒温搅拌2 h, 25 ℃黑暗条件下老化48 h, 再将其离心、洗涤4次, 70 ℃烘干, 研磨过0.075 mm筛备用.
2.3 吸附实验 2.3.1 吸附动力学实验分别称取0.05 g蒙脱石和羟基铁柱撑蒙脱石添加到初始浓度为100 mg·L-1的单一Cd(Ⅱ)和As(Ⅴ)溶液中, 溶液体积为25 mL, 并将溶液初始pH调节至5.5, 再将其置于25 ℃的恒温振荡器中, 恒温振荡30 h((25±1) ℃).每隔一段时间取样, 离心分离, 上清液用0.45 μm滤膜过滤, 每个处理4个重复.测定不同时间吸附后溶液中Cd(Ⅱ)和As(Ⅴ)浓度, 计算吸附量.采用准一级动力学和准二级动力学方程来描述吸附动力学过程(谢厦等, 2019).
2.3.2 等温吸附实验Cd/As单一体系:配制一系列体积为25 mL, 初始浓度分别为1、5、10、20、50、100、150、200 mg·L-1的单一Cd(Ⅱ)和As(Ⅴ)溶液.加入0.05 g改性前后的蒙脱石, 调节溶液初始pH分别为5.5和6.5(Ramesh et al., 2007;Ren et al., 2014).Cd(Ⅱ)-As(Ⅴ)复合体系:配制一系列体积为25 mL, 不同初始浓度及初始pH条件的Cd(Ⅱ)-As(Ⅴ)复合溶液(pH=5.5条件下Cd(Ⅱ)和As(Ⅴ)初始浓度分别为0.8~200 mg·L-1和0.1~25 mg·L-1;pH=6.5条件下Cd(Ⅱ)和As(Ⅴ)初始浓度分别为0.8~40 mg·L-1和0.1~5 mg·L-1)(Li et al., 2018).恒温振荡24 h((25±1) ℃), 吸附后离心分离, 上清液用0.45 μm滤膜过滤, 每个处理4个重复.测定吸附前后溶液中Cd(Ⅱ)和As(Ⅴ)浓度, 计算吸附量.采用Langmuir和Freundlich等温吸附模型方程拟合(Xu et al., 2019).
2.4 分析方法和仪器采用BET比表面积仪(ASAP 2020, 美国)对改性前后蒙脱石的比表面积和平均孔径进行表征.采用扫描电子显微镜(XL-30 ESEM, 荷兰)对改性前后蒙脱石的表面形貌进行测定.采用X-射线衍射(Ultima IV, 日本)测定改性前后蒙脱石的矿物组成, 测定条件为:X-射线管选用铜靶, Ka1射线波长为1.5406 Å, 管压为40 kV, 管流为40 mA, 扫描范围2θ为0°~60°, 步长为0.02°.采用X-射线光电子能谱仪(Escalab 250xi, 美国)表征羟基铁柱撑蒙脱石吸附前后元素的表面组成及结合状态, 测定条件:激发源为Al Kα X射线源, 工作电压为15 kV.溶液pH值采用pH计测定(PHS-3E, 中国上海).溶液中的As(Ⅴ)采用原子荧光分光光度计(AFS-9130, 中国)和电感耦合等离子体发射光谱仪ICP-OES(ICAP7400, 美国)测定;Cd(Ⅱ)采用电感耦合等离子体发射质谱仪ICP-MS(7700x, 美国)和电感耦合等离子体发射光谱仪ICP-OES(ICAP7400, 美国)测定.
3 结果与讨论(Results and discussion) 3.1 改性前后蒙脱石的表征根据表 1的比表面积和平均孔径表征结果可得羟基铁柱撑蒙脱石较蒙脱石比表面积增大, 增加了28.2%, 有助于增加对重金属的吸附, 但平均孔径无明显变化.由图 1可得, 蒙脱石(001)峰的2θ值为6.05°, 而改性后的羟基铁柱撑蒙脱石(001)峰的2θ值为7.00°(Yuan et al., 2008).改性后蒙脱石(001)峰强度的降低和峰形变宽表明羟基铁柱撑蒙脱石层的叠置较蒙脱石层的叠置更加无序(Luengo et al., 2011).根据布拉格方程可知改性后蒙脱石的层间距由原来的1.47 nm减少至1.28 nm, 这可能是由于水合钙离子半径大于铁离子.而关于羟基铁柱撑改性后的蒙脱石层间距的结果报道并不一致.Wu等(2009)研究发现, 羟基铁修饰可以增加蒙脱石的层间距, 但Borgnino等(2009)研究发现, 三价铁修饰后蒙脱石层间距减小, 并将其归因于Fe3+的水合半径小于Ca2+或Na+的水合半径.改性后蒙脱石的XRD图谱上并未观察到具有晶型结构单独的铁氧化物相.但水合氧化铁表面积一般为300 m2·g-1, 甚至是600 m2·g-1, 所以羟基铁柱撑蒙脱石BET比表面积的增加间接证实了无定形水合氧化铁的存在(Green et al., 2000;Antelo et al., 2010;Hiemstra et al., 2010).
| 表 1 蒙脱石和羟基铁柱撑蒙脱石的BET比表面积和平均孔径 Table 1 BET specific surface area and average pore width of montmorillonite and hydroxy-iron-pillared montmorillonite |
 |
| 图 1 蒙脱石及羟基铁柱撑蒙脱石的XRD图 Fig. 1 XRD patterns of montmorillonite and hydroxy-iron-pillared montmorillonite |
蒙脱石和羟基铁柱撑蒙脱石的SEM结果如图 2所示.蒙脱石表面结构相互堆积, 成片状, 粒径大小不均一(图 2a、2b);羟基铁柱撑蒙脱石表面光滑, 粒径大小趋于均一, 堆积紧实, 空隙减小(图 2c、2d).改性后蒙脱石层间距的变化和形貌的改变可能对镉、砷的吸附扩散动力学过程产生影响(Ramesh et al., 2007).
 |
| 图 2 不同尺度下蒙脱石(a.1 μm, b.50 μm)和羟基铁柱撑蒙脱石(c.1 μm, d.50 μm)的扫描电子显微镜图片 Fig. 2 SEM images of montmorillonite (a.1 μm, b.50 μm) and hydroxy-iron-pillared montmorillonite (c.1 μm, d.50 μm) modification at different scales |
采用XPS对改性前后的蒙脱石和吸附Cd(Ⅱ)和As(Ⅴ)后的羟基铁柱撑蒙脱石进行表征, 结果如图 3所示.XPS对蒙脱石和羟基铁柱撑蒙脱石的广谱扫描结果显示(图 3a), 蒙脱石表面主要由氧、硅、铝和镁等元素组成, 而羟基铁柱撑改性后的蒙脱石中Fe元素峰信号明显加强, 表明改性后蒙脱石的表面或层间Fe元素含量增加.羟基铁柱撑蒙脱石吸附Cd(Ⅱ)和As(Ⅴ)前后Fe 2p区域的窄扫描结果证实了材料表面铁的氧化状态(图 3b).结合能与原子的化学环境密切相关, 可反映原子的结合形态.Fe 2p3/2和Fe 2p1/2的结合能分别为711.5和723.9 eV, 拟合结果显示分别对应的是Fe2O3和FeOOH(Yamashita et al., 2007;Peng et al., 2019).吸附As(Ⅴ)和Cd(Ⅱ)后的羟基铁柱撑蒙脱石在45.65 eV处出现了As 3d3/2的特征峰(图 3c), 在406.94 eV处出现了Cd 3d5/2的特征峰(图 3d).
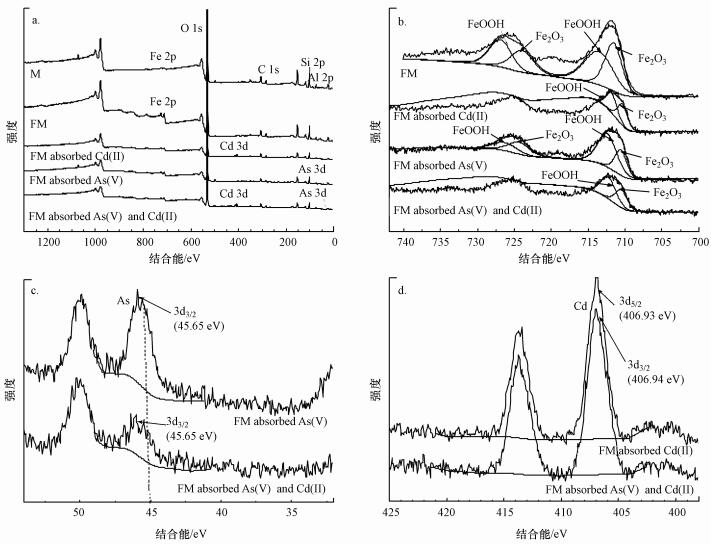 |
| 图 3 羟基铁柱撑蒙脱石吸附Cd、As前后和蒙脱石的XPS图谱(a.宽扫描, b~d.Fe 2p、As 3d和Cd 3d的窄扫描)(M:蒙脱石;FM:羟基铁柱撑蒙脱石;下同) Fig. 3 XPS spectra of hydroxy-iron-pillared montmorillonite before and after adsorption for Cd and As and montmorillonite(a.wide scanning, b~d.narrow scan of Fe 2p, As 3d and Cd 3d) |
图 4为改性前后蒙脱石吸附Cd(Ⅱ)和As(Ⅴ)的动力学曲线.由图 4可知, 蒙脱石在初始1 h内快速吸附Cd(Ⅱ), 吸附量达14.76 mg·g-1, 约5 h后趋于稳定, 吸附达到平衡.羟基铁柱撑蒙脱石在初始1 h内快速吸附Cd(Ⅱ), 约10 h后吸附达到平衡, 平衡吸附量略低于蒙脱石, 但无明显差异.由图 4还可知, 蒙脱石对As(Ⅴ)没有亲合力, 原因是蒙脱石层间带负电, 与负电性的As(V)之间存在强烈的静电排斥作用, 而蒙脱石对水的吸附导致溶液中的As(Ⅴ)浓度增加, 故吸附量显示为负值.羟基铁柱撑蒙脱石在初始1 h内迅速吸附As(Ⅴ), 约5 h后吸附达到平衡, 可能原因是羟基铁柱撑蒙脱石层间内部存在不同类型的吸附点位, As(V)初期在表面吸附点位快速吸附, 后期吸附速率较慢是As(V)扩散到羟基铁柱撑蒙脱石层间内部吸附点位过程较慢所致.根据表 2的拟合参数结果可得, 准二级动力学方程更能准确地描述羟基铁柱撑蒙脱石对Cd(Ⅱ)的吸附, 而羟基铁柱撑蒙脱石对As(Ⅴ)的吸附过程更符合准二级动力学方程, 这与前人的研究结果相符(Wu et al., 2009;Ren et al., 2014).
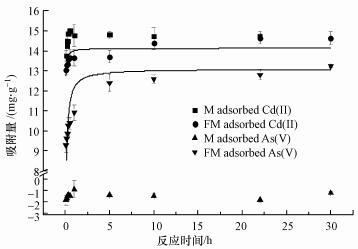 |
| 图 4 蒙脱石(M)及羟基铁柱撑蒙脱石(FM)吸附Cd或As的吸附动力学曲线图 Fig. 4 Kinetic adsorption curves of Cd or As on montmorillonite and hydroxy-iron-pillared montmorillonite |
| 表 2 羟基铁柱撑蒙脱石吸附Cd、As的动力学参数 Table 2 Kinetic parameters for the adsorption of Cd and As on hydroxy-iron-pillared montmorillonite |
采用Langmuir和Freundlich模型方程对改性前后蒙脱石吸附Cd(Ⅱ)和As(Ⅴ)的吸附等温线进行拟合(图 5), 相关参数见表 3.Langmuir模型假设固体表面吸附位点是均匀和有限的, 每个吸附位点只吸附一个分子, 且吸附分子间无作用力.Freundlich模型假设吸附是多层吸附.在单一Cd(Ⅱ)溶液体系中, Langmuir模型(R2=0.9768~0.9971)能更好地描述蒙脱石和羟基铁柱撑蒙脱石对Cd(Ⅱ)的吸附.由图 5a可知, 不同初始pH(5.5和6.5)可影响吸附剂表面电荷, 进而影响镉在改性前后蒙脱石上的吸附行为, 改性前后蒙脱石对Cd(Ⅱ)的吸附量随pH值的增加而增加.在酸性条件下, 吸附剂表面发生质子化反应, 低pH条件下, 大量H+吸附在吸附剂表面, H+与Cd(Ⅱ)存在竞争吸附, 而pH值增加, OH-浓度增加, 吸附剂表面带的负电荷点位增加, H+对Cd(Ⅱ)的竞争作用减弱, Cd(Ⅱ)与吸附剂边缘断键羟基点位的络合反应增强(邹献中等, 2004;徐明岗等, 2005;Wu et al., 2009).羟基铁柱撑改性后的蒙脱石对Cd(Ⅱ)的吸附量降低, 最大吸附量为21.36 mg·g-1, 可能原因是羟基铁的进入造成阳离子交换量降低, 进而主要通过表面络合和沉淀来增强重金属的吸附能力(Wu et al., 2009).此外, 由图 3b可得, 羟基铁柱撑蒙脱石吸附Cd(Ⅱ)后, Fe2O3和FeOOH的比例发生不同变化, 单一吸附Cd(Ⅱ)后, FeOOH的比例下降表明FeOOH主要参与镉的吸附(Xu et al., 2019).
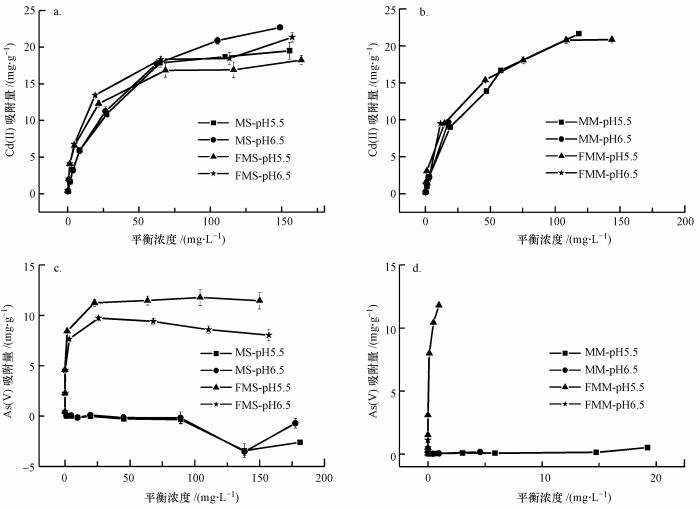 |
| 图 5 不同pH下改性前后蒙脱石对Cd(a.单一体系, b.复合体系)和As(c.单一体系, d.复合体系)的吸附等温曲线(MS:蒙脱石单独吸附Cd或As;FMS:羟基铁柱撑蒙脱石单独吸附Cd或As;MM:蒙脱石同时吸附Cd和As;FMM:羟基铁柱撑蒙脱石同时吸附Cd和As) Fig. 5 Adsorption isotherms of Cd(a.single system, b.composite system) and As(c.single system, d.composite system) on montmorillonite and modified montmorillonite at different pH |
Freundlich模型(R2=0.9387~0.9989)能更好地解释羟基铁柱撑蒙脱石对单一体系中As(Ⅴ)的等温吸附过程, 且1/n在0.1~1之间, 表明As(Ⅴ)在羟基铁柱撑蒙脱石表面是多层吸附, 可能受化学吸附控制(Ren et al., 2014).由图 5c可知, 改性后蒙脱石对As(Ⅴ)表现出较强的亲和力, 吸附量明显增加, 最大吸附量为11.45 mg·g-1, 表明羟基铁的存在为As(Ⅴ)创造了有利的吸附位点(Luengo et al., 2011).根据XPS图谱(图 3b)的拟合结果可得, 羟基铁柱撑蒙脱石吸附As(Ⅴ)后, Fe2O3和FeOOH的比例发生了不同变化, 单一吸附As(Ⅴ)后Fe2O3比例下降, 表明Fe2O3主要参与砷的吸附, 验证了羟基铁的作用(Xu et al., 2019).羟基铁的存在可促进As(Ⅴ)在羟基铁柱撑蒙脱石表面和内层形成络合物, 发生络合作用.有研究发现, As(Ⅴ)在含铁材料表面可以形成双齿双核结构的络合物(吴志坚等, 2010; Antelo et al., 2015).此外, pH值的变化会影响改性后蒙脱石对As(Ⅴ)的吸附.随着体系pH值的增加, OH-浓度增加, 减弱了砷酸根离子与羟基铁的络合作用, 进而造成对砷吸附量的降低.
| 表 3 不同pH下蒙脱石和羟基铁柱撑蒙脱石对单一Cd、As及复合Cd和As的等温吸附参数 Table 3 Isothermal adsorption parameters for Cd and As adsorption isotherms on montmorillonite and hydroxy-iron-pillared montmorillonite in singular and binary Cd and As solutions at different pH |
在Cd(Ⅱ)-As(Ⅴ)复合体系等温吸附实验中, Cd(Ⅱ)和As(Ⅴ)质量浓度比设为8:1.吸附前所配制的复合溶液中Cd(Ⅱ)和As(Ⅴ)浓度均不随时间增长发生变化, 保证了溶液体系中未形成Cd3(AsO4)2沉淀.根据表 3的拟合结果可得, 初始pH为5.5时, Langmuir模型能更好地解释蒙脱石和羟基铁柱撑蒙脱石对复合体系中Cd(Ⅱ)的等温吸附过程, 而初始pH为6.5时, Freundlich模型能更好地拟合蒙脱石和羟基铁柱撑蒙脱石对复合体系中Cd(Ⅱ)的等温吸附过程, 且1/n值较Cd(Ⅱ)单一体系值有所增加, 表明Cd(Ⅱ)-As(Ⅴ)复合体系中Cd(Ⅱ)与吸附剂的相互作用增强.Freundlich模型能更好地拟合羟基铁柱撑蒙脱石吸附As(Ⅴ)的过程, 且1/n值在0.1~1之间, 说明该吸附较易发生, 且1/n值较As(Ⅴ)单一体系值也有所增加, 表明Cd(Ⅱ)-As(Ⅴ)复合体系中As(Ⅴ)与吸附剂的相互作用增强.在Cd(Ⅱ)-As(Ⅴ)复合溶液体系中, pH=5.5条件下改性后蒙脱石对Cd(Ⅱ)和As(Ⅴ)吸附量高于改性后蒙脱石在单一Cd(Ⅱ)和As(Ⅴ)溶液中的吸附量, 分别增加了14.4%和23.7%, 说明镉、砷之间存在协同吸附作用.在较低的pH条件下, H+的存在增强了羟基铁对砷的吸附, 从而产生新的吸附位点增强了对镉的吸附, 也可能是羟基铁柱撑蒙脱石先与Cd(Ⅱ)形成复合物, 进而增强与As(Ⅴ)的络合和静电作用, 形成三元复合物(Li et al., 2018).在较高pH值条件下, 复合体系中镉、砷吸附量较单一体系无明显变化, 可能是OH-浓度的增加减弱了低酸性条件下的静电作用, 而As(Ⅴ)和OH-竞争与羟基铁发生络合作用, 羟基铁柱撑蒙脱石表面吸附的砷同时为Cd(Ⅱ)提供一个新的吸附位点, 因此, 造成单一和复合体系吸附量的差异不大(刘闯等, 2015).根据XPS图谱(图 3b)拟合结果可得, 改性后蒙脱石同时吸附Cd(Ⅱ)和As(Ⅴ)时, Fe2O3比例的下降程度较单独吸附As(Ⅴ)高, 表明镉、砷同时存在的体系中, 羟基铁柱撑蒙脱石对砷具有更高的亲和力, 进而进一步解释了高pH值条件下镉、砷吸附量未明显增加的原因(Xu et al., 2019).
与文献报道的其他改性粘土吸附剂对Cd(Ⅱ)和As(Ⅴ)的最大吸附量相比, 发现羟基铁柱撑改性蒙脱石对Cd(Ⅱ)的吸附能力高于腐殖酸改性蒙脱石(14.15 mg·g-1)(Wu et al., 2011)和巯基有机硅烷改性高岭石(4.38 mg·g-1)(李骁等, 2017), 对As(Ⅴ)的吸附能力高于Fe(Ⅲ)改性蒙脱石(7.22 mg·g-1)(Luengo et al., 2011)和有机改性蒙脱石(4.73 mg·g-1)(Mukhopadhyay et al., 2019), 且pH为5.5时, 镉、砷复合体系中改性后蒙脱石对Cd(Ⅱ)和As(Ⅴ)的吸附量高于改性后蒙脱石在单一Cd(Ⅱ)和As(Ⅴ)溶液中的吸附量, 表明该吸附剂对Cd(Ⅱ)和As(Ⅴ)的复合污染环境具有修复潜力.
4 结论(Conclusions)1) 不同初始时间、初始浓度和初始pH对改性蒙脱石的吸附能力均有一定影响.羟基铁柱撑蒙脱石吸附Cd(Ⅱ)的最优初始pH和最佳接触时间分别为6.5和10 h, 吸附As(Ⅴ)的最优初始pH和最佳接触时间分别为5.5和5 h.
2) 羟基铁柱撑蒙脱石对Cd(Ⅱ)和As(Ⅴ)的最大吸附量分别为21.36 mg·g-1和11.45 mg·g-1.XRD、XPS、动力学实验和等温吸附实验结果表明, 离子交换和化学络合是羟基铁柱撑蒙脱石吸附Cd(II)和As(Ⅴ)的主要机理.
3) 在Cd(Ⅱ)-As(Ⅴ)复合溶液体系中, pH为5.5时, 羟基铁柱撑蒙脱石对Cd(Ⅱ)和As(Ⅴ)的吸附量高于在单一体系Cd(Ⅱ)和As(Ⅴ)溶液中的吸附量, 分别增加了14.4%和23.7%, 表明Cd(Ⅱ)和As(Ⅴ)之间存在协同吸附作用.Cd(Ⅱ)-As(Ⅴ)复合溶液体系中Cd(Ⅱ)和As(Ⅴ)吸附量的增加, 表明羟基铁柱撑蒙脱石在农田镉、砷复合污染中具有一定的的修复潜力和应用价值.
Almasri D A, Rhadfi T, Atieh M A, et al. 2018. High performance hydroxyiron modified montmorillonite nanoclay adsorbent for arsenite removal[J]. Chemical Engineering Journal, 335: 1-12. DOI:10.1016/j.cej.2017.10.031 |
Antelo J, Fiol S, Perez C, et al. 2010. Analysis of phosphate adsorption onto ferrihydrite using the CD-MUSIC model[J]. Journal of Colloid and Interface Science, 347(1): 112-119. DOI:10.1016/j.jcis.2010.03.020 |
Antelo J, Arce F, Fiol S. 2015. Arsenate and phosphate adsorption on ferrihydrite nanoparticles[J]. Chemical Geology, 410: 53-62. DOI:10.1016/j.chemgeo.2015.06.011 |
Asere T G, Stevens C V, Du Laing G. 2019. Use of (modified) natural adsorbents for arsenic remediation:A review[J]. Science of the Total Environment, 676: 706-720. DOI:10.1016/j.scitotenv.2019.04.237 |
Awad A M, Shaikh S M R, Jalab R, et al. 2019. Adsorption of organic pollutants by natural and modified clays:A comprehensive review[J]. Separation and Purification Technology, 228: 1-39. |
Bhattacharyya K G, Gupta S S. 2008. Adsorption of a few heavy metals on natural and modified kaolinite and montmorillonite:A review[J]. Advances in Colloid and Interface ScienceA, 140(2): 114-131. DOI:10.1016/j.cis.2007.12.008 |
Borgnino L, Avena M J, De Pauli C P. 2009. Synthesis and characterization of Fe(III)-montmorillonites for phosphate adsorption[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 341(1): 46-52. |
Franco F, Benitez-Guerrero M, Gonzalez-Trivino I, et al. 2016. Low-cost aluminum and iron oxides supported on dioctahedral and trioctahedral smectites:A comparative study of the effectiveness on the heavy metal adsorption from water[J]. Applied Clay Science, 119: 321-332. DOI:10.1016/j.clay.2015.10.035 |
Green-Pedersen H, Pind N. 2000. Preparation, characterization, and sorption properties for Ni(II) of iron oxyhydroxide-montmorillonite[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 168(2): 133-145. |
Hu B J, Luo H J. 2010. Adsorption of hexavalent chromium onto montmorillonite modified with hydroxyaluminum and cetyltrimethylammonium bromide[J]. Applied Surface Science, 257(3): 769-775. DOI:10.1016/j.apsusc.2010.07.062 |
Hiemstra T, Antelo J, Rahnemaie R, et al. 2010. Nanoparticles in natural systems I:The effective reactive surface area of the natural oxide fraction in field samples[J]. Geochim Cosmochim Acta, 74(1): 41-58. DOI:10.1016/j.gca.2009.10.018 |
雷明婧, 朱健, 王平, 等. 2012. 粘土矿物无机柱撑改性及其吸附研究进展[J]. 中南林业科技大学学报, 32(12): 73-77. |
李丽, 刘中, 宁阳, 等. 2017. 不同类型粘土矿物对镉吸附与解吸行为的研究[J]. 山西农业大学学报(自然科学版), 37(1): 60-66. DOI:10.3969/j.issn.1671-8151.2017.01.011 |
李骁, 吴宏海, 宋振豪, 等. 2017. 巯基有机硅烷嫁接高岭石对Cd(Ⅱ)的吸附性能研究[J]. 岩石矿物学杂志, 36(6): 865-872. DOI:10.3969/j.issn.1000-6524.2017.06.012 |
Li Z, Wang L, Meng J, et al. 2018. Zeolite-supported nanoscale zero-valent iron:New findings on simultaneous adsorption of Cd(II), Pb(II), and As(III) in aqueous solution and soil[J]. Journal of Hazardous Materials, 344: 1-11. DOI:10.1016/j.jhazmat.2017.09.036 |
刘闯, 黄力群, 谢毅, 等. 2015. 磁性氧化石墨烯同时吸附砷(Ⅴ)和镉的性能研究[J]. 环境工程, 33(s1): 165-169. |
Liu J, Wu P, Li S, et al. 2019. Synergistic deep removal of As(III) and Cd(II) by a calcined multifunctional MgZnFe-CO3 layered double hydroxide:Photooxidation, precipitation and adsorption[J]. Chemosphere, 225: 115-125. DOI:10.1016/j.chemosphere.2019.03.009 |
Luengo C, Puccia V, Avena M. 2011. Arsenate adsorption and desorption kinetics on a Fe(III)-modified montmorillonite[J]. Journal of Hazardous Materials, 186(2/3): 1713-1719. |
Mukhopadhyay R, Manjaiah K M, Datta S C, et al. 2019. Comparison of properties and aquatic arsenic removal potentials of organically modified smectite adsorbents[J]. Journal of Hazardous Materials, 377: 124-131. DOI:10.1016/j.jhazmat.2019.05.053 |
Nawab J, Ghani J, Khan S, et al. 2018. Minimizing the risk to human health due to the ingestion of arsenic and toxic metals in vegetables by the application of biochar, farmyard manure and peat moss[J]. Journal of Environmental Management, 214: 172-183. |
Peng Y T, Sun Y Q, Sun R Z, et al. 2019. Optimizing the synthesis of Fe/Al (Hydr)oxides-Biochars to maximize phosphate removal via response surface model[J]. Journal of Cleaner Production, 237: 1-11. |
Ramesh A, Hasegawa H, Maki T, et al. 2007. Adsorption of inorganic and organic arsenic from aqueous solutions by polymeric Al/Fe modified montmorillonite[J]. Separation and Purification Technology, 56(1): 90-100. DOI:10.1016/j.seppur.2007.01.025 |
Ren X H, Zhang Z L, Luo H J, et al. 2014. Adsorption of arsenic on modified montmorillonite[J]. Applied Clay Science, 97. |
单天宇, 刘秋辛, 阎秀兰, 等. 2017. 镉砷复合污染条件下镉低吸收水稻品种对镉和砷的吸收和累积特征[J]. 农业环境科学学报, 36(10): 1938-1945. DOI:10.11654/jaes.2017-0462 |
Tan S Y, Praveena S M, Abidin E Z, et al. 2016. A review of heavy metals in indoor dust and its human health-risk implications[J]. Reviews on Environmental Health, 31(4): 447-456. |
Wang H Y, Chen P, Zhu Y G, et al. 2019. Simultaneous adsorption and immobilization of As and Cd by birnessite-loaded biochar in water and soil[J]. Environmental Science and Pollution Research, 26(9): 8575-8584. DOI:10.1007/s11356-019-04315-x |
Wu P, Wu W, Li S, et al. 2009. Removal of Cd2+ from aqueous solution by adsorption using Fe-montmorillonite[J]. Journal of Hazardous Materials, 169: 824-830. DOI:10.1016/j.jhazmat.2009.04.022 |
Wu P, Zhang Q, Dai Y, et al. 2011. Adsorption of Cu(II), Cd(II) and Cr(III) ions from aqueous solutions on humic acid modified Ca-montmorillonite[J]. Geoderma, 164(3): 215-219. |
吴和秋, 侯钦宣, 张英. 2018. 含铁介质用于修复砷污染土壤研究综述[J]. 中国土壤与肥料, 274(2): 13-21. |
吴志坚, 刘海宁, 张慧芳. 2010. 离子强度对吸附影响机理的研究进展[J]. 环境化学, 29(6): 7-13. |
谢厦, 徐应明, 闫翠侠, 等. 2019. 酸碱复合改性海泡石亚结构特征及其对Cd(Ⅱ)吸附性能[J]. 环境科学, 40(1): 401-414. |
徐明岗, 季国亮. 2005. 恒电荷土壤及可变电荷土壤与离子间相互作用的研究[J]. 土壤学报, 42(2): 225-231. DOI:10.3321/j.issn:0564-3929.2005.02.008 |
Xu F, Chen H, Dai Y, et al. 2019. Arsenic adsorption and removal by a new starch stabilized ferromanganese binary oxide in water[J]. Journal of Environmental Management, 245: 160-167. |
Yamashita T, Hayes P. 2007. Analysis of XPS spectra of Fe2+ and Fe3+ ions in oxide materials[J]. Applied Surface Science, 254(8): 2441-2449. |
Yadav V B, Gadi R, Kalra S. 2019. Clay based nanocomposites for removal of heavy metals from water:A review[J]. Journal of Environmental Management, 232: 803-817. DOI:10.1016/j.jenvman.2018.11.120 |
Yuan P, Annabi-Bergaya F, Tao Q, et al. 2008. A combined study by XRD, MR, TG and HRTEM on the structure of delaminated Fe-intercalated/pillared clay[J]. Journal of Colloid and Interface Science, 324(1): 142-149. |
Zhao Y, Tian G Y, Duan X H, et al. 2019. Environmental applications of diatomite minerals in removing heavy metals from water[J]. Industrial & Engineering Chemistry Research, 58(27): 11638-11652. |
朱丹丹, 周启星. 2018. 功能纳米材料在重金属污染水体修复中的应用研究进展[J]. 农业环境科学学报, 37(8): 1551-1564. |
邹献中, 徐建民, 赵安珍, 等. 2004. 可变电荷土壤中铜离子的解吸[J]. 土壤学报, 41(1): 68-73. DOI:10.3321/j.issn:0564-3929.2004.01.011 |
 2020, Vol. 40
2020, Vol. 40


