2. 广东工业大学分析测试中心, 广州 510006
2. Analysis and Test Center, Guangdong University of Technology, Guangzhou 510006
碳纳米管(CNTs)是一种由碳原子通过SP2杂化与周围3个碳原子完全键合后形成的六边形管状结构纳米材料, 也是继C60之后碳的又一同素异形体(Lijima et al., 1991; Elhissi et al., 2012).由于其独特的比表面积、电导率、电磁性和催化活性等理化性质, 碳纳米管被广泛应用于科学、生物、医药、工业、环境等各个领域(Koumoulos et al., 2016; Trompeta et al., 2019; Bondavalli et al., 2019).随着纳米技术的不断发展, 碳纳米管的应用不断扩大.自2006年以来, 世界范围内碳纳米管产量至少增长了10倍, 相关文献报道和专利也在持续增加(De Volder et al., 2013).如此巨大的产量和使用量, 使得CNTs不可避免地在生产、运输、使用等过程释放到环境中.进入环境的碳纳米管容易随着水流在环境中迁移, 一旦被动物直接摄食或经食物链进入体内, 便可在生物体内富集, 从而影响生物健康, 威胁水生生态环境, 甚至会通过食物链进入人体, 造成人体健康风险(Petersen et al., 2011; Jovanovic et al., 2012; Callaghan et al., 2017; Pietroiusti et al., 2018).
研究表明, 碳纳米管会对杜氏藻(Wei et al., 2010)、斜生栅藻(Miao et al., 2009)等藻类微生物的生长产生抑制作用, 也会引起悬浮培养的水稻细胞聚集, 产生质壁分离和氧化胁迫效应(Tan et al., 2009; 袁刚强等, 2015), 还会对斑马鱼(da Rocha et al., 2013)、大型溞(Wang et al., 2016)、小鼠(Chou et al., 2008; 钟柏华等, 2014)等生物造成组织损伤病变, 甚至能够使人表皮角化细胞活性降低(Shvedova et al., 2003).其毒性作用机理主要包括诱导细胞内氧化应激和脂质过氧化作用(Nel et al., 2006), 或破坏生物体蛋白二级结构(Linse et al., 2007), 或通过呼吸系统、摄食途径进入动物体内造成机体损伤(Kam et al., 2004), 或直接物理渗透进入细胞壁/膜进行累积或转移(Maes et al., 2014)等.如果水生动物长期暴露于含有碳纳米管的水环境中, 其后代的发育也可能会受到影响, 可能导致基因突变、畸形甚至死亡.Martinez等(2019)研究发现, 多壁碳纳米管能够引起斑马鱼胚胎畸形、中性粒细胞迁移减少和心率改变.Asharani等(2008)也发现当多壁碳纳米管浓度高于60 μg·mL-1时, 斑马鱼胚胎会出现细胞凋亡、延迟孵化和异常脊索等现象.可见, 碳纳米管对水生动物胚胎的发育是具有毒性效应的.然而, 目前关于碳纳米管对两栖动物胚胎发育毒性的研究仍比较少.
热带爪蛙(Xenopus tropicalis)是近年新兴的发育生物学模式动物, 被誉为模式生物中的“青蛙王子”(毛炳宇等, 2008).由于具有生长周期短、产卵量大、胚胎形态易于观察、背景信息简单等特点, 被广泛应用于生态毒理学、细胞生物学、生殖发育学等领域(Kaltenbrun et al., 2011; 施华宏等, 2014; Hu et al., 2015).早在1991年, 爪蛙胚胎致畸实验(FETAX)就已经被标准化为发育毒性的实验方法(Dawson et al., 1991).因此, 本研究选用热带爪蛙胚胎作为试验生物, 选择不同发育时期(囊胚期、原肠胚期、神经胚期和尾芽期)的热带爪蛙胚胎, 暴露在不同浓度(25、50 mg·L-1)多壁碳纳米管溶液中, 通过比较评价热带爪蛙胚胎的死亡率、孵化率、畸形率、畸形类型、心率和体长等毒性指标, 探究多壁碳纳米管对爪蛙胚胎的发育毒性效应和敏感窗口, 以期为合理评价碳纳米管对水生生物胚胎的潜在毒性提供科学依据.
2 材料和方法(Materials and methods) 2.1 MWCNTs悬液的配制与表征多壁碳纳米管(MWCNT)购自北京博宇高科技新材料技术有限公司, 干燥粉末状, 直径 < 50 nm, 长度10~20 μm, 纯度98%.
准确称量0.01 g MWCNTs粉末于100 mL容量瓶中, 加入经自然曝气24 h的去离子水, 在使用前经0.45 μm微孔滤膜过滤, 避免其他固体颗粒影响实验结果, 最后将其定容至100 mL.在超声振荡器(100 W, 40 kHz)中振荡30 min, 以促进多碳纳米颗粒分散, 配成100 mg·L-1 MWCNTs储备液(现配现用).正式实验前将储备液超声30 min, 利用事先准备好的胚胎培养液(NaCl 25.713 g·L-1、Hepes 11.915 g·L-1、NaHCO3 1.008 g·L-1、KCl 0.373 g·L-1、MgSO4 0.494 g·L-1、Ca(NO3)2 0.779 g·L-1、CaCl2 0.227 g·L-1)配制得到不同浓度MWCNTs暴露液, 用于实验.
用一次性滴管取2~3滴MWCNTs储备液于干净的锡箔纸上, 自然晾干, 制成SEM样品, 置于场发射电子扫描显微镜(SU8220, 日本)下观察其表面形貌.同样, 取2~3滴MWCNTs储备液于干净的铜网微栅上, 用氙灯将其烘干制成TEM样品, 置于场发射电子透射显微镜(Talos F200S, 捷克)下观察其内部结构.
2.2 胚胎的获取与染毒处理成年热带爪蛙养殖于本实验室水循环系统中, 温度控制在25~28 ℃之间, 16 h光照8 h黑暗, 每天投喂2次赤虫或面包虫.实验前一天, 挑取健康且性成熟的雄、雌蛙各一只, 分别注射20单位人绒毛膜促性腺激素(HCG), 隔24 h后再各注射160单位HCG, 然后同时放进盛有胚胎培养液的2 L烧杯中, 置于恒温培养箱中在黑暗条件下使其抱对产卵.受精30 min后, 挑取适量的受精卵, 利用pH为7.9~8.0的3%半胱氨酸去除受精卵外的胶质膜得到早期胚胎.
为了探究MWCNTs对爪蛙胚胎的敏感窗口和胚胎毒性, 本研究根据爪蛙联盟数据库(http://www.xenbase.org/entry/)划分的5个胚胎发育时期, 选择囊胚期、原肠胚期、神经胚期和尾芽期的胚胎进行分阶段暴露, 对应的培养时间分别为4~7、7~14、14~22、22~92 h.为了降低胚胎之间的差异性, 实验时选取同一批但不同发育时期(囊胚期、原肠胚期、神经胚期、尾芽期)的胚胎作为试验生物.将实验浓度设置为25、50 mg·L-1, 每个浓度设置6个平行, 以6孔板作为暴露容器, 每孔添加10 mL不同浓度MWCNTs暴露液, 并吸取20颗与实验设置相应发育时期的胚胎, 暴露期间不喂食, 周期结束后将胚胎转移至新鲜胚胎培养液中继续孵化至96 h.染毒设计方案如图 1所示.
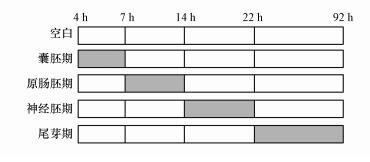 |
| 图 1 染毒设计方案 Fig. 1 Design scheme for poisoning |
实验期间, 利用体式荧光显微镜(SZX10, 上海)观察并记录相应发育时期胚胎的毒理学终点, 例如, 胚胎的死亡率、孵化率、畸形率、畸形类型、体长、心率等.胚胎凝结、停止心跳和未能发育都被认为是死亡的标志.死亡率为死亡胚胎数与胚胎总数之比, 孵化率为孵出胚胎数与胚胎总数之比.本研究中, “孵化”是指胚胎能够顺利从卵膜中脱出并发育, 而“没孵化”是指胚胎不能够顺利地从卵膜中挣脱出来, 或者挣脱卵膜后的胚胎受碳纳米颗粒影响不能继续发育.通过观察和记录畸形类型(包括心腔水肿、脊椎弯曲、发育紊乱、泄殖腔畸形和眼睛畸形等)和个数, 以畸形胚数与胚胎总数之比确定畸形率.此外, 胚胎的体长利用显微镜自带测量软件测定, 胚胎的心率记录为1 min的心跳次数.为了进行心跳测量, 从每个暴露组中随机挑取6只胚胎, 滴加2~3滴100 mg·L-1 3-乙氧酰基苯胺甲磺酸盐溶液(MS-222)麻醉后, 在室温下静置1 min以稳定其心跳速率, 置于体式显微视频下观察并记录1 min内的心跳次数.
2.4 拉曼光谱测定为了获得空白组和不同发育时期MWCNTs暴露处理后热带爪蛙胚胎体内MWCNTs的拉曼光谱, 以此来判断爪蛙胚胎是否摄入MWCNTs.本研究使用显微共焦拉曼光谱(LabRAM HR Evolution, 法国), 在50倍物镜, 波长为532 nm, 激光输出功率为25 mW, 光栅为600 gr·mm-1, 收集时间为5 s的条件下收集其光谱.96 h周期结束后, 利用100 mg·L-1 MS-222将存活胚胎麻醉, 放入4%多聚甲醛溶液(PFA)中于-4 ℃冰箱中保存待用.实验前, 用一次性吸管随机吸取数只胚胎, 并用磷酸盐缓冲溶液(PBS)洗涤两次, 盛于干净载玻片上进行冷冻干燥制成样品, 取出置于显微共焦拉曼光谱仪下收集拉曼光谱.为了鉴定热带爪蛙胚胎体内中MWCNTs的摄入情况, 将对照组和碳纳米管暴露组的光谱进行对比.
2.5 数据统计分析将爪蛙胚胎的死亡率、孵化率、畸形率、心率和体长数值表示为平均值±标准误差, 利用SPSS 17.0及Sigmaplot 10进行数据统计分析, 使用Origin 8.1进行作图(用*p < 0.05、**p < 0.01、***p < 0.001表示参数之间差异的显著性).
3 结果与讨论(Results and discussion) 3.1 MWCNTs形貌表征将利用曝气水制备的MWCNTs储备液在电镜下进行微观形貌观察, 结果如图 2所示.从图 2a可以看出, 经超声分散后MWCNT材料呈蓬松状, 没有明显的团聚现象, 分散性良好, 长度在10~20 μm之间.从图 2b的TEM图像可以看出, MWCNTs材料呈中空管状结构, 直径小于50 nm, 有较大的比表面积, 但表面结构比较粗糙, 且管中出现少量“黑点”, 有可能掺杂了其他物质, 说明本实验使用的MWCNTs与厂家提供的参数相符.所用MWCNTs经X射线衍射测得在2θ=26°处有明显的高峰值碳峰, 且未见多余的峰, 纯度较高(Ye et al., 2019).
 |
| 图 2 MWCNTs的扫描电镜(a)和透射电镜(b)图像 Fig. 2 SEM(a) and TEM(b) images of MWCNTs |
图 3为MWCNTs染毒后不同发育时期胚胎发育至96 h的死亡率变化情况.与对照组相比, 不同剂量MWCNTs暴露后均显著提高了爪蛙胚胎的死亡率(p < 0.05).在同一发育时期下, 50 mg·L-1 MWCNTs处理组的胚胎死亡率均略高于25 mg·L-1 MWCNTs处理组, 差值为1.42%~1.67%.而在同一浓度下, 不同发育时期胚胎的死亡率各不相同, 原肠胚期组的胚胎死亡率最高, 囊胚期组次之.利用25 mg·L-1 MWCNTs对不同发育阶段(囊胚期、原肠胚期、神经胚期、尾芽期)胚胎进行染毒后发育至96 h, 胚胎死亡率分别为6.42%、7.32%、5.80%、4.23%;同样, 50 mg·L-1 MWCNTs处理后, 对应阶段胚胎死亡率分别为8.09%、8.96%、7.22%、5.80%, 说明25 mg·L-1和50 mg·L-1 MWCNTs对早期发育阶段爪蛙胚胎的急性毒性均较低.Shaw等(2016)利用MWCNTs(≤160 mg·L-1)暴露处理斑马鱼胚胎, 发现MWCNTs对斑马鱼胚胎阶段的急性毒性较低, 大多数观察到的死亡现象是发生在暴露5 d或6 d后的孵化幼虫中.Da Silva等(2018)也发现TiO2-MWCNTs纳米杂交体对斑马鱼胚胎阶段没有急性毒性.
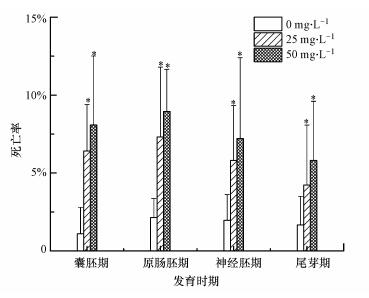 |
| 图 3 MWCNTs暴露下不同发育时期胚胎的死亡率 Fig. 3 Mortality rate of embryos at different developmental stages under MWCNTs exposure |
不同剂量MWCNTs处理组和对照组的爪蛙胚胎孵化率如图 4所示.由图 4可见, 不同剂量MWCNTs处理后, 原肠胚期组的胚胎孵化率均为最低, 分别仅有76.5%(25mg·L-1)和68.5%(50 mg·L-1), 与对照组相比显著下降(p < 0.05), 而尾芽期组的胚胎孵化率几乎不受影响.另外, 同一时期胚胎在不同剂量条件下, 50 mg·L-1 MWCNTs处理组的胚胎孵化率比25 mg·L-1处理组低, 说明50 mg·L-1 MWCNTs对胚胎孵化率的影响大于25 mg·L-1 MWCNTs, 且浓度效应最明显的为原肠胚期胚胎.囊胚期组与原肠胚期组选用的胚胎外层均含有一层胶质膜/绒毛膜, 在实验过程中能清楚地观察到胚胎外层包裹一层MWCNTs, 而这一事实也被其他研究报道过(Chen et al., 2011; Clemente et al., 2014).由图 5可见, 50 mg·L-1处理组中胚胎外层包裹的MWCNTs比25 mg·L-1处理组多, 这可能阻碍了胚胎的正常孵化, 成为导致该阶段胚胎孵化率较低的主要原因之一(Ghobadian et al., 2015; Sun et al., 2016).Aksakal等(2019)通过MWCNTs-COON暴露斑马鱼胚胎, 也发现其会延迟发育, 降低斑马鱼胚胎的孵化率.
 |
| 图 4 MWCNTs暴露下不同发育时期胚胎的孵化率 Fig. 4 Hatching rate of embryos at different developmental stages under MWCNTs exposure |
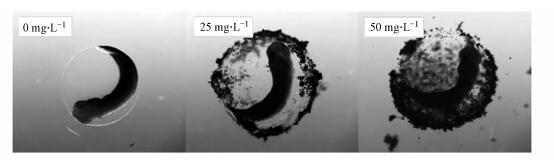 |
| 图 5 MWCNTs粘附原肠胚的显微图像 Fig. 5 Micrographs of MWCNTs adhering to gastrula embryos |
由图 6可知, 不同剂量的MWCNTs暴露均提高了爪蛙胚胎的畸形率.在50 mg·L-1 MWCNTs的神经胚期组中获得了最高的爪蛙胚胎畸形率(6.18%), 而在25 mg·L-1 MWCNTs的原肠胚期组中爪蛙胚胎畸形率达到最高(4.82%), 与对照组相比均显著升高(p < 0.05).Migliore等(2010)通过微核和彗星试验检测到MWCNTs能诱导小鼠巨噬细胞系(RAW 264.7)细胞中少量染色体和核酸受损.而原肠胚和神经胚正处于细胞分化器官形成阶段, 可能对MWCNTs比较敏感, 导致基因发生上调或下调.由于所有处理组中胚胎的畸形率在3.20%~6.18%之间, 与对照组相比仅提高了1.46%~3.52%, 说明MWCNTs(25、50 mg·L-1)对爪蛙胚胎没有显著的致畸效应, 该结论与Liu等(2014)的研究结果一致.
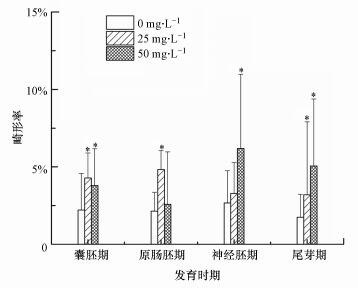 |
| 图 6 MWCNTs暴露下不同发育时期胚胎的畸形率 Fig. 6 Malformation rate of embryos at different developmental stages under MWCNTs exposure |
然而, 在不同发育时期的所有处理组(包括对照组)中均能观察心腔水肿、泄殖腔畸形(水肿/增大)和脊索弯曲等畸形胚胎.经MWCNTs暴露后, 囊胚期组中增加了眼睛水肿, 原肠胚期组中增加了眼睛变小, 神经胚组中增加了眼睛水肿、眼睛变小和全身萎缩畸形, 尾芽期组中增加了发育紊乱和其他畸形(图 7), 这些畸形类型在其他研究中也被报道过(刘臻等, 2011).Asharani等(2008)发现高浓度(>60 μg·mL-1)MWCNTs会参与斑马鱼胚胎脊索异常的形成.同时, 本研究也发现一只畸形胚胎往往携带1~3种畸形类型, 不同畸形类型出现的概率各不相同.经统计, 所有处理组(包括空白组)存活胚胎中一共有49只畸形胚胎, 8种畸形类型(图 7), 所有畸形类型出现的次数达108次.图 8为不同畸形类型出现次数占所有畸形类型出现总次数的比例, 其中, 心腔水肿出现的概率最大(28.7%), 脊索弯曲次之(图 8), 说明在碳纳米颗粒暴露下胚胎可能更容易发生心腔水肿畸形, 具体毒性机理还需进一步研究.
 |
| 图 7 MWCNTs暴露下不同发育时期胚胎的畸形类型(no:正常胚胎;ac:心腔水肿;ep:泄殖腔水肿;bn:脊索弯曲;elp:泄殖腔增大;ee:眼睛水肿;se:小眼睛;be:大眼睛;sb:发育紊乱;od:其他畸形) Fig. 7 Malformation types of embryos at different developmental stages under MWCNTs exposure |
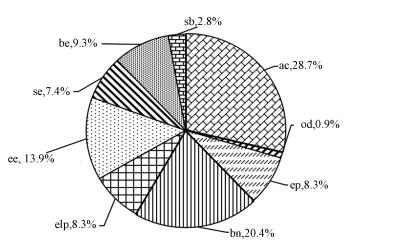 |
| 图 8 所有畸形胚胎的畸形类型比例(no, 正常胚胎;ac, 心腔水肿;ep, 泄殖腔水肿;bn, 脊索弯曲;elp, 泄殖腔增大;ee, 眼睛水肿;se, 小眼睛;be, 大眼睛;sb, 发育紊乱;od, 其他畸形) Fig. 8 Proportion of malformation types of all malformed embryos |
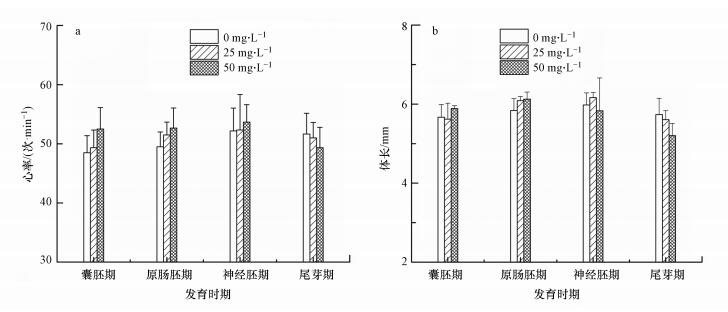
为了评估心力衰竭, 本研究测量了爪蛙胚胎的心跳率, 因为心脏是爪蛙胚胎发育的最早阶段形成的功能器官之一, 而心跳率的测量对于评估心功能非常重要.图 9a为不同剂量MWCNTs暴露下不同发育时期爪蛙胚胎发育至96 h的心率.通过体式显微镜测定可知, 所有处理组(包括对照组)中爪蛙胚胎的心率在1 min中内平均跳动50次左右, 与对照组相比没有显著升高或降低(p>0.05).尽管在囊胚期、原肠胚期和神经胚期爪蛙胚胎的心率有上升趋势, 在尾芽期胚胎心率有下降趋势, 但这种上升或下降是没有统计学意义的.Aksakal等(2019)研究发现, 斑马鱼胚胎的心跳速率具有剂量效应, 会随着浓度的升高而降低.因此, MWCNTs对爪蛙胚胎心率没有显著性效应, 可能是剂量较低导致的.
 |
| 图 9 MWCNTs暴露下不同发育时期胚胎的心率(a)与体长(b) Fig. 9 Heart rate(a) and body length(b) of embryos at different developmental stages under MWCNTs exposure |
图 9b比较了不同发育时期的爪蛙胚胎暴露MWCNTs后发育至96 h的体长.通过体式显微镜测量结果可知, 正常爪蛙胚胎发育至96 h后, 体长在5.6~6.0 mm之间.不同剂量MWCNTs处理后其体长与对照组没有显著变化(p>0.05), 但尾芽期组胚胎体长出现下降的趋势, 可能是测量误差所致, 也可能是MWCNTs会延迟胚胎发育, 抑制其体长(Aksakal et al., 2019).
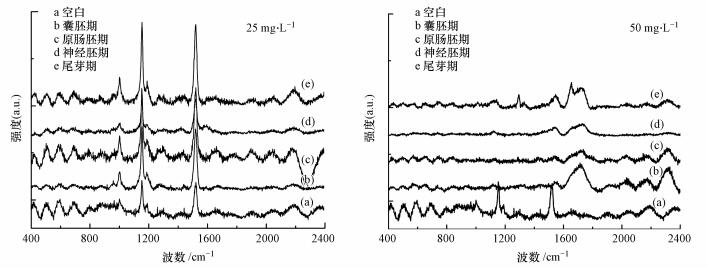
3.6 拉曼光谱分析为了进一步确定不同发育时期胚胎染毒后发育至96 h时胚胎中MWCNTs的拉曼信号, 即MWCNTs是否进入爪蛙胚胎的体内(Maes et al., 2014), 本研究采用拉曼光谱仪对不同发育时期、不同染毒剂量(25、50 mg·L-1)的存活胚胎进行拉曼信号测定, 空白组及不同发育时期处理组爪蛙胚胎的光谱如图 10所示.
 |
| 图 10 MWCNTs暴露下不同发育时期胚胎的拉曼光谱 Fig. 10 Raman spectra of embryos at different developmental stages under MWCNTs exposure |
研究表明, MWCNTs粉末的光谱中最清晰可见的带是在1360 cm-1处由CC引起的D(Defect)带和在1580 cm-1处由C≡C引起的G(Graphite)带(陈师等, 2014).
经25 mg·L-1 MWCNTs暴露后不同发育时期爪蛙胚胎体内出现D/G峰信号, 而50 mg·L-1 MWCNTs处理组中没有明显的D/G峰信号(图 10).这可能是由于25 mg·L-1 MWCNTs在水中的分散性较好, 水中悬浮颗粒更容易被胚胎摄食, 而50 mg·L-1碳纳米颗粒更容易发生团聚沉降行为, 使得颗粒物分子量较大, 无法被胚胎摄食, 因此检测不到D/G峰信号.Kirsten等(2011)的研究结果表明, 早期胚胎绒毛膜的孔径较小, 分子量大于400 ku的大分子或纳米颗粒难以穿透其外层绒毛膜.但也有研究利用X射线荧光光谱仪(μ-XRF)对暴露后的斑马鱼幼虫进行定性/定量, 并找出了TiO2-MWCNTs在胚胎体内的富集位点及富集量(Da Silva et al., 2018), 具体还需要进一步研究.
4 结论(Conclusions)本实验通过分阶段暴露发现, MWCNTs对不同发育时期爪蛙胚胎均有毒性作用, 与对照组相比能显著提高爪蛙胚胎的死亡率, 降低其孵化率(p < 0.05), 而对暴露后爪蛙胚胎发育至96 h的心率和体长没有显著影响(p>0.05).在所有处理组中(包括对照组), 爪蛙胚胎均有少量心腔水肿、脊索弯曲、泄殖腔畸形(水肿/增大)等畸形胚胎, 经MWCNTs暴露后, 增加了眼睛畸形(水肿/增大/变小)和发育紊乱, 其中, 心腔水肿占所有存活畸形胚胎畸形总数的比例最大, 达到28.7%, 而脊索弯曲次之.拉曼光谱分析结果表明, 爪蛙胚胎体内MWCNTs的拉曼信号较弱, 无法直接判断爪蛙胚胎的死亡是否与MWCNTs的摄入有关, 主要的毒性机理与MWCNTs粘附在胚胎外层的胶质膜上有间接关系.综上所述, 爪蛙胚胎对MWCNTs的敏感程度由强到弱依次是:原肠胚期、囊胚期、神经胚期、尾芽期, 该研究结果可为合理评价碳纳米管对水生生物胚胎的影响提供一定的理论参考.
Asharani P V, Serina N G B, Nurmawati M H, et al. 2008. Impact of multi-walled carbon nanotubes on aquatic species[J]. Journal of Nanoscience and Nanotechnology, 8(7): 3603-3609. DOI:10.1166/jnn.2008.432 |
Aksakal F I, Ciltas A, Ozek N S, et al. 2019. A holistic study on potential toxic effects of carboxylated multi-walled carbon nanotubes (MWCNTs-COON) on zebrafish (Danio rerio) embryos/larvae[J]. Chemosphere, 225: 820-828. DOI:10.1016/j.chemosphere.2019.03.083 |
Bondavalli P, Martin M B, Hamidouche L, et al. 2019. Nano-graphitic based non-volatile memories fabricated by dynamic spray gun deposition method[J]. Micromachines, 10: 95. DOI:10.3390/mi10020095 |
Chou C C, Hsiao H Y, Hong Q S, et al. 2008. Single-walled carbon nanotube can induce pulmonary injury in mouse mode[J]. Nano letter, 8(2): 437-445. DOI:10.1021/nl0723634 |
Chen T H, Lin C Y, Tseng M C, et al. 2011. Behavioral effects of titanium dioxide nanoparticles on larval zebrafish (Danio rerio)[J]. Marine Pollution Bulletin, 63: 303-308. DOI:10.1016/j.marpolbul.2011.04.017 |
陈师, 史燕妮, 夏少旭, 等. 2014. 多壁碳纳米管的拉曼光谱研究[J]. 高科技纤维与应用, 39(6): 40-44+50. DOI:10.3969/j.issn.1007-9815.2014.06.008 |
Clemente Z, Castro V L S S, Moura M A M, et al. 2014. Toxicity assessment of TiO2 nanoparticles in zebrafish embryos under different exposure conditions[J]. Aquatic Toxicology, 147: 129-139. DOI:10.1016/j.aquatox.2013.12.024 |
Callaghan N I, MacCormack T J, et al. 2016. Ecophysiological perspectives on engineered nanomaterial toxicity in fifish and crustaceans[J]. Comparative Biochemistry and Physiology, C, 193: 30-41. |
Dawson D A, Wilke T S. 1991. Evaluation of the frog embryo teratogenesis assay:Xenopus (FETAX) as a model system for mixture toxicity hazard assessment[J]. Environmental Toxicology and Chemistry, 10: 940-948. DOI:10.1002/etc.5620100710 |
De Volder M F L, Tawfick S H, Baughman R H, et al. 2013a. Carbon nanotubes:Present and future commercial applications[J]. Science, 339(6119): 535-539. DOI:10.1126/science.1222453 |
da Rocha A M, Ferreira J R, Barros D M, et al. 2013b. Gene expression and biochemical responses in brain of zebrafish Danio rerio exposed to organic nanomaterials:Carbon nanotubes (SWCNT) and fullerenol (C-60(OH)(18-22)(OK4)[J]. Comparative Biochemistry and Physiology, A, 165(4): 460-467. DOI:10.1016/j.cbpa.2013.03.025 |
Da Silva G H, Clemente Z, Khan L U, et al. 2018. Toxicity assessment of TiO2-MWCNT nanohybrid material with enhanced photocatalytic activity on Danio rerio (Zebrafish) embryos[J]. Ecotoxicology and Environmental Safety, 165: 136-143. DOI:10.1016/j.ecoenv.2018.08.093 |
Elhissi A M, Abdelbary W, Hassan I U, et al. 2012. Carbon nanotubes in cancer therapy and drug delivery[J]. Emerging Nanotechnologies in Dentistry, (2090/3014): 347-363. |
Ghobadian M, Nabiuni M, Parivar K, et al. 2015. Toxic effects of magnesium oxide nanoparticles on early developmental and larval stages of zebrafish (Danio rerio)[J]. Ecotoxicology and Environmental Safety, 122: 260-267. DOI:10.1016/j.ecoenv.2015.08.009 |
Hu L, Zhu J, Rotchell J M, et al. 2015. Use of the enhanced frog embryo teratogenesis assay-xenopus (fetax) to determine chemically-induced phenotypic effects[J]. Science of the Total Environment, 508: 258-265. DOI:10.1016/j.scitotenv.2014.11.086 |
Jovanovic B, Palic D. 2012. Immunotoxicology of non-functionalized engineered nanoparticles in aquatic organisms with special emphasis on fifish-Review of current knowledge, gap identifification, and call for further research[J]. Aquatic Toxicology, 118: 141-151. |
Kam N W S, Jessop T C, Wender P A, et al. 2004. Nanotube molecular transporters:Internalization of carbon nanotube protein conjugates into mammalian cells[J]. Journal of the American Chemical Society, 126(22): 6850-6851. DOI:10.1021/ja0486059 |
Kirsten H, Thomas B. 2011. Dechorionation as a tool to improve the fish embryo toxicity test (FET) with the zebrafish (Danio rerio)[J]. Comparative Biochemistry and Physiology, 153: 91-98. |
Kaltenbrun E, Tandon P, Amin N M, et al. 2011. Xenopus:An emerging model for studying congenital heart disease[J]. Birth Defects Research Part A, 91(6): 495-510. DOI:10.1002/bdra.20793 |
Koumoulos E P, Parousis T, Trompeta A F A, et al. 2016. Investigation of MWCNT addition into poly-dimethylsiloxane-based coatings[J]. Plastics Rubber and Composites, 45: 106-117. DOI:10.1080/14658011.2016.1144376 |
Lijima S. 1991. Helical microtubes of graphitic carbon[J]. Nature, 354: 56-58. DOI:10.1038/354056a0 |
Linse S, Cabaleiro Lago C, Xue W F, et al. 2007. Nucleation of protein fibrillation by nanoparticles[J]. Proceedings of the National Academy of Sciences of the United States of America, 104(21): 8691-8696. DOI:10.1073/pnas.0701250104 |
刘臻, 施华宏, 黄宏, 等. 2011. 3种抗生素对热带爪蟾胚胎发育的毒性影响[J]. 安全与环境学报, 11(5): 1-6. DOI:10.3969/j.issn.1009-6094.2011.05.001 |
Liu X T, Mu X Y, Wu X L, et al. 2014. Toxicity of multi-walled carbon nanotubes, graphene oxide, and reduced graphene oxide to zebrafish embryos[J]. Biomedical and Environmental Science, 27: 676-683. |
毛炳宇. 2008. 非洲爪蟾:模式生物里的青蛙王子[J]. 生命世界, (5): 60-63. |
Miao A J, Schwehr K, Xu C, et al. 2009. The algal toxicity of silver engineered nanoparticles and detoxification by exopolymeric substances[J]. Environmental Pollution, 157(11): 3034-3041. DOI:10.1016/j.envpol.2009.05.047 |
Migliore L, Saracino D, Bonelli A, et al. 2010. Carbon nanotubes induce oxidative DNA damage in RAW 264.7 cells[J]. Environmental and Molecular Mutagenesis, 5(4): 294-303. |
Maes H M, Stibany F, Giefers S, et al. 2014. Accumulation and distribution of multiwalled carbon nanotubes in zebrafish (Danio rerio)[J]. Environmental Science and Technology, 48(20): 12256-12264. DOI:10.1021/es503006v |
Martinez C S, Igartua D E, Czarnowski I, et al. 2019. Biological response and developmental toxicity of zebrafish embryo and larvae exposed to multi-walled carbon nanotubes with different dimension[J]. Heliyon, 5(8). DOI:10.1016/j.heliyon.2019.e02308 |
Nel A, Xia T M, Dler L, et al. 2006. Toxic potential of materials at the nanolevel[J]. Science, 311(5761): 622-627. DOI:10.1126/science.1114397 |
Petersen E J, Zhang L, Mattison N T, et al. 2011. Potential release pathways, environmental fate, and ecological risks of carbon nanotubes[J]. Environmental Science and Technology, 45(23): 9837-9856. DOI:10.1021/es201579y |
Pietroiusti A, Stockmann-Juvala H, Lucaroni F, et al. 2018. Nanomaterial exposure, toxicity, and impact on human health[J]. Wiley Interdisciplinary Reviews-Nanomedicine and Nanobiotechnology, 10(5). DOI:10.1002/wnan.1513 |
Shvedova A A, Castranova V, Kisin E R, et al. 2003. Exposure to carbon nanotube material:assessment of nanotube cytotoxicity using human keratinocyte cells[J]. Journal of Toxicology and Environmental Health:Part A, 66(20): 1909-1926. DOI:10.1080/713853956 |
施华宏, 朱静敏, 朱攀, 等. 2014. 热带爪蟾(Xenopus tropicalis)胚胎在生态毒理学中的应用前景[J]. 生态毒理学报, 9(2): 190-198. |
Shaw B J, Liddle C C, Windeatt K M, Handy R D, et al. 2016. A critical evaluation of the fish early-life stage toxicity test for engineered nanomaterials:experimental modifications and recommendations[J]. Archives of Toxicology, 90(9): 2077-2107. DOI:10.1007/s00204-016-1734-7 |
Sun Y, Zhang G, He Z Z, et al. 2016. Effects of copper oxide nanoparticles on developing zebrafish embryos and larvae[J]. International Journal of Nanomedicine, 11: 905-918. DOI:10.2147/IJN.S100350 |
Tan X, Lin C, Fugetsu B, et al. 2009. Studies on toxicity of multi walled carbon nanotubes on suspension rice cells[J]. Carbon, 47(15): 3479-3487. DOI:10.1016/j.carbon.2009.08.018 |
Trompeta A F A, Koumoulos E P, Stavropoulos S G, et al. 2019. Assessing the critical multifunctionality threshold for optimal electrical, thermal, and nanomechanical properties of carbon nanotubes/epoxy nanocomposites for aerospace applications[J]. Aerospace, 6: 7. DOI:10.3390/aerospace6010007 |
Wei L P, Thakkar M, Chen Y H, et al. 2010. Cytotoxicity effects of water dispersible oxidized multiwalled carbon nanotubes on marine alga, Dunaliella tertiolecta[J]. Aquatic Toxicology, 100(2): 194-201. |
Wang X, Qu R, Liu J, Wei Z, et al. 2016. Effect of different carbon nanotubes on cadmium toxicity to Daphnia magna:The role of catalyst impurities and adsorption capacity[J]. Environmental Pollution, 208: 732-738. DOI:10.1016/j.envpol.2015.10.053 |
袁刚强, 龚继来, 曾光明, 等. 2015. 单壁碳纳米管材料对水稻幼苗的毒性效应[J]. 环境科学学报, 35(12): 4143-4149. |
Ye S J, Zhou X, Xu Y B, et al. 2019. Photocatalytic performance of multi-walled carbon nanotube/bivo4 synthesized by electro-spinning process and its degradation mechanisms on oxytetracycline[J]. Chemical Engineering Journal, 373: 880-890. DOI:10.1016/j.cej.2019.05.109 |
钟柏华, 付超, 刘旭东, 等. 2014. 单壁碳纳米管致昆明小鼠脑组织的氧化损伤[J]. 环境科学学报, 34(2): 507-513. |
 2020, Vol. 40
2020, Vol. 40


