2. 南京农业大学, 无锡渔业学院, 无锡 214081
2. Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214081
镉(Cd)是全球重点防控污染物(Campbell, 2006; Kubier et al., 2019).在联合国环境规划署提出的12种危害全球环境的化学物清单中, Cd位居首位(Yuan et al., 2019).同时, Cd也被国际癌症研究机构和世界卫生组织列为Ⅰ类致癌物和第三位优先研究的食品污染物(Yuan et al., 2019).我国淡水生态环境中Cd污染形势仍较为严峻(蓝郁等, 2017), 《2018中国生态环境状况公报》即指出淡水水体存在Cd超标现象.水体受到Cd污染能够导致水生生物的器官、生物学参数、行为、生长率和血液发生损伤(Hameed et al., 2019), 并且会通过食物链传递威胁到人体的免疫系统和防御系统(Kubier et al., 2019).值得注意的是, 水体中的Cd主要以Cd2+形式存在(Kubier et al., 2019), 因此, 亟需灵敏评价水体中Cd2+的毒性效应.
生命系统在不同水平对Cd2+毒性的应答顺序大不相同, 个体和组织的应答效应可能要数小时到数天才能把握, 而细胞的应答时间可以短至数秒到数小时(Van der Oost et al., 2003).贝类因具有活动能力差(鱼类、虾蟹类等遇到污染则会快速逃离)、对污染物的高富集性和低代谢性、体内污染物积累量与水环境中污染物含量简单相关等特点, 被认为是水环境污染监测、评价的理想指示生物(Yang et al., 2008; Chen et al., 2019).背角无齿蚌(Anodonta woodiana)作为“淡水贝类观察”研究体系(我国淡水生态环境污染评价应用最为广泛的生物监测体系之一)的专用指示生物(Yang et al., 2008; 邢慧芳等, 2013; Chen et al., 2019), 其鳃是Cd2+积累和毒性作用的关键“靶器官”(陈修报等, 2017).然而, 背角无齿蚌鳃细胞尚无培养成功的先例.值得注意的是,迄今贝类的相关研究认为, 离体后首次培养、生物性状尚未发生明显变化、基本保持原组织特性的原代培养鳃细胞, 非常适合建立较灵敏评价Cd2+等污染物毒性的研究模型(Gómez-mendikute et al., 2005; Nogueira et al., 2013; Katsumiti et al., 2014), 有着活体动物无法比拟的优点, 特别是①污染物与细胞直接作用, 反应速度快, 毒理学检测周期短; ②大大减少了活体动物的使用量; ③细胞的均一性避免了动物间的个体差异, 且实验条件可以精确控制, 结果重复性好; ④不需要大型养殖设备和大量换水及充氧, 毒物的使用量大幅度降低, 研究成本低且更环保(刘涛等, 2014).然而,目前已报道的淡水贝类鳃细胞原代培养, 维持细胞存活率≥90%的优良状态(开展细胞毒理学研究的基本前提条件(万小琼等, 2002)), 往往难以超过72 h(Quinn et al., 2009; Yurdakök-Dikmen et al., 2018), 而毒理学研究中要求对照组存活率≥90%的持续时间在96 h及以上(American Society for Testing and Materials, 2009), 这样才能更客观、准确的评价污染物毒性效应及破解毒理机制, 因此, 目前的淡水贝类鳃细胞原代培养的存活时间严重限制了其在评价水体Cd2+等污染物毒性方面的研究和应用.如果能在已有的个体水平“淡水贝类观察”体系的基础上, 突破该蚌鳃细胞培养的“瓶颈”, 开拓极具上述潜力和优势的细胞水平污染物毒性评价技术, 对完善上述“观察”体系而言无疑具有明显的必要性和应用价值.
生命系统在不同水平对Cd2+毒性的应答顺序大不相同, 个体和组织的应答效应可能要数小时到数天才能把握, 而细胞的应答时间可以短至数秒到数小时(Van der Oost et al., 2003).贝类因具有活动能力差(鱼类、虾蟹类等遇到污染则会快速逃离)、对污染物的高富集性和低代谢性、体内污染物积累量与水环境中污染物含量简单相关等特点, 被认为是水环境污染监测、评价的理想指示生物(Yang et al., 2008; Chen et al., 2019).背角无齿蚌(Anodonta woodiana)作为“淡水贝类观察”研究体系(我国淡水生态环境污染评价应用最为广泛的生物监测体系之一)的专用指示生物(Yang et al., 2008; 邢慧芳等, 2013; Chen et al., 2019), 其鳃是Cd2+积累和毒性作用的关键“靶器官”(陈修报等, 2017).然而, 背角无齿蚌鳃细胞尚无培养成功的先例.值得注意的是, 迄今贝类的相关研究认为, 离体后首次培养、生物性状尚未发生明显变化、基本保持原组织特性的原代培养鳃细胞, 非常适合建立较灵敏评价Cd2+等污染物毒性的研究模型(Gómez-Mendikute et al., 2005; Nogueira et al., 2013; Katsumiti et al., 2014), 有着活体动物无法比拟的优点, 特别是①污染物与细胞直接作用, 反应速度快, 毒理学检测周期短; ②大大减少了活体动物的使用量; ③细胞的均一性避免了动物间的个体差异, 且实验条件可以精确控制, 结果重复性好; ④不需要大型养殖设备和大量换水及充氧, 毒物的使用量大幅度降低, 研究成本低且更环保(刘涛等, 2014).然而,目前已报道的淡水贝类鳃细胞原代培养, 维持细胞存活率≥90%的优良状态(开展细胞毒理学研究的基本前提条件(万小琼等, 2002)), 往往难以超过72 h(Quinn et al., 2009; Yurdakök-Dikmen et al., 2018), 而毒理学研究中要求对照组存活率≥90%的持续时间在96 h及以上(American Society for Testing and Materials, 2009), 这样才能更客观、准确的评价污染物毒性效应及破解毒理机制, 因此, 目前的淡水贝类鳃细胞原代培养的存活时间严重限制了其在评价水体Cd2+等污染物毒性方面的研究和应用.如果能在已有的个体水平“淡水贝类观察”体系的基础上, 突破该蚌鳃细胞培养的“瓶颈”, 开拓极具上述潜力和优势的细胞水平污染物毒性评价技术, 对完善上述“观察”体系而言无疑具有明显的必要性和应用价值.
针对上述问题, 本研究拟先围绕背角无齿蚌鳃细胞原代培养及确保细胞存活率的方法进行探索, 并取得突破; 在此基础上, 基于该细胞来实际探究和评价Cd2+的细胞水平毒性效应, 以期一方面突破淡水贝类鳃细胞“存活率低、存活时间短”的瓶颈难题, 另一方面从细胞毒性效应的新角度为基于背角无齿蚌生物监测的水体污染评价应用提供进一步的理论支撑.
2 材料与方法(Materials and methods) 2.1 实验材料背角无齿蚌(2龄)采自中国水产科学研究院淡水渔业研究中心的“标准化”背角无齿蚌(陈修报等, 2017)繁育基地.
氯化镉(CdCl2)为分析纯, 购自国药集团化学试剂有限公司; 无菌水、PBS缓冲液、链霉蛋白酶和胰蛋白酶购自美国Sigma公司; 双抗、胎牛血清(FBS)和L-15培养基购自美国Gibco公司; 台盼蓝染色细胞存活率检测试剂盒和WST-1细胞增殖及细胞毒性检测试剂盒购自碧云天生物技术研究所; 总超氧化物歧化酶(SOD)测定试剂盒、过氧化氢酶(CAT)测定试剂盒和酸性磷酸酶(AcP)测定试剂盒购自南京建成生物工程研究所.
2.2 鳃细胞原代培养背角无齿蚌鳃细胞原代培养方法参照Quinn等(2009)的培养方法并进一步探索和改进.将洗净的背角无齿蚌暂养于抗生素溶液中进行初步消毒, 然后用70%酒精冲洗蚌并自然晾干.无菌操作解剖出鳃, 用PBS缓冲液清洗后, 剪成1~2 mm2小块.鉴于细胞分解方法(如应用较为广泛的0.25%胰蛋白酶在26 ℃分解30 min(靳雨丽, 2011; 贾睿等, 2011); 0.025%链霉蛋白酶在4 ℃分解16 h(Quinn et al., 2009)和细胞培养基的血清浓度(如通常加入的FBS含量为10%(Quinn et al., 2009; Nogueira et al., 2013)或20%(贾睿等, 2011; 张念伟等, 2017))是决定细胞培养成败的关键因素(谭凤霞等, 2009; 贾睿等, 2011), 因此, 分别用上述两种细胞分解方法分解鳃小块, 进而用上述两种FBS含量的L-15培养基开展鳃细胞的原代培养, 以弄清适宜背角无齿蚌鳃细胞的分解方法和血清浓度.鳃细胞的密度均为2×105 cell·mL-1, 由于贝类细胞原代培养的最适宜温度为20 ℃(Dessai, 2012), 因此, 将鳃细胞置于20 ℃生化培养箱中培养.用霍夫曼相衬倒置显微镜(DYS-810C型)观察细胞形态, 用台盼蓝染色法检测细胞存活率.
2.3 Cd2+暴露将密度为106 cell·mL-1的背角无齿蚌鳃细胞, 接种到96孔细胞培养板(丹麦NUNC公司)和24孔细胞培养板(丹麦NUNC公司)中, 96孔细胞培养板中每孔100 μL, 24孔细胞培养板中每孔0.5 mL, 培养24 h以保证细胞贴壁(贾睿等, 2013).通过预实验得出, Cd2+对鳃细胞的LC25为1.0 mg·L-1.再根据LC25值设定5个Cd2+理论浓度梯度(Katsumiti et al., 2014), 依次为0.0625、0.125、0.25、0.5和1.0 mg·L-1, 并设置对照组(Cd2+理论浓度为0 mg·L-1), 以上每个组别均设4个重复孔.依据Katsumiti等(2014)的研究方法, 对鳃细胞进行24 h的暴露.96孔细胞培养板用于检测细胞活力, 24孔细胞培养板上清用于检测对Cd2+较为敏感的SOD、CAT及AcP含量(贾睿等, 2013; Katsumiti et al., 2014).
2.4 毒性效应指标测定严格按照试剂盒操作说明, 分别测定96孔细胞培养板中鳃细胞的细胞活力, 以及24孔细胞培养板中鳃细胞上清液的SOD、CAT及AcP含量.
2.5 统计分析所得数据运用SPSS 22.0统计软件分析.采用概率单位分析(Probit Analysis)计算LC25.采用单因素方差分析(One-way ANOVA)对细胞存活率、细胞活力、SOD、CAT及AcP含量进行组间差异性分析.应用Pearson等级相关系数分析细胞存活率与培养时间、细胞活力与Cd2+浓度之间的相关性, 并用回归模型分析变量之间的关系.p < 0.05表示差异水平或相关性显著.
3 结果与讨论(Results and discussion) 3.1 原代培养利用0.025%链霉蛋白酶在4 ℃分解16 h的鳃细胞存活率为98.2%±0.2%, 0.25%胰蛋白酶在26 ℃分解30 min的鳃细胞存活率为89.4%±3.5%, 前者显著高于后者(p < 0.05).根据贝类细胞种类的形态学分类方法(Dessai, 2012), 分解出的鳃细胞主要归为3类:上皮细胞(占66%)、颗粒上皮细胞(占31%)和纤维细胞(占3%).对0.025%链霉蛋白酶分解的鳃细胞进行原代培养, L-15培养基加入10% FBS的细胞存活率在各个时期均显著高于20% FBS(p < 0.05;图 1).对0.25%胰蛋白酶分解的鳃细胞进行原代培养, L15培养基加入10% FBS的细胞存活率在96 h显著高于20% FBS(p < 0.05;图 1).由图 1可见, 以0.025%链霉蛋白酶在4 ℃分解16 h为细胞分解方法、L-15培养基中FBS含量为10%的培养效果最佳.应用该方法, 对鳃细胞进行168 h连续培养, 细胞存活率与培养时间之间呈线性负相关(p < 0.05), 120 h后细胞存活率仍高达90.1%±4.7%(图 2~图 3).
 |
| 图 1 不同培养方法(细胞分解方法分别为0.025%链霉蛋白酶(PR), 4 ℃条件下分解16 h和0.25%胰蛋白酶(TR), 26 ℃条件下分解30 min; 人工合成细胞培养基中FBS含量分别为10%和20%)的背角无齿蚌鳃细胞存活率(n=3) Fig. 1 Survival rates of gill cells from Anodonta woodiana with different culture methods (cell dissociation methods were add gills to 0.025% pronase at 4 ℃ for 16 h and add gills to 0.25% trypsin at 26 ℃ for 30 min respectively; artificial cell culture media contain 10% FBS and 20% FBS respectively) (n=3) |
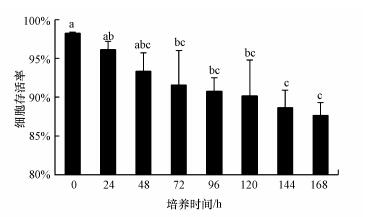 |
| 图 2 背角无齿蚌原代培养鳃细胞的存活率(n=3;不同字母表示差异显著, p < 0.05) Fig. 2 Survival rates of primarily cultured gill cells from Anodonta woodiana (n=3; different letters indicate significant differences, p < 0.05) |
 |
| 图 3 背角无齿蚌原代培养120 h的鳃细胞(×200) Fig. 3 Gill cells primary cultured for 120 h from Anodonta woodiana |
由于淡水贝类鳃等组织的生理结构、功能分化、营养需求等方面的特殊性, 至今还没有建立起细胞系, 原代培养仍然是主要方法(李勇等, 2011).需要引起重视的是, 淡水贝类鳃细胞原代培养至今尚未取得实质性突破(维持细胞存活率≥90%的优良状态往往难以超过72 h(Quinn et al., 2009; Yurdakök-Dikmen et al., 2018), 而本研究是背角无齿蚌鳃细胞原代培养的首次尝试.
胰蛋白酶和链霉蛋白酶是细胞培养过程中广泛应用的细胞分解酶(Quinn et al., 2009; Dessai, 2012), 然而, 在不同物种中其分解细胞的存活率具有明显的差别(刘国安等, 2004; Quinn et al., 2009; Dessai, 2012).应用0.25%胰蛋白酶分解人胃粘膜上皮细胞的细胞存活率为88.7%, 高于0.02%链霉蛋白酶分解后83.9%的细胞存活率(刘国安等, 2004).用0.1%链霉蛋白酶分解猪肌卫星细胞的细胞存活率为95.0%±3.5%, 与0.25%胰蛋白酶分解后的细胞存活率为93.0%±3.0%没有明显差别(p>0.05)(罗桂芬等, 2006).而本研究发现在背角无齿蚌鳃细胞的分解过程中, 0.025%链霉蛋白酶在4 ℃分解16 h的细胞成活率显著高于0.25%胰蛋白酶在26 ℃分解30 min, 这在斑马贻贝(Dreissena polymorpha)组织细胞分解中也有相似效果(Quinn et al., 2009).鉴于链霉蛋白酶所需浓度较低(可以节省酶的用量), 且分解细胞成活率高(对细胞的损伤小), 因此, 0.025%链霉蛋白酶在4 ℃分解16 h适宜用作淡水贝类鳃细胞的分解方法.
细胞培养基中FBS的含量是影响细胞存活率的又一关键因素(谭凤霞等, 2009; 贾睿等, 2011).相较于FBS含量为10%的细胞培养基, 稀有鮈鲫(Gobiocypris rarus)鳍细胞更适宜在FBS含量为20%的细胞培养基生长(谭凤霞等, 2009).而鲫鱼(Carassius auratus)肝细胞(贾睿等, 2011)和锯齿巴非蛤(paphia malabarica)外套膜细胞(Dessai, 2012)更适宜在FBS含量为10%的细胞培养基中生长.与后者类似, 本研究发现无论是以链霉蛋白酶还是胰蛋白酶分解背角无齿蚌鳃细胞, 细胞培养基中FBS含量为10%的细胞存活率均高于FBS含量为20%(图 1).这可能是由于较高浓度FBS中的脂质成分引起细胞膜组成的改变或脂质堆积(Tocher et al., 1988), 从而导致细胞活力/存活率降低造成的.
根据上述研究结果, 收集0.025%链霉蛋白酶在4 ℃分解16 h的背角无齿蚌鳃细胞, 用10% FBS含量的L-15培养基进行原代培养, 虽然细胞存活率与培养时间之间呈线性负相关, 与三角帆蚌外套膜细胞(靳雨丽, 2011)、斑马贻贝(Quinn et al., 2009)及淡水珠蚌(Unio sp.)(Yurdakök-Dikmen et al., 2018)鳃细胞原代培养的变化趋势一致, 但是其维持细胞存活率≥90%优良状态的时间达到了120 h(图 2), 明显高于其它淡水贝类如斑马贻贝(< 24 h)(Quinn et al., 2009)和淡水珠蚌(< 72 h)(Yurdakök-Dikmen et al., 2018)鳃细胞维持如此高存活率的培养时间.同时, 也达到细胞毒理学研究对细胞存活率和存活时间(万小琼等, 2002)的要求.
3.2 毒性效应鳃细胞活力(V)随着Cd2+浓度(C)的增加而降低(表 1), 两者之间呈显著的线性负相关(p < 0.05), 回归关系为; V=-2.3153C + 103.41 (R2=0.9567).随着Cd2+浓度的增加, SOD和AcP含量总体呈增加的趋势, 且均在0.5 mg·L-1时含量最高(表 1).而CAT含量呈现出“诱导-抑制”的变化趋势, 其最高含量出现在Cd2+浓度为0.0625 mg·L-1的暴露组, 平均含量达到对照组的5倍且显著高于对照组(p < 0.05);暴露组CAT含量最低出现在Cd2+浓度为1.0 mg·L-1时, 尽管如此, 其CAT平均含量仍是对照组的2倍(表 1).
| 表 1 背角无齿蚌原代培养鳃细胞对Cd2+的毒性效应(n=4) Table 1 Cytotoxicity of cadmium on primarily cultured gill cells from Anodonta woodiana (n=4) |
水体中Cd2+能通过细胞钙离子通道(ECaC)和二价金属离子转运蛋白(DMT1)透过细胞膜而进入细胞内(Komjarova et al., 2014), 从而诱导产生大量的活性氧(ROS)(Katsumiti et al., 2014), 当过量的ROS无法被及时清除时就会对细胞造成氧化损伤、影响细胞活力(Katsumiti et al., 2014; 杨佳等, 2018).ROS产生量与Cd2+浓度总体呈正相关(Katsumiti et al., 2014), 因此, 导致背角无齿蚌鳃细胞活力与Cd2+浓度之间呈显著的线性负相关(表 1), 这与Cd2+对斑马贻贝鳃细胞的毒性效应相吻合(Katsumiti et al., 2014), 也与CdCl2胁迫猪肾PK-15细胞引起的毒性效应相一致(杨佳等, 2018).提示细胞活力有潜力应用于水环境Cd2+污染评价.
本研究发现Cd2+暴露的鳃细胞培养上清液中SOD、CAT和AcP的平均含量较对照组明显升高(表 1), 且0.125和0.5 mg·L-1 Cd2+暴露组的SOD含量、0.0625和0.5 mg·L-1 Cd2+暴露组的CAT含量以及所有Cd2+暴露组的AcP含量均显著高于对照组(p < 0.05;表 1).这可能是由于鳃细胞受到氧化损伤后, 导致细胞膜的通透性增强, 从而引起细胞内的SOD、CAT和AcP溢出量增加.SOD能够催化超氧阴离子自由基(O2·-)歧化生成氧(O2)和过氧化氢(H2O2), 保护细胞免受或减少O2·-的氧化损伤, 在机体的氧化与抗氧化平衡中起着至关重要的作用(Liu et al., 2018).CdCl2暴露猪肾PK-15细胞后, 亦引起SOD含量增加(杨佳等, 2018), 与本研究结果一致.CAT的主要作用是促使H2O2分解成O2和H2O, 从而免于或降低H2O2对细胞氧化损伤(Liu et al., 2018).Katsumiti等(2014)报道0.1~1 mg·L-1的Cd2+暴露斑马贻贝鳃细胞24 h并未引起CAT含量明显增加, 而Cd2+浓度达到2 mg·L-1时CAT含量显著增加至对照组的近2倍(p < 0.05).虽然本研究的CAT变化的最终结果与Katsumiti等(2014)研究相似, 但是随着Cd2+浓度增加呈现出明显的“诱导-抑制”特征(表 1), 提示背角无齿蚌鳃细胞可能较斑马贻贝鳃细胞对Cd2+毒性更为敏感, 在受到较低Cd2+浓度(如0.0625 mg·L-1)暴露时即可激活CAT以应对氧化损伤, 而Cd2+浓度进一步增加(如1.0 mg·L-1)则会导致CAT失活.AcP是贝类重要的免疫因子, 同时也可作为环境应激指标(Katsumiti et al., 2014).贝类鳃细胞的溶酶体中含有丰富的AcP(Katsumiti et al., 2014).本研究中, 经Cd2+暴露的鳃细胞培养上清液中AcP含量较对照组显著增加(p < 0.05;表 1), 这与Cd2+暴露斑马贻贝鳃细胞的AcP含量变化趋势一致(Katsumiti et al., 2014), 可能是由于Cd2+暴露激活了AcP活力或者诱导了溶酶体合成.
4 结论(Conclusions)本研究首次探究淡水贝类背角无齿蚌鳃细胞的原代培养, 初步建立了较为适宜的培养方法, 并获得了培养时间长达120 h, 存活率≥90%的鳃细胞, 突破了淡水贝类鳃细胞“存活率低、存活时间短”的瓶颈, 同时为利用细胞评价水体污染及污染物毒性奠定了必要的基础.背角无齿蚌鳃细胞的细胞活力及SOD、CAT、AcP含量变化有潜力作为评价水环境Cd2+毒性/污染的生物指标.在此基础上, 今后可尝试背角无齿蚌鳃细胞的传代培养, 并进一步研究Cd2+对其毒性机制.
American Society for Testing and Materials. 2009. Standard guide for conducting laboratory toxicity tests with freshwater mussels[S]. E2455-06.
|
Campbell P G C. 2006. Cadmium-a priority pollutant[J]. Environmental Chemistry, 3: 387-388. DOI:10.1071/EN06075 |
Chen X, Su Y, Liu H, et al. 2019. Active biomonitoring of metals with cultured Anodonta woodiana:a case study in the Taihu Lake, China[J]. Bulletin of Environmental Contamination and Toxicology, 102: 198-203. DOI:10.1007/s00128-018-2482-6 |
陈修报, 刘洪波, 苏彦平, 等. 2017. 镉对"标准化"背角无齿蚌的急性毒性及脂质过氧化和DNA损伤的影响[J]. 农业环境科学学报, 36(10): 1960-1967. DOI:10.11654/jaes.2017-0430 |
Dessai S N. 2012. Primary culture of mantle cells of bivalve mollusc, Paphia malabarica[J]. In Vitro Cellular and Developmental Biology-Animal, 48: 473-477. DOI:10.1007/s11626-012-9538-4 |
Gómez-Mendikute A, Elizondo M, Venier P, et al. 2005. Characterization of mussel gill cells in vivo and in vitro[J]. Cell and Tissue Research, 321: 131-140. DOI:10.1007/s00441-005-1093-9 |
Hameed F, Riaz M A, Zahid U, et al. 2019. Hazardous effects of cadmium contaminated water on biological characteristics of fish:a review[J]. RHAZES:Green and Applied Chemistry, 6: 1-10. |
贾睿, 曹丽萍, 丁炜东, 等. 2011. 鲫鱼肝细胞分离与原代培养方法的优化[J]. 华北农学报, 26(S2): 206-212. DOI:10.7668/hbnxb.2011.S2.044 |
贾睿, 曹丽萍, 杜金梁, 等. 2013. 水飞蓟素对四氯化碳致鲫肝(细胞)损伤的保护和抗氧化作用[J]. 中国水产科学, 20(3): 551-560. |
靳雨丽. 2011.三角帆蚌外套膜细胞培养的改进及大型有核珍珠的培育[D].上海: 上海海洋大学 http://d.wanfangdata.com.cn/periodical/shscdxxb201105010
|
Katsumiti A, Gilliland D, Arostegui I, et al. 2014. Cytotoxicity and cellular mechanisms involved in the toxicity of CdS quantum dots in hemocytes and gill cells of the mussel Mytilus galloprovincialis[J]. Aquatic Toxicology, 153: 39-52. DOI:10.1016/j.aquatox.2014.02.003 |
Komjarova I, Bury N R. 2014. Evidence of common cadmium and copper uptake routes in Zebrafish Danio rerio[J]. Environmental Science and Technology, 48(21): 12946-12951. DOI:10.1021/es5032272 |
Kubier A, Wilkin R T, Pichler T. 2019. Cadmium in soils and groundwater:a review[J]. Applied Geochemistry, 108: 104388. DOI:10.1016/j.apgeochem.2019.104388 |
Liu H, Chen X, Oshima Y, et al. 2018. Biochemical changes in Chinese pond mussel Anodonta woodiana following exposure to copper[J]. Journal of the Faculty of Agriculture Kyushu University, 63(2): 311-318. |
蓝郁, 梁荣昌, 赵学敏, 等. 2017. 突发镉、铊环境污染事件及应急处置对贺江生态风险的影响[J]. 环境科学学报, 37(9): 3602-3612. |
李勇, 孟立霞. 2011. 贝类细胞培养研究概况[J]. 凯里学院学报, 29(3): 81-83. DOI:10.3969/j.issn.1673-9329.2011.03.24 |
刘国安, 杨燕, 关泉林, 等. 2004. 酶水解分离人胃粘膜上皮细胞[J]. 西北师范大学学报(自然科学版), 40(2): 59-62. DOI:10.3969/j.issn.1001-988X.2004.02.018 |
刘涛, 郭辰, 赵晓红. 2014. 毒理学研究中的体外细胞毒性评价[J]. 生命科学, 26(3): 319-324. |
罗桂芬, 文旭辉, 杨公社, 等. 2006. 猪肌卫星细胞的分离培养及鉴定[J]. 细胞与分子免疫学杂志, 22(6): 823-825. DOI:10.3321/j.issn:1007-8738.2006.06.045 |
马陶武, 王子健, 易浪波. 2010. 稀有鮈鲫和日本青鳉肝细胞原代培养及其对2, 3, 7, 8-TCDD的敏感性比较[J]. 环境科学学报, 30(6): 1243-1249. |
Nogueira L S, Wood C M, Gillis P L, et al. 2013. Isolation and fractionation of gill cells from freshwater (Lasmigona costata) and seawater (Mesodesma mactroides) bivalves for use in toxicological studies with copper[J]. Cytotechnology, 65: 773-783. DOI:10.1007/s10616-013-9647-2 |
Quinn B, Costello M J, Dorange G, et al. 2009. Development of an in vitro culture method for cells and tissues from the zebra mussel (Dreissena polymorpha)[J]. Cytotechnology, 59: 121-134. DOI:10.1007/s10616-009-9202-3 |
谭凤霞, 杨方星, 王卫民, 等. 2009. 稀有鮈鲫鳍细胞系的建立及其作为测定重金属毒性模型的探讨[J]. 水生生物学报, 33(4): 767-771. |
Tocher D R, Sargen J R, Frerichs G N. 1988. The fatty acid compositions of established fish cell lines after long-term culture in mammalian sera[J]. Fish Physiology and Biochemistry, 5(4): 219-227. DOI:10.1007/BF01874799 |
Van der Oost R, Beyer Jonny, Vermeulen N P E. 2003. Fish bioaccumulation and biomarkers in environmental risk assessment:A review[J]. Environmental Toxicology and Pharmacology, 13: 57-149. DOI:10.1016/S1382-6689(02)00126-6 |
万小琼, 吴文忠, 贺纪正. 2002. 利用草鱼原代肝细胞培养评价二噁英毒性效应[J]. 中国环境科学, 22(2): 114-117. DOI:10.3321/j.issn:1000-6923.2002.02.005 |
邢慧芳, 李涌泉, 杨慧珍, 等. 2013. 镉对背角无齿蚌外套膜和鳃抗氧化酶活性及脂质过氧化的影响[J]. 环境科学学报, 33(3): 856-860. |
杨佳, 董峰, 李向阳, 等. 2018. 镉胁迫对猪肾PK-15细胞活性氧和抗氧化酶活性的影响[J]. 生物技术通讯, 29(1): 44-49. DOI:10.3969/j.issn.1009-0002.2018.01.009 |
Yang J, Harino H, Liu H B, et al. 2008. Monitoring the organotin contamination in the Taihu Lake of China by bivalve mussel Anodonta woodiana[J]. Bulletin of Environmental Contamination and Toxicology, 81: 164-168. DOI:10.1007/s00128-008-9464-z |
Yuan Z, Luo T, Liu X, et al. 2019. Tracing anthropogenic cadmium emissions:From sources to pollution[J]. Science of the Total Environment, 676: 87-96. DOI:10.1016/j.scitotenv.2019.04.250 |
Yurdakök-Dikmen B, Arslan P, Kuzukıran Ö, et al. 2018. Unio sp. primary cell culture potential in ecotoxicology research[J]. Toxin Reviews, 37(1): 75-81. DOI:10.1080/15569543.2017.1331360 |
张念伟, 刘肖峰, 王娜, 等. 2017. 大菱鲆脑细胞系的建立[J]. 农业生物技术学报, 25(5): 820-826. |
 2020, Vol. 40
2020, Vol. 40


