2. 北京工业大学, 环境与能源工程学院, 北京 100124
2. College of Environmental and Energy Engineering, Beijing University of Technology, Beijing 100124
近年来, 大气细颗粒物(空气动力学直径 <2.5 μm)(PM2.5 )作为环境污染物对人体造成的健康危害备受关注.首都北京作为重点工业区, 其冬季PM2.5平均浓度常年居高不下, 据统计, 2013—2015年北京市PM2.5的年平均质量浓度为102 μg·m-3, 超过环境空气质量标准(GB3095-2012)的2~3倍(Wang et al., 2016).据分析, 北京市PM2.5主要来源于长途运输、道路交通、工业排放、煤炭燃烧、土壤和建筑粉尘等(Yu et al., 2011).流行病学研究表明, 暴露于PM2.5会诱发肺损伤, 并且与肺部疾病的发病率密切相关, 如肺气肿、间质性肺异常、哮喘、慢性阻塞性肺疾病、肺纤维化甚至肺癌(吕广娜等, 2013;Loomis et al., 2014; Rice et al., 2019).
肺响应环境污染物的关键分子信号传导途径是芳香烃受体(Aryl hydrocarbon receptor, AhR)通路.AhR是一种配体激活的核转录因子, 可介导多环芳烃类化合物的毒性(包括致癌性)反应, 还参与一些重要的生物学过程, 如信号转导、细胞分化、细胞凋亡等(Liu et al., 2017).而与其他器官相比, 肺是AhR的最高表达器官.AhR的异常表达或激活还与环境污染物质引起的一系列肺部疾病密切相关, 包括慢性阻塞性肺疾病、哮喘和肺动脉高压等(Chiba et al., 2011).另一方面, AhR/AhR核转运蛋白(Aryl hydrocarbon receptor nuclear translocator, ARNT)异二聚体的形成激活了细胞色素P450(CYP450), 这是环境污染物产生致癌性的关键步骤之一.CYP450对有机物代谢产生的中间体会引起细胞毒性或与DNA靶位点相互作用形成加合物, 这些加合物可能导致DNA复制错配或可遗传的DNA突变, 最终可能促进癌症的发生(Moorthy et al., 2015).因此, 研究PM2.5对AhR通路的作用和机制有助于理解PM2.5与肺部疾病、甚至PM2.5与肺癌之间的关系.
本课题组前期通过转录组测序技术筛选出了PM2.5暴露导致的细胞差异表达基因, 其中, AhR的靶基因CYP450排在高表达组的前几位(Zhou et al., 2015), 这提示了AhR通路可能参与PM2.5诱发的毒性效应.国外也有研究表明暴露于当地的颗粒物会造成细胞中CYP450(CYP1A1/1B1)的表达增加(Gualtieri et al., 2011;Salcido-Neyoy et al., 2015).尽管PM2.5的主要成分包括重金属、硫酸盐、硝酸盐和多环芳烃(PAHs), 但它是化学物的异质混合物, 具有复杂性和可变性, 其具体组成随季节、来源和地理分布而变化(Hamad et al., 2016), 因此, 其毒性作用也随地区的不同而发生改变(Gabelova et al., 2004).然而, 北京市作为国内PM2.5污染严重的地区之一, 有关其来源的PM2.5样品对细胞内AhR通路影响的研究还未见报道.基于此, 本研究采集冬季北京城区PM2.5作为样本, 通过检测AhR靶基因CYP1A1在细胞中的表达和活性水平变化, 探讨PM2.5对人肺上皮细胞A549中AhR通路的激活作用, 以期为深入研究AhR介导的信号通路参与PM2.5对肺部的毒性作用机制提供实验依据.
2 材料和方法(Materials and methods) 2.1 主要仪器与试剂仪器:空气颗粒采样器(武汉天虹仪表, 中国);多功能酶标仪(PerkinElmer, 美国);奥德赛红外扫膜仪(LI-COR Biosciences, 美国);激光共聚焦显微镜(Leica TCS SP2, 德国);ViiA7实时定量PCR仪(AppliedBiosystems, 美国).
试剂:CCK-8试剂购自同仁化学研究所;PrimeScript RT Reagent Kit和SYBR® Premix DimerEraser购自大连Takara公司;抗AhR抗体购自南京Bioworld, 抗CYP1A1抗体和抗Histone1抗体购自武汉Proteintech, 抗β-actin抗体购自英国Abcam, 羊抗鼠远红外荧光二抗和羊抗兔远红外荧光二抗购自KPL, 驴抗兔绿色荧光二抗购自美国Earthox;Hoechst 33258购自美国MedChemExpress;核蛋白和胞浆蛋白提取试剂盒购自江苏凯基生物;pGl4.43[luc2P/XRE/Hygro]质粒、pGL4.74[hRluc/TK]质粒和CYP1A1活性检测试剂盒购自美国Promega;Lipofectamine 3000转染试剂购买自美国Invitrogen.
2.2 PM2.5样品的采集和提取于2017年1月1—31日, 在北京工业大学采集PM2.5样品.PM2.5由空气颗粒采样器以1 m3·min-1的流量连续采样, 收集在石英过滤器(47 mm, 2 μm)上.将1月份采集的所有样品混合在一起制备PM2.5悬液, 方法如下:将石英纤维膜用乙醇润湿, 放入盛有超纯水的托盘中冰浴超声4次, 每次5 min, 以防止过热.使用6层纱布过滤超声后的洗脱液, 真空冷冻干燥后将所有样品混合在一起转移到无菌的离心管中称重, 用超纯水配成浓度为4 mg·mL-1的PM2.5样品, 超声混匀后用1.5 mL EP管分装, 于-80 ℃下保存备用.
2.3 细胞培养和处理A549细胞作为评价环境污染物的经典模型被用于本研究, 其虽然是肺癌细胞, 但具有肺上皮细胞的功能.A549在含有10%胎牛血清和1%抗青霉素/链霉素(100 U·mL-1)的DMEM细胞培养基中生长, 并于37 ℃、5%CO2下培养.细胞接种到相应培养板后, 37 ℃培养24 h, 根据CCK-8检测的50%抑制浓度(IC50), 用含218 μg·mL-1 PM2.5的新鲜培养基替换原有培养基, 暴露2、4、6、12 h后用于后续检测.
2.4 细胞存活率检测为了确定PM2.5的IC50, 通过CCK-8测量细胞存活率.将A549细胞以8000个·孔-1接种在96孔板中, 培养24 h后用含有PM2.5的新鲜培养基替换原有培养基, 使终浓度分别为50、100、200、400和800 μg·mL-1, 培养24 h.将10 μL CCK-8添加到每个孔中, 在37 ℃下孵育2 h, 然后通过多功能酶标仪在450 nm处读数.
2.5 荧光定量PCR将A549细胞以5×105个·孔-1接种在6孔板中, 培养24 h后用含有218 μg·mL-1 PM2.5的新鲜培养基替换原有培养基, 培养2、4、6和12 h后用于检测.使用Trizol法提取总RNA, 根据制造商的说明书, 使用PrimeScript RT Reagent Kit将1 μg RNA逆转录成cDNA.引物序列如表 1所示.
| 表 1 荧光定量PCR所用引物序列 Table 1 Primers used in q-PCR |
荧光定量PCR体系使用SYBR® Premix DimerEraser, 按照制造商说明书进行.使用ViiA7实时定量PCR仪进行PCR反应, PCR反应程序如下:95 ℃变性5 s, 55 ℃退火30 s, 72 ℃延伸30 s, 40个循环.结果采用2-△△Ct计算CYP1A1 mRNA表达差异.
2.6 Western blot检测A549细胞以4×106个·瓶-1接种于T75培养瓶, 培养24 h后用218 μg·mL-1 PM2.5分别处理2、4、6、12 h或6、12 h后用于检测.细胞用冷的PBS洗涤2次后, 用含有蛋白酶抑制剂的RIPA裂解液提取总蛋白.或者根据说明书, 使用核蛋白和胞浆蛋白提取试剂盒分离核蛋白和胞质蛋白.使用BCA蛋白定量法调整蛋白浓度为等量.在8%或10%的SDS-聚丙烯酰胺凝胶上分离蛋白质, 然后转移到PVDF膜上.5%BSA室温封闭2 h, 一抗使用抗AhR抗体、抗CYP1A1抗体、抗β-actin抗体和抗Histone1抗体, 4 ℃过夜.二抗使用羊抗鼠远红外荧光抗体或羊抗兔远红外荧光二抗, 最后使用奥德赛红外扫膜仪获得条带.
2.7 免疫荧光A549细胞以8×104个·孔-1接种于24孔板中, 培养24 h后用218 μg·mL-1 PM2.5暴露12 h, 然后进行检测.细胞用PBS洗涤2遍后, 用4%多聚甲醛室温固定15 min, 0.3% TritonX-100室温通透10 min.然后用10%驴血清室温封闭0.5 h, 一抗使用抗AhR抗体, 4 ℃过夜, 二抗使用驴抗兔绿色荧光二抗, 室温避光孵育1 h.最后使用Hoechst 33258进行染核, 室温避光孵育10 min后洗涤封片, 在激光共聚焦显微镜下观察荧光.
2.8 双荧光素酶报告实验使用含有多个重复异源物质应答元件(xenobiotic-responsive element, XRE)序列的pGl4.43[luc2P/XRE/Hygro]质粒和作为内参的含有海参荧光素酶基因的pGL4.74[hRluc/TK]质粒转染A549细胞.A549细胞以8000个·孔-1接种于白色透明底的96孔板中, 温育24 h后进行转染.根据制造商的说明书, 使用Lipofectamine 3000转染试剂以质量比10:1的比例转染pGl4.43[luc2P/XRE/Hygro]和pGL4.74[hRluc/TK], 转染24 h后用218 μg·mL-1 PM2.5处理6、12 h后用于检测.双荧光素酶报告检测的步骤按照制造商说明书进行, 用多功能酶标仪测定荧光值, 结果用萤火虫的荧光值除以海参荧光值归一化, 以确定相对荧光素酶活性.
2.9 CYP1A1活性检测将A549细胞以8000个·孔-1接种于96孔板中, 培养24 h后用218 μg·mL-1 PM2.5暴露6、12 h, 然后进行检测.使用CYP1A1活性检测试剂盒, 根据制造商的说明书使用非裂解法进行检测, 结果使用多功能酶标仪读数.其检测原理是细胞内的CYP1A1酶会将试剂盒中的底物转化为荧光素产物, 其从细胞中释放后可被荧光素检测试剂检测.
2.10 统计分析数据表示为平均值±标准差.使用GraphPad Prism 6和SPSS进行统计学分析, 实验组与对照组间采用方差齐性检验、独立样本t检验的方法比较样本数据有无显著性差异.如果p < 0.05, 则认为结果差异显著;如果p < 0.01, 则认为结果差异极显著.
3 结果(Results) 3.1 PM2.5暴露对A549细胞毒性的影响在暴露于PM2.5 24 h后, 本研究使用CCK-8法来检测A549细胞的存活率.由图 1可知, 当PM2.5浓度达到50 μg·mL-1时, 与未处理的对照组相比, 细胞存活率显著降低;随着PM2.5浓度的增加, A549的细胞存活率逐渐降低.通过细胞存活率计算IC50值, 可知PM2.5将A549细胞存活率降低至50%的IC50值为218 μg·mL-1.
 |
| 图 1 不同浓度PM2.5对A549细胞存活率的影响(**p < 0.01) Fig. 1 Effects of different doses of PM2.5 on the viability of A549 cells(**p < 0.01) |
由于AhR通路的激活依赖于AhR易位至细胞核.因此, 本研究首先验证PM2.5是否激活了AhR.在对照组中, AhR蛋白的荧光均匀地分布在细胞质中, 而很少分布在细胞核中(图 2a).用218 μg·mL-1 PM2.5处理12 h后, AhR逐渐在细胞核中积累.通过分离细胞质与细胞核蛋白进行Western blot测定进一步评估PM2.5暴露6和12 h后AhR在A549细胞中的亚细胞定位, 结果显示, PM2.5暴露后AhR蛋白在细胞核中明显积聚(图 2b).结果表明, PM2.5具有AhR配体活性, 能够激活AhR, 并使之从细胞质转位到细胞核中.
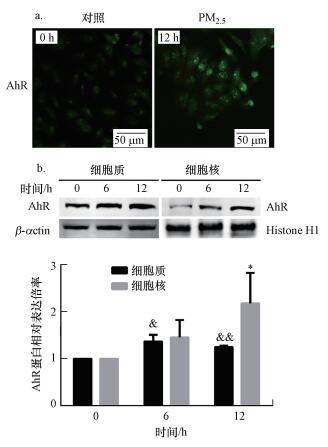 |
| 图 2 PM2.5对A549细胞中AhR核转位的影响(a.免疫荧光分析;b.Western blot分析;& p < 0.05;&&p < 0.01;*p < 0.05) Fig. 2 Effect of PM2.5 on AhR nuclear translocation in A549 cells(a. immunofluorescence analysis; b. western blot analysis; & p < 0.05; &&p < 0.01; *p < 0.05) |
由于激活的AhR可作为转录因子启动其靶基因的表达, 因此, 本研究将A549细胞暴露于218 μg·mL-1 PM2.5 2、4、6和12 h后检测了PM2.5暴露对AhR靶基因CYP1A1的影响.荧光定量PCR结果表明, 暴露于PM2.5后A549细胞中的CYP1A1 mRNA水平呈时间依赖性上调(图 3a).此外, 通过Western blot分析证实由PM2.5诱导的CYP1A1蛋白表达增加(图 3b).这些结果显示, PM2.5可诱导细胞中CYP1A1基因的表达增加.
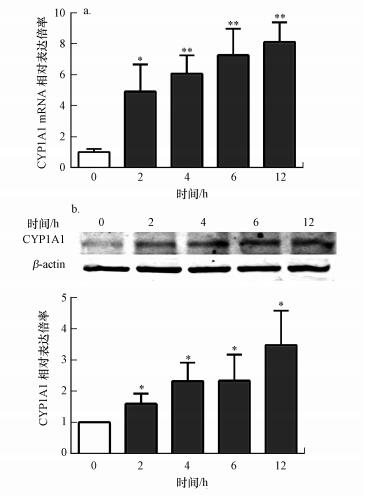 |
| 图 3 PM2.5对A549细胞CYP1A1表达的影响(a.荧光定量PCR分析转录水平;b.Western blot分析翻译水平;*p < 0.05;**p < 0.01) Fig. 3 Effect of PM2.5 on the expression of CYP1A1 in A549 cells(a. q-PCR analysis of transcription levels; b. Western blot analysis of translation levels; p < 0.05; **p < 0.01) |
为了确定PM2.5是否通过AhR与XRE结合的形式调控CYP1A1转录, 本研究利用含有多个重复XRE序列的pG14.43质粒和含有海肾荧光素酶基因的pGL4.74质粒来检测其结合活性.由图 4可知, 与对照组相比, 用218 μg·mL-1 PM2.5暴露6和12 h后, A549细胞中XRE-荧光素酶报告基因的活性以时间依赖性的方式显着增强.该结果表明PM2.5导致了AhR的XRE结合活性激活, 从而诱导下游靶标CYP1A1的转录.
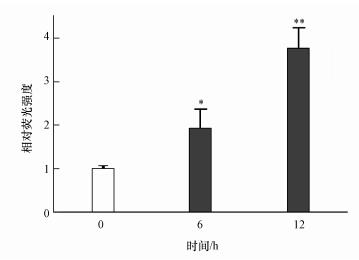 |
| 图 4 基于双荧光素酶报告实验分析PM2.5对AhR与XRE结合的影响(*p < 0.05, **p < 0.01) Fig. 4 The dual luciferase reporter assay was used to analyze the effect of PM2.5 on the binding of AhR to XRE(*p < 0.05, **p < 0.01) |
为了证明PM2.5诱导的CYP1A1蛋白的增加与其酶活性的增加具有一致性, 本研究将A549细胞暴露于218 μg·mL-1 PM2.5 6和12 h后, 用CYP1A1活性测定试剂盒测定了CYP1A1的酶活性.由图 5可知, 用PM2.5处理的A549细胞在CYP1A1酶活性中显示出明显的时间依赖性升高, 这与蛋白质水平的增加相对应.
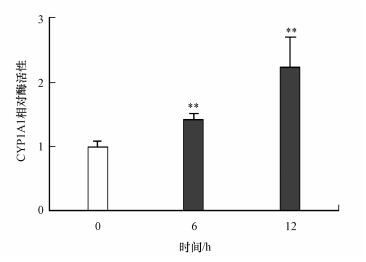 |
| 图 5 PM2.5对CYP1A1酶活性的影响(**p < 0.01) Fig. 5 Effect of PM2.5 on enzyme activity of CYP1A1(**p < 0.01) |
PM2.5是中国重要的大气环境污染物之一, 其在许多肺部疾病中具有不可或缺的作用.AhR是一种典型的环境传感器, 可对环境刺激作出反应, 并且参与重要的生物学过程, 如维持细胞稳态和调节免疫反应等.据国外报道, 暴露于PM2.5或其提取的有机物中会增加呼吸道中AhR靶基因的表达, 提示AhR通路可能在PM2.5诱导的肺部疾病的发展中起重要作用(Libalova et al., 2012).
本研究使用的A549细胞系被广泛作为肺部模型用于评价PM2.5的毒性.为了研究急性暴露对A549细胞中AhR通路的影响, 本文选择了具有明显毒性作用的IC50(218 μg·mL-1)用作研究剂量, 而200 μg·mL-1的剂量为PM2.5体外细胞模型的常用暴露剂量, 可以有效用于PM2.5的毒性评价和损伤研究(Gao et al., 2016; Peng et al., 2017; Feng et al., 2019).作为转录因子, AhR通常以无活性的蛋白复合物状态存在于细胞质中, 在与配体结合之后, 它从蛋白复合物中解离释放, 然后通过AhR N末端暴露出的核定位信号易位到细胞核中(Henry et al., 2003).在本研究中, 在暴露于PM2.5的A549细胞中也观察到相似的现象:随着暴露时间的增加AhR逐渐从细胞质向细胞核易位, 这表明PM2.5样品具有AhR激活配体的作用.这很可能跟PM2.5中普遍存在的组分PAHs有关, 大多数PAHs是已知的AhR的外源性异源配体, 其极易与PM2.5结合, 并成为PM2.5毒性作用的主要因素(Salcido-Neyoy et al., 2015; Borgie et al., 2015; Zhu et al., 2019).几项研究报告显示, PM2.5的有机提取物激活了斑马鱼胚胎中的AhR通路, 并提高了AhR靶基因的水平(Zhang et al., 2016;Yue et al., 2017).在PM2.5有机提取物中鉴定出存在US EPA优先控制的PAHs, 并且是已知的AhR配体(Chen et al., 2019).本课题组最近也检测并报道了本PM2.5样品的组分, 其中含有大量US EPA优先控制的PAHs成份, 其中包括被国际癌症研究机构(IARC)归类为致癌物质的苯并(k)荧蒽、苯并(a)芘和苯并(b)荧蒽等(Miao et al., 2019).AhR的表达在肺组织中丰富, AhR的异常表达与环境污染物引起的肺损伤和肺部疾病密切相关, 这意味着PM2.5可能通过激活的AhR通路介导肺部疾病的发病机制.
CYP1A1是典型的AhR靶基因, 其在肺中表达, 持续暴露于化学物质或环境污染物会通过AhR引起肺组织中CYP1A1表达水平的升高(Cervena et al., 2019).本研究显示, PM2.5可诱导A549细胞中CYP1A1转录翻译水平的增加.CYP1A1调控的主要途径是激活的AhR转移到细胞核后与ARNT形成二聚体, 然后能够识别并结合到AhR靶基因(CYP1A1)5′启动子区域中的XRE上, 从而启动其转录(Tong et al., 2016).为了确定PM2.5诱导CYP1A1的表达上调是通过AhR和XRE的结合, 本研究通过含有3个XRE的荧光素酶报告质粒来模拟CYP1A1启动子中AhR结合位点的活性情况, 结果表明, PM2.5暴露导致A549细胞中AhR与XRE的配体依赖性结合, 进一步推测PM2.5诱导CYP1A1的转录上调是因为AhR与其DNA序列中的XRE结合.
AhR通路的激活导致一系列重要的下游生物学效应, 包括PAHs的致癌性转化.PM2.5中的PAHs可通过呼吸进入呼吸道, 分布到肺组织中或沉积在肺泡中, 是其毒性作用的关键成分.然而PAHs不是直接的损伤诱导剂, 它需要进行生物转化才能生成可以靶向生物大分子(如DNA)的化学反应性中间体.AhR激活可调控1期代谢酶CYP450的增加, CYP450反过来又有助于催化PAHs.即在代谢过程中, 包括CYP1A1/1B1在内的CYP450将PAHs转化为环氧化物和二醇环氧化物, 从而将PAHs转化为致癌性中间体(Tsay et al., 2013).因此, AhR的激活和CYP1A1的后续活化可能在环境污染物诱发肺癌中起重要作用(El et al., 2014).而本研究也检测到PM2.5暴露后细胞中CYP1A1酶活性增加, 提示PM2.5可能由此产生毒性作用.从分子生物学角度深入研究AhR必将有助于人们认识环境污染物及其对人体的致病过程, 以及外界对其的影响, 从而对阐明化学物质在癌症发生发展的作用具有非常重要的意义.
5 结论(Conclusions)PM2.5可诱导人肺上皮细胞系A549中多环芳烃受体(AhR)的核转位.PM2.5通过AhR与靶基因结合位点(XRE)的结合增加靶基因CYP1A1的表达, 且PM2.5可增加CYP1A1的酶活性.研究表明, 北京冬季的PM2.5诱导了A549细胞中AhR通路的激活, 提示细胞中AhR通路的激活可能与PM2.5对肺部的毒性效应有关.
Borgie M, Ledoux F, Verdin A, et al. 2015. Genotoxic and epigenotoxic effects of fine particulate matter from rural and urban sites in Lebanon on human bronchial epithelial cells[J]. Environmental Research, 136: 352-362. DOI:10.1016/j.envres.2014.10.010 |
Cervena T, Vrbova K, Rossnerova A, et al. 2019. Short-term and long-term exposure of the mucilair model to polycyclic aromatic hydrocarbons[J]. Alternatives to Laboratory Animals, 47(1): 9-18. DOI:10.1177/0261192919841484 |
Chen T, Jin H, Wang H, et al. 2019. Aryl hydrocarbon receptor mediates the cardiac developmental toxicity of EOM from PM2.5 in P19 embryonic carcinoma cells[J]. Chemosphere, 216: 372-378. DOI:10.1016/j.chemosphere.2018.10.160 |
Chiba T, Uchi H, Yasukawa F, et al. 2011. Role of the arylhydrocarbon receptor in lung disease[J]. International Archives of Allergy and Immunology, 155(1): 129-134. |
El S N, Ibrahim B M, Alassal M A. 2014. Cytochrome P450-isoenzyme 1A1 in susceptibility to tobacco-related lung cancer[J]. Asian Cardiovascular & Thoracic Annals, 22(3): 315-318. DOI:10.1177/0218492313492987 |
Feng Y, Lin H, Zhu R, et al. 2019. PM2.5 inhibits the expression of occludin in human nasal mucosal epithelial cells[J]. Chinese Journal of Cellular and Molecular Immunology, 35(2): 152-157. |
Gabelova A, Valovicova Z, Horvathova E, et al. 2004. Genotoxicity of environmental air pollution in three European cities:Prague, Kosice and Sofia[J]. Mutation Research, 563(1): 49-59. DOI:10.1016/j.mrgentox.2004.05.014 |
Gao Z X, Song X L, Li S S, et al. 2016. Assessment of DNA damage and cell senescence in corneal epithelial cells exposed to airborne particulate matter (PM2.5) collected in Guangzhou, China[J]. Investigative Ophthalmology & Visual Science, 57(7): 3093-3102. |
Gualtieri M, Ovrevik J, Mollerup S, et al. 2011. Airborne urban particles (Milan winter-PM2.5) cause mitotic arrest and cell death:Effects on DNA, mitochondria, AhR binding and spindle organization[J]. Mutation Research, 713(1/2): 18-31. |
Hamad S H, Schauer J J, Antkiewicz D S, et al. 2016. ROS production and gene expression in alveolar macrophages exposed to PM2.5 from Baghdad, Iraq:Seasonal trends and impact of chemical composition[J]. The Science of the Total Environment, 543(Pt A): 739-745. |
Henry E C, Gasiewicz T A. 2003. Agonist but not antagonist ligands induce conformational change in the mouse aryl hydrocarbon receptor as detected by partial proteolysis[J]. Molecular Pharmacology, 63(2): 392-400. DOI:10.1124/mol.63.2.392 |
Libalova H, Uhlirova K, Klema J, et al. 2012. Global gene expression changes in human embryonic lung fibroblasts induced by organic extracts from respirable air particles[J]. Particle and Fibre Toxicology, 9: 1. DOI:10.1186/1743-8977-9-1 |
Liu Q, Wu J, Song J, et al. 2017. Particulate matter 2.5 regulates lipid synthesis and inflammatory cytokine production in human SZ95 sebocytes[J]. International Journal of Molecular Medicine, 40(4): 1029-1036. DOI:10.3892/ijmm.2017.3109 |
Loomis D, Huang W, Chen G. 2014. The International Agency for Research on Cancer (IARC) evaluation of the carcinogenicity of outdoor air pollution:focus on China[J]. Chinese Journal of Cancer, 33(4): 189-196. DOI:10.5732/cjc.014.10028 |
吕广娜, 李荣山. 2013. 大气细颗粒物PM2.5对人体损害及致病机制的研究进展[J]. 中国医药指南, 11(29): 43. DOI:10.3969/j.issn.1671-8194.2013.29.029 |
Miao X, Li W, Niu B, et al. 2019. Mitochondrial dysfunction in endothelial cells induced by airborne fine particulate matter ( < 2.5 μm)[J]. Journal of Applied Toxicology, 39(10): 1424-1432. DOI:10.1002/jat.3828 |
Moorthy B, Chu C, Carlin D J. 2015. Polycyclic aromatic hydrocarbons:From metabolism to lung cancer[J]. Toxicological Sciences, 145(1): 5-15. DOI:10.1093/toxsci/kfv040 |
Peng H, Zhao X H, Bi T T, et al. 2017. PM2.5 obtained from urban areas in Beijing induces apoptosis by activating nuclear factor-kappa B[J]. Military Medical Research, 4(1): 27. |
Rice M B, Li W, Schwartz J, et al. 2019. Ambient air pollution exposure and risk and progression of interstitial lung abnormalities:the framingham heart study[J]. Thorax, 74(11): 1063-1069. DOI:10.1136/thoraxjnl-2018-212877 |
Salcido-Neyoy M E, Sanchez-Perez Y, Osornio-Vargas A R, et al. 2015. Induction of c-Jun by air particulate matter (PM10) of Mexico city:Participation of polycyclic aromatic hydrocarbons[J]. Environmental Pollution, 203: 175-182. DOI:10.1016/j.envpol.2015.03.051 |
Tong B, Yuan X, Dou Y, et al. 2016. Norisoboldine, an isoquinoline alkaloid, acts as an aryl hydrocarbon receptor ligand to induce intestinal Treg cells and thereby attenuate arthritis[J]. The International Journal of Biochemistry & Cell Biology, 75: 63-73. |
Tsay J J, Tchou-Wong K M, Greenberg A K, et al. 2013. Aryl hydrocarbon receptor and lung cancer[J]. Anticancer Research, 33(4): 1247-1256. |
Wang Y, Yang W, Han B, et al. 2016. Gravimetric analysis for PM2.5 mass concentration based on year-round monitoring at an urban site in Beijing[J]. Journal of Environmental Science, 40: 154-160. DOI:10.1016/j.jes.2015.09.015 |
Yu Y, Schleicher N, Norra S, et al. 2011. Dynamics and origin of PM2.5 during a three-year sampling period in Beijing, China[J]. .Journal of Environmental Monitoring, 13(2): 334-346. |
Yue C, Ji C, Zhang H, et al. 2017. .Protective effects of folic acid on PM2.5-induced cardiac developmental toxicity in zebrafish embryos by targeting AhR and Wnt/beta-catenin signal pathways[J]. Environmental Toxicology, 32(10): 2316-2322. DOI:10.1002/tox.22448 |
Zhang H, Yao Y, Chen Y, et al. 2016. .Crosstalk between AhR and wnt/beta-catenin signal pathways in the cardiac developmental toxicity of PM2.5 in zebrafish embryos[J]. Toxicology, 355-356: 31-38. DOI:10.1016/j.tox.2016.05.014 |
Zhou Z, Liu Y, Duan F, et al. 2015. Transcriptomic analyses of the biological effects of airborne PM2.5 exposure on human bronchial epithelial cells[J]. PLoS One, 10(9): e138267. |
Zhu J, Hsu C Y, Chou W C, et al. 2019. PM2.5- and PM10-bound polycyclic aromatic hydrocarbons (PAHs) in the residential area near coal-fired power and steelmaking plants of Taichung City, Taiwan:In vitro-based health risk and source identification[J]. Science of the Total Environmental, 670: 439-447. DOI:10.1016/j.scitotenv.2019.03.198 |
 2020, Vol. 40
2020, Vol. 40


