2. 福建农林大学林学院, 福州 350002
2. College of Forestry, Fujian Agriculture and Forestry University, Fuzhou 350002
藻类过量繁殖会使水体透明度及溶解氧含量降低, 加重水体富营养化过程, 同时, 藻类代谢过程所产生的藻毒素及腥臭味物质也会对水环境造成污染, 进而威胁人类和动物的饮水安全(Anderson et al., 2009;Paerl et al., 2013;Wang et al., 2017).因此, 寻求高效且环保的藻类治理方法, 已成为目前亟待解决的问题.
迄今为止, 国内学者已开发出包括物理、化学及生物技术在内的多种除藻措施, 其中, 光催化技术因成本低廉、环境友好, 在灭活藻细胞的同时可降解藻类产生的有害物质, 从而被认为更适合水体原位修复(黄微雅等, 2012;王鑫等, 2016).石墨相氮化碳(g-C3N4)是一种新型的具有可见光响应的半导体光催化剂, 由于具有优良的热、化学稳定性及原料成本低等优点(田海锋等, 2012), 因而展现出良好的应用前景(Zhang et al., 2012;Zhao et al., 2015;Liang et al., 2016).但该材料在实际应用中却受到禁带宽度较大(2.7 eV)、对可见光的响应范围较窄(一般小于460 nm)、光生电子-空穴对复合率高及比表面积较小等条件的制约(张金水等, 2014;Sun et al., 2017;Chen et al., 2017).如Sun等(2012)利用g-C3N4-D/UV在100 min内对十溴二苯醚(BDE209)的降解率不超过40%;Zhao等(2018)以三聚氰胺(M)、碳酸胍(G)和双氰胺(D)为前驱体热聚合生成g-C3N4, 通过光催化降解甲基橙发现, g-C3N4-M在120 min内可降解54.67%的甲基橙, 而g-C3N4-G和g-C3N4-D的降解效率仅分别为23.46%和22.16%;Song等(2018)曾以双氰胺作为前驱体制备g-C3N4, 热剥离后用来光催化灭活藻细胞, 结果发现受材料自身条件的限制, 纯g-C3N4对藻细胞的灭活效果并不理想.
为了提升g-C3N4的光催化活性, 国内研究人员相继在g-C3N4结构中引入金属元素, 在其价带和导带之间形成能量陷阱, 这不仅能够增加其对可见光的吸收能力, 提高其对可见光的利用率, 还可以促进其光生电子-空穴对的快速分离, 从而达到提高g-C3N4光催化性能的目的(Zhang et al., 2015).Yue等(2011)采用软化学合成法制备了一系列Zn/g-C3N4用来制氢, 其中, 10%Zn/g-C3N4样品的析氢速率比纯g-C3N4高10倍以上.Meng等(2011)通过热聚合法制备了Ag/g-C3N4, 其光降解活性较纯g-C3N4而言明显提高, 其中, 1%Ag/g-C3N4具有最佳的光催化活性, 与纯g-C3N4相比, 亚甲基蓝的降解率从34%增加到58%.Zhang等(2015)利用双氰胺和碘化钾热聚合制备出K-C3N4, 其对苯酚和亚甲基蓝的降解效率分别是纯g-C3N4的3.3和5.8倍.Shu等(2019)通过Na元素掺杂改性将g-C3N4的光催化产氢效率提高了约13倍.近年来, 金属掺杂改性g-C3N4的研究已经取得了突破性进展, 改性后的光催化剂已成功应用在水解制氢、降解有机物及有机合成等多个领域, 但在水体藻类灭活方面至今尚未见相关报道.
因此, 本文以双氰胺和CuCl2·2H2O为前驱物质通过热聚合法制备不同比例Cu掺杂g-C3N4复合光催化剂, 采用X射线衍射光谱(XRD)、紫外-可见光谱(UV-Vis)、光致发光光谱(PL)、扫描电子显微镜/能量色散X射线光谱(SEM/EDX)、傅里叶红外光谱(FT-IR)、X射线光电子能谱(XPS)等技术手段对光催化剂进行表征, 考察Cu的引入对g-C3N4形貌结构和光学性质的影响, 研究Cu-C3N4对铜绿微囊藻的灭活效果, 并通过活性氧猝灭实验及抗氧化酶活性测定对其灭活机理进行探讨.以期为有害藻类去除及水体环境治理提供理论参考.
2 材料与方法(Materials and methods) 2.1 实验材料铜绿微囊藻(Microcystis aeruginosa)FACHB-315由中国科学院水生生物研究所提供;BG-11培养基;双氰胺、二水合氯化铜(CuCl2·2H2O)、乙二胺四乙酸二钠(EDTA-2Na)、对苯醌(BQ)、草酸钠(SO)、硫酸亚铁(FeSO4·7H2O)、异丙醇(IPA)、无水乙醇均为分析纯试剂, 购自国药集团化学试剂有限公司(天津).
2.2 催化剂的制备催化剂的制备参考Li等(2016)的方法, 具体操作为:将10 g双氰胺分散在50 mL超纯水中, 加入一定量的CuCl2·2H2O(Cu/双氰胺=0.5%、1%、3%、5%), 超声1 h, 80 ℃搅拌蒸干水分, 将所得固体在550 ℃煅烧4 h, 自然冷却至室温, 充分研磨, 过120目筛子, 即可得到不同比例Cu掺杂g-C3N4.纯g-C3N4粉末的制备方法与之相同, 只是不添加CuCl2·2H2O.
2.3 催化剂的表征使用X射线衍射仪(XRD, 79HW-1型, 日本Rigaku公司)以Cu阳极、Kα靶作为辐射电源对样品进行物相分析, 扫描速度为2.5°·min-1, 测试角度范围为10°~80°.使用扫描电子显微镜/能量色散X射线光谱(SEM/EDX, Phenom ProX型, 荷兰飞纳公司)观察材料表面微观形貌及元素组成.使用傅里叶红外光谱(FT-IR, Nicolet iS10型, 美国赛默飞公司)对材料的结构组成与化学基团进行定性分析.使用紫外可见分光光度计(UV-vis DRS, Cary 5000型, 美国安捷伦公司)对材料进行紫外可见光漫反射分析, 样品测试时以BaSO4为基底.使用光致发光光谱(PL, FluoroLog-3型, 美国HORIBA公司)分析材料中光生载流子的分离效率.使用X射线光电子能谱仪(XPS, Quantum 2000型, 美国PHI公司)对材料的化学元素组成进行分析, 确定元素是否掺杂及掺杂元素的成键状态.使用比表面积与孔隙度分析仪(BET, Tristar Ⅱ 3020型, 美国麦克公司)测定材料的比表面积和孔径分布, 测试前首先在氮气氛围中150 ℃干燥4 h, 测试温度为77 K.
2.4 藻种培养将铜绿微囊藻(Microcystis aeruginosa)FACHB-315接入已灭菌的小三角瓶中弱光下培养2~3 d后, 加入等体积BG-11培养基, 放置在人工气候箱中培养, 温度为25 ℃, 光照强度为2200 lx, 光照周期为12 h(昼)/12 h(夜), 每天定时摇晃3次, 待藻液OD680>0.5时, 再进行扩大培养.
2.5 光催化除藻实验光催化除藻实验在自主搭建的光催化反应器中进行, 具体如图 1所示.光源为500W氙灯, 控制光子通量密度约为600 μmol·m-2·s-1, 用滤光片滤去波长λ < 420 nm的紫外光, 反应容器为夹层烧杯, 外接回流水以排除温度对实验的干扰, 低速磁力搅拌用于模拟天然水体的流动.具体实验步骤:收集对数生长期的藻细胞, 用超纯水(pH=7.0±0.2)重悬并稀释至OD680=0.2;取50 mL藻液于夹层烧杯中, 投加0.01 g的催化剂, 在磁力搅拌器上暗反应30 min, 打开氙灯及回流水;每隔1 h取1 mL藻液, 采用乙醇提取法提取藻细胞中的叶绿素a, 取上清液分别测定A663和A645, 按照式(1)计算叶绿素a含量C(mg·L-1), 以此来表征溶液中藻细胞密度(刘湘庆等, 2016).按照式(2)计算除藻效率R.
 |
| 图 1 光催化反应装置图 Fig. 1 Image of photocatalytic reactor |

|
(1) |

|
(2) |
式中, CT和Cc分别为经过和未经过光催化处理的藻细胞叶绿素a含量.
2.6 生理生化指标测定采用脱氢酶还原法测定藻细胞活力的变化(梁文艳等, 2010);利用SEM观察藻细胞表面形态的变化;藻细胞蛋白质含量的测定:考马斯亮蓝法(Bradford, 1976);藻细胞SOD的测定:氮蓝四唑光化还原法(Beauchamp et al., 1971);CAT的测定:紫外吸收法(Giannoplities et al., 1977);POD的测定:愈创木酚法(Evans et al., 1965);T-AOC的测定:亚铁还原法(Pellegrini et al., 2003);MDA含量的测定:硫代巴比妥酸法(Shiu et al., 2005);利用酶标仪扫描光合色素光谱图的变化.采用Excel 2007和Origin 5.0进行数据处理和作图.
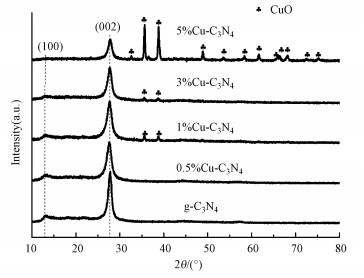
3 结果与讨论(Results and analysis) 3.1 光催化剂的表征 3.1.1 XRD分析g-C3N4和Cu-C3N4的XRD图谱如图 2所示.从图中可以看出, 所有材料在2θ=13.1°和27.5°处均存在明显特征峰, 分别对应于g-C3N4材料的(100)和(002)晶面(标准卡片JCPDS87-1526).此外, Cu的引入使得合成材料在2θ=35.6°、38.8°和48.9°处出现了新的衍射峰, 分别对应于CuO材料的(002)、(111)、(202)晶面(标准卡片JCPDS45-0937).随着Cu掺杂比例的增加, 2θ=13.1°和27.5°处的特征峰逐渐减弱, 说明Cu的引入抑制了氮化碳晶粒的生长, 而2θ=35.6°、38.8°和48.9°处的特征峰逐渐增强, 即CuO生成量随着Cu掺杂量的增加而增加.XRD结果表明成功制备了Cu-C3N4复合材料.
 |
| 图 2 催化剂的XRD谱图 Fig. 2 XRD patterns of the catalysts |
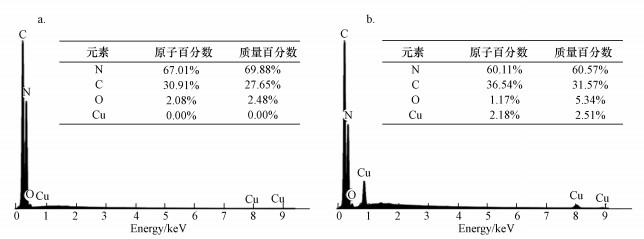
g-C3N4和Cu-C3N4的SEM图如图 3所示.纯g-C3N4由许多表面平滑但形状不规则的片状颗粒堆积而成, 颗粒尺寸和厚度较大, 导致材料表面孔径较大(图 3a和3b).对于Cu掺杂的复合材料, 与纯g-C3N4相比, 颗粒尺寸和厚度减小, 材料表面呈现出明显的层状(图 3c~3f).随着Cu掺杂量的增加, 材料表面的皱折层明显增多, 但材料的空隙也逐渐消失, 表明在热缩合过程中氯化铜的分解可以抑制石墨相氮化碳晶体生长.同时, EDX图谱分析表明, Cu-C3N4复合材料中含有C、N、O、Cu 4种元素, 且Cu元素含量与理论值相近(图 4).
 |
| 图 3 催化剂的SEM图(a, b. g-C3N, c.0.5%Cu-C3N4, d.1%Cu-C3N4, e.3%Cu-C3N4, f.5%Cu-C3N4) Fig. 3 SEM images of g-C3N4(a, b), 0.5%Cu-C3N4(c), 1%Cu-C3N4(d), 3%Cu-C3N4(e) and 5%Cu-C3N4(f) |
 |
| 图 4 g-C3N4(a)和5%Cu-C3N4(b)的能量色散光谱图 Fig. 4 EDX spectra of g-C3N4(a) and 5%Cu-C3N4(b) |
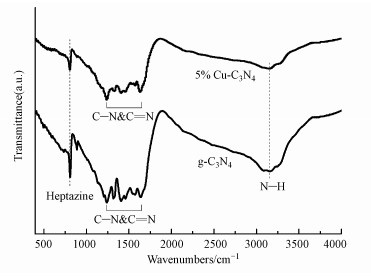
g-C3N4和5%Cu-C3N4的傅里叶红外光谱图如图 5所示.由图可知, g-C3N4在3000~3300 cm-1处的一系列特征峰归因于g-C3N4材料中N—H的伸缩振动, 位于807 cm-1附近的特征峰对应于三嗪环结构的弯曲振动(Ma et al., 2018).位于1240~1650 cm-1范围内的特征峰归因于芳香族C—N杂环的伸缩振动(Ji et al., 2018).5%Cu-C3N4的光谱特征与g-C3N4相似, 未发现明显的CuO特征峰, 这可能是由于CuO的浓度太低及g-C3N4的响应值过高所致(Duan, 2018).
 |
| 图 5 g-C3N4和5%Cu-C3N4的傅里叶红外光谱图 Fig. 5 FT-IR spectra of g-C3N4 and 5%Cu-C3N4 |
g-C3N4和5%Cu-C3N4的N2吸附-脱附等温线和孔径分布如图 6a和6b所示.从图中可以看出, 2种催化剂都呈现出典型的Ⅳ型等温线, 表明两者均具有介孔结构.g-C3N4和5%Cu-C3N4样品的比表面积分别为21.1398 m2·g-1和12.4607 m2·g-1, 孔体积分别为0.141238 cm3·g-1和0.080647 cm3·g-1.上述结果说明, Cu掺杂会使g-C3N4的比表面积和孔体积减小, 这种结果与前人报道的Cu掺杂可使g-C3N4比表面积增加的结论并不一致(Oh et al., 2017;Plachy et al., 2019), 这可能归因于过量生成的CuO对材料的表面覆盖和孔隙填充, 导致了材料比表面积和孔径的减小(Liu et al., 2020).
 |
| 图 6 g-C3N4和5%Cu-C3N4的N2吸附-脱附等温线(a)及孔径分布(b) Fig. 6 N2 adsorption-desorption isotherms(a) and pore size distribution curves(b) of g-C3N4 and 5%Cu-C3N4 |
采用紫外-可见漫反射光谱法研究了g-C3N4和5%Cu-C3N4光催化剂的光学性质、吸收边缘及相应的带隙.如图 7a所示, g-C3N4和5%Cu-C3N4的吸收边界分别位于462 nm和538 nm, 说明所制备的材料对可见光均表现出吸收特性.与纯g-C3N4相比, 5%Cu-C3N4复合材料的吸收边界向可见光区域移动, 说明Cu掺杂可以增强g-C3N4材料的可见光吸收性能.按照式(3)计算本实验所制备材料的带隙(Duan, 2018).
 |
| 图 7 g-C3N4和5%Cu-C3N4的紫外可见漫反射光谱(a)和带隙(b) Fig. 7 UV-vis DRS(a) and band gap(b) of g-C3N4 and 5%Cu-C3N4 |

|
(3) |
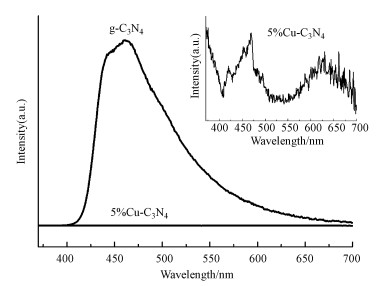
式中, α为吸光指数, h为普朗克常数, v为频率, A为常数, Eg代表半导体禁带宽度.用(αhv)2对hv作图, 结果如图 7b所示.由图可知, g-C3N4和5%Cu-C3N4的带隙分别为2.70 eV和2.45 eV, 带隙的减小证明了5%Cu-C3N4具有比g-C3N4更强的光吸收性能.利用光致发光(PL)光谱分析研究了g-C3N4和5%Cu-C3N4样品中光生电子和空穴的分离效率, 结果如图 8所示.由图可知, 5%Cu-C3N4的PL发射强度低于g-C3N4, 说明Cu的引入显著抑制了光生电子和空穴的复合率,进而提升了g-C3N4的光催化活性.
 |
| 图 8 g-C3N4和5%Cu-C3N4的光致发光光谱 Fig. 8 Photoluminescence spectra of g-C3N4 and 5%Cu-C3N4 |
利用X射线光电子能谱分析复合材料的元素组成及成键状态.图 9a为5%Cu-C3N4的XPS全谱扫描图, 可以发现, 5%Cu-C3N4样品中含有C、N、O、Cu 4种元素.图 9b为5%Cu-C3N4材料的C 1s轨道谱图, 结合能位于284.85 eV处的特征峰在文献中通常指定为石墨碳, 但也可对应于sp2杂化轨道上的C—N键, 结合能位于287.96 eV处的特征峰对应于芳环中与—NH2基团连接的sp2-杂化碳(Cui et al., 2011).图 9c为5%Cu-C3N4材料的N 1s轨道谱图, 结合能位于398.51 eV处的特征峰对应于C=N—C键, 结合能位于400.37 eV处的特征峰对应于来自g-C3N4前体的C—NH2键(Tahir et al., 2017).图 9d为5%Cu-C3N4材料的O 1s轨道谱图, 结合能位于531.40 eV处的特征峰对应于CuO晶格中的氧原子(Li et al., 2016).图 9e为5%Cu-C3N4材料的Cu 2p轨道谱图, 结合能为932.43 eV和952.25 eV处存在明显的特征峰, 分别对应于Cu 2p 3/2和Cu 2p 1/2轨道, 结合能差为19.82 eV, 表明5%Cu-C3N4材料中的Cu是以Cu2+形式存在(Muniandy et al., 2017).
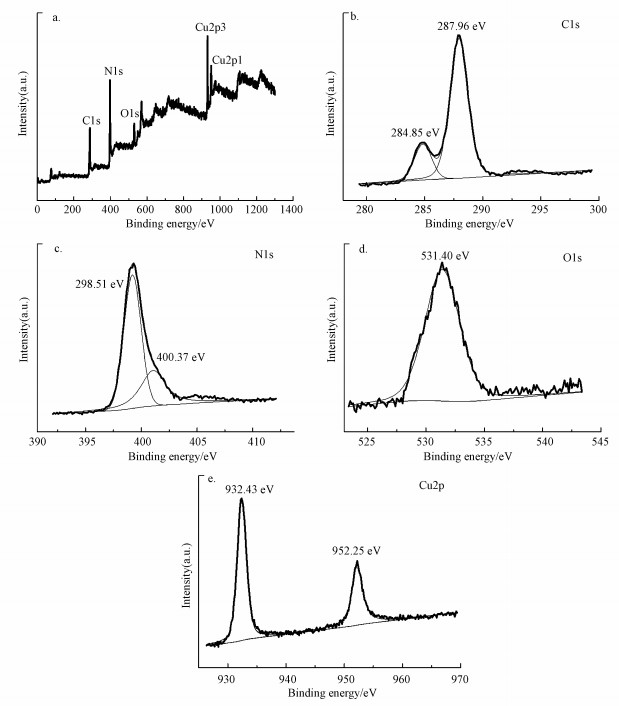 |
| 图 9 5%Cu-C3N4的XPS全谱图(a)、C 1s(b)、N 1s(c)、O 1s(d)和Cu 2p(e)轨道图 Fig. 9 XPS survey spectrum(a), C 1s spectrum(b), N 1s spectrum(c), O 1s spectrum(d) and Cu 2p spectrum(e) of 5%Cu-C3N4 |
由图 10a可知, 不添加任何催化剂, 将藻细胞置于光照条件下, 与对照组相比, 藻细胞叶绿素a含量未发生明显变化, 表明该光照强度不会对藻细胞产生灭活效果.避光条件下, 将5种光催化剂加入藻液中, 在6.5 h内叶绿素a含量均不会发生明显变化, 表明催化剂对藻细胞无毒害作用, 且其吸附作用对灭活藻细胞的贡献微乎其微.这是因为热聚合形成的光催化剂比表面积较小, 因而对藻细胞吸附效果较差.由图 10b可知, 在光催化反应过程中, 纯g-C3N4对藻细胞几乎没有灭活作用, 但随着Cu掺杂量的增加, CuO生成量逐渐增加, 过量的CuO覆盖在催化剂表面, 提高了催化剂对可见光的吸收效率, 同时抑制了光生电子和空穴的复合率, 使其对藻细胞的灭活作用逐渐增强.5%Cu-C3N4催化剂中CuO含量最高, 对藻细胞的灭活效率最好, 可达79.4%, 灭活效果如图 11a所示.且在5轮循环试验后, 5%Cu-C3N4催化性能没有明显损失(图 11c).由此可见, Cu掺杂g-C3N4具有良好的可重复性和稳定性, 可作为有效手段来灭活藻细胞.
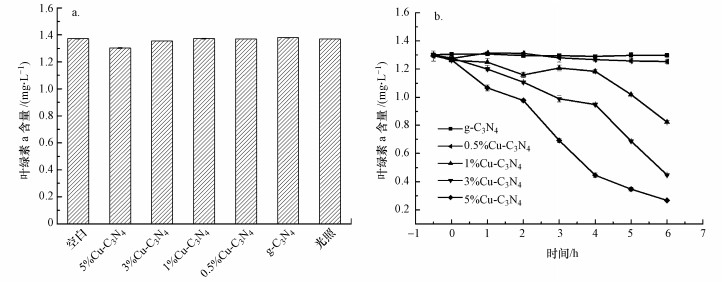 |
| 图 10 催化剂对藻细胞毒性(a)及光催化效果(b) Fig. 10 Toxicity (a) and photocatalytic efficiency(b) of the catalysts on Microcystis aeruginosa |
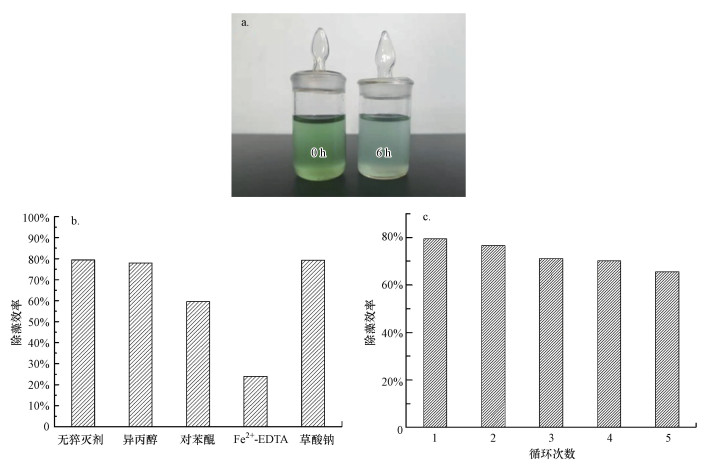 |
| 图 11 5% Cu-C3N4光催化灭活效果(a)、机制(b)和循环试验(c) Fig. 11 Photocatalytic inactivation efficiency(a), mechanism(b) and recycling experiments(c) of 5% Cu-C3N4 |
分别将异丙醇(0.5 mmol·L-1)、草酸钠(0.5 mmol·L-1)、Fe2+-EDTA(0.1 mmol·L-1)和对苯醌(0.1 mmol·L-1)作为羟基自由基、光生空穴、过氧化氢和超氧自由基的清除剂(Gao et al., 2015;Song et al., 2018), 通过活性氧自由基清除实验研究了不同活性氧在光催化过程中的作用, 实验中不同清除剂的抑制强度可以反映相应活性氧的重要性(Wang et al., 2019).由图 11b可知, Fe2+-EDTA对光催化灭活藻细胞的抑制效果最强, 对苯醌也明显抑制了光催化灭活效果, 但异丙醇和草酸钠的加入对于灭活效果并没有产生显著影响, 表明过氧化氢和超氧自由基是在光催化灭活藻细胞过程中起主要作用的活性物质.该结果与Dou等(2018)的实验结果一致, 此外, Hu等(2018)也证实Cu-C3N4具有光催化制备H2O2的功能, 可将O2还原为H2O2.
通过以上分析, 推断Cu-C3N4光催化灭活藻细胞的反应机理可用下述反应式表示.CuO(1.68 eV)与g-C3N4(2.70 eV)相比具有较小的带隙, 在光能的激发作用下, CuO价带上的h+可以转移到g-C3N4的价带上, 而g-C3N4导带上的e-可以转移到CuO的导带上, 从而有效抑制了光生电子和空穴的复合(Zhang et al., 2020), 致使其内部产生了大量的光生电子(e-)和空穴(h+)(式(4)).自由基清除实验表明, 向反应体系中加入h+清除剂对藻细胞灭活效率几乎没有影响.Shi等(2018)通过测定Cu/C3N4-6光催化反应体系中O2生成量, 证明h+可与H2O反应生成O2(式(5)).由此推测, 本实验中产生的h+主要参与了光解水制氧的反应, 但由于实验环境中含氧量充足, 所以并不需要借助h+氧化H2O生成的O2, 因此, 加入草酸钠未对灭活藻细胞产生影响.与此同时, e-还原O2生成具有强氧化性的·O2-(式(6)), 可用于灭活藻细胞.此外, O2与反应体系中的H+和e-反应生成H2O2(式(7)), 对于灭活藻细胞贡献更大.
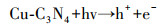
|
(4) |
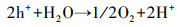
|
(5) |

|
(6) |
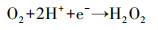
|
(7) |
研究了光催化灭活过程中藻细胞生理生化指标的变化, 结果如图 12a和12b所示.由图可知, 随着光催化反应的进行, 藻细胞表面逐渐皱缩变形, 失去球形结构, 细胞活力下降, 胞内蛋白质含量逐渐降低, 表明光催化产生的活性氧(ROS)对胞内蛋白造成氧化性损伤, 致使其氧化分解, 进而导致藻细胞皱缩.由图 12c和12d可知, 光催化过程中超氧化物岐化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)及总抗氧化能力(T-AOC)均呈现出先升后降的趋势, 这归因于光催化产生的ROS对藻细胞持续施加氧化压力, 致使藻细胞在光催化反应初期(0~2 h)抗氧化能力快速上升.但随着光催化反应的进行, 藻细胞无法逆转这种不利局面, 细胞体遭受不可逆的损害, 抗氧化系统崩溃, 导致其抗氧化能力逐渐降低.丙二醛(MDA)是生物膜中多种不饱和脂肪酸在氧自由基攻击下形成的脂质过氧化产物, 其含量的变化可反映出机体损伤的程度.光催化反应过程中藻细胞MDA含量逐步降低, 这种现象可能源自光催化过程中产生的ROS将藻细胞膜释放的MDA进一步氧化(Gu et al., 2015).
 |
| 图 12 5%Cu-C3N4光催化过程中藻细胞生理生化指标的变化 Fig. 12 Changes of physiological and biochemical indexes of Microcystis aeruginosa during 5%Cu-C3N4 photocatalytic process |
光合色素在藻细胞光合系统中起着重要的作用.为此, 实验研究了光催化灭活过程中光合色素的变化情况, 结果如图 13所示.由图可知, 藻细胞光合色素在433、478、586、618、663 nm波长处存在明显的吸收峰, 随着光催化时间的增加吸收峰强度逐渐降低, 表明光合色素逐步降解.叶绿素(663 nm和645 nm)是藻类必需的光合色素, 可用来捕获光并将其转化为生化能(刘湘庆等, 2016;Chen et al., 2018);类胡萝卜素(454 nm)除了捕获光之外, 还能起到防止光氧化损伤及保护叶绿素和光合机构的作用(杨远帆等, 2005;Pérez-Pérez et al., 2012);叶黄素(444 nm)对叶绿素和光合器官可起到保护作用(Baroli et al., 2000;彭艳芬等, 2007).光催化过程中这3种光合色素逐步降解, 表明藻细胞受到了不可逆转的氧化损伤, 导致其光转化效率逐步降低, 最终丧失细胞活性.
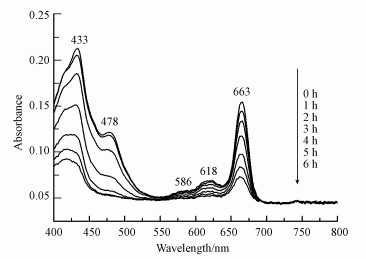 |
| 图 13 5%Cu-C3N4光催化过程中藻细胞光合色素的变化 Fig. 13 Changes of photosynthetic pigments in Microcystis aeruginosa during 5%Cu-C3N4 photocatalytic process |
1) 采用热聚合法制备出不同比例Cu掺杂g-C3N4光催化材料, 随着Cu掺杂比例的增加, 催化剂对藻细胞的光催化灭活效果逐渐增强.5%Cu-C3N4在6 h内对藻细胞的光催化灭活效率可达到79.4%.
2) H2O2和·O2-是5%Cu-C3N4光催化反应体系中主要的活性物质, 与纯g-C3N4相比, 5%Cu-C3N4复合材料光催化性能增强的原因是Cu掺杂改性有利于催化剂表面光生电子-空穴的分离, 提高了催化剂对可见光的利用率.
3) 光催化过程中产生的活性物质会干扰藻细胞抗氧化系统, 使得藻细胞抗氧化能力呈现出先升后降的趋势, 最终破坏抗氧化系统和自由基之间的平衡, 使细胞氧化性损伤, 导致细胞死亡.
Anderson D M. 2009. Approaches to monitoring, control and management of harmful algal blooms (HABs)[J]. Ocean & Coastal Management, 52(7): 342-347. |
Baroli I, Niyogi K K. 2000. Molecular genetics of xanthophyll-dependent photoprotection in green algae and plants[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 355(1402): 1385-1394. |
Beauchamp C, Fridovich I. 1971. Superoxide dismutase:improved assays and an assay applicable to acrylamide gels[J]. Analytical Biochemistry, 44(1): 276-287. |
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 72: 248-254. |
Chen P, Wang F L, Zhang Q X, et al. 2017. Photocatalytic degradation of clofibric acid by g-C3N4/P-25 composites under simulated sunlight irradiation:The significant effects of reactive species[J]. Chemosphere, 172: 193-200. DOI:10.1016/j.chemosphere.2017.01.015 |
Chen S L, Zheng T F, Ye C L, et al. 2018. Algicidal properties of extracts from Cinnamomumcamphora fresh leaves and their main compounds[J]. Ecotoxicology and Environmental Safety, 163: 594-603. |
Cui Y, Zhang J, Zhang G, et al. 2011. Synthesis of bulk and nanoporous carbon nitride polymers from ammoniumthiocyanate for photocatalytic hydrogen evolution[J]. Journal of Materials Chemistry, 21(34): 13032-13039. DOI:10.1039/c1jm11961c |
Dou H L, Chen L, Zheng S H, et al. 2018. Band structure engineering of graphitic carbon nitride via Cu2+/Cu+ doping for enhanced visible light photoactivity[J]. Materials Chemistry and Physics, 214: 482-488. DOI:10.1016/j.matchemphys.2018.04.071 |
Duan Y Z. 2018. Facile preparation of CuO/g-C3N4 with enhanced photocatalytic degradation of salicylic acid[J]. Materials Research Bulletin, 105: 68-74. DOI:10.1016/j.materresbull.2018.04.038 |
Evans S S. 1965. The distribution of peroxidase in extreme dwarf and normal tomato[J]. Phytochemistry, 4: 449-503. |
Fan G D, Zhou J J, Zheng X M, et al. 2020. Fast photocatalytic inactivation of Microcystis aeruginosa by metal-organic frameworks under visible light[J]. Chemosphere, 239: 124721. DOI:10.1016/j.chemosphere.2019.124721 |
Gao M H, Ng T W, An T C, et al. 2015. The role of catalase and H2O2 in photocatalytic inactivation of Escherichia coli:Genetic and biochemical approaches[J]. Catalysis Today, 266: 205-211. |
Giannoplities C N, Ries S K. 1977. Superoxid dismutase:Ⅱ.purification and quantitative relationship with water-soluble protein in seedlings[J]. Plant Physiology, 59(2): 315-318. |
Gu N, Gao J L, Wang K T, et al. 2015. ZnO-montmorillonite as photocatalyst and flocculant for inhibition of cyanobacterial bloom[J]. Water Air and Soil Pollution, 226(5): 136. DOI:10.1007/s11270-015-2407-5 |
Hu S Z, Qu X Y, Li P, et al. 2018. Photocatalytic oxygen reduction to hydrogen peroxide over copper doped graphitic carbon nitride hollow microsphere:The effect of Cu(I)-N active sites[J]. Chemical Engineering Journal, 334: 410-418. DOI:10.1016/j.cej.2017.10.016 |
黄微雅, 杨骏, 张渊明. 2012. 光催化去除有害藻类的研究进展[J]. 环境科学与技术, 35(5): 65-70. DOI:10.3969/j.issn.1003-6504.2012.05.015 |
Ji C, Yin S N, Sun S S, et al. 2018. An in situ mediator-free route to fabricate Cu2O/g-C3N4 type-Ⅱ heterojunctions for enhanced visible-light photocatalytic H2 generation[J]. Applied Surface Science, 434: 1224-1231. DOI:10.1016/j.apsusc.2017.11.233 |
Li L, Hu Y, Deng D Y, et al. 2016. Highly sensitive cataluminescence gas sensors for 2-butanone based on g-C3N4 sheets decorated with CuO nanoparticles[J]. Analytical and Bioanalytical Chemistry, 408(30): 8831-8841. DOI:10.1007/s00216-016-9906-0 |
Li Z, Kong C, Lu G X. 2016. Visible photocatalytic water splitting and photocatalytic two-electron oxygen formation over Cu- and Fe-doped g-C3N4[J]. Journal of Physical Chemistry C, 120(1): 56-63. |
Liang F F, Zhu Y F. 2016. Enhancement of mineralization ability for phenol via synergetic effect of photoelectrocatalysis of g-C3N4 film[J]. Applied Catalysis B:Environmental, 180: 324-329. |
梁文艳, 王珂, 阮铃铃, 等. 2010. 电氧化杀藻过程中藻细胞活性变化的研究[J]. 环境科学, 31(6): 1464-1469. |
Liu J, Li J, He S, et al. 2020. Heterogeneous catalytic ozonation of oxalic acid with an effective catalyst based on copper oxide modified g-C3N4[J]. Separation and Purification Technology, 234: 116120. |
刘湘庆, 姜美洁, 刘璐, 等. 2016. 浒苔藻体叶绿素提取方法的比较[J]. 海洋环境科学, 35(1): 144-148. |
Ma X Z, Zhang J T, Wang B, et al. 2018. Hierarchical Cu2O foam/g-C3N4 photocathode for photoelectrochemical hydrogen production[J]. Applied Surface Science, 427: 907-916. |
Meng Y L, Shen J, Chen D, et al. 2011. Photodegradation performance of methylene blue aqueous solution on Ag/g-C3N4 catalyst[J]. Rare Metals, 30: 276-279. DOI:10.1007/s12598-011-0284-7 |
Muniandy L, Adam F, Mohamed A R, et al. 2017. Cu2+ coordinated graphitic carbon nitride (Cu-g-C3N4) nanosheets from melamine for the liquid phase hydroxylation of benzene and VOCs[J]. Applied Surface Science, 398: 43-55. |
Oh W D, Chang V W C, Hu Z T, et al. 2017. Enhancing the catalytic activity of g-C3N4 through Me doping (Me=Cu, Co and Fe) for selective sulfathiazole degradation via redox-based advanced oxidation process[J]. Chemical Engineering Journal, 323: 260-269. |
Paerl H W, Otten T G. 2013. Harmful cyanobacterial blooms:Causes, consequences, and controls[J]. Microbial Ecology, 65(4): 995-1010. |
Pellegrini N, Serafini M, Colombi B, et al. 2003. Total antioxidant capacity of plant foods, beverages and oils consumed in Italy assessed by three different in vitro assays[J]. Journal of Nutrition, 133(9): 2812-2819. |
彭艳芬, 刘天宝. 2007. 蚕沙中叶黄素的提取研究[J]. 资源开发与市场, 23(11): 964-965. DOI:10.3969/j.issn.1005-8141.2007.11.002 |
Perez-Perez M E, Couso I, Crespo J L. 2012. Carotenoid deficiency triggers autophagy in the model green alga Chlamydomonas reinhardtii[J]. Autophagy, 8(3): 376-388. |
Plachy T, Masar M, Mrlik M, et al. 2019. Switching between negative and positive electrorheological effect of g-C3N4 by copper ions doping[J]. Advanced Powder Technology, 30(4): 714-723. DOI:10.1016/j.apt.2019.01.001 |
Shi G D, Yang L, Liu Z W, et al. 2018. Photocatalytic reduction of CO2 to CO over copper decorated g-C3N4 nanosheets with enhanced yield and selectivity[J]. Applied Surface Science, 427: 1165-1173. |
Shiu C T, Lee T M. 2005. Ultraviolet-B-induced oxidative stress and responses of the ascorbate-glutathione cycle in a marine macroalga Ulva fasciata[J]. Journal of Experimental Botany, 56(421): 2851-2865. DOI:10.1093/jxb/eri277 |
Shu Z, Wang Y, Wang W B, et al. 2019. A green one-pot approach for mesoporous g-C3N4 nanosheets with in situ sodium doping for enhanced photocatalytic hydrogen evolution[J]. International Journal of Hydrogen Energy, 44(2): 748-756. |
Song J K, Wang X J, Ma J X, et al. 2018. Visible-light-driven in situ inactivation of Microcystis aeruginosa with the use of floating g-C3N4 heterojunction photocatalyst:Performance, mechanisms and implications[J]. Applied Catalysis B Environmental, 226: 83-92. DOI:10.1016/j.apcatb.2017.12.034 |
Sun C Y, Chen C C, Ma W H, et al. 2012. Photocatalytic debromination of decabromodiphenyl ether by graphitic carbon nitride[J]. Science China-Chemistry, 55(12): 2532-2536. DOI:10.1007/s11426-012-4644-4 |
Sun S D, Liang S H. 2017. Recent advances in functional mesoporous graphitic carbon nitride (mpg-C3N4) polymers[J]. Nanoscale, 9(30): 10544-10578. |
Tahir B, Tahir M, Amin N A S. 2017. Photo-induced CO2 reduction by CH4/H2O to fuels over Cu-modifiedg-C3N4nanorodsunder simulated solar energy[J]. Applied Surface Science, 419: 875-885. DOI:10.1016/j.apsusc.2017.05.117 |
田海峰, 宋立民. 2012. g-C3N4光催化剂研究进展[J]. 天津工业大学学报, 31(6): 55-59. DOI:10.3969/j.issn.1671-024X.2012.06.014 |
Wang X, Song J K, Zhao J F, et al. 2019. In-situ active formation of carbides coated with NP-TiO2 nanoparticles for efficient adsorption-photocatalytic inactivation of harmful algae in eutrophic water[J]. Chemosphere, 228: 351-359. |
Wang X, Wang X J, Song J K, et al. 2019. A highly efficient TiOX(X=N and P) photocatalyst for inactivation of Microcystis aeruginosa under visible light irradiation[J]. Separation and Purification Technology, 222: 99-108. |
王鑫, 王学江, 张晶, 等. 2016. 漂浮型光催化剂制备及其除藻性能初探[J]. 同济大学学报:自然科学版, 44(9): 1424-1429. |
Wang X, Wang X J, Zhao J F, et al. 2017. Efficient visible light-driven in situ photocatalytic destruction of harmful alga by worm-like N, P co-doped TiO2/expanded graphite carbon layer (NPT-EGC) floating composites[J]. Catalysis Science & Technology, 7(11): 2335-2346. |
杨远帆, 倪辉, 肖志强, 等. 2005. 胡萝卜中水溶性类胡萝卜素稳定性的研究[J]. 集美大学学报:自然科学版, 10(1): 33-36. |
Yue B, Li Q Y, Iwai H, et al. 2011. Hydrogen production using zinc-doped carbon nitride catalyst irradiated with visible light[J]. Science and Technology of Advanced Materials, 12(3): 034401. DOI:10.1088/1468-6996/12/3/034401 |
张金水, 王博, 王心晨. 2014. 氮化碳聚合物半导体光催化[J]. 化学进展, 26(1): 19-29. |
Zhang M, Bai X J, Liu D, et al. 2015. Enhanced catalytic activity of potassium-doped graphitic carbon nitride induced by lower valence position[J]. Applied Catalysis B:Environmental, 164: 77-81. DOI:10.1016/j.apcatb.2014.09.020 |
Zhang Y, Li K D, Liao J, et al. 2020. Microwave-assisted synthesis of graphitic carbon nitride/CuO nanocomposites and the enhancement of catalytic activities in the thermal decomposition of ammonium perchlorate[J]. Applied Surface Science, 499: 143875. DOI:10.1016/j.apsusc.2019.143875 |
Zhao Y K, Tang R R, Huang R. 2015. Palladium supported on graphitic carbon nitride:An efficient and recyclable heterogeneous catalyst for reduction of nitroarenes and suzuki coupling reaction[J]. Catalysis Letters, 145(11): 1961-1971. DOI:10.1007/s10562-015-1600-x |
Zhao Z H, Ma Y, Fan J M, et al. 2018. Synthesis of graphitic carbon nitride from different precursors by fractional thermal polymerization method and their visible light induced photocatalytic activities[J]. Journal of Alloys and Compounds, 735: 1297-1305. |
 2020, Vol. 40
2020, Vol. 40


