2. 浙江省固体废物处理与资源化重点实验室, 杭州 310012
2. Zhejiang Provincial Key Laboratory of Solid Waste Treatment and Recycling, Hangzhou 310012
生物强化(Bioaugmentation)是指通过添加外源菌株、种群或基因, 从而提高原有污染系统中污染物去除率的一种环境修复技术(Singer et al., 2005).由于生物强化技术具有低成本、便于维护等优点, 故而研究如何提高菌株定植成功率成为国内外学者的研究热点.群体感应是指微生物之间通过一种或几种特定的“语言”进行交流的一种现象, 常见的信号分子有AHLs、AI、PQS和DSF等四类(Yong et al., 2013).群体感应可以通过信号分子与其他微生物进行交流从而影响菌株定植及污染物的去除(Yang et al., 2011), 但信号分子易在猪肾酰化酶(Acylase I from porcine kidney)的作用下失活, 从而阻断微生物之间的信息交流(即发生群体感应淬灭)(Yeon et al., 2008), 因此通过群体感应和群体感应淬灭可以对微生物的行为进行有效调控.Toyofuku等(2007)、Schuster等(2003)发现, 一定条件下, 群体感应对硝酸盐的去除具有抑制作用.为了提高反硝化效率, 本研究从群体感应角度出发, 选取革兰氏阴性菌(铜绿假单胞菌)作为研究菌株, 研究了群体感应在生物强化中的作用, 并在菌株定植成功后, 选取群体感应淬灭酶——猪肾酰化酶(Acylase I from porcine kidney)进一步研究群体感应被淬灭后对硝酸盐去除的影响.
2 材料与方法(Materials and methods) 2.1 菌株与污泥Pseudomonas aeruginosa为实验室保藏的标准菌株.实验所用活性污泥取自杭州市七格污水处理厂.
| 表 1 实验菌株与活性污泥 Table 1 Strain and activated sludge in the experiment |
实验采用序批式活性污泥反应器(Sequencing batch reactor, SBR), 直径为4 cm, 有效容积为250 mL.实验过程中水温控制在(30±1)℃, 曝气量为2 L · min-1.人工配置水的进水COD为4000 mg · L-1, 硝酸盐浓度为1000 mg · L-1(以N计), 磷酸氢二钠和磷酸二氢钾的浓度均为12.5 mmol · L-1, 氨基酸(酪蛋白水解产物)粉末为0.5%.反应器的排水比为30%, 污泥浓度控制在3.0 g · L-1左右, 污泥龄为6.8 d.反应器运行程序为进水5 min、曝气20 h、沉淀30 min、排水5 min和闲置排泥20 min.反应器共分4组, 每组3个平行, 分为生物强化和群体感应淬灭两个阶段进行, 共计运行21 d.
| 表 2 试验设计 Table 2 Design of the experiment |
各反应器作如下处理:①非生物强化(non-BA)组:不加菌株P. aeruginosa和群体感应淬灭剂;②生物强化(BA)组:3%(菌液体积/人工配水体积)P. aeruginosa(OD600=2.00)共连续接种6次(第1~6 d), 第7~21 d不再添加菌株;③群体感应淬灭(QQ)组:每次接种3%(菌液体积/人工配水体积)P. aeruginosa(OD600=2.00)并添加群体感应淬灭剂(0.002 g), 共连续处理6次(第1~6 d), 第7~21 d不再添加菌株和猪肾酰化酶;④生物强化+群体感应淬灭(BA+QQ)组:生物强化成功后, 连续4 d(第7~10 d)添加群体感应淬灭剂(0.002 g), 第11~21 d不再添加菌株和猪肾酰化酶.
2.3 分析项目及测定方法 2.3.1 AHLs类信号分子的萃取和测定① 信号分子的提取. ①取4 mL菌液至15 mL玻璃离心管中, 加入4 mL含1‰醋酸的乙酸乙酯, 涡旋30 s(用力摇晃10次).②室温静置10 min使两相分离, 若分层不明显则以10000 r · min-1离心10 min使两相分离.③用移液枪吸取有机层至干净的西林瓶中.④上述步骤2次, 共吸取12 mL有机层.⑤氮吹样品至全干, 加入含1‰醋酸的乙酸乙酯1 mL, -20 ℃保存.
② 信号分子3oxo-C12-HSL和C4-HSL的测定.信号分子的测定方法参见Wang等(2017)的方法.
2.3.2 反应器菌株定植情况分析取反应器运行结束时的污泥样品2 mL, 在4 ℃下离心(13000×g)5 min.利用Trizol试剂提取总RNA.将提取的RNA样品用DNaseI试剂盒进行纯化, 获得无DNA的RNA样品.接着用Thermo试剂盒合成cDNA并进行PCR扩增, 鉴定菌株是否在活性污泥中定植.引物序列为:napA正向引物5′-AGCCGATCAGTTGGGAAC AG-3′, 反向引物5′-CATGGTCCAGAACGACAC CA-3′.
2.3.3 分析测定方法硝酸盐采用紫外分光光度法测定, 亚硝酸盐的测定采用N-(1-萘基)-乙二胺光度法, COD测定采用重铬酸钾法.
2.4 数据处理图表绘制采用Origin8.5软件(美国).数据统计分析采用SPSS软件(美国), p值小于0.05则认为有显著性差异.
3 结果与讨论(Results and discussion) 3.1 群体感应对菌株生物强化过程的影响 3.1.1 反应器中菌株定植情况周质硝酸盐还原酶NAP是P. aeruginosa进行反硝化活动的关键酶, 该酶由napA基因进行编码.Wang等(2013)研究表明, 如果在停止添加外源菌株很长一段时间内依然可以检测到外源菌株的基因片段, 则说明外源菌株定植成功.
如图 1所示, 通过提取生物强化阶段3组反应器运行结束时的污泥样品的RNA进行反转录PCR发现, 生物强化试验结束后, BA反应器中检测到约700 bp的napA基因片段, non-BA反应器和QQ反应器均未检出.该结果表明, P. aeruginosa在BA反应器中定植成功.由于non-BA反应器未添加外源菌株, 故而未检测到硝酸盐还原酶的特异性片段.由于QQ反应器在引入目标菌株的同时加入了群体感应淬灭酶-猪肾酰化酶(Acylase I from porcine kidney)(Xu et al., 2003), 导致用于菌株间交流的信号分子失活, 故而QQ反应器中生物强化失败.上述结果表明, 群体感应在生物强化过程中起到关键作用.
 |
| 图 1 napA基因的反转录PCR扩增 Fig. 1 Partial amplification of the napA gene by reverse transcription PCR |
① 硝酸盐的去除如图 2a所示, 连续接菌5次后, BA反应器中的硝酸盐去除率为70%~80%, 已显著高于non-BA反应器和QQ反应器(50%左右).这表明P. aeruginosa在反应器中定植成功, 并提高了硝酸盐的去除率;若P. aeruginosa定植失败, 如QQ反应器, 其中硝酸盐去除率与非生物强化组无显著性差异.因此, 从硝酸盐的去除可以看出, 群体感应有利于菌株P. aeruginosa定植.
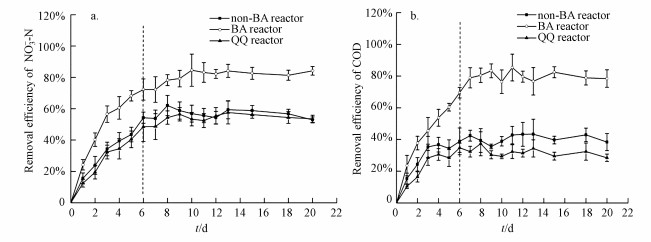 |
| 图 2 生物强化对硝酸盐(a)及COD去除的影响(b) (反应器运行分为菌株P. aeruginosa投加和非投加阶段, 虚线之前为菌株投加阶段, 虚线之后为菌株非投加阶段, 下同) Fig. 2 Effect of bioaugmentation on the removal of NO3--N(a) and COD in reactors(b) (Operation is divided into two periods: addition of strain P. aeruginosa (front of dashed vertical line) and no addition of strain P. aeruginosa (back side of dashed vertical line)) |
② COD的去除由图 2b可知, COD去除与硝酸盐去除相似.连续接种目标菌株后, BA反应器中COD的去除率高达75%.由于P. aeruginosa具有完整的反硝化酶系, 因而P. aeruginosa菌株的定植有利于反硝化过程中有害中间产物(如亚硝酸盐、一氧化氮)的快速转化, 可以降低毒性中间产物对土著菌造成的危害, 从而提高反应器中污染物的去除效率.non-BA反应器中COD的去除率稳定维持在35%~40%之间, QQ反应器中的COD去除率仅为25%~30%.这是因为反应器中AHLs信号分子(包括目标菌株和土著菌拥有的AHLs类信号分子)在猪肾酰化酶的作用下失活(Ren et al., 2013), 菌株之间的信息交流被中断.土著菌的AHLs信号分子失活后, 菌株之间无法进行信息交流, 故而污染物降解受到了阻碍(Jiang et al., 2012).综上分析, 群体感应不仅对P. aeruginosa定植具有促进作用, 还对土著菌的污染物去除具有重要的影响.
③ 反应器中AHLs分泌情况由上文可知, 群体感应对菌株生物强化有重要作用.由于只有AHLs浓度达到一定阈值时群体感应系统方可启动, 因而对生物强化阶段的3组反应器中的信号分子的分泌情况进行了分析测定.如图 3所示, BA反应器中3-oxo-C12-HSL和C4-HSL均呈先升高后降低的趋势, 而这两种信号分子在non-BA反应器和QQ反应器中一直处于低浓度且运行期间无显著变化的状态.这可能是因为BA反应器在运行前期接种了大量的P. aeruginosa, 反应器中原有的生态平衡被打破、AHLs大量分泌;当停止添加外源菌株P. aeruginosa且定植菌株适应新环境后, 反应器中的土著菌与外源菌株建立新的生态平衡, 信号分子的分泌趋于新的平衡(郑昕, 2014).non-BA反应器未添加外源菌株, 因而原有的生态平衡未发生改变, 故AHLs信号分子无明显变化.猪肾酰化酶(Acylase I from porcine kidney)的添加导致QQ反应器中AHLs信号分子失活, 信号分子无法进行累积, 故而信号分子浓度变化不明显.
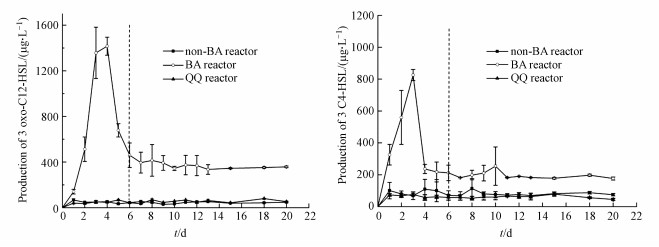 |
| 图 3 生物强化阶段反应器中AHLs浓度 Fig. 3 Concentration of AHLs in the reactors after bioaugmentation |
已有研究表明(Marketon et al., 2003; Hooshangi et al., 2008; Reid et al., 2008; Vu et al., 2009), 群体感应系统可以通过调控EPS分泌、生物膜形成等生物行为来促进外源菌株的定植.群体感应淬灭剂的添加可以大大降低EPS(尤其是胞外蛋白)的产生(Jiang et al., 2012), 最终导致菌株定植失败.除此以外, 反应体系中存在的大量土著菌特有的信号分子会对外源菌株的定植产生抵抗作用(Kim et al., 2013).
3.2 群体感应淬灭对生物强化反应器中菌株反硝化的影响 3.2.1 反应器中菌株存活状况Toyokufu等(2007)发现, 菌株的反硝化作用会受到群体感应系统的抑制.本研究向定植成功的反应体系中加入群体感应淬灭酶, 进一步研究群体感应淬灭对污染物降解的影响.3.1节的试验结果表明, 群体感应淬灭酶和外源菌株同时添加至同一反应器后, 菌株无法在反应器中定植成功.为了了解群体感应淬灭酶对定植成功后的P. aeruginosa菌株存活的影响, 试验提取了BA+QQ反应器运行结束时污泥中总RNA, 检测其是否含有特异性基因napA, 若能检测到特异性基因, 则菌株在该环境中存在, 若检测不到, 说明P. aeruginosa菌株不存在(Wang et al., 2013).
如图 4所示, BA+QQ反应器第21 d的污泥样品中依旧可以检测到napA特异性片段.这一结果表明, 猪肾酰化酶(Acylase I from porcine kidney)无法对定植成功后的菌株构成生存威胁, 因此反应器中可以检测到反硝化的特异性基因片段.
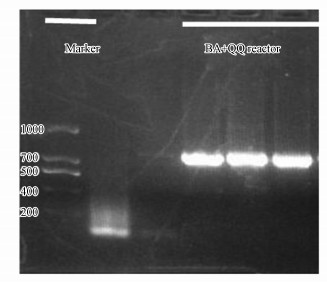 |
| 图 4 napA基因的反转录PCR扩增 Fig. 4 Partial amplification of the napA gene by reverse transcription PCR |
① 硝酸盐的去除为进一步研究群体感应对硝酸盐去除的影响, 试验从群体感应淬灭角度, 研究了各反应器中硝酸盐的去除情况.如图 5所示, 添加群体感应淬灭酶——猪肾酰化酶后, 反应器中硝酸盐的去除率显著上升, 连续3次添加猪肾酰化酶后, 反应器的处理效率大大提高, 硝酸盐的去除率高于95%, 但未添加猪肾酰化酶的反应器, 硝酸盐的去除率稳定在80%左右.因此, 从硝酸盐去除的角度可以证明, 群体感应淬灭对提升菌株P. aeruginosa反硝化作用具有促进作用.
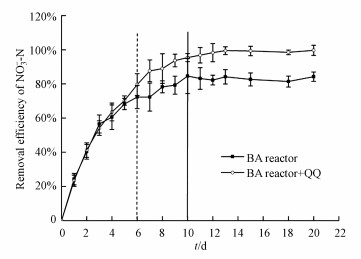 |
| 图 5 不同反应器中硝酸盐的去除(黑色虚线之前为菌株投加阶段, 黑色虚线之后为菌株非投加阶段, 第6~10 d投加猪肾酰化酶) Fig. 5 Performance of reactors in NO3--N removal (Acylase I from porcine kidney was added to reactor from day 7 to day10) |
② 反应器中AHLs的分泌情况群体感应淬灭是指通过添加群体感应淬灭剂、信号分子类似物等方式阻断微生物间有效信息交流的过程.为了确认反应器中群体感应被抑制, 在添加群体感应淬灭剂后, 分析了各反应器中信号分子的分泌状况.图 6表明, P. aeruginosa在反应器中定植成功后, 外来菌株和土著菌之间建立了新的生态平衡, 故而BA反应器中信号分子3-oxo-C12-HSL和C4-HSL浓度趋于一个新的平衡.由于猪肾酰化酶可以分解AHLs类信号分子(Xu et al., 2003), 因而在建立新的生态平衡的反应器中加入群体感应淬灭酶后, AHLs类信号分子失活, 3oxo-C12-HSL和C4-HSL浓度显著降低(图 6).结合3.2.2节中①的结论(群体感应淬灭对提升菌株P. aeruginosa反硝化作用具有促进作用)可以得出, 猪肾酰化酶可能是通过降解信号分子、抑制群体感应, 从而提高硝酸盐的去除效果.
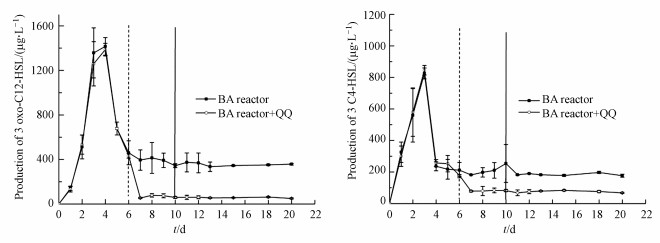 |
| 图 6 群体感应淬灭阶段反应器中AHLs浓度 Fig. 6 Concentration of AHLs in the reactors after quorum quenching |
1) 向反应器中连续接种菌株P. aeruginosa后, 菌株分泌大量的信号分子, 并逐渐适应新环境, 与土著菌建立了新的生态平衡体系, 菌株定植成功.接种菌株P. aeruginosa, 同时外源添加猪肾酰化酶会导致信号分子失活, 不利于菌株的定植.
2) 生物强化失败的QQ反应器中硝酸盐和COD的去除能力弱于原有污泥体系, 这主要是因为猪肾酰化酶不仅会使P. aeruginosa AHLs信号分子失活, 还会使土著菌的AHLs失去活性.由此可见, 群体感应对生物强化过程具有重要作用.
3) 菌株定植成功后, 添加群体感应淬灭剂——猪肾酰化酶可以使信号分子3-oxo-C12-HSL和C4-HSL失活, 阻断微生物间的信息交流, 抑制群体感应, 从而提升菌株的反硝化效率.
Hooshangi S, Bentley William E. 2008. From unicellular properties to multicellular behavior:bacteria quorum sensing circuitry and applications[J]. Current Opinion in Biotechnology, 19(6): 550-555. DOI:10.1016/j.copbio.2008.10.007 |
Jiang B, Liu Y. 2012. Roles of ATP-dependent N-acylhomoserine lactones (AHLs) and extracellular polymeric substances (EPSs) in aerobic granulation[J]. Chemosphere, 88(9): 1058-1064. DOI:10.1016/j.chemosphere.2012.04.059 |
Kim S R, Oh H S, Jo S J, et al. 2013. Biofouling control with bead-entrapped quorum quenching bacteria in membrane bioreactors:physical and biological effects[J]. Environmental Science&Sechnology, 47(2): 836-842. |
Marketon Melanie M, Glenn Sarah A, Eberhard A, et al. 2003. Quorum sensing controls exopolysaccharide production in Sinorhizobium meliloti[J]. Journal of Bacteriology, 185(1): 325-331. DOI:10.1128/JB.185.1.325-331.2003 |
Reid E, Liu X, Judd S J. 2008. Sludge characteristics and membrane fouling in full-scale submerged membrane bioreactors[J]. Desalination, 219(1/3): 240-249. |
Ren J L, Zhang E, Ye X W, et al. 2013. Design, synthesis and antibacterial evaluation of novel AHL analogues[J]. Bioorganic&Medicinal Chemistry Letters, 23(14): 4154-4156. |
Schuster M, Lostroh C P, Ogi T, et al. 2003. Identification, timing, and signal specificity of Pseudomonas aeruginosa quorum-controlled genes:a transcriptome analysis[J]. Journal of Bacteriology, 185(7): 2066-2079. DOI:10.1128/JB.185.7.2066-2079.2003 |
Singer Andrew C, van der Gast Christopher J, et al. 2005. Perspectives and vision for strain selection in bioaugmentation[J]. Trends in biotechnology, 23(2): 74-77. DOI:10.1016/j.tibtech.2004.12.012 |
Toyofuku M, Nomura N, Fujii T, et al. 2007. Quorum sensing regulates denitrification in Pseudomonas aeruginosa PAO1[J]. Journal of Bacteriology, 189(13): 4969-4972. DOI:10.1128/JB.00289-07 |
Vu B, Chen M, Crawford R J, et al. 2009. Bacterial Extracellular polysaccharides involved in biofilm formation[J]. Molecules, 14(7): 2535-2554. DOI:10.3390/molecules14072535 |
Wang J H, He H Z, Wang M Z, et al. 2013. Bioaugmentation of activated sludge with Acinetobacter sp. TW enhances nicotine degradation in a synthetic tobacco wastewater treatment system[J]. Bioresource Technology, 142(Complete): 445-453. |
Wang M Z, Lai B M, Dandekar A A, et al. 2017. Nitrogen-source stabilization of quorum sensing in the Pseudomonas aeruginosa bioaugmentation strain SD-1[J]. Applied and Environmental Microbiology, 83(16): 00870-17. |
Xu F, Byun T, Deussen H J, et al. 2003. Degradation of N-acylhomoserine lactones, the bacterial quorum-sensing molecules, by acylase[J]. Journal of Biotechnology, 101(1): 89-96. |
Yang L, Liu Y, Wu H, et al. 2011. Current understanding of multi|[hyphen]|species biofilms[J]. International Journal of Oral Science, 3(2): 74-81. DOI:10.4248/IJOS11027 |
Yeon K M, Cheong W S, OH H S, et al. 2008. Quorum sensing:A new biofouling control paradigm in a membrane bioreactor for advanced wastewater treatment[J]. Environmental Science&Technology, 43(2): 380-385. |
Yong Y C, Zhong J J. 2013. Regulation of aromatics biodegradation by rhl quorum sensing system through induction of catechol meta-cleavage pathway[J]. Bioresource Technology, 136(Complete): 761-765. |
郑昕.2014.群体感应理论在Pseudomonas sp.HF-1定植中的作用及其应用潜能分析[D].杭州: 浙江工商大学 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2531270
|
 2020, Vol. 40
2020, Vol. 40


