2. 农业农村部农业环境重点实验室, 北京 100081;
3. 北京林业大学水土保持学院, 北京 100081
2. Key Laboratory of Agro-Environment, Ministry of Agriculture and Rural Affairs, Beijing 100081;
3. School of Soil and Water Conservation, Beijing Forestry University, Beijing 100081
农田重金属污染时刻威胁着我国农产品质量与安全, 是当前我国面临的重要农业环境问题.2014年, 原国土资源部和环保部联合公布的《全国土壤污染状况调查公报》显示:中国耕地土壤环境质量不容乐观, 点位超标率达19.4%, 其中, 镉(Cd)、砷(As)超标率分别为7.0%和2.7%(Cai et al., 2014; Zhao et al., 2015).水稻是我国最重要的口粮作物, 有研究表明水稻对Cd、As的吸收能力较强, 而食用Cd、As超标稻米是人体摄入Cd、As的主要来源(Brus et al., 2009; 刘文菊等, 2011), 进而可能导致癌症、骨质疏松等疾病, 严重危害人类身体健康和生命安全(Alfvén et al., 2000).因此, 有必要深入研究稻田土壤Cd、As生物有效性的变化规律及其背后的微观机制, 从而进行有效的人为调控, 实现粮食安全生产.
鉴于水稻种植前期多处于淹水环境, 而后期则需要排水烤田.故而其特有的淹水-落干过程导致土壤氧化还原电位(Eh)经历还原-氧化过程, 进而诱发土壤pH变化、铁、硫等变价元素价态变化及厌氧-好氧微生物群落变化等一系列生化反应过程(Yang et al., 2015; Sun et al., 2015).土壤中Cd、As的活性及其移动性与土壤Eh和pH密切相关(Marin et al., 1993; Guo et al., 1997).研究表明, 在稻田水分落干条件下, 土壤Eh升高, As主要以铁锰氧化物吸附态形式存在因而活性较低, 而在淹水条件下, Eh降低会诱导铁锰氧化物还原性溶解, 从而大大增加了As的移动性(Takahashi et al., 2004).与As相反, 大量研究表明, Cd在还原条件下易形成硫化镉沉淀从而抑制水稻对Cd的吸收(Uraguchi et al., 2012; Fulda et al., 2013; Hashimoto et al., 2013), 并且稻田土壤硫化镉也被同步辐射X射线吸收光谱技术直接表征证实(Khaokaew et al., 2011; Fulda et al., 2013);而落干后Eh上升将导致S2-被氧化进而提高Cd的移动性(Bingham et al., 1976).对于Cd、As复合污染土壤而言, 同样有研究表明在长期淹水条件下, 随着Eh的升高, As的移动性降低, 但同时Cd的移动性升高(Rinklebe et al., 2016);新近研究还发现, 通过调控水稻的淹水和落干时间, 可同时降低水稻对Cd、As的吸收(Honma et al., 2016).但目前关于对Cd、As复合污染稻田的重金属释放规律及微观机制鲜有报道.
土壤微反应器可对淹水土壤Eh进行高精度控制, 为揭示土壤Eh变化耦合的重金属释放及形态转化规律提供了独特的研究平台.当前土壤微反应器已成功地运用在研究河流沉积土壤和稻田土壤的重金属动态释放实验.Shaheen等(2016)利用土壤微反应器研究了德国乌帕河漫滩在不同氧化还原条件下重金属砷、钴、铜等重金属的释放过程.Shaheen等(2014)和Rinklebe等(2016)分别利用土壤微反应器研究了尼罗河、美国和亚洲水稻土在预设氧化还原电位条件下重金属的动态释放过程.Lemonte等(2017)利用土壤微反应器模拟了海平面上升对重金属砷活性的影响.因此, 本研究拟利用高精度土壤微反应器模拟稻田土壤淹水-落干过程, 探究Cd、As复合污染水稻土Eh变化耦合的Cd、As释放机制, 以期为污染稻田安全利用提供一定的理论依据.
2 材料与方法(Materials and methods) 2.1 土壤样品采集及基本理化性质分析供试Cd、As复合污染水稻土采自湖南省石门雄黄矿(111.38°N, 29.58°E)周边稻田表层土壤(0~20 cm), 采用多点取样法, 样品风干后分别过10目筛和100目筛后备用.参照《土壤农化性质分析》(鲍士旦, 2016)对土壤基本理化性质进行分析测定(表 1), 其中, 土壤pH值按照土水比1:2.5进行测定, 土壤总碳、总氮利用元素分析仪(KDY-9820, KETUO)测定, 土壤CEC采用醋酸铵法测定, 土壤总镉采用高氯酸-硝酸-氢氟酸消解后用ICP-OES(Optima 5300DV, PerkinElmer)测定, 土壤总砷采用USEPA 3050B方法消煮后用原子荧光光谱仪(AFS-2202, 北京吉天仪器公司)测定.
| 表 1 供试污染水稻土壤的基本理化性质 Table 1 Basic physicochemical properties of the polluted paddy soil |
本实验利用土壤微反应器模拟稻田淹水-落干下的Eh梯度变化过程.该反应器购置于德国Umwelt- und Ingenieurtechnik GmbH Dresden公司(图 1), 具有以下优点:①Eh值可以精确重复设置和快速改变, 即通过自动引入N2/O2调节装置内的Eh至设置值;②气密性强, 可长期保持厌氧条件;③实时记录反应器内土壤溶液Eh和pH变化(Yu et al., 2017).鉴于水稻土淹水过程中Eh最低可达-200 mV以下(Honma et al., 2017), 因此, 该模拟实验的Eh范围设置为-250~170 mV, 分别模拟淹水和落干期间的还原和氧化环境条件.实验中, 首先向150 g风干土壤加入1.2 L去离子水, 连续搅拌至均匀状态;设定仪器每隔15 min监测一次Eh、pH值和温度;分别在仪器运行初和24 h时, 将5 g葡萄糖添加到土壤微反应器容器中, 为微生物提供额外的有机物来源进而快速降低土壤Eh (宋建潇等, 2013;Ghorbanzadeh et al., 2017), 同时向容器中通入N2, 直至Eh达到-250 mV左右;稳定24 h后, 进行取样;然后通过向容器中通入O2达到设定的Eh值(-50 mV和170 mV), 分别稳定24 h后取样.实验设置两个重复, 每次取样50 mL, 保持土水比一致;实验过程中反应器容器用铝箔包裹, 防止藻类生长和光氧化.
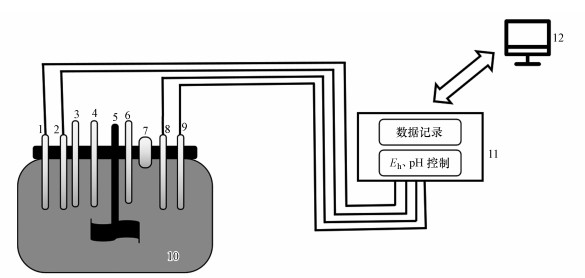 |
| 图 1 土壤微反应器图 (1.N2进气口, 2.O2进气口, 3.Eh电极, 4.pH电极, 5.搅拌器, 6.温度电极, 7.排气口, 8.HCl进口, 9.NaOH进口, 10.玻璃容器, 11.中央控制器, 12.显示器) Fig. 1 The picture of microcosmos |
当达到设定Eh值并保持系统稳定24 h后, 在氮气环境下取出泥浆样品, 并迅速转移至厌氧手套箱中.将样品过滤(0.45 μm)后, 部分滤液滴加0.1 mL浓HNO3保存于-4 ℃冰箱, 用于ICP-OES(安捷伦5110)测定Cd、As及相关元素(Fe、Ca、Al、P、S)含量;另一部分滤液及时用TOC分析仪(Elementar Vario)测定DOC含量.过滤后的土壤样品在厌氧手套箱中晾干后, 用Kapton胶带封好, 供后续采集μ-XRF光谱.
2.4 μ-XRF光谱采集与数据分析供试土壤样品μ-XRF光谱在加拿大光源VESPERS线站采集.实验过程中采用全光通量模式, 用Kirkpatrick-Baez反射镜将光束聚焦到5 μm×5 μm的测量光斑尺寸;根据样品的表观形貌确定扫描面积, 扫描停留时间为1 s;测试所得μ-XRF信号数据用SMRK软件进行处理, 以获取As及相关元素(Fe、Mn、S、K和Ca)的微区分布荧光谱图, 目标元素As与各元素之间的相关性及散点分布图用Origin8.0软件分析绘制.
3 结果与讨论(Results and discussion) 3.1 Eh变化耦合的pH和DOC变化特征通过预设供试反应体系, 将Eh由-250 mV进行梯度变化至170 mV, 对水稻土淹水-落干过程中Eh变化进行模拟, 结果发现, 供试土壤溶液pH和DOC均随着Eh的梯度增加而降低(图 2).一般而言, 土壤溶液pH变化与NO3-、Mn(Ⅲ)、Mn(Ⅳ)和Fe(Ⅲ)等无机高价离子的还原过程及微生物代谢作用密切相关.Yu等(2011)研究发现, 酸性土壤pH随Eh的下降而增加, 这主要是由于低Eh条件下NO3-、Mn(Ⅳ)和Fe(Ⅲ)还原消耗质子所致.此外, 有研究表明在低Eh条件下, 微生物介导的有机物分解生成CO2和有机酸亦可降低土壤pH值(易维洁等, 2010; Wang et al., 2013).因此, 本实验土壤pH逐渐降低很可能与上述非生物和生物过程密切相关.另外, 土壤溶液中DOC的变化与土壤铁氧化物还原、有机碳的微生物分解等过程相关.在氧化条件下, 土壤铁氧化物是DOC的重要固定载体, 而在低Eh条件下因其还原溶解而释放DOC(Shaheen et al., 2014).
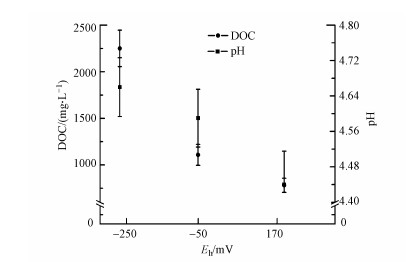 |
| 图 2 土壤溶液中Eh变化对DOC、pH的影响 Fig. 2 The impact of Eh changes on DOC、pH values of the surface water |
随着Eh从最低点(-250 mV)逐步升高至氧化环境的最高点(170 mV), 土壤溶液中Cd、As及相关元素Fe、Al、S和P浓度均逐渐升高(图 3).这表明Eh升高到一定条件下可同时促进供试污染水稻土中Cd、As的共释放.在所有测定元素中, Cd、S、Al呈相似变化特征, 即随着Eh的升高呈先快后慢的增长趋势.Rinklebe等(2016)研究发现, 在还原条件下土壤溶液中的Cd浓度较低, 且随着Eh的升高而增加, 这主要是由于低Eh条件下S2-与溶液中的Cd形成CdS沉淀, 而随着Eh的升高, S2-会被氧化成SO42-, 进而导致CdS沉淀溶解, Cd重新释放到溶液中.可见, 本实验结果和前人研究结果相似, 均发现还原条件下Cd浓度较低, 但随着Eh的升高, Cd浓度也逐渐升高, 同时伴随着S浓度的升高.该实验结果说明还原条件下Cd很可能以金属硫化物沉淀的形式赋存于供试水稻土中.此外, 实验中还伴随着Al浓度的升高, 这可能与Eh升高过程中pH的降低(Frohne et al., 2014a), 以及淹水导致Fe2+等阳离子浓度升高而后与Al3+、Cd2+竞争土壤表面吸附位点有关(徐仁扣, 2014; Frohne et al., 2014b).
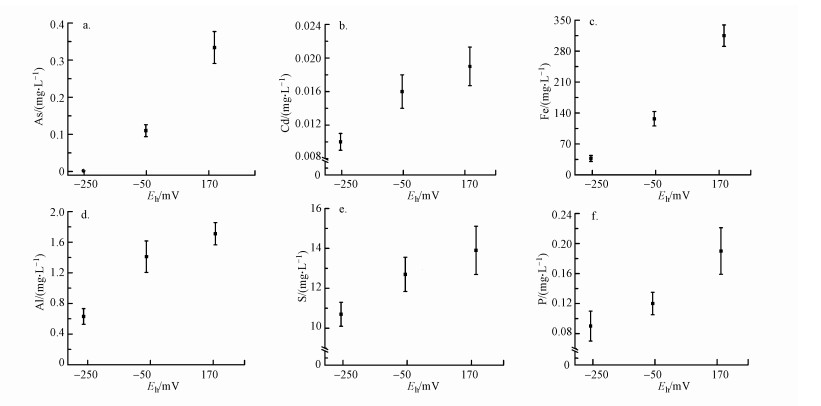 |
| 图 3 土壤溶液中Eh变化对砷(a)、镉(b)、铁(c)、铝(d)、硫(e)、磷(f)释放的影响 Fig. 3 The impact of Eh changes on the release of As(a), Cd(b), Fe(c), Al(d), S(e), P(f) in the surface water |
相对于土壤溶液Cd浓度的增长趋势而言, 尽管土壤溶液中As浓度也呈总体逐渐增加的趋势, 但上升幅度先慢后快, 且与土壤溶液中Fe、P浓度的变化特征相似.通常而言, 低Eh条件易导致As(Ⅴ)被还原成As(Ⅲ), 从而增加As的流动性及毒性, 同时, 也可导致铁锰氧化物还原性溶解从而释放其表面吸附态As, 这进一步增加了As的移动性(Du et al., 2009).然而, 在本实验中低Eh条件下土壤溶液中As的浓度最低, 而后随着Eh的升高呈现出先慢后快的增长趋势, 这与前人的实验结果不符.这可能是由于微生物介导的铁氧化物还原溶解需要一定的时间, 这与Rinklebe(2016)的实验结果一致.同时, 在本实验中尽管加入葡萄糖而促进了Eh的快速降低, 但铁氧化物却没有及时响应溶解也会导致砷在低Eh条件下浓度较低.由于磷酸根与砷酸根具有相似的pKa、几何形状和热化学半径(Mikael et al., 2012), 进而能够竞争土壤表面的吸附位点, 而当吸附点位由于还原反应减少时, 会导致磷酸根与砷酸根同时释放.这很可能是土壤溶液中P浓度上升趋势与As相似的主要原因.另外, 在土壤溶液中, DOC会与As、P竞争土壤表面的吸附位点(Frohne et al., 2011), 因此随着Eh的升高, DOC含量降低有利于As、P的固定, 但As、P浓度反而升高.这说明铁氧化物还原释放很可能是主导因素(Shaheen et al., 2016).
3.3 不同Eh条件下As及相关元素微区分布特征为进一步阐明土壤As在Eh变化耦合过程中的释放机理, 本研究利用同步辐射μ-XRF技术对不同Eh条件下的土壤样品进行了表征, 试图揭示As、Fe、Mn、S、Ca和K在土壤中的微区分布特征及其相互之间的相关性变化, 结果如图 4、图 5所示.由图可见, 供试土壤样品中As与相关元素在微米尺度上均呈非均相分布.在低Eh值(-250 mV)条件下, 土壤颗粒上As与Fe、Mn及S的高含量点信号重合(图 4), 其可决系数(R2)分别高达0.943、0.644、0.852(图 5), 远高于其他Eh条件下As-Fe、As-Mn和As-S之间的可决系数;而As与K、Ca的分布显著不同, 可决系数也较小, 表明As的形态分布主要受富含铁、锰、硫元素的矿物控制.随着Eh升高到-50 mV和170 mV, As-Fe、As-Mn和As-S之间的可决系数较之-250 mV条件下明显降低, 而As-K和As-Ca之间的可决系数变化差异则相对较小.综上说明, Eh变化显著影响了As与Fe、S及Mn之间的交互作用.
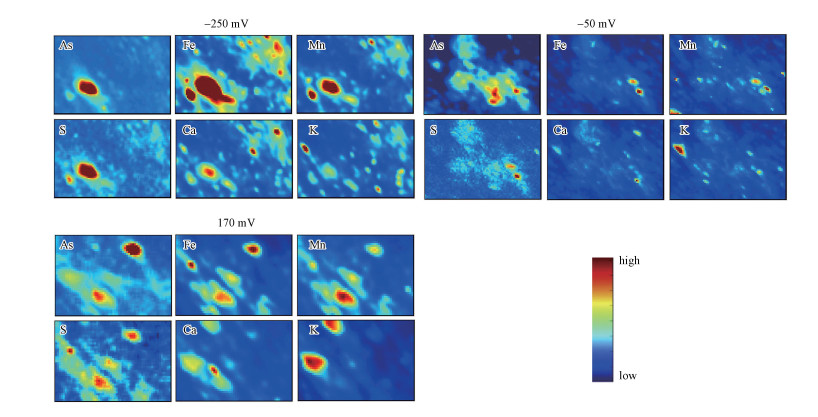 |
| 图 4 不同氧化还原条件下(-250、-50和170 mV)土壤中砷、铁、钙、锰、硫、钾的微区X射线荧光光谱图 (色阶越高表示该元素浓度越高) Fig. 4 The distribution of arsenic, cadmium, iron, calcium, manganese, sulfur and potassium under different redox conditions (-250、-50和170 mV) by μ-XRF |
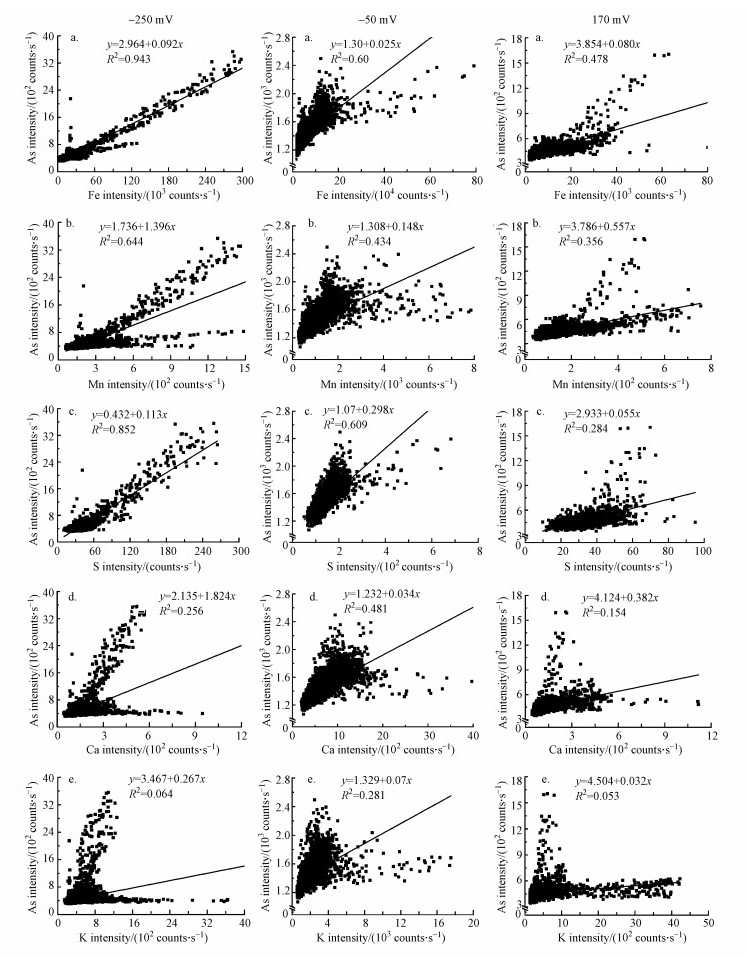 |
| 图 5 不同氧化还原条件下(-250、-50和170 mV)砷与铁(a)、锰(b)、硫(c)、钙(d)、钾(e)之间的关系 Fig. 5 The relationship between the intensities of As with Fe(a), Mn(b), S(c), Ca (d), K(e) under different redox conditions(-250, -50 and 170 mV) |
结合X射线荧光光谱的元素分布特征, 可推测本实验低Eh条件下(-250 mV)很可能生成了FeS沉淀, 进而通过吸附和共沉淀作用固定As.有研究表明, 在中性的厌氧环境条件下, FeS-As共沉淀体系对较宽浓度范围内的As都具有显著的固持作用(Ilgen et al., 2012).随着Eh的逐渐升高, FeS沉淀中S2-和Fe(Ⅱ)被氧化成SO42-和Fe(Ⅲ)从而释放其固持的As, 导致土壤溶液中As浓度升高.因此认为在低Eh条件下铁氧化物的还原溶解导致其所固持的As释放出来, 而当Eh进一步从-50 mV升高至170 mV时, 被FeS沉淀固持的As进一步释放, 故而土壤溶液中As的浓度呈先慢后快的增长趋势(图 3a).另外, 虽然供试土壤样品中Cd含量较低, 无法用μ-XRF进行表征, 但从土壤溶液中Cd、S浓度随着Eh升高而升高的变化特征分析可知, 在低Eh条件下, Cd很可能被FeS以吸附或共沉淀的方式固定, 而在Eh升高的过程中则随着FeS沉淀的氧化过程而释放.土壤溶液中Fe、Mg、Ca等离子浓度上升也可能通过竞争吸附促进Cd从土壤颗粒物表面解吸而释放.
4 结论(Conclusions)1) 随着Eh的升高, 土壤溶液的pH与DOC值均呈降低趋势, 而土壤溶液中Cd与S、Al浓度呈相似的增长趋势, As与P、Fe浓度呈相似的增长趋势, 这间接表明Cd主要被金属硫化物控制, As主要受铁锰氧化物或铁的硫化物影响.
2) 同步辐射μ-XRF分析进一步发现, 在低Eh条件下, 土壤颗粒上As、Fe和S的高含量点信号重合且相关性较高, 说明铁的金属硫化物是As的主要固定相.
3) 本文研究结果有利于进一步深入认识污染稻田在淹水-落干过程中的Cd、As释放规律, 可为有效调控As、Cd生物有效性及其超标农田的安全利用与修复奠定理论基础.
Alfvén T, Elinder C G, Carlsson M D, et al. 2000. Low level cadmium exposure and osteoporosis[J]. Journal of Bone & Mineral Research, 15(8): 1579-1586. |
Bingham F T, Page A L, R J Mahler R J, et al. 1976. Cadmium availability to rice in sludge-amended soil under "Flood" and "Nonflood" culture1[J]. Soil Science Society of America Journal, 40(5): 715-719. |
Brus D J, Li Z B, Jing S, et al. 2009. Predictions of patially averaged cadmium contents in rice grains in the Fuyang valley, P.R.China[J]. Journal of Environment Quality, 38(3): 1126-1136. DOI:10.2134/jeq2008.0228 |
Cai M, Li K, Xie D, et al. 2014. The Status and protection strategy of farmland soils polluted by heavy metals[J]. Environmental Science & Technology, 37(12): 224-230. |
Du L G, Rinklebe J, Vandecasteele B, et al. 2009. Trace metal behaviour in estuarine and riverine floodplain soils and sediments:a review[J]. Science of the Total Environment, 407(13): 3972-3985. |
Frohne T, Diaz-Bone R A, Du L G, et al. 2014a. Impact of systematic change of redox potential on the leaching of Ba, Cr, Sr, and V from a riverine soil into water[J]. Journal of Soils and Sediments, 15(3): 623-633. |
Frohne T, Rinklebe J, Diaz-BoneR A. 2014b. Contamination of floodplain soils along the Wupper River, Germany, with As, Co, Cu, Ni, Sb, and Zn and the impact of pre-definite redox variations on the mobility of these elements[J]. Soil and Sediment Contamination, 23(7): 779-799. |
Frohne T, Rinklebe J, Diaz-BoneR A, et al. 2011. Controlled variation of redox conditions in a floodplain soil:Impact on metal mobilization and biomethylation of arsenic and antimony[J]. Geoderma, 160(3/4): 414-424. |
Fulda B, Voegelin A, Kretzschmar R. 2013. Redox-controlled changes in cadmium solubility and solid-phase speciation in a paddy soil as affected by reducible sulfate and copper[J]. Environmental Science & Technology, 47(22): 1270-1275. |
Ghorbanzadeh N, Lakzian A, A Halajnia A, et al. 2017. Impact of bioreduction on remobilization of adsorbed cadmium on iron minerals in anoxic condition[J]. Water Environment Research, 89(6): 519-523. |
Guo T, Delaune R D. 1997. The influence of sediment redox chemistry on chemically active forms of arsenic, cadmium, chromium, and zinc in estuarine sediment[J]. Environment International, 23(3): 305-316. |
Hashimoto Y, Amaguchi N Y. 2013. Chemical speciation of cadmium and sulfur K-Edge XANES spectroscopy in flooded paddy soils amended with zerovalent iron[J]. Soil Science Society of America Journal, 77(4): 1189-1194. |
Honma T, Ohba H, Kanekokadokura A, et al. 2016. Optimal soil Eh, pH, and water management for simultaneously minimizing arsenic and cadmium concentrations in rice grains[J]. Environmental Science & Technology, 50(8): 4178-4184. |
Ilgen A G, Foster A L, Trainor T P. 2012. Role of structural Fe in nontronite NAu-1 and dissolved Fe(Ⅱ) in redox transformations of arsenic and antimony[J]. Geochimica Et Cosmochimica Acta, 94(4): 128-145. |
Khaokaew S, Chaney R L, Landrot G, et al. 2011. Speciation and release kinetics of cadmium in an alkaline paddy soil under various flooding periods and draining conditions[J]. Environmental Science & Technology, 45(10): 4249-4255. |
Laing G D, E Meers E, Dewispelaere M, et al. 2009. Effect of water table level on metal mobility at different depths in wetland soils of the scheldt estuary(Belgium)[J]. Water Air & Soil Pollution, 202(1/4): 353-367. |
LeMonte J J, Stuckey J W, Sanchez J Z, et al. 2017. Sea level rise induced arsenic release from historically contaminated coastal soils[J]. Environmental Science & Technology, 51(11): 5913-5922. |
刘文菊, 赵方杰. 2011. 植物砷吸收与代谢的研究进展[J]. 环境化学, 30(1): 56-62. |
Marin A R, Masscheleyn P H. 1993. Soil redox-pH stability of arsenic species and its influence on arsenic uptake by rice[J]. Plant and Soil, 152(2): 245-253. |
Ren H T, Jia S Y, Wu S H, et al. 2013. Abiotic oxidation of Mn(Ⅱ) induced oxidation and mobilization of As(Ⅲ) in the presence of magnetite and hematite[J]. Journal of Hazardous Materials, 254-255(254): 89-97. |
Rinklebe J, Shaheen S M, Yu K. 2016. Release of As, Ba, Cd, Cu, Pb, and Sr under pre-definite redox conditions in different rice paddy soils originating from the U.S.A.and Asia[J]. Geoderma, 270: 21-32. |
Satoshi M, Teppei H, Harada Y, et al. 2006. Comparison of antimony behavior with arsenic under various soil redox conditions[J]. Environmental Science & Technology, 40(B08): 88-99. |
Shaheen S M, Rinklebe J, Frohne T, et al. 2014. Biogeochemical factors governing Cobalt, Nickel, Selenium, and Vanadium dynamics in periodically flooded Egyptian North Nile delta rice soils[J]. Soil Science Society of America Journal, 78(3): 1065-1073. |
Shaheen S M, Rinklebe J, Frohne T, et al. 2016. Redox effects on release kinetics of arsenic, cadmium, cobalt, and vanadium in Wax Lake Deltaic freshwater marsh soils[J]. Chemosphere, 150: 740-748. DOI:10.1016/j.chemosphere.2015.12.043 |
Sun L, Zheng C, Yang J, et al. 2016. Impact of sulfur(S) fertilization in paddy soils on copper(Cu) accumulation in rice(Oryza sativa L.) plants under flooding conditions[J]. Biology and Fertility of Soils, 52(1): 31-39. DOI:10.1007/s00374-015-1050-z |
Takahashi Y, Minamikawa R, Hattori K H, et al. 2004. Arsenic behavior in paddy fields during the cycle of flooded and Non-flooded periods[J]. Environmental Science & Technology, 38(4): 1038-1044. |
Uraguchi S, Fujiwara T. 2012. Cadmium transport and tolerance in rice:perspectives for reducing grain cadmium accumulation[J]. Rice, 5(1): 5. |
Wang Y, Tang C, Wu J, et al. 2013. Impact of organic matter addition on pH change of paddy soils[J]. Journal of Soils & Sediments, 13(1): 12-23. |
徐仁扣, 李九玉, 姜军. 2014. 可变电荷土壤中特殊化学现象及其微观机制的研究进展[J]. 土壤学报, 51(2): 207-215. |
Yu K, Böhme F, Rinklebe J, et al. 2007. Major Biogeochemical processes in soils-A microcosm incubation from reducing to oxidizing conditions[J]. Soil Science Society of America Journal, 71(4): 1406-1413. |
Yu K, Rinklebe J. 2011. Advancement in soil microcosm apparatus for biogeochemical research[J]. Ecological Engineering, 37(12): 2071-2075. DOI:10.1016/j.ecoleng.2011.08.017 |
Yang J, Zhu S, Zheng C, et al. 2015. Impact of S fertilizers on pore-water Cu dynamics and transformation in a contaminated paddy soil with various flooding periods[J]. Journal of Hazardous Materials, 286: 432-439. DOI:10.1016/j.jhazmat.2015.01.035 |
易维洁, 曲东, 黄婉玉, 等. 2010. 淹水培养时间对水稻土中Fe(Ⅲ)异化还原能力的影响[J]. 农业环境科学学报, 29(9): 1723-1729. |
Zhao F J, Ma Y, Zhu Y G, et al. 2015. Soil contamination in China:Current status and mitigation strategies[J]. Environmental Science & Technology, 49(2): 750-759. |
 2020, Vol. 40
2020, Vol. 40


