2. 广州亚加达国际预科, 广州 511458
2. Guangzhou Alcanta International College, Guangzhou 511458
工业废水中的有机污染物(尤其是有色染料污染物)大部分具有难降解特性, 通过常规处理工艺或者强化常规工艺很难处理达标(Liu et al., 2015;孙慧萍等, 2019).有色染料具有致突变性、致癌性和过敏性质(Dassanayake et al., 2018), 研究表明, 即使只含有少量染料的废水也会严重影响水生生物的生长(Sekar et al., 2012).目前, 大多数染色工业更偏向于使用阳离子染料(Doltabadi et al., 2016).然而, 由于阳离子染料具有离域电子的芳环结构及其特殊的合成方式, 比阴离子染料的毒性更大(Kumar et al., 2011).因此, 对工业废水中的阳离子染料(如罗丹明B(RhB)、亚甲基紫(MV)和亚甲基蓝(MB))进行高效低耗降解, 成为目前亟待解决的一个难题(Cui et al., 2015).
染料废水的处理主要有以下几种方法:离子交换(Wawrzkiewicz et al., 2013)、絮凝沉淀(Teh et al., 2016)、高级氧化技术(齐璠静等, 2017;Dassanayake et al., 2018;孙慧萍等, 2019)、活性炭吸附(吴少基等, 2019)和生物降解(Dhall et al., 2012).其中一些物理技术(如活性炭吸附和絮凝沉淀)的处理效果显著, 但它们仅是将有机染料从废水中转移到另一个相位中分离, 存在严重的二次污染.生物处理法对于具有一定毒性且难降解的染料废水处理效果不理想.高级氧化技术因为利用一些强氧化性活性基团(如羟基自由基、硫酸根自由基等)对有机污染物进行氧化分解, 生成水与二氧化碳等小分子物质而受到广泛关注(Yang et al., 2017).其中, 臭氧化及芬顿法对污染物降解效果显著, 但该方法需对废水持续投加氧化剂, 从而增加了废水的处理成本.同时, 芬顿法会产生大量的污泥, 而臭氧化初期投资大且降解过程可能产生更难降解的物质(Wang et al., 2018).光催化技术虽然在能源利用方面有巨大优势, 但染料废水色度较大, 会阻碍光源进入;同时, 紫外光催化耗能巨大;可见光催化效率低, 难以实现工程运用(Dassanayake et al., 2018).这些都限制了光催化技术在印染废水处理领域的应用.
电化学氧化法属于高级氧化技术的一种.电催化降解染料的优势主要有3点:①电催化装置占地面积小, 投资费用少;②操作简便, 易于形成自动化操作;③适用范围广, 降解效率高.电化学氧化一般分为直接氧化与间接氧化两种形式.其中, 直接电化学氧化法主要利用阳极氧化分解水中污染物, 从而达到降解目的, 该部分研究主要集中在电极的改性方面.电极的改性力求氧化效率高、稳定性良好、较高的析氧过电位及低制造成本, 以求取代贵金属铂电极及BDD金刚石电极, 如钛基金属氧化物电极的改性(陈阳雯等, 2019)、碳纳米管电极的改性(陶虎春等, 2017)及三维电极(刘伟军, 2019)等.间接氧化法又称为介体电化学氧化技术(MEO), 通过在水中加入介体离子, 使得介体离子在阳极被氧化形成强氧化性离子, 利用这些强氧化性离子进而氧化目标污染物.在此过程中介体离子经氧化还原后并未改变, 不产生消耗(司斌, 2018).目前常用的介体离子有Ag+、Ce3+、Co2+、PO43-、SO42-(Chung et al., 2002;Chung et al., 2009;Costa et al., 2009;Soleymani et al., 2018).其中, Ag+易同水中的氯离子形成沉淀, Ce3+在常规pH值下溶解度较低, PO43-及SO42-同电极的反应速率较慢, 这些离子难以组成高效的电化学氧化体系.而钴离子在水中溶解性较高、氧化性强、与电极反应速率快(Chung et al., 2002), 因此, 本文选用PO43-协同钴介体电催化体系.
电化学氧化法在氧化过程中只需消耗电能, 故而又称为电催化法.MEO技术可在一定程度上改善直接电催化法能源利用率低的问题.研究表明, MEO体系在强酸性环境(浓硫酸、浓硝酸等)中可以高效降解多种难降解有机污染物(Lubis et al., 2015).然而, 有关MEO体系在常规环境下的研究却鲜有报道, 不利于该技术的推广应用.因此, 本文以亚甲基蓝染料(MB)为目标污染物, 在常规pH下, 利用PO43-离子协同Co2+介体电化学氧化技术对含有MB的阳离子染料废水进行降解, 并探究不同电催化体系、Co2+与PO43-初始浓度、电流密度、初始pH值、电解质浓度对体系降解的影响.同时, 分析MB降解过程中氧化性中间产物种类及其分解产物, 并探讨其降解机理.
2 材料与方法(Materials and methods) 2.1 绘制亚甲基蓝(MB)溶液标准曲线配制MB标准液, 浓度分别为1、2、4、8和13 mg·L-1, 在其最大吸收波长(665 nm)处测定各浓度下对应的吸光度.以吸光度为纵坐标, MB染料浓度为横坐标, 得到吸光度随MB浓度变化的标准曲线(图 1).
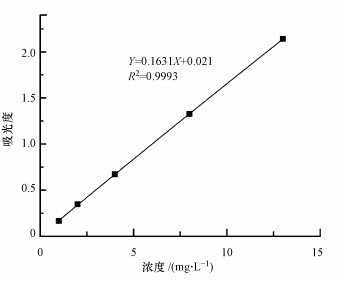 |
| 图 1 吸光度随MB浓度变化的标准曲线 Fig. 1 Standard curve of absorbance varied with MB concentration |
叔丁醇tBA(AR, 化学式C4H10O, 分子量74, 天津福晨化学试剂有限公司)、甲醇(AR, 化学式CH3OH, 分子量32, 天津市大茂化学试剂厂)、硫酸钴(Ⅱ)(AR, 化学式CoSO4·7H2O, 分子量281, 天津福晨化学试剂有限公司)、亚甲基蓝MB(AR, 化学式C16H18ClN3S, 分子量319.86, 天津市天新精细化工开发中心)、铂钛电极(规格为3.5 cm×5 cm, 苏州苏恩泰工业科技有限公司)、5, 5-二甲基-1-吡咯啉-N-氧化物DMPO(AR, 化学式为C6H11NO, 分子量为113.16, 阿拉丁)
2.2.2 实验仪器紫外可见光分光光度计(UV-5100, 上海元析仪器有限公司)、直流稳压电源(MS305D, 迈胜有限公司)、磁力搅拌器(79-1, 金坛大地自动化仪器厂)、pH计(STARTER3100, OHAUS, 美国)、电子顺磁共振波普仪EPR(EMXplus-10/12, Bruker, 德国)、超高分辨四极杆组合静电场轨道阱液质联用仪(Q Exactive, 中国).
2.3 实验装置与步骤 2.3.1 电催化实验电催化实验装置如图 2所示.实验以不锈钢电极夹连接阴阳极并用导线接至电源.电解槽体积为700 mL, 电极间隔为2 cm.实验步骤如下:首先取25 mmol·L-1电解质(硫酸钠)、2 mmol·L-1硫酸钴、3 mmol·L-1磷酸钠及400 mL浓度为12.5 mg·L-1的MB溶液于电解槽中;然后利用硫酸/氢氧化钠(0.1 mmol·L-1)调节pH=4, 启动磁力搅拌器(转速800 r·min-1), 接通直流电源并调节电流密度至12 mA·cm-2进行电催化实验.电解过程中, 在反应时间分别为5、10、15、20、30、40 min时对MB染料溶液取样, 测定相应样品的吸光度, 并根据图 1所示的标准曲线确定溶液中MB的残余浓度Ce.则MB残留率由所测得的残余浓度Ce与初始浓度C0的比值确定, 降解率由1-Ce/C0计算得到.测试MB的降解率指标.每组实验重复3次, 对3次实验数据取平均值, 获得MB的平均降解率.
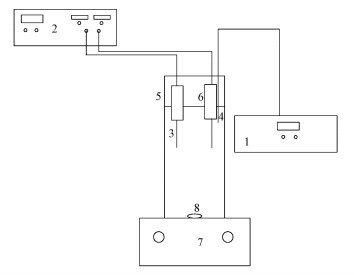 |
| 图 2 电催化实验装置简图(1.pH计, 2.直流稳压电源, 3.电极板, 4. pH计探头, 5.电解槽, 6.电极夹, 7.磁力搅拌器, 8.磁力转子) Fig. 2 The setup of the electrocatalysis experiment |
间接电催化体系的液相中存在着氧化性中间产物, 可通过向体系引入屏蔽剂掩盖氧化性中间产物对MB的作用, 通过考察降解率的变化, 间接证明氧化性过程产物的存在.此外, 氧化活性物质可与某些捕获剂形成络合物, 向体系引入对应的捕获剂, 通过检测是否产生相应的络合物, 从而证明该氧化活性物质的存在.
使用叔丁醇对自由基进行屏蔽实验, 使用硫代硫酸钠对溶液中所有氧化性物质进行屏蔽实验, 使用DMPO、氨水分别对自由基和Co3+进行捕获.
屏蔽剂浓度的选择:以该浓度对直接电催化体系进行试验, 确保屏蔽剂的加入不会对电极直接电催化MB产生影响.
3 结果与讨论(Results and discussion) 3.1 PO43--MEO/Co(Ⅱ)体系中氧化性中间产物的种类向PO43--MEO/Co(Ⅱ)体系引入叔丁醇及硫代硫酸钠等屏蔽剂, 测定体系对MB氧化降解率的影响, 判断体系中是否存在对应的氧化性中间产物(自由基、Co3+), 结果如图 3所示.
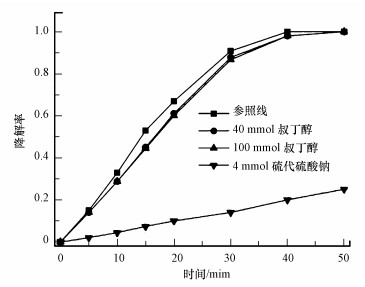 |
| 图 3 硫代硫酸钠及叔丁醇对PO43--MEO/Co(Ⅱ)体系对MB降解效率的影响 Fig. 3 The effect of sodium thiosulfate and tBA on the degradation rate of MB in PO43--MEO/Co(Ⅱ) system |
向体系中引入叔丁醇(tBA)进行羟基自由基、硫酸根自由基检测.由图 3可知, 加入40 mmol tBA后, 体系对MB的降解效率略有下降(在反应15 min时, 降解效率从53%降至45%), 这表明PO43-MEO/Co(Ⅱ)体系在降解MB的过程中有少量自由基生成.继续增加tBA投加量至100 mmol, 体系对MB的降解率基本不变, 这反映出该电催化体系的自由基氧化降解作用微弱.为了进一步确定自由基的种类, 采用DMPO为捕获剂进行EPR测试, 结果如图 4所示.图 4中出现了微弱的羟基自由基图谱(图中●所示), 该自由基为羟基自由基(·OH).
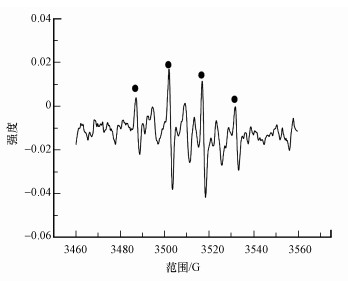 |
| 图 4 自由基的EPR图谱 Fig. 4 EPR atlas of radical |
硫代硫酸钠作为一种强还原剂, 常用来检测溶液中是否存在氧化性物质.向PO43-MEO/Co(Ⅱ)体系中加入4 mmol硫代硫酸钠时, 体系对MB的降解率明显下降(在反应40 min时, 降解率从100%降至20%).这间接表明电催化体系液相中存在着强氧化性中间产物, 该强氧化性中间产物对MB具有强氧化降解作用.通过检测得到体系内主要氧化性中间产物为Co3+, 同时存在少量羟基自由基及过磷酸盐, 这与文献报道的结果吻合(Costa et al., 2009;Lubis et al., 2015).
Co3+的检测:Co3+在常规pH值下的停留时间极短, 难以直接测出.但Co3+可被氨分子捕获形成多种稳定的钴氨络合物, 其在320~520 nm的波长下具有最大吸收峰(Okubo et al., 2010).为了验证Co3+的存在, 通过向体系中引入1 mL浓度为25%的氨水进行Co3+的捕获实验, 并对溶液进行紫外-可见全扫描光谱分析, 结果如图 5所示.结果表明, 在反应5、15、30 min时, 反应溶液于350 nm及517 nm处产生了吸收峰, 这与Okubo等(2010)报道的三价钴氨络合物吸收峰相符.随反应时间延长, Co3+的数量增加, 氨分子捕获的Co3+随之增加, 吸光度升高.捕获实验结果证实了Co3+的存在.
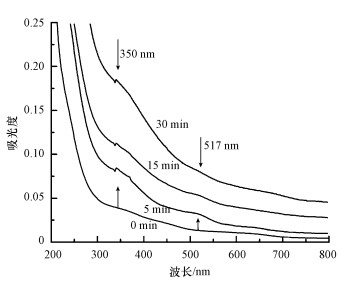 |
| 图 5 紫外-可见全波段扫描光谱 Fig. 5 UV-vis spectra results |
过磷酸根的检测:根据过磷酸盐在溶液中停留时间较长的特性, 在体系断电后, 测试MB是否继续分解来判断体系过磷酸根的存在.结果表明, PO43--MEO/Co(Ⅱ)体系断电10 min后, 溶液吸光度从1.400降低至1.393, 说明PO43--MEO/Co(Ⅱ)体系中可能存在过磷酸根.但断电后溶液的吸光度下降不明显, 可能是因为过磷酸盐与二价钴离子发生反应, 进而使得体系内过磷酸盐浓度不高(Hariharan et al., 1979).
为了排除硫酸钠电解质的干扰, 实验将PO43--MEO/Co(Ⅱ)体系中电解质替换为磷酸钠后, 以KI-淀粉试纸检测该断电后的反应液中是否存在氧化性过程产物.结果发现, KI-淀粉试纸显蓝色, 说明PO43--MEO/Co(Ⅱ)体系断电后溶液中仍有氧化性物质存在.而Co3+及羟基自由基停留时间极短(Liu Z et al., 2018), 断电后难以检测出它们的存在, 故而推断该氧化性物质为过磷酸根.综上所述, 体系内主要氧化性中间产物为Co3+, 同时存在少量羟基自由基及过磷酸盐.
3.2 几种不同催化体系对MB降解效果的比较几种不同电催化体系对MB的降解效果如图 6所示.在不通电的条件下, Co2+与磷酸根离子同时作用时, MB在50 min内并未降解(图 6中■).在电解质为25 mmol·L-1 Na2SO4及3 mmol·L-1 Na3PO4的情况下, 经过30 min电化学氧化作用, 钛镀铂电极对MB的直接电化学氧化降解率仅为18%(图 6中▲).为了消除Na3PO4电解质的影响, 将▲数据条件中的3 mmol·L-1 Na3PO4用3 mmol·L-1 Na2SO4替代, 得到28 mmmol·L-1 Na2SO4电解质作用下的直接电化学氧化体系作用30 min时的MB降解率为20%(图 6中●).结果表明, 直接电催化下Na3PO4电解质对MB的降解效率不如Na2SO4电解质.对于MEO/Co(Ⅱ)体系时, 其对MB的降解率在30 min时达到76.3%(图 6中▼).而PO43--MEO/Co(Ⅱ)体系对MB的降解率在30 min时高达91%(图 6中◆), 在40 min时降解率达到100%.因此, 在降解MB时, 直接电化学氧化(图 6中▲和●数据)的电流利用率低, 降解率低于20%;MEO/Co(Ⅱ)体系的降解效果有所提升, 降解率达到76.3%, 电流利用率有所提高.PO43--MEO/Co(Ⅱ)体系对MB的降解效果最高(高达100%), 是直接电化学氧化体系降解率的5倍, 说明该体系是一种高效的电催化体系.
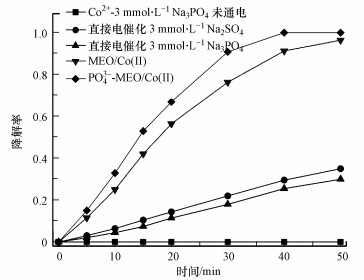 |
| 图 6 不同体系对MB的降解率随时间的变化 Fig. 6 The degradation rate of MB in different systems varied with time |
同时, 为了探究PO43--MEO/Co(Ⅱ)体系对MB的矿化程度, 实验对PO43--MEO/Co(Ⅱ)体系降解MB进行了TOC测试, 并对比了直接电催化下MB的TOC变化情况, 结果如图 7所示.从图 7可以看出, MB经PO43--MEO/Co(Ⅱ)体系降解2.5 h, TOC降解率达到60%, 是直接电催化矿化效率(23%)的2.6倍.
 |
| 图 7 直接电催化体系与PO43--MEO/Co(Ⅱ)体系的TOC降解效率 Fig. 7 TOC removal efficiency of PO43--MEO/Co(Ⅱ) system and Direct electrocatalytic system |
采用PO43--MEO/Co(Ⅱ)电催化体系对MB进行降解, 得到不同因素(如硫酸钴及磷酸钠的浓度、电流密度、溶液初始pH、电解质浓度等)对该体系降解效果的影响规律如图 8所示.
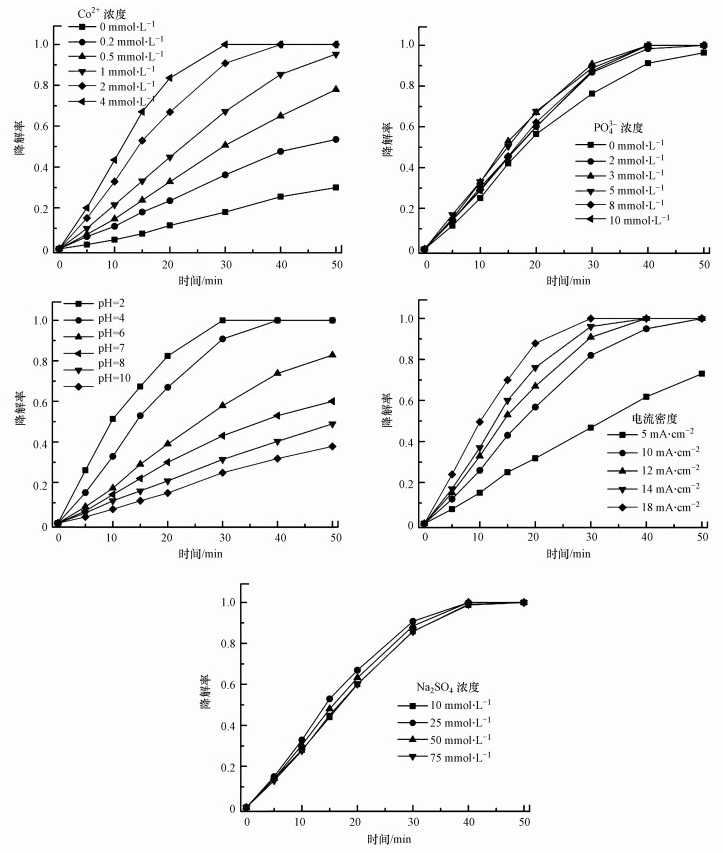 |
| 图 8 Co2+浓度(a)、PO43-浓度(b)、pH值(c)、电流密度(d)和Na2SO4浓度(e)对PO43--MEO/Co(Ⅱ)体系对MB降解效率的影响 Fig. 8 Effect of Co2+ concentration(a), PO43-concentration(b), pH(c), current density(d) and Na2SO4 concentration(e) on the degradation rate of MB in PO43--MEO/Co(Ⅱ) system |
初始Co2+浓度对PO43--MEO/Co(Ⅱ)体系中MB溶液的降解效果如图 8a所示.从图 8a可以得到, PO43--MEO/Co(Ⅱ)反应体系的氧化能力随着Co2+浓度的增加而提高显著.当Co2+浓度从0、0.2、0.5、1、2 mmol·L-1变化到4 mmol·L-1时, MB溶液经30 min电催化降解后, 降解率分别为18%、36%、51%、67%、94%和100%.增加Co2+浓度, 单位时间内强氧化性物质Co3+的生成量随之增加, 使PO43--MEO/Co(Ⅱ)体系的氧化性能显著增强(Lubis et al., 2015).同时, 在图 8a中可以看到, 加入0.2 mmol·L-1的Co2+, 体系的降解效率较直接电催化(Co2+浓度为0 mmol·L-1)的效率提高1倍.这一现象表明, 对于电流的利用效率及MB的降解效率, 钴离子介电体系效果显著(效率为直接电催化的5倍).
3.3.2 初始PO43-浓度的影响在不同PO43-浓度下, PO43--MEO/Co(Ⅱ)体系对MB溶液的降解效果如图 8b所示.当PO43-浓度分别为0、2、3、5、8和10 mmol·L-1时, 经过30 min电催化降解, PO43--MEO/Co(Ⅱ)体系对MB的降解率分别为76.3%、86.8%、91%、88.8%、87.3%和87.3%.数据表明, 在PO43-浓度较低(0~3 mmol·L-1)时, 随着PO43-浓度增加, PO43--MEO/Co(Ⅱ)体系的氧化能力显著提高;在PO43-浓度较高(3~10 mmol·L-1)时, 随着PO43-浓度增加, PO43--MEO/Co(Ⅱ)体系的氧化能力略有下降.这可能是因为PO43-浓度增加, 过磷酸根生成量相应增加, 而过磷酸根可迅速氧化二价钴离子形成Co3+(Hariharan et al., 1979), 从而增强体系的氧化能力.但另一方面, PO43-浓度增大导致阴极上形成更多的Co3(PO4)2沉淀物, 从而减少液相中的Co2+, 使得体系氧化效率下降.因此, 增大PO43-浓度对体系的氧化效率影响并不明显.
3.3.3 初始pH值的影响初始pH值对PO43--MEO/Co(Ⅱ)体系对MB溶液的降解效果如图 8c所示.在初始pH值分别为2、4、6、7、8和10时, 经过30 min电催化降解后, 体系对MB的降解率分别为100%、91%、58%、50%、42%和25%.结果表明, 随着pH值升高, 体系的降解效率逐渐下降.主要是因为碱性条件下Co2+以Co(OH)42-形态存在, 使体系的氧化性能下降, 而酸性环境会抑制体系副反应(电解水反应)及Co2+的水解.此外, 当初始pH值为4、6和8时, 阴极表面粘附着不同程度的黑色沉淀物质(其中pH=6时最多).PO43--MEO/Co(Ⅱ)体系在电流的作用下, 阴极表面pH值会高于溶液的pH值, 继而生成一定量的Co(OH)x与Co3(PO4)2沉淀(Chaplin et al., 2014), 从而降低体系的降解效率.
3.3.4 电流密度的影响不同电流密度下, PO43--MEO/Co(Ⅱ)体系对MB溶液的降解效果如图 8d所示.在电流密度分别为5、10、12、14和18 mA·cm-2时, 经过20 min电催化降解, PO43--MEO/Co(Ⅱ)体系对MB的降解率分别为32%、57%、67%、76%和88%.数据表明, 电流密度增大能加快MB的分解速率, 但其电流利用率也随之呈非线性降低趋势.这是因为随着电流密度增大, 体系产生了以下的变化:①体系中的Co3+生成速率随之加快, 体系氧化效率提高;②增强了电极对污染物的直接电催化作用;③体系内的副反应(电解水反应)增强, 体系能耗也随之增加(表 1).
| 表 1 不同电流密度下PO43--MEO/Co(Ⅱ)体系降解50%MB的能耗 Table 1 Energy consumption of removing 50% MB at different current densities |
从表 1可以看出, 增大电极的电流密度使体系降解效率提高, 但能耗也相应增大.综合考虑能耗和降解效率的影响, 本文选取12 mA·cm-2的电流密度用于体系实验.
3.3.5 Na2SO4电解质的影响电解质在电催化体系中起到电子传递的作用, 并可在阳极被氧化生成各种氧化性物质, 起到一定的介体电化学氧化作用(Araújo et al., 2018).不同浓度Na2SO4电解质对PO43--MEO/Co(Ⅱ)体系对MB溶液的降解效果如图 8e所示.当电解质Na2SO4浓度分别为10、25、50和75 mmol·L-1时, PO43--MEO/Co(Ⅱ)体系在30 min时对MB溶液的降解效率分别为86%、91%、88%及86%.结果显示, 体系对MB的降解效率随Na2SO4浓度增加呈先上升而后趋于平稳的变化趋势.可能的原因是, 当Na2SO4电解质浓度较低时(如10~25 mmol·L-1), 体系电压升高, 副反应增强, 体系对MB的降解率下降;但阴极沉淀物减少, 液相中Co3+和PO43-数量增加.同时, SO42-浓度减小, 增加了PO43-在总离子浓度中所占的比例, Co3+和PO43-与阳极的接触率上升, Co3+和P2O84-产量增加, 导致体系氧化效率增强.在两种情况的相互作用下, 电解质浓度下降时, PO43--MEO/Co(Ⅱ)体系对MB的降解效率趋于稳定.同样, 当Na2SO4电解质浓度较高时, 电解质浓度上升对体系氧化效率改变不明显.
3.4 PO43--MEO/Co(Ⅱ)体系对MB的降解过程及降解机理分析 3.4.1 MB降解过程产物分析PO43--MEO/Co(Ⅱ)体系对MB的降解过程产物分析如图 9所示.当降解10、30、60 min时分别取样(分别记为样品1、样品2、样品3).在保留时间为8.44 min时, 样品1和2均检测出C16H18N3S(m/z=284)、C16H20N3S(m/z=286)、C16H18ON3S(m/z=300)及C16H20ON3S(m/z=302), 样品3中仅检出少量的C16H20N3S(m/z=286);在保留时间为7.40 min时, 样品1、2中检出C15H16N3S(m/z=270).这表明经过60 min的电催化作用, PO43--MEO/Co(Ⅱ)体系基本降解了MB及其第一阶段降解的过程产物.此外, 在保留时间为1.82 min时, 样品1、2均检出C8H13N2(m/z=137);在保留时间为14.58 min时, 样品3检出C12H8NS(m/z=198).
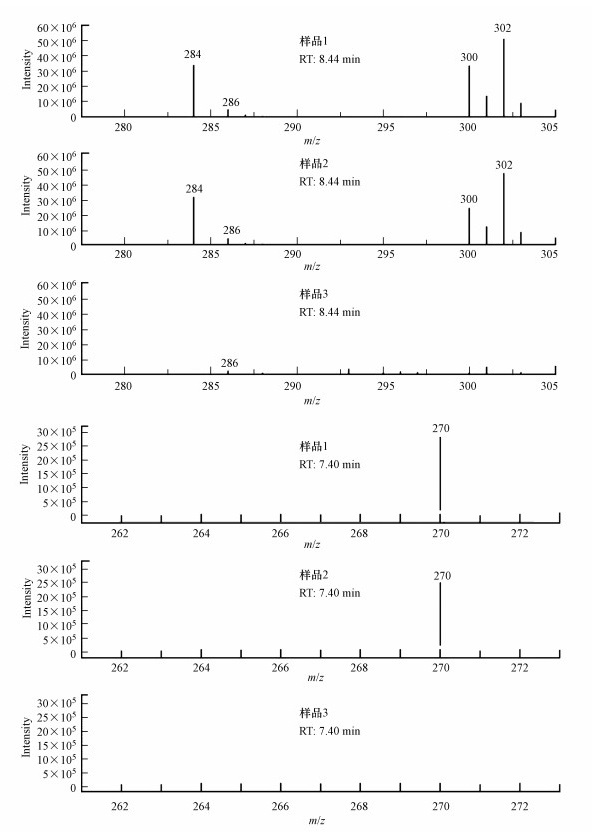 |
| 图 9 MB分解产物质谱 Fig. 9 Spectrum of MB decomposition products |
通过相关研究(Rauf et al., 2010;Yu et al., 2010;林骋等, 2014)及MB分子结构推断, PO43--MEO/Co(Ⅱ)体系对染料分子可能的降解过程如图 10所示.MB分子先从N—C连接处断键(Rauf et al., 2010;Yu et al., 2010)(主要从支链二甲氨基及吩噻嗪中间环上断裂)形成吩噻嗪、2-氨基-5-(N-甲基甲酰胺)苯磺酸及N1, N1-二甲基-1, 4二氨苯等物质(林骋等, 2014), 再开环降解成为苯胺、苯酚、苯磺酸等小分子, 最终分解成二氧化碳、水等无机物.
 |
| 图 10 MB降解过程图 Fig. 10 Degradation process of methylene blue |
根据3.1节对PO43--MEO/Co(Ⅱ)体系中氧化性物种的测定分析结果, 推测PO43--MEO/Co(Ⅱ)体系对MB可能的降解机理如图 11所示.
 |
| 图 11 PO43--MEO/Co(Ⅱ)体系反应机理图 Fig. 11 Reaction mechanism diagram of PO43--MEO/Co(Ⅱ) system |
PO43--MEO/Co(Ⅱ)体系一方面存在着铂钛电极的直接电催化作用, 阳极氧化有机污染物、二价钴离子及PO43-, 分别形成小分子有机物、Co3+及过磷酸根离子(见3.1节);另一方面是Co3+、过磷酸根、羟基自由基的间接电催化作用, 其中, 起主导作用的是Co3+的电催化氧化(见3.2节中PO43--MEO/Co(Ⅱ)体系与直接电催化体系对比).溶液中的有机物(如MB)在Co3+的强氧化性下被迅速分解成小分子(如吩噻嗪), 并使Co3+还原成二价钴离子, 进而形成钴离子的循环利用(见3.1.2节).对于过磷酸根离子, 它一方面氧化有机物(如MB), 另一方面催化二价钴生成更多的Co3+, 使体系的氧化能力进一步增强.同时, 过磷酸盐的消耗, 根据化学平衡原理又促进阳极生成更多的过磷酸盐(见3.1.2节).因此, PO43-与MEO/Co(Ⅱ)体系产生了明显的协同催化降解MB作用(见3.2节PO43--MEO/Co(Ⅱ)体系与MEO/Co(Ⅱ)体系对比).此外, 体系中还存在少量羟基自由基氧化有机物(如MB)的反应(图 4).
因此, PO43--MEO/Co(Ⅱ)体系对MB的降解机理, 一方面是通过电极的直接电催化作用, 另一方面是Co3+、过磷酸根、羟基自由基的间接氧化作用, 其中起主导作用的是Co3+的电催化氧化.
4 结论(Conclusions)1) PO43--MEO/Co(Ⅱ)体系主要的氧化性中间产物为Co3+, 同时存在少量羟基自由基及过磷酸盐.
2) PO43-与MEO/Co(Ⅱ)体系之间具有明显的协同催化作用.PO43--MEO/Co(Ⅱ)体系40 min内对MB的降解率高达100%, 为直接电化学氧化体系降解率的5倍和MEO/Co(Ⅱ)体系降解率的1.2倍, 是一种高效的电催化体系.
3) 钴离子浓度、电流密度及pH值对PO43--MEO/Co(Ⅱ)体系的影响较大, 而PO43-浓度、电解质浓度对PO43--MEO/Co(Ⅱ)体系的影响较小.
4) PO43--MEO/Co(Ⅱ)体系对MB的降解过程为:先从MB分子的N—C连接处断键, 形成吩噻嗪、2-氨基-5-(N-甲基甲酰胺)苯磺酸及N1, N1-二甲基-1, 4二氨苯等物质, 然后将其降解为苯胺、苯酚、苯磺酸等, 最终分解成CO2和水等无机物.
5) PO43--MEO/Co(Ⅱ)体系对MB的降解机理为:通过铂钛电极直接电催化, 以及Co3+、过磷酸根、羟基自由基的间接氧化, 其中, 起主导作用的是Co3+的电催化氧化.
Agustina T E, Ang H M, Vareek V K. 2005. A review of synergistic effect of photocatalysis and ozonation on wastewater treatment[J]. Journal of Photochemistry and Photobiology C-Photochemistry Reviews, 6(4): 264-273. |
Araújo D M D, Sáez C, Cañizares P, et al. 2018. Improving the catalytic effect of peroxodisulfate and peroxodiphosphate electrochemically generated at diamond electrode by activation with light irradiation[J]. Chemosphere, 207: 774-780. |
Chaplin B P. 2014. Critical review of electrochemical advanced oxidation processes for water treatment applications[J]. Environmental Science Processes & Impacts, 16(6): 1182-1203. |
陈阳雯, 刘蕊, 姚洁, 等. 2018. La掺杂钛基氧化物电极降解水中2, 4-二氯酚的研究[J]. 环境科学与技术, 41(1): 94-98. |
Chung S J, Pillai K C, Moon I S. 2009. A sustainable environmentally friendly NOx removal process using Ag(Ⅱ)/Ag(Ⅰ)-mediated electrochemical oxidation[J]. Separation & Purification Technology, 65(2): 156-163. |
Chung Y H, Park S M. 2000. Destruction of aniline by mediated electrochemical oxidation with Ce(Ⅳ) and Co(Ⅲ) as mediators[J]. Journal of Applied Electrochemistry, 30(6): 685-691. |
Costa C R, Montilla F, Emilia Morallón, et al. 2009. Electrochemical oxidation of acid black 210 dye on the boron-doped diamond electrode in the presence of phosphate ions:Effect of current density, pH, and chloride ions[J]. Electrochimica Acta, 54(27): 7048-7055. |
Cui H J, Huang H Z, Yuan B, et al. 2015. Decolorization of RhB dye by manganese oxides:effect of crystal type and solution pH[J]. Geochemical Transactions, 16(1): 10. |
Dassanayake R S, Rajakaruna E. 2018. Abidi N.Preparation of aerochitin-TiO2 composite for efficient photocatalytic degradation of methylene blue[J]. Journal of Applied Polymer Science, 135(8): 45908. |
Dhall P, Kumar R, Kumar A. 2012. Degradation of sewage wastewater using autochthonous bacteria[J]. The Scientific World Journal, 5: 861903. |
Doltabadi M, Alidadi H, Davoudi M, et al. 2016. Comparative study of cationic and anionic dye removal from aqueous solutions using sawdust-based adsorbent[J]. Environmental Progress & Sustainable Energy, 35(4): 1078-1090. |
Hariharan S S, Maruthamuthu M. 1979. Polymerization of acrylonitrile initiated by the redox-system peroxodiphosphate-Co(Ⅱ)[J]. Macromolecular Chemistry & Physics, 180(10): 2513-2515. |
Kumar R, Ahmad R. 2011. Biosorption of hazardous crystal violet dye from aqueous solution onto treated ginger waste (TGW)[J]. Desalination, 265(1/3): 112-118. |
林骋, 刘明言, Lin Cheng, 等. 2014. 铜离子掺杂二氧化钛光催化板式微反应器[J]. 化工学报, 65(11): 4325-4332. |
Liu L, Zhang B, Zhang Y, et al. 2015. Simultaneous removal of cationic and anionic dyes from environmental water using montmorillonite-pillared graphene oxide[J]. Journal of Chemical & Engineering Data, 60(5): 1270-1278. |
刘伟军, 段平洲, 胡翔, 等. 2019. 活性炭纤维三维电极电催化降解水中间甲酚-效能及影响因素研究[J]. 中国环境科学, 39(1): 166-171. |
Liu Z, Zhao C, Wang P, et al. 2018. Removal of carbamazepine in water by Electro-activated carbon fiber-peroxydisulfate:Comparison, optimization, recycle, and mechanism study[J]. Chemical Engineering Journal, 343: 28-36. |
Lubis R A, Bahti H H, Hastiawan I, et al. 2015. Optimization in mediated electrochemical oxidation using cobalt sulfate as a mediator[J]. Procedia Chemistry, 17: 153-156. |
Malik P K. 2004. Dye removal from wastewater using activated carbon developed from sawdust:adsorption equilibrium and kinetics[J]. Journal of Hazardous Materials, 113(1): 81-88. |
Okubo T, Yamamura Y, Ise N. 2010. Role of solvation and desolvation in polymer "catalysis".VI.Influence of ionic valencies of reactants on the desolvation effects in the spontaneous and Hg2+-induced aquation of Co(NH3)5SO4+, Co(NH3)5Br2+ and Cr(NH3)5Br2+[J]. Journal of Physical Chemsitry, 86(10): 922-925. |
齐璠静, 李一兵, 王彦斌, 等. 2017. H2O2强化g-C3N4可见光电催化降解亚甲基蓝的研究[J]. 中国科学:化学, 47(3): 376-382. |
Rauf M A, Meetani M A, Khaleel A, et al. 2010. Photocatalytic degradation of methylene blue using a mixed catalyst and product analysis by LC/MS[J]. Chemical Engineering Journal, 157(2): 373-378. |
Sekar S, Surianarayanan M, Ranganathan V, et al. 2012. Choline-based ionic liquids-enhanced biodegradation of azo dyes[J]. Environmental Science & Technology, 46(9): 4902. |
司斌.2018.常规pH下Co(Ⅲ)介体电化学氧化体系降解水中难降解有机污染物的研究[D].重庆: 重庆大学
|
孙慧萍, 吕文洲. 2019. 膨润土负载锌-钴催化臭氧处理模拟染料废水[J]. 纺织学报, 40(3): 118-124. |
Soleymani A R, Moradi M. 2018. Performance and modeling of UV/Persulfate/Ce(Ⅳ) process as a dual oxidant photochemical treatment system:kinetic study and operating cost estimation[J]. Chemical Engineering Journal, 347: 243-251. |
Teh C Y, Budiman P M, Shak K P Y, et al. 2016. Recent advancement of coagulation-flocculation and its application in wastewater treatment[J]. Industrial & Engineering Chemistry Research, 55(16): 4363-4389. |
陶虎春, 石刚, 于太安, 等. 2017. PEI/MWCNT修饰含铁电芬顿电极处理印染废水的研究[J]. 北京大学学报(自然科学版), 53(5): 982-988. |
Wawrzkiewicz M. 2013. Removal of C.I.Basic Blue 3 dye by sorption onto cation exchange resin, functionalized and non-functionalized polymeric sorbents from aqueous solutions and wastewaters[J]. Chemical Engineering Journal, 217: 414-425. |
Wang S, Wang J, Wang T, et al. 2018. Effects of ozone treatment on pesticide residues in food:A review[J]. International Journal of Food Science & Technology, 54(2): 301-312. |
吴少基, 江坤, 叶跃元, 等. 2019. 污泥与杨木屑共热解焦制活性炭及其废水处理应用[J]. 林产化学与工业, 39(4): 56-64. |
Yang Y, Lu X, Jiang J, et al. 2017. Degradation of sulfamethoxazole by UV, UV/H2O2, and UV/persulfate (PDS):Formation of oxidation products and effect of bicarbonate[J]. Water Research, 118: 196-207. |
Yu Z, Chuang S S. 2007. Probing methylene blue photocatalytic degradation by adsorbed ethanol with in situ IR[J]. The Journal of Physical Chemistry C, 11(37): 13813-13820. |
 2020, Vol. 40
2020, Vol. 40


