2. 江南大学化学与材料工程学院, 无锡 214112
2. School of Chemistry and Materials Engineering, Jiangnan University, Wuxi 214112
快速的工业化进程促进了重金属向自然环境中释放, 致使水体重金属污染治理、土壤重金属污染修复成为世界性的环境难题, 其中, 镉因其低量高毒、危害极大而被高度关注(Lian et al., 2019; 汪辰等, 2020).目前, 针对Cd2+污染水体的治理方法有很多种, 主要包括化学沉淀法、电解法、离子交换法、膜分离法和吸附法(Ahluwalia et al., 2005; Fu et al., 2011; Tofighy et al., 2011).其中, 吸附法因其材料来源广泛、选择性好、吸附容量大、处理效率高、再生处理容易、适用范围广等优势而被广泛研究与应用, 而此技术的关键在于优质吸附剂的筛选与研发.
近年来, 国内外针对吸附剂的研究颇多, 按其来源可分4类:天然无机吸附剂、高分子有机吸附剂、复合型吸附剂、新型吸附剂.其中, 前两类材料来源广泛、价格低廉, 但再生处理相对困难、效果低, 一般对Cd2+的吸附容量仅有10~100 mg·g-1(Vila et al., 2011; Bai et al., 2019; Li et al., 2019; Luo et al., 2019);复合型吸附剂结合了以上两类材料的优点, 具有相对较好的选择优越性, 但去除效果依旧不太理想, 饱和吸附量在65~200 mg·g-1之间(Xiong et al., 2018; Chen et al., 2018; Cai et al., 2018);新型吸附剂凭借其巨大的表面积、高表面能、丰富的活性基团而使吸附容量大、速度快、效率高, 且再生容易, 这类吸附剂常见的为多孔、纳米材料, 对Cd2+的吸附量一般高达240~800 mg·g-1(Mahoud et al., 2015; Javaheri et al., 2019; Ali et al., 2019), 但大多数新型材料制备工艺复杂、成本高、产量低, 很难实现规模化生产.总体而言, 各类吸附剂普遍存在“廉价不高效、高效不廉价”的通病, 因此, 研制两者兼得、制备工艺简单、具有工业化生产潜力的新型吸附剂成为优质吸附材料的发展方向, 更具科学意义.Li等(2017)采用KMnO4改性油菜秸秆生物炭, 成功地将纳米氧化锰颗粒负载在生物炭表面上, 增加了含氧官能团数量, 产生了更多吸附位点, 对Cd2+的吸附量可达81.10 mg·g-1, 高于同等条件下原始生物炭吸附量的10倍, 但吸附效果依旧欠佳.Zhao等(2014)采用纳米自组装技术制成了形成于硅酸钙材料(CSH)表面的壳聚糖介孔微球, 比表面积达356 m2·g-1, BJH孔径为12 nm, 对Cd2+的饱和吸附量达578 mg·g-1, 然而水热合成的高能耗限制了其工业化生产的可能.Liu等(2017)采用硫醇功能化合成的介孔硅酸钙在298 K下对Cd2+的饱和吸附量高达601.51 mg·g-1, 但相对复杂的合成步骤同样限制了其可应用性.由此可见, 尽管现有开发的CSH对Cd2+具有较优的吸附效果, 但仍旧不能同时满足优质吸附剂的诸多要求.大量文献显示, 新型吸附材料的制备方法有多种, 常见的有水热合成法和化学沉淀法(Lin et al., 2006; Baciu et al., 2007; Yuan et al., 2011), 其中, 化学沉淀法因工艺简单、成本低、易实现工业化生产而被广泛研究, 但主要由于其反应物中钙源、硅源的用量不同, 以致合成的材料结构不一, 性能差异很大(Phattharachindanuwong et al., 2018; 徐文等, 2018).研究发现, 合成新型纳米材料时表面活性剂的添加可以控制晶体的成核与生长, 利用静电效应可防止颗粒间团聚, 通过表面活性剂的空间位阻效应能提高颗粒间的分散性, 同时, 不同类型、不同浓度的表面活性剂可以调控颗粒尺寸大小和形貌, 从而可得到多种形貌、不同性能的纳米材料(Wei et al., 2005; Zhang et al., 2018), 且目前关于表面活性剂在CSH制备中的应用相对较少.
基于此, 本文从添加表面活性剂的角度出发, 采用低能耗、易操作的化学沉淀法制备介孔硅酸钙, 选用不同表面活性剂种类及用量, 同时调控钙硅比(Ca/Si), 探讨各因素对制备材料吸附性能的影响, 寻找最优制备条件, 研制高效、廉价、制备工艺简单、更具工业化生产潜力的新型吸附材料.同时, 结合扫描电镜(SEM)、红外光谱(FTIR)、比表面积测试(BET)、X-射线衍射分析(XRD), 对所制备吸附剂的形貌结构、材料性能进行评价, 以期为Cd2+污染水体治理、土壤修复提供潜在优势新材料.
2 材料与方法(Materials and methods) 2.1 制备方法将一定质量的Na2SiO3·9H2O、Ca(NO3)2·4H2O分别溶于去离子水中, 向Na2SiO3·9H2O溶液中加入一定质量的表面活性剂, 搅拌混匀置于三口烧瓶并放入恒温磁力搅拌器(ZNCL-GS型, 上海凌科公司)中, 随后用蠕动泵(BT100-2J, 保定兰格恒流泵有限公司)将Ca(NO3)2·4H2O溶液滴加至三口烧瓶中, 于80 ℃、600 r·min-1下充分搅拌反应, 待反应完成后对沉淀物进行3次水洗和酒精洗, 最后用真空泵(GM 0.33A型, 天津津腾公司)对沉淀物进行抽滤, 于105 ℃下烘8 h后即得制备材料.
2.2 正交试验设计选择钙硅比(Ca/Si)、表面活性剂种类及其用量作为正交试验设计的3个因素, 记作A、B、C, 分别拟定各自的4个水平, 建立L16(43)的正交试验, 具体设置如表 1所示.
| 表 1 正交试验因素及水平 Table 1 Orthogonal test factors and levels |
准确称取上述正交试验制备的16组材料各5 mg于50 mL锥形瓶中, 加入20 mL浓度1000 mg·L-1的Cd2+溶液, 加入0.01 mol·L-1的NaNO3作为背景电解质溶液, 用稀HNO3和NaOH溶液调节初始溶液pH为5.2, 在25 ℃、150 r·min-1条件下恒温振荡12 h, 取上清液用0.45 μm微孔滤头过滤, 最后用原子吸收分光光度计(AA7000型, 日本岛津公司)测定滤液中Cd2+浓度, 每个处理设置3个平行, 吸附平衡时单位吸附剂所吸附溶液中的重金属量为:
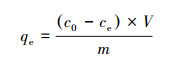
|
(1) |
式中, qe为平衡吸附量(mg·g-1);c0为初始溶液中Cd2+浓度(mg·L-1);ce为吸附平衡后溶液中Cd2+浓度(mg·L-1);V为溶液体积(mL);m为吸附剂的用量(mg).
2.4 吸附等温线准确称取5 mg最优条件下制备的材料于一系列50 mL锥形瓶中, 加入20 mL浓度分别为20、40、80、150、300、500、800、1000、1500 mg·L-1的Cd2+溶液, 加入0.01 mol·L-1的NaNO3作为背景电解质溶液, 用稀HNO3和NaOH溶液调节初始溶液pH为5.2, 在25℃、150 r·min-1下恒温振荡12 h, 取上清液于0.45 μm微孔滤头过滤, 用原子吸收分光光度计测定滤液中Cd2+浓度, 每个处理设置3个平行, 平衡时吸附量计算同公式(1).
2.5 材料的表征采用D8 advance型X-射线衍射仪(德国布鲁克AXS有限公司)分析材料的晶体结构及物项组成, 利用Nicolet 6700型傅立叶变换红外光谱仪(美国赛默尔世尔科技有限公司)研究其官能团种类, 使用Belsorp-Max型全自动比表面及孔隙分布测定仪(日本Microtrac BEL公司)分析材料表面相关参数, 利用S-4800型场发射扫描电子显微镜(日本日立株式会社)观察材料的形貌特征.
3 结果与讨论(Result and discussion) 3.1 正交试验结果 3.1.1 极差分析极差分析是正交试验结果分析中最直观、常用的分析方法, L16(43)正交试验方案极差分析结果如表 2所示.由表中的K值可知, 最优组合为A1B2C3, 最佳制备条件为:Ca/Si为1/1, 选用聚乙二醇(PEG)作为表面活性剂, 其用量为Ca(NO3)2·4H2O质量的2%.
| 表 2 正交试验方案极差分析表 Table 2 Orthogonal test scheme range analysis table |
极差R反映了因素水平波动时试验结果的变动幅度, R越大, 说明该因素水平变化时对试验结果的影响越大.从表 2中的R值可知, 各因素对制备的介孔硅酸钙吸附性能影响顺序为:表面活性剂种类>表面活性剂用量>Ca/Si.
3.1.2 方差分析为了更好地了解各因素对制备材料吸附性能影响的显著性差异, 对正交试验结果进行方差分析, 结果如表 3所示.从表中可知, 因素B对试验结果的影响高度显著, 因素A和C影响显著, 影响主次顺序为B>C>A.通过比较因素A的各水平Kij值, 可确定其最优水平为A1, 同理可得因素B、C的最优水平分别为B2、C3, 因此, 最优制备条件为A1B2C3, 即Ca/Si为1:1, PEG作为表面活性剂, 添加量为2%, 与极差分析结果一致.
| 表 3 方差分析结果 Table 3 Analysis of variance table |
最优条件下制备的介孔硅酸钙对Cd2+的吸附等温线如图 1所示.由图可知, 随着初始Cd2+浓度的增加, 介孔硅酸钙对Cd2+的吸附量也随之增加, 并逐渐趋于饱和状态, 这与绝大多数吸附剂的结果一致.对吸附曲线进行Langmuir和Freundlich等温吸附方程拟合, 由R2值可知该材料对Cd2+的吸附更符合Langmuir吸附模型, 其饱和吸附量高达687.71 mg·g-1, 与单伟等(2019)采用化学沉淀法制备的改性硅酸钙相比, 吸附容量显著提高了35.8%.这主要是由于材料制取时表面活性剂的使用与否、Ca/Si用量不同所致, 也由此可见表面活性剂的添加能显著提高材料的吸附性能.Freundlich拟合结果1/n介于0.1~0.5之间, 表明吸附容易进行.
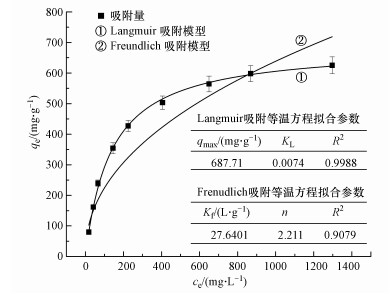 |
| 图 1 Langmuir和Freundlich吸附等温线拟合 Fig. 1 Fitting of Langmuir and Freundlich adsorption isotherms |
为了更好地评价合成材料的吸附性能、结构及形貌特征, 现从制备材料中按不同Ca/Si、不同表面活性剂及用量筛选5组材料进行BET、XRD、FTIR、SEM表征, 分别标记为CSH-1(Ca/Si=1:1, PEG, 用量2%, 最优)、CSH-2 (Ca/Si=1.35:1, GTAB, 用量4%)、CSH-3(Ca/Si=1.70:1, SDS, 用量2%)、CSH-4(Ca/Si=2:1, PVP, 用量0.5%)、CSH-5 (Ca/Si=1:1, 不加分散剂).
3.3.1 BET分析图 2为5组样品的N2吸附脱附曲线和孔径分布图.从吸附曲线图可知, 5组材料均具有低压区凸、高压区毛细凝聚、吸脱附不重合的特点, 且存在明显的H3型吸附滞后环, 属于IUPAC吸附类型的Ⅳ型(杨正红, 2017), 这是介孔材料N2吸脱附的典型特征.从孔径分布图可知, 曲线开口均较窄, 5组材料的孔径范围均在5~60 nm之间, CSH-1、CSH-2、CSH-4的孔径主要在10 nm高度密集分布, CSH-3、CSH-5的孔径分布主要集中在20 nm.
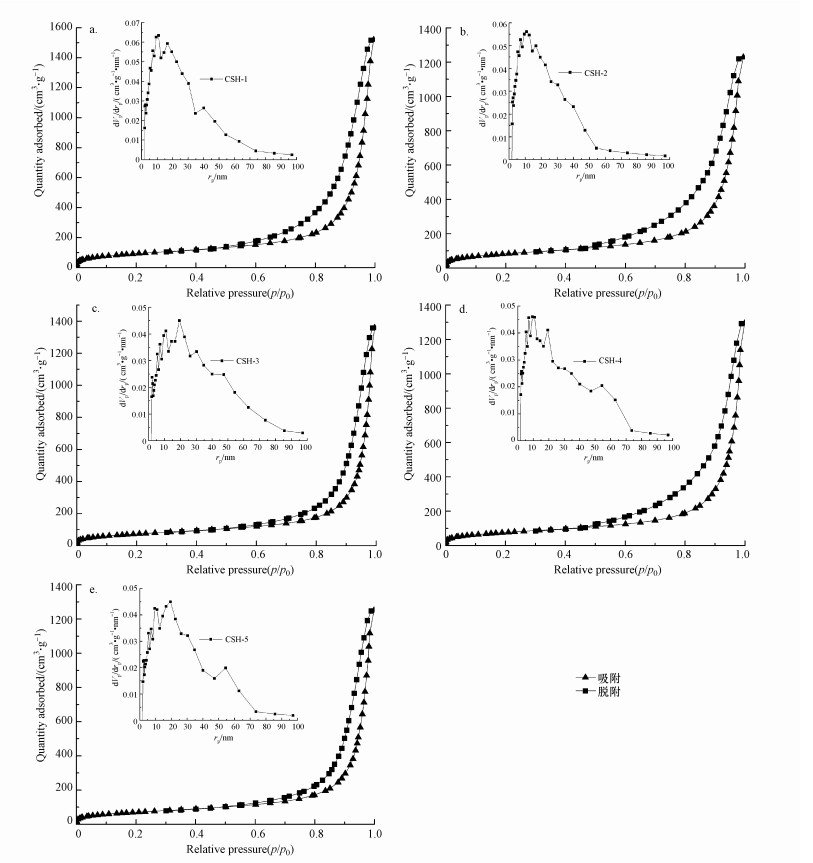 |
| 图 2 5组样品的N2吸附脱附曲线及BJH孔径分布(a~e分别对应样品CSH-1~CSH-5) Fig. 2 N2 adsorption desorption curve and BJH pore size distribution of five groups of samples |
表 4为5组样品的比表面积、BJH孔径、孔隙度参数, 可见加表面活性剂制备的材料的比表面积、BJH孔径及孔隙度都大于不加表面活性剂制备的材料, 其次, 不同表面活性剂及用量合成的介孔硅酸钙表面参数也有较大差异, 这与杨刚刚等(2016)分别采用SDS、P123(阿拉丁试剂)、CTAB、CTAB+TMAH(四甲基氢氧化胺)作为模板剂合成的多种形貌、尺寸介孔硅酸钙的结果一致.主要是由于表面活性剂的添加可以控制硅酸钙晶体的成核与生长, 利用静电效应防止颗粒间团聚, 通过表面活性剂的空间位阻效应提高颗粒分散性, 从而增大比表面积;另外, 不同类型、不同浓度的表面活性剂可以调控颗粒尺寸大小和形貌, 进而改善纳米材料的表面性能(张玲, 2018).可见表面活性剂类型及用量对合成介孔硅酸钙的形貌特征影响很大, 最优条件下制备的介孔硅酸钙比表面积大(333.47 m2·g-1)、BJH孔径小(10.9 nm)、孔隙度高(2.199 cm3·g-1), 具有相对较优的材料性能, 其对Cd2+的饱和吸附量高达687.71 mg·g-1, 与Zhao等(2014)采用纳米自组装技术形成的壳聚糖涂覆于硅酸钙表面的介孔微球比表面积(356 m2·g-1)、BJH孔径(12 nm)相近, 该材料对Cd2+的吸附容量达578 mg·g-1.Liu等(2017)采用硫醇(—SH)功能化合成的改性硅酸钙的比表面积为129.32 m2·g-1, BJH孔径为17 nm, 对Cd2+的吸附容量达601.51 mg·g-1, 刘立华等(2017)通过共沉淀法合成的改性硅酸钙比表面积为250.12 m2·g-1, 对Pb2+的饱和吸附量达613.42 mg·g-1, 均因其较大的比表面积而具有较高的表面能, 以及材料表面含有大量能与Cd2+、Pb2+配位的活性基团, 致使改性材料对Cd2+、Pb2+具有很高的吸附作用, 本研究结果与之一致.另一方面, 材料优异的吸附性能还可能归因于CSH材料中Ca2+的释放, Ca2+与Cd2+发生离子交换反应, 降低了其浓度, 从而大大提高了材料对Cd2+的吸附作用.Shao等(2018)认为从钢渣中制备的绿色、廉价的分层结构CSH材料对Cu2+、Pb2+、Zn2+具有上述吸附作用机理.显然, 最优条件下合成的介孔硅酸钙材料与目前文献报道中最优异的同类型材料相较, 吸附能力相当;相比之下, 本研究制备的介孔硅酸钙原料简单、经济可行, 无需复杂的工艺及设备, 更具有工业化生产的潜力.
| 表 4 5组材料的BET测试参数 Table 4 Comparison of BET test parameters of five groups of materials |
图 3为5组样品的X-射线衍射图, 表 5为5组样品XRD出峰位置及峰强.从图 5a中可以看出, 5组材料均在2θ=29.28°、32.07°、49.88°处出现了较强的衍射峰, 峰形基本相似, 无特殊差异, 特征峰尖锐, 杂峰甚少, 说明合成物质较纯.通过比较5组材料出峰位置及峰强可发现, 4组加表面活性剂制备材料(CSH-1~CSH-4)的三大主峰峰强均比不加分散剂制备材料(CSH-5)的峰强有所增加, 其中以最优条件制备的材料(CSH-1)峰强增加最多.这是因为分散剂的添加使得颗粒间的团聚减少, 有利于介孔硅酸钙结晶, 致使合成材料内部晶胞排列方式有序增加, 离子间的无序缩合几率减少, 这与张玲(2018)采用沉淀法以十二烷基苯磺酸钠(SDBS)为表面活性剂合成的水化硅酸钙的结果相符.经检索发现, 最优条件下制备材料的XRD图谱与JCPDS卡片中No.33-0306衍射峰型基本吻合(图 3b), 物项为Ca1.5SiO3.5·xH2O, 表明合成的样品为水化硅酸钙, 这与Zhang等(2010)报道的水化硅酸钙的XRD特征峰也一致, 说明合成材料为水化硅酸钙.
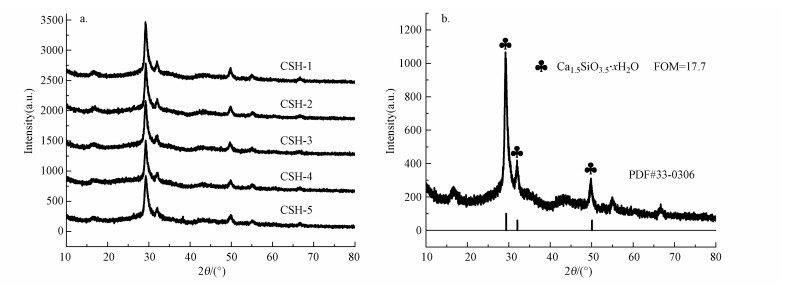 |
| 图 3 5组样品的XRD图谱 Fig. 3 XRD pattern of five groups of samples |
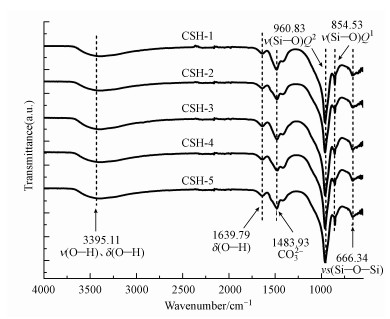 |
| 图 4 5组样品的红外光谱图 Fig. 4 The FTIR spectrum of five groups of samples |
 |
| 图 5 5组样品的扫描电镜图(a~e分别代表样品CSH-1~CSH-5) Fig. 5 Scanning electron micrograph of samples |
| 表 5 5组样品的XRD出峰位置及峰强度比较 Table 5 Comparison of XRD peak position and peak intensity of five groups of samples |
图 4为5组样品的红外光谱图, 图中波数位于3395.11 cm-1处的振动峰归属于δ(O—H)弯曲振动、ν(O—H)伸缩振动共同作用的结果, 1639.79 cm-1处的振动峰为结合水中ν(O—H)伸缩振动, 与Zhang等(2018)通过超声辅助溶胶-凝胶反应制备的CSH具有相似的特征峰, 说明样品表面含有丰富的—OH活性基团, 能与Cd2+发生表面络合形成沉淀, 因而大大提高了对Cd2+的吸附作用;1483.93 cm-1处的振动峰则是CO32-的非对称伸缩振动峰, 此峰的出现可能是由于制备过程是在敞口的三口烧瓶中进行, 反应液中的Ca2+吸收了空气中的CO2造成的;波数在960.83、854.53、666.34 cm-1附近出现的峰均为硅氧四面体结构峰值, 具体分别对应ν(Si—O)Q2伸缩振动、ν(Si—O)Q1伸缩振动和νs(Si—O—Si)对称伸缩振动.Zak等(2015)采用Ca(NO3)2·4H2O、Na2Si3O7溶胶-凝胶法合成的水化硅酸钙在波数为974、875、665 cm-1处出现了相同的特征峰, 本研究结果与之一致.
3.3.4 SEM分析图 5为5组样品的扫描电镜图.可见, 不加表面活性剂的合成样品(CSH-5), 表面相对蓬松但粗糙, 结构形貌由不规则的层状颗粒堆积而成(图 5e);加入2%SDS(CSH-3, 图 5c)、0.5% PVP(CSH-4, 图 5d)制备的样品, 颗粒表面相对密实, 局部小区颗粒间无明显团聚现象, 这主要是由于表面活性剂用量较少, 致使颗粒间分散不均匀, 显现出相对密集现象;添加4%GTAB制备的样品(CSH-2, 图 5b), 具有较多细小孔道, 疏松丰富, 具有相对较大的比表面积(301.4 m2·g-1)和孔隙度(1.8109 cm3·g-1), 这与王易峰等(2017)采用十六烷基三甲基溴化铵作为模板剂、借助超声辅助、通过模板法合成的介孔硅酸钙的SEM结果相似, 其比表面积为244.32 m2·g-1, 两者差异主要是由于制备方法不同所致;图 5a为最优条件下制备的介孔硅酸钙(CSH-1), 可见材料表面蓬松, 呈纳米花状, 晶形生长较好, 由许多薄片均匀密集、不规则排列形成狭缝孔结构, 正是由于这些特殊孔道及结构以致其具有大比表面积、高孔隙度等特点, 这也很好地诠释了BET测试结果(Zhao et al., 2017).Yazdankhah等(2010)分别采用氯化十六烷吡啶(CPC)、Triton X-100 (TX)、SDS作为表面活性剂制备纳米介孔炭, 并与不加表面活性剂制备的样品进行Cd2+吸附性能比较, 结果发现, 不同表面活性剂对制备的介孔炭性能影响很大, 对Cd2+的去除率分别达94.5%、88.4%、84%和68%, 主要机理解释为表面活性剂在介孔炭表面产生静电效应, 致使表面产生更多的吸附活性位点.Jiang等(2016)使用聚乙烯吡咯烷酮(PVP)作为表面活性剂, 设计不同添加量, 采用水热法制备了多种形貌、尺寸的二氧化铈(CeO2)空心纳米球, 发现其对Cr6+具有优异的吸附性能, 相较于原始CeO2对Cr6+的去除率显著提高了30.5%, 造成形貌尺寸差异可能的原因为PVP的存在影响了材料界面能, 从而控制了纳米球的成核与生长, 这与本研究结果相似.可见不同类型、不同用量的表面活性剂对合成水化硅酸钙的形貌结构影响很大, 致使材料吸附性能千差万别.
通过本文对制备材料的表征, 以及结合文献中诸多学者对CSH的研究, 推测其对水溶液中Cd2+的吸附机理主要包括吸附沉淀、表面络合和离子交换, 巨大的比表面积、高孔隙度、表面特殊孔结构为介孔硅酸钙材料对Cd2+的物理吸附创造了可能, Wu等(2013)制备的超薄硅酸钙纳米片具有上述同样的机理.表面丰富的—OH活性基团与Cd2+发生表面络合, 巨大比表面积致使材料表面产生更多的吸附位点及材料本身富含可交换态Ca2+与Cd2+发生离子交换, 均为材料对Cd2+的化学吸附创造了良好的条件.可见CSH对Cd2+的吸附是物理吸附、化学吸附共同存在的过程, 从而使得最优条件下制备的介孔硅酸钙吸附性能优越.
4 结论(Conclusions)1) 正交试验结果表明, 各因素对介孔硅酸钙吸附重金属Cd2+性能影响由大到小的顺序为:表面活性剂种类>表面活性剂用量>Ca/Si;表面活性剂种类对试验结果的影响高度显著, Ca/Si和表面活性剂用量影响显著, 最佳制备条件为:Ca/Si为1/1, 选用PEG作为表面活性剂, 其用量为Ca(NO3)2·4H2O质量的2%.
2) 吸附等温线实验表明, 合成材料对Cd2+的吸附曲线更符合Langmuir吸附模型, 表面活性剂的添加能显著提高材料的吸附性能, 其饱和吸附量高达687.71 mg·g-1.
3) BET测试表明, 最优条件下制备的材料比表面积最大、孔隙度最高, 分别达333.47 m2·g-1和2.199 cm3·g-1;XRD图谱与JCPDS卡片中No.33-0306衍射峰型基本吻合, 说明合成物质较纯, 为带有结晶水的水化硅酸钙(Ca1.5SiO3.5·xH2O);FTIR图谱表明, 合成的硅酸钙富含许多活性集团, 致使其对Cd2+具有很好的吸附作用;SEM图显示最优材料表面疏松, 呈纳米花状, 晶形生长较好, 具有由许多薄片均匀密集、不规则排列形成特殊的微孔结构.
4) 最优条件下制备的介孔硅酸钙凭借其巨大的比表面积和高孔隙度、表面丰富的活性—OH及材料富含可交换态Ca2+, 能与Cd2+发生吸附沉淀、表面络合和离子交换, 使其具有优异的吸附性能.
Ahluwalia S S, Goyal D. 2005. Removal of heavy metals by waste tea leaves from aqueous solution[J]. Engineering in Life Sciences, 5(2): 158-162. DOI:10.1002/elsc.200420066 |
Ali I, Peng C S, Lin D C, et al. 2019. Encapsulated green magnetic nanoparticles for the removal of toxic Pb2+ and Cd2+ from water:Development, characterization and application[J]. Journal of Environmental Management, 234: 273-289. |
Baciu D, Simitzis J. 2007. Synthesis and characterization of a calcium silicate bioactive glass[J]. Journal of Optoelectronics & Advanced, 11(9): 3320-3324. |
Bai S X, Chu M, Zhou L M, et al. 2019. Modified oil shale ash and oil shale ash zeolite for the removal of Cd2+ ion from aqueous solutions[J]. Environmental Technology, 40(11): 1485-1493. DOI:10.1080/09593330.2018.1537311 |
Bolan N, Kunhikrishnan A, Thangarajan R, et al. 2014. Remediation of heavy metal(loid)s contaminated soils-To mobilize or to immobilize[J]. Journal of Hazardous Materials, 266: 141-166. DOI:10.1016/j.jhazmat.2013.12.018 |
Cai L M, Cui L H, Lin B J, et al. 2018. Advanced treatment of piggery tail water by dual coagulation with Na+ zeolite and Mg/Fe chloride and resource utilization of the coagulation sludge for efficient decontamination of Cd2+[J]. Journal of Cleaner Production, 202: 759-769. DOI:10.1016/j.jclepro.2018.08.192 |
Chen L Y, Wu P X, Chen M Q, et al. 2018. Preparation and characterization of the eco-friendly chitosan/vermiculite biocomposite with excellent removal capacity for cadmium and lead[J]. Applied Clay Science, 159: 74-82. DOI:10.1016/j.clay.2017.12.050 |
Fu F, Wang Q. 2011. Removal of heavy metal ions from wastewaters:A review[J]. Journal of Environmental Management, 92(3): 407-418. DOI:10.1016/j.jenvman.2010.11.011 |
Javaheri F, Kheshti Z, Ghasemi S, et al. 2019. Enhancement of Cd2+ removal from aqueous solution by multifunctional mesoporous silica:Equilibrium isotherms and kinetics study[J]. Separation and Purification Technology, 224: 199-208. DOI:10.1016/j.seppur.2019.05.017 |
Jiang X L, Xu X, Yu L, et al. 2016. Synthesis of mono-dispersed ceria hollow nanospheres by a hydrothermal method[J]. Micro & Nano Letters, 11(3): 137-141. |
Khalid S, Shahid M, Niazi N K, et al. 2017. A comparison of technologies for remediation of heavy metal contaminated soils[J]. Journal of Geochemical Exploration, 182: 247-268. DOI:10.1016/j.gexplo.2016.11.021 |
Khan M A, Khan S, Khan A, et al. 2017. Soil contamination with cadmium, consequences and remediation using organic amendments[J]. Science of the Total Environment, 601-602: 1591-1605. DOI:10.1016/j.scitotenv.2017.06.030 |
Li B, Yang L, Wang C Q, et al. 2017. Adsorption of Cd(Ⅱ) from aqueous solutions by rape straw biochar derived from different modification processes[J]. Chemosphere, 175: 332-340. DOI:10.1016/j.chemosphere.2017.02.061 |
Li F, Tang Y X, Li C C, et al. 2019. Adsorption and sequestration of cadmium ions by polyptychial mesoporous biochar derived from Bacillus sp.biomass[J]. Environmental Science and Pollution Research, 26(23): 23505-23523. DOI:10.1007/s11356-019-05610-3 |
Lian M H, Wang J, Sun L N, et al. 2019. Profiles and potential health risks of heavy metals in soil and crops from the watershed of Xi River in Northeast China[J]. Ecotoxicology and Environmental Safety, 169: 442-448. DOI:10.1016/j.ecoenv.2018.11.046 |
Liu L H, Li T, Yang G G, et al. 2017. Synthesis of thiol-functionalized mesoporous calcium silicate and its adsorption characteristics for heavy metal ions[J]. Journal of Environmental Chemical Engineering, 5(6): 6201-6215. DOI:10.1016/j.jece.2017.11.046 |
刘立华, 李童, 杨刚刚, 等. 2017. 介孔硅酸钙的合成及其对Pb(Ⅱ)的吸附性能[J]. 湖南科技大学学报(自然科学版), 32(3): 96-102. |
Lin K L, Chang J, Lu J X. 2006. Synthesis of wollastonite nanowires via hydrothermal microemulsion methods[J]. Materials Letters, 60(24): 3007-3010. DOI:10.1016/j.matlet.2006.02.034 |
Luo M K, Lin H, He Y H, et al. 2019. Efficient simultaneous removal of cadmium and arsenic in aqueous solution by titanium-modified ultrasonic biochar[J]. Bioresource Technology, 284: 333-339. DOI:10.1016/j.biortech.2019.03.108 |
Mahar A, Wang P, Li R H, et al. 2015. Immobilization of lead and cadmium in contaminated soil using amendments:A review[J]. Pedosphere, 25(4): 555-568. DOI:10.1016/S1002-0160(15)30036-9 |
Mahmoud M E, Nabil G M, Mahmoud S M E. 2015. High performance nano-zirconium silicate adsorbent for efficient removal of copper(Ⅱ), cadmium(Ⅱ) and lead(Ⅱ)[J]. Journal of Environmental Chemical Engineering, 3(2): 1320-1328. DOI:10.1016/j.jece.2014.11.027 |
Phattharachindanuwong C, Hansupalak N, Plank J, et al. 2018. Template-assisted facile synthesis and characterization of hollow calcium silicate hydrate particles for use as reflective materials[J]. Materials Research Bulletin, 97: 343-350. DOI:10.1016/j.materresbull.2017.09.027 |
Shao N N, Tang S Q, Liu Z, et al. 2018. Hierarchically structured calcium silicate hydrate-based nanocomposites derived from steel slag for highly efficient heavy metal removal from wastewater[J]. ACSSustainable Chemistry & Engineering, 6(11): 14926-14935. |
单伟, 郁红艳, 邹路易, 等. 2019. 改性硅酸钙对Cd2+的吸附性能及其对Cd污染土壤的修复潜力[J]. 环境工程学报, 13(4): 918-926. |
Tofighy M A, Mohammadi T. 2011. Adsorption of divalent heavy metal ions from water using carbon nanotube sheets[J]. Journal of Hazardous Materials, 185(1): 140-147. DOI:10.1016/j.jhazmat.2010.09.008 |
Vila M, Sánchez-Salcedo S, Cicuéndez M, et al. 2011. Novel biopolymer-coated hydroxyapatite foams for removing heavy-metals from polluted water[J]. Journal of Hazardous Materials. |
Wei H, Shen Q, Zhao Y, et al. 2005. On the crystallization of calcium carbonate modulated by anionic surfactants[J]. Journal of Crystal Growth, 279(3/4): 439-446. |
Wu J, Zhu Y J, Chen F. 2013. Ultrathin calcium silicate hydrate nanosheets with large specific surface areas:Synthesis, Crystallization, layered self-assembly and applications as excellent adsorbents for drug, protein, and metal ions[J]. Small, 9(17): 2911-2925. DOI:10.1002/smll.201300097 |
王易峰.2017.介孔硅酸钙及其与氧化石墨烯、纳米零价铁复合材料的制备及吸附性能研究[D].湘潭: 湖南科技大学 http://cdmd.cnki.com.cn/Article/CDMD-10534-1017852902.htm
|
汪辰, 毕磊, 潘纲. 2020. 硫化锰纳米颗粒高效去除重金属镉[J]. 环境工程学报, 14(1): 24-33. |
Xiong T, Yuan X Z, Chen X H, et al. 2018. Insight into highly efficient removal of cadmium and methylene blue by eco-friendly magnesium silicate-hydrothermal carbon composite[J]. Applied Surface Science, 427: 1107-1117. DOI:10.1016/j.apsusc.2017.08.115 |
徐文, 武小雷. 2018. 钙硅比对水热合成水化硅酸钙实验的影响研究[J]. 硅酸盐通报, 37(4): 1294-1298. |
杨刚刚.2016.介孔硅酸钙的合成、改性及其对重金属离子的吸附性能[D].湘潭: 湖南科技大学 http://cdmd.cnki.com.cn/Article/CDMD-10534-1016792440.htm
|
杨正红. 2017. 物理吸附100问[M]. 北京: 化学工业出版社.
|
Yazdankhah A, Moradi S E, Amirmahmoodi S, et al. 2010. Enhanced sorption of cadmium ion on highly ordered nanoporous carbon by using different surfactant modification[J]. Microporous and Mesoporous Materials, 133(1/3): 45-53. |
Yuan C Z, Yang Y, Pei L Z, et al. 2011. Hydrothermal deposition and characterizations of calcium silicate nanosheets[J]. Micro & nanosystems, 2(3): 161-165. |
Zak R, Deja J. 2015. Spectroscopy study of Zn2+, Cd2+, Pb2+ and Cr6+ ions immobilization on C-S-H phase[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 134: 614-620. DOI:10.1016/j.saa.2014.06.069 |
张玲.2018.十二烷基苯磺酸钠对水合硅酸钙结构及形貌的影响[D].长春: 吉林大学 http://cdmd.cnki.com.cn/Article/CDMD-10183-1018218079.htm
|
Zhang L, Zhao C M, Jiang Y L, et al. 2018. Effect of sodium dodecyl benzene sulfonate on morphology and structure of calcium silicate hydrate prepared via precipitation method[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 540: 249-255. DOI:10.1016/j.colsurfa.2018.01.014 |
Zhang M L, Chang J. 2010. Surfactant-assisted sonochemical synthesis of hollow calcium silicate hydrate (CSH) microspheres for drug delivery[J]. Ultrasonics Sonochemistry, 17(5): 789-792. DOI:10.1016/j.ultsonch.2010.01.012 |
Zhang Z H, Wang X J, Wang H, et al. 2018. Removal of Pb(Ⅱ) from aqueous solution using hydroxyapatite/calcium silicate hydrate (HAP/C-S-H) composite adsorbent prepared by a phosphate recovery process[J]. Chemical Engineering Journal, 344: 53-61. DOI:10.1016/j.cej.2018.03.066 |
Zhao J, Zhu Y J, Wu J, et al. 2014. Chitosan-coated mesoporous microspheres of calcium silicate hydrate:Environmentally friendly synthesis and application as a highly efficient adsorbent for heavy metal ions[J]. Journal of Colloid and Interface Science, 418: 208-215. DOI:10.1016/j.jcis.2013.12.016 |
Zhao Y, Chen H, Yan Q. 2017. Enhanced phosphate removal during the simultaneous adsorption of phosphate and Ni2+ from electroless nickel wastewater by calcium silicate hydrate (CSH)[J]. Environmental Technology &Innovation, 8: 141-149. |
 2020, Vol. 40
2020, Vol. 40



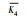
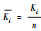 (n为水平数);Rj=max(
(n为水平数);Rj=max(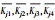 )-min (
)-min (