地聚合物(GP)是由含硅铝酸盐的偏高岭土或固体废料(如粉煤灰)经碱性激活制备的立体网状结构无机聚合物, 由Al—O和Si—O四面体结构单元组成, 有着丰富的介孔隙(Morsy et al., 2014).四面体结构包裹的Na+或K+可与外界阳离子进行离子交换, 以此有效吸附大部分金属阳离子(Naghsh et al., 2017).尽管地聚合物在重金属吸附领域的应用已有诸多研究, 但都几乎无法吸附如Cr(Ⅵ)之类以阴离子形态存在的重金属(Liu et al., 2016;Lee et al., 2017 Maleki et al., 2019).以表面活性剂对高岭土进行有机改性, 借由表面的有机官能团与阴离子发生静电吸附, 进而去除阴离子形态重金属是一种思路, 但缺点在于对阳离子的吸附性能并不理想.在电镀等表面处理行业产生的废水中往往不止一种重金属, 且有的以阴离子形态存在, 如Cr(Ⅵ).不论是地聚合物还是有机改性高岭土都无法同时有效吸附阴、阳离子, 难以同时达到理想的吸附效果(Lee et al., 2002;Li et al., 2007).
十六烷基三甲基溴化铵(Cetyltrimethylammonium bromide, 简称CTAB)和十二烷基硫酸钠(简称K12)等表面活性剂被引入到地聚合物的制备体系中, 作为发泡剂增大样品的比表面积, 通常并未考虑其他的改性作用(Singhal et al., 2017;Tang et al., 2018).同时, 大部分关于重金属吸附的研究仅限于一元吸附, 对二元吸附, 尤其是阴、阳离子同时吸附的研究甚少.本研究通过在地聚合物的制备过程中加入定量CTAB, 使偏高岭土同时进行碱性激活和有机改性, 在不改变地聚合物四面体主体结构的条件下使其表面携带季铵盐阳离子, 以期获得同时吸附以阴、阳离子形态存在的重金属的效果.
2 材料与方法(Materials and methods) 2.1 材料与制备本研究所用偏高岭土由高岭土(上海阿拉丁公司)在马弗炉中以800 ℃煅烧2 h获得, 其化学成分(质量百分比)为:48.65% Al2O3、46.95% SiO2、0.51% CaO、0.47% Fe2O3、1.19%其他成分及2.23%烧失量.试验所用NaOH、NaAlO2、Na2SiO3·5H2O和CTAB试剂均由阿拉丁公司出品, 纯度等级均为分析纯.
地聚合物的制备方法基于Ding等(2019)的研究.首先将NaOH、NaAlO2、Na2SiO3·5H2O以1:1.3:2.8的物质的量比配制碱性激活剂, 再以偏高岭土:碱性激活剂=1.5 g:50 mL的投料比混合, 于30 ℃、180 r·min-1条件下振荡24 h.所得产物加水搅拌, 静置沉淀后弃去液体留下沉淀, 重复步骤直到上清液呈中性.将沉淀加少许水后在6000 r·min-1条件下离心5 min, 收集沉淀, 置于65 ℃烘箱中烘干, 再进行研磨和过筛(≤110目), 制备出的地聚合物(以下简称GP)在干燥器保存备用.
同时制备经过有机改性的地聚合物, 以偏高岭土:碱性激活剂:CTAB=1.5 g:50 mL:0.5 g的比例混合, 其余步骤保持不变.制备出的地聚合物(以下简称CTAB-GP)在干燥器保存备用.
2.2 吸附实验以单因素实验考察pH、吸附剂投加量对Cu(Ⅱ)/Cr(Ⅵ)一元或二元混合体系吸附效果的影响.配制Cu(Ⅱ)、Cr(Ⅵ)浓度分别为50 mg·L-1的一元和二元重金属溶液, 试剂分别为CuSO4·5H2O、K2Cr2O7.用稀NaOH或HCl调节溶液pH范围为2~7并保持吸附剂投加量(0.4 g·L-1)、振荡时间(4 h)和温度(30 ℃)恒定, 以考察pH的影响, 为排除调节较高pH时Cu(Ⅱ)产生沉淀对实验结果的影响, 以调节pH后溶液的金属浓度作为初始浓度.pH调节至5, 分别添加0~10 g·L-1的吸附剂并在恒定30 ℃下振荡24 h, 以考察吸附剂投加量的影响.用0.45 μm滤膜过滤后, 使用原子吸收分光光度计测定溶液中Cu(Ⅱ)和Cr(Ⅵ)的浓度.每个样品均设3个平行样, 实验数据取其平均值.吸附量Qe和去除率R的计算公式如下所示:

|
(1) |
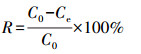
|
(2) |
式中, Qe为地聚合物对溶液中重金属离子的吸附量(mg·g-1);C0为溶液中重金属离子的初始浓度(mg·L-1);Ce为吸附后溶液中重金属离子的浓度(mg·L-1);V为重金属溶液的体积(L);m为地聚合物的质量(g).
2.3 吸附动力学研究用一级动力学模型和二级动力学模型对时间影响因素的实验数据进行拟合, 以进一步分析地聚合物吸附金属离子的过程, 一级动力学模型和二级动力学模型方程式分别如式(3)和(4)所示.
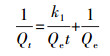
|
(3) |

|
(4) |
式中, Qe为平衡吸附量(mg·g-1);Qt为t时刻吸附量(mg·g-1);k1为准一级吸附速率常数(min-1);k2为准二级吸附速率常数(g·mg-1·min-1), t为吸附时间(min).
2.4 吸附等温模型Langmuir型和Freundlich型吸附等温线是地聚合物吸附重金属研究中最常见的两种模型, 可以反映吸附机制、吸附层结构和吸附剂的宏观表面结构.
Langmuir吸附等温线的形式如下所示:

|
(5) |
Langmuir方程的本质特征可用分离系数RL表示:

|
(6) |
Freundlich模型是经验公式, 用于非理想条件下的表面吸附和多分子层吸附过程.其等温方程可表示为:
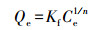
|
(7) |
式中, Qe为吸附平衡时的吸附量(mg·g-1);Ce为吸附平衡时金属离子浓度(mg·L-1);Qm为最大吸附量(mg·g-1);b为Langmuir平衡常数(L·mg-1);C0为初始金属离子浓度(mg·L-1);Kf为与吸附剂吸附容量有关的常数(g·L-1);n为吸附强度特征常数, n值越大表明吸附剂与金属离子间的相互作用越大.
2.5 表征分析地聚合物的表面结构决定着其对金属离子的吸附性能, 通过对比偏高岭土与地聚合物的表面形态和结构, 可以为地聚合物吸附金属离子提供理论指导.本研究通过以下表征方法对地聚合物和偏高岭土的结构进行对比研究.
2.5.1 X射线衍射(XRD)采用德国布鲁克(Bruker)公司的XRD-7000型号分析仪分别对偏高岭土及地聚合物进行分析, 设定参数为:2θ扫描区间为10°~70°, 步长为0.5°·min-1, 工作电压为40 kV.
2.5.2 红外光谱(FT-IR)地聚合物官能团采用傅里叶变换红外光谱仪(Nicolet380)进行表征.利用KBr压片法对样品进行处理, 扫描范围为500~4000 cm-1.
2.5.3 比表面积及孔径分析仪(BET)地聚合物的比表面积和孔径用美国麦克仪器(Micromeritics)公司的ASAP2020测定仪进行分析.测试条件为:采用N2吸附法, 373.15 K下脱附6 h.
3 结果与讨论(Results and discussion) 3.1 pH对地聚合物吸附铜、铬的影响图 1为pH对地聚合物吸附效果的影响趋势图.总体上看, 对Cu(Ⅱ)的吸附量为GP>CTAB-GP, 对Cr(Ⅵ)的吸附量为CTAB-GP>GP.对于Cu(Ⅱ)来说, 当pH为2时, GP和CTAB-GP对其吸附效果均较差, 因pH较低时, 溶液中的H+与Cu(Ⅱ)发生竞争吸附, 阻碍了Cu(Ⅱ)的吸附过程.随着pH的增加, H+浓度降低, 竞争变弱, 两种地聚合物对Cu(Ⅱ)的吸附量逐渐增大, 在pH=4~5范围内为最高且相差不大.随着pH>5, 溶液中部分Cu(Ⅱ)因调节pH导致Cu(Ⅱ)初始浓度降低, 以致吸附量逐渐降低.对于Cr(Ⅵ)来说, GP的吸附量极低.当溶液呈较强酸性时(pH < 3), Cr(Ⅵ)主要以呈电中性的H2CrO4形式存在, 不利于吸附, 故CTAB-GP的吸附量较低.当pH为3~5时, Cr(Ⅵ)主要以HCrO4-和少量Cr2O72-的形式存在, HCrO4-带一个负电荷, 当与吸附剂相互作用时, HCrO4-占据的吸附位点和需要的吸附自由能均最少, 容易与CTAB-GP中的季铵盐阳离子(CTA+)发生结合, 故在此pH范围内(4~5)CTAB-GP对Cr(Ⅵ)的吸附量达到最大值.当pH>5, HCrO4-随着pH的增加而迅速转化为负二价离子CrO42-, 同时, OH-也会使已经被吸附的HCrO4-解除与CTA+的结合并转变成带两个负电荷的CrO42-, 占据的吸附位点和需要的吸附自由能比HCrO4-要多, 吸附量因此降低(Cai et al., 2018;Xu et al., 2019).
 |
| 图 1 pH对GP(a)和CTAB-GP(b)吸附铜、铬的影响 Fig. 1 Effect of pH on adsorption of Cu(Ⅱ) and Cr(Ⅵ) by GP(a) and CTAB-GP(b) |
在实验范围内, CTAB-GP对Cu(Ⅱ)和Cr(Ⅵ)的平衡吸附量分别为57.7 mg·g-1和13.8 mg·g-1, 且在对Cu(Ⅱ)吸附量与GP相差无几的情况下, CTAB-GP体现出对Cr(Ⅵ)较好的吸附性能.后续的实验选取pH为5进行吸附.
3.2 投加量对吸附铜、铬的影响图 2为投加量对地聚合物吸附效果的影响趋势图.可以看出, 随着吸附剂投加量的增加, 两种地聚合物对Cu(Ⅱ)的去除率呈急速上升的趋势, 到1 g·L-1时几乎完全吸附.平衡吸附量则因地聚合物所提供吸附活性位点出现过量情况而呈现出下降趋势.对Cr(Ⅵ)的吸附除吸附量与Cu(Ⅱ)一样逐渐降低外, 去除率则呈现出了不同的趋势:CTAB-GP对Cr(Ⅵ)的去除率先是升高到25.6%(投加量1 g·L-1), 随后降低, 稳定在14%左右.通过对比CTAB-GP在一元/二元体系中的吸附效果可以发现:CTAB-GP在二元体系达到Cu(Ⅱ)完全吸附的投加量比一元体系(0.6 g·L-1)高, Cu(Ⅱ)吸附量也比一元体系低;不论是在一元体系还是二元体系, Cr(Ⅵ)和Cu(Ⅱ)达到最高去除率时吸附剂的投加量接近或相同;CTAB-GP在二元体系中对Cr(Ⅵ)的去除率和吸附量均比一元体系有所提高.
 |
| 图 2 投加量对GP(a)、CTAB-GP(b)混合吸附铜、铬和CTAB-GP(c)单独吸附铜、铬的影响 Fig. 2 Effect of dosage on adsorption of Cu(Ⅱ)/Cr(Ⅵ) binary system by GP(a), CTAB-GP(b) and single system by CTAB-GP(c) |
由上可知, 在Cu(Ⅱ)/Cr(Ⅵ)二元体系中, CTAB-GP对Cu(Ⅱ)的吸附受到抑制的同时, Cr(Ⅵ)的吸附则受到促进.吸附后的地聚合物在一定浓度的Na+或K+溶液中会再次发生离子交换, 原先吸附的离子会发生解吸(Naghsh et al., 2017).对于Cu(Ⅱ), 因为二元体系内存在一元体系中没有的K+, 会将已被地聚合物吸附的部分Cu(Ⅱ)交换出来, 相当于发生了解吸.由于Cr(Ⅵ)的吸附速度比Cu(Ⅱ)快, Cr(Ⅵ)在吸附位点附近聚集时, 会吸引溶液中的Cu(Ⅱ)以保持电中性并形成局部的静电屏蔽, 数量更多的待吸附的Cu(Ⅱ)聚集在已吸附的Cr(Ⅵ)周围, 静电屏蔽效应加强, 有利于Cr(Ⅵ)到达其他吸附位点(Zhu et al., 2016), 即材料表面聚集起来待被吸附的Cu(Ⅱ)促进了Cr(Ⅵ)的吸附.该推测有待进一步深入研究.
由此可继续对Cr(Ⅵ)去除率先升后降这一现象进行推测:①因Cu(Ⅱ)被完全吸附, 溶液中已无Cu(Ⅱ)对吸附Cr(Ⅵ)起到促进作用;②二元体系内存在着Cr(Ⅵ)一元体系中没有的SO42-, 随着溶液中Cr(Ⅵ)浓度的降低, SO42-对未被吸附的Cr(Ⅵ)干扰作用也更强;③随着吸附剂投加量不断升高, 即使试验操作前经多次清洗, 吸附期间仍会使溶液的pH渐渐增加0.15~3.00左右(Luukkonen et al., 2016).本研究也发现了这一现象, 表 1为吸附前后的pH变化结果.由3.1节可知, pH>6时, 对Cr(Ⅵ)的吸附并不利.综合以上3点, CTAB-GP对Cr(Ⅵ)的吸附效果下降, 从而影响到去除率, 出现了先升后降的趋势.
| 表 1 投加地聚合物对溶液pH的影响 Table 1 Effect of geopolymers addition on the pH of the solution |
采用一级动力学模型和二级动力学模型对CTAB-GP同时吸附Cu(Ⅱ)/Cr(Ⅵ)二元体系进行拟合, 表 2为两种模型的拟合结果.可以看出, CTAB-GP对Cu(Ⅱ)/Cr(Ⅵ)二元体系的吸附过程符合准二级动力学规律, R2达到0.99以上, 得出的平衡吸附量也更接近于实验值, 这与其他地聚合物吸附重金属的研究结果相一致(Ge et al., 2015).准二级动力学模型认为化学反应是控速步骤, 可用于多种吸附研究(Fayazi, 2015), 表明CTAB-GP对Cu(Ⅱ)/Cr(Ⅵ)二元体系的吸附过程主要以化学吸附为主.二级动力学模型中的k2是动力学中的重要参数, 可以反映吸附速率的快慢, k2越大则吸附速率越快.由表 2中可看出, CTAB-GP吸附Cr(Ⅵ)的k2值高于Cu(Ⅱ), 说明在二元体系中地聚合物对Cr(Ⅵ)的吸附速率更快, 这也与3.2节中的推测相吻合.
| 表 2 CTAB-GP吸附铜、铬离子的准一级动力学和准二级动力学拟合参数 Table 2 Calculated kinetic parameters for adsorption of Cu(Ⅱ) and Cr(Ⅵ) by the geopolymer |
因Cu(Ⅱ)/Cr(Ⅵ)二元体系存在3.2节中提到的吸附现象, 随着溶液浓度的升高这种现象也愈加明显, 以至于Langmuir模型、Freundlich模型或其他吸附等温模型拟合效果均极差.因此, 本文采用Langmuir模型和Freundlich模型对CTAB-GP吸附Cu(Ⅱ)/Cr(Ⅵ)一元体系进行拟合, 各模型拟合系数见表 3.
| 表 3 Cu(Ⅱ)和Cr(Ⅵ)离子吸附等温线模型相关参数 Table 3 Isotherm model constants and correlation for adsorption of Cu(Ⅱ) and Cr(Ⅵ) ions from aqueous solution |
拟合结果显示, CTAB-GP吸附Cu(Ⅱ)/Cr(Ⅵ)一元体系的Langmuir和Freundlich等温线拟合效果均较好, R2在0.99以上, Langmuir等温线的拟合效果相对于Freundlich等温线较好.Cu(Ⅱ)和Cr(Ⅵ)的最大吸附量分别为147.1 mg·g-1和61.3 mg·g-1.基于Langmuir等温线拟合结果, 表明CTAB-GP对Cu(Ⅱ)和Cr(Ⅵ)的吸附符合Langmuir等温式单层吸附的假设, 这可能是由于吸附分子之间的相互作用均匀且可忽略不计.当Langmuir等温线中的RL值在0~1之间, 或Freundlich等温线中的n值大于1时, 说明吸附过程为优惠吸附(Singhal et al., 2017).通过比较表 3中的RL和n值, 发现CTAB-GP吸附Cu(Ⅱ)/Cr(Ⅵ)一元体系均为优惠吸附, 均能容易地对Cu(Ⅱ)和Cr(Ⅵ)进行吸附.
表 4总结了其他文献报道的不同吸附剂对Cu(Ⅱ)和Cr(Ⅵ)的吸附容量, 可以看出本研究制备的地聚合物对Cu(Ⅱ)和Cr(Ⅵ)具有较高的吸附量, 还具有可同时吸附的优势.
| 表 4 其他研究中所制备材料的吸附能力比较 Table 4 Adsorption results of Cu(Ⅱ) and Cr(Ⅵ) onto different adsorbents from literature reports |
图 3展示了偏高岭土和地聚合物的X射线衍射图谱.由图可看出, 偏高岭土是晶态物质, 主要含有高岭石、莫来石和石英等.曲线a中大部分反射峰在曲线b中明显降低, 推断是因地聚合物形成过程中, 偏高岭土在碱性条件下发生溶解, 导致了峰的消失或减落(Heah et al., 2012).而地聚合物是非晶态物质, 曲线b中依然存有几个峰, 应该是未反应的莫来石相.曲线b和曲线c几乎一样, 说明GP和CTAB-GP具有相同的主体结构.
 |
| 图 3 MK(a)、GP(b)、CTAB-GP(c)的X射线衍射图谱 Fig. 3 X-ray diffraction spectra of MK(a), GP(b), and CTAB-GP(c) |
图 4展示了偏高岭土和地聚合物的傅里叶变换红外光谱.图中3435 cm-1处较宽的吸收峰来自于—OH, 1646 cm-1处对应H—O—H的弯曲振动.将图 4中曲线a和b进行比对, 在偏高岭土经过碱性激活的过程中, 曲线b中出现在1052、714和575 cm-1的吸收峰表明在GP的结构中存在Si—O—Si、Al—O—Si和Si—O—Al(Mihaly-Cozmuta et al., 2014;Sarkar et al., 2017), 这与地聚合物的结构特征相一致.将图 4中曲线b和c进行比对, 曲线c中出现在2920和2850 cm-1处的吸收峰表明在CTAB-GP中存在—CHn(Aslan et al., 2017;Xu et al., 2018), 证实了季铵盐阳离子的存在.同时地聚合物的结构特征峰在CTAB-GP中仍然存在, 且整体吸收峰没有出现较大变化, 证明即使经过有机改性, CTAB-GP上仅携带了季铵盐阳离子, 仍属于地聚合物.
 |
| 图 4 MK(a)、GP(b)、CTAB-GP(c)的FTIR扫描图 Fig. 4 The FTIR spectra of the (a) MK, (b) GP, and (c) CTAB-GP |
采用N2吸附-脱附法对CTAB-GP的比表面积和孔径进行表征, 结果如表 5所示.在MK形成GP和CTAB-GP过程中, 比表面积从3.11 m2·g-1分别增加到31.83 m2·g-1和26.45 m2·g-1.CTAB-GP的比表面积相比GP有所降低,归因于CTA+的附着(Cai et al., 2018).两者的孔体积和孔径均增加, 但CTAB-GP的数值都比GP的大.随着比表面积和孔体积的增加, 可获得更多的吸附位点和更大的吸附容量, 其中9.12 nm的孔径最多, 属于有利于吸附的介孔(2~50 nm), 这些都解释了地聚合物与原料相比具有更高的吸附能力.
| 表 5 偏高岭土及地聚合物的比表面积及孔结构特性 Table 5 Specific surface area and pore structure of metakaolin and geopolymer |
1) 经过有机改性后, 制备出的产物依然属于地聚合物, 与常规地聚合物的区别在于表面附着了季铵盐阳离子.改性地聚合物对重金属阳离子的吸附性能略有降低, 但具有吸附阴离子重金属的能力, 可用作阴、阳离子重金属共同存在时的吸附材料.在Cu(Ⅱ)/Cr(Ⅵ)二元体系中, Cu(Ⅱ)的吸附受到干扰离子的影响而小幅降低, Cr(Ⅵ)的吸附则因溶液中未被吸附的Cu(Ⅱ)引起静电屏蔽而得到促进, 其机理仍需进一步研究.
2) 在Cu(Ⅱ)和Cr(Ⅵ)初始浓度均为50 mg·L-1的混合溶液中, 当pH为5、吸附剂投加量为1 g·L-1时, Cu(Ⅱ)的去除率达到98.6%, Cr(Ⅵ)的去除率为25.6%.Cr(Ⅵ)去除率出现先升后降趋势的原因是溶液中无Cu(Ⅱ)进行促进作用、干扰离子SO42-的存在及吸附期间pH的升高.
3) CTAB-GP吸附Cu(Ⅱ)和Cr(Ⅵ)的过程很好地符合二级动力学规律.采用Langmuir模型和Freundlich模型对CTAB-GP单独吸附Cu(Ⅱ)和Cr(Ⅵ)的数据进行拟合, 发现两种模型均有较好的模拟效果.在0.4 g·L-1投加量和4 h吸附时间下, 对Cu(Ⅱ)和Cr(Ⅵ)的最大吸附量分别为147.1 mg·g-1和63.1 mg·g-1, 具有较高吸附量的同时, 还具有可同时吸附的优势.
Andrejkovičová S, Sudagar A, Rocha J, et al. 2016. The effect of natural zeolite on microstructure, mechanical and heavy metals adsorption properties of metakaolin based geopolymers[J]. Applied Clay Science, 126: 141-152. DOI:10.1016/j.clay.2016.03.009 |
Aslan D I, Özoğul B, Ceylan S, et al. 2018. Thermokinetic analysis and product characterization of medium density fiberboard pyrolysis[J]. Bioresource Technology, 258: 105-110. DOI:10.1016/j.biortech.2018.02.126 |
Cai W, Gu M, Jin W, et al. 2018. CTAB-functionalized C@SiO2 double-shelled hollow microspheres with enhanced and selective adsorption performance for Cr(Ⅵ)[J]. Journal of Alloys and Compounds, 777: 1304-1312. |
Chen H, Yan T, Jiang F. 2014. Adsorption of Cr(Ⅵ) from aqueous solution on mesoporous carbon nitride[J]. Journal of the Taiwan Institute of Chemical Engineers, 45(4): 1842-1849. DOI:10.1016/j.jtice.2014.03.005 |
Ding P F, Song W F, Wang C, et al. 2019. Adsorption of Cu(Ⅱ) and Pb(Ⅱ) from aqueous solutions onto a metakaolin-based geopolymer[J]. Desalin Water Treat, 158: 164-173. DOI:10.5004/dwt.2019.24190 |
Duan P, Yan C J, Zhou W, et al. 2016. Development of fly ash and iron ore tailing based porous geopolymer for removal of Cu(Ⅱ) from wastewater[J]. Ceramics International, 42(12): 13507-13518. DOI:10.1016/j.ceramint.2016.05.143 |
Fayazi M. 2019. Facile hydrothermal synthesis of magnetic sepiolite clay for removal of Pb(Ⅱ) from aqueous solutions[J]. Analytical And Bioanalytical Chemistry Research, 6(1): 125-136. |
Ge Y, Cui X, Kong Y, et al. 2015. Porous geopolymeric spheres for removal of Cu(Ⅱ) from aqueous solution:synthesis and evaluation[J]. Journal of Hazardous Materials, 283: 244-251. DOI:10.1016/j.jhazmat.2014.09.038 |
Heah C Y, Kamarudin H, Bakri A M M A, et al. 2012. Study on solids-to-liquid and alkaline activator ratios on kaolin-based geopolymers[J]. Construction & Building Materials, 35: 912-922. |
He J, Li Y, Wang C, et al. 2017. Rapid adsorption of Pb, Cu and Cd from aqueous solutions by β-cyclodextrin polymers[J]. Applied Clay Science, 426: 29-39. |
Hu H J, Liu J Y, Xu Z H, et al. 2019. Hierarchical porous Ni/Co-LDH hollow dodecahedron with excellent adsorption property for Congo red and Cr(Ⅵ) ions[J]. Applied Surface Science, 478: 981-990. DOI:10.1016/j.apsusc.2019.02.008 |
Lee N K, Khalid H R, Lee H K. 2017. Adsorption characteristics of cesium onto mesoporous geopolymers containing nano-crystalline zeolites[J]. Microporous and Mesoporous Materials, 242: 238-244. DOI:10.1016/j.micromeso.2017.01.030 |
Lee S Y, Kim S J. 2002. Adsorption of naphthalene by HDTMA modified kaolinite and halloysite[J]. Applied Clay Science, 22(1): 55-63. |
Li Z, Beachner R, Mcmanama Z, et al. 2007. Sorption of arsenic by surfactant-modified zeolite and kaolinite[J]. Microporous and Mesoporous Materials, 105(3): 291-297. DOI:10.1016/j.micromeso.2007.03.038 |
Liu Y, Yan C, Zhang Z, et al. 2016. A comparative study on fly ash, geopolymer and faujasite block for Pb removal from aqueous solution[J]. Fuel, 185: 181-189. DOI:10.1016/j.fuel.2016.07.116 |
Luukkonen T, Runtti H, Niskanen M, et al. 2016. Simultaneous removal of Ni(Ⅱ), As(Ⅲ), and Sb(Ⅲ) from spiked mine effluent with metakaolin and blast-furnace-slag geopolymers[J]. Journal of Environmental Management, 166: 579-588. DOI:10.1016/j.jenvman.2015.11.007 |
Maleki A, Hajizadeh Z, Sharifi V, et al. 2019. A green, porous and eco-friendly magnetic geopolymer adsorbent for heavy metals removal from aqueous solutions[J]. Journal of Cleaner Production, 215: 1233-1245. DOI:10.1016/j.jclepro.2019.01.084 |
Mihaly-Cozmuta L, Mihaly-Cozmuta A, Peter A, et al. 2014. Adsorption of heavy metal cations by Na-clinoptilolite:equilibrium and selectivity studies[J]. Journal of Environmental Management, 137: 69-80. |
Mobarak M, Mohamed E A, Selim A Q, et al. 2019. Surfactant-modified serpentine for fluoride and Cr(Ⅵ) adsorption in single and binary systems:Experimental studies and theoretical modeling[J]. Chemical Engineering Journal, 369: 333-343. DOI:10.1016/j.cej.2019.03.086 |
Morsy M S, Alsayed S H, Al-Salloum Y, et al. 2014. Effect of sodium silicate to sodium hydroxide ratios on strength and microstructure of fly ash geopolymer binder[J]. Arabian Journal for Science and Engineering, 39(6): 4333-4339. DOI:10.1007/s13369-014-1093-8 |
Naghsh M, Shams K. 2017. Synthesis of a kaolin-based geopolymer using a novel fusion method and its application in effective water softening[J]. Applied Clay Science, 146: 238-245. DOI:10.1016/j.clay.2017.06.008 |
Sarkar C, Basu J K, Samanta A N. 2017. Removal of Ni2+ ion from waste water by geopolymeric adsorbent derived from LD Slag[J]. Journal of Water Process Engineering, 17: 237-244. DOI:10.1016/j.jwpe.2017.04.012 |
Singhal A, Gangwar B P, Gayathry J M. 2017. CTAB modified large surface area nanoporous geopolymer with high adsorption capacity for copper ion removal[J]. Applied Clay Science, 150: 106-114. DOI:10.1016/j.clay.2017.09.013 |
Tang Q, Wang K, Yaseen M, et al. 2018. Synthesis of highly efficient porous inorganic polymer microspheres for the adsorptive removal of Pb2+ from wastewater[J]. Journal of Cleaner Production, 193: 351-362. DOI:10.1016/j.jclepro.2018.05.094 |
Xu F F, Wang B, Yang D, et al. 2018. Thermal degradation of typical plastics under high heating rate conditions by TG-FTIR:Pyrolysis behaviors and kinetic analysis[J]. Energy Conversion and Management, 171: 1106-1115. DOI:10.1016/j.enconman.2018.06.047 |
Xu Q, Wang Y, Jin L, et al. 2017. Adsorption of Cu(Ⅱ), Pb (Ⅱ) and Cr(Ⅵ) from aqueous solutions using black wattle tannin-immobilized nanocellulose[J]. Journal of Hazardous Materials, 339: 91-99. DOI:10.1016/j.jhazmat.2017.06.005 |
Xu Y L, Chen J Y, Chen R, et al. 2019. Adsorption and reduction of chromium(Ⅵ) from aqueous solution using polypyrrole/calcium rectorite composite adsorbent[J]. Water Research, 160: 148-157. DOI:10.1016/j.watres.2019.05.055 |
Zhu C, Liu F, Zhang Y, et al. 2016. Nitrogen-doped chitosan-Fe(Ⅲ) composite as a dual-functional material for synergistically enhanced co-removal of Cu(Ⅱ) and Cr(Ⅵ) based on adsorption and redox[J]. Chemical Engineering Journal, 306: 579-587. DOI:10.1016/j.cej.2016.07.096 |
 2020, Vol. 40
2020, Vol. 40


