2. 湖南大学环境科学与工程学院, 长沙 410082
2. College of Environmental Science and Engineering, Hunan University, Changsha 410082
全氟化合物(PFCs)是一类人工合成的持久性有机化合物, 具有特殊的表面活性及高稳定性, 自20世纪中叶以来, 被广泛地应用于工业和商业等领域(Schultz et al., 2003; 王亚韡等, 2010).随着PFCs的大量生产和使用, 该类物质在全球范围的各类环境介质中均被广泛检出, 特别是全氟辛酸(PFOA)最为常见(Zhou et al., 2010; Li et al., 2013).在PFOA分子中, 由于F的高电负性及C—F键极高的键能(544 kJ·mol-1), 使其难以发生降解和生物转化, 长期接触PFOA会导致发育和生殖毒性、肝脏损害, 以及内分泌干扰和潜在的致癌性, 因此, 开发有效的PFOA去除方法已变得越来越迫切(Peng et al., 2010; Zeng et al., 2011; 方淑红等, 2019; Yang et al., 2020).
传统的吸附法、生物处理法均难以有效地去除PFOA, 甚至有可能引起PFOA含量的升高(Vecitis et al., 2009; Senevirathna et al., 2011; 王世亮等, 2018).目前, 有许多关于氧化处理技术的报道, 包括超声氧化、直接光解、电化学氧化和光催化氧化等(Hori et al., 2003; Panchangam et al., 2009b; Lee et al., 2010; Li et al., 2012).TiO2光催化氧化正是一种有效处理持久性有机物的高级氧化技术, 例如, Dillert等(2007)首次报道了在TiO2存在的酸性溶液中紫外光催化降解PFOA, 但降解效率不高.有关降解机理的研究表明, TiO2在光激发过程中, 形成光生电子和空穴, 电子与氧形成氧负离子, 空穴可以依靠其强氧化性与水反应形成羟基自由基, 以此对目标污染物进行降解(李明洁等, 2014).但由于TiO2存在自身缺陷, 如禁带宽度大(3.2 eV)、光生电子与空穴易复合等, 制约了其在光催化技术领域的发展, 因此, 需要通过掺杂改性的方式改变其晶体结构和光学性能, 提高催化剂活性(Estrellan et al., 2010; Parshetti et al., 2010).Yan等(2012)制备了Ce掺杂TiO2纳米粒子并光催化降解亚甲基蓝, 结果表明, Ce离子掺入TiO2晶格中, 可以控制晶粒尺寸的增加, 扩大可见光的吸收区域, 抑制光生电子和空穴对的复合.刘晴等(2015)制备了Pd掺杂TiO2, 紫外光下, 全氟辛酸的降解效率得到了提升.此外, 还有研究报道可以通过Pt(Behafarid et al., 2012)、Sn(Tu et al., 2009)、In(Chai et al., 2011)掺杂及Ti3+(Cai et al., 2014)自掺杂等方式提高TiO2光催化效率.为进一步提高可见光下的催化效果, 科研人员开发了半导体复合材料, 如TiO2与非金属半导体氮化碳(g-C3N4)合成的异质结复合材料已应用于有机染料、抗生素等物质的光催化降解(Wang et al., 2016; 傅敏等, 2017).g-C3N4的禁带宽度为2.7 eV, 与TiO2的能带结构匹配良好, 能有效分离光生电子和空穴对, 使可见光的催化活性增强(Chetri et al., 2014; Zheng et al., 2017).
为了克服单一改性TiO2仅能在紫外光下降解PFOA的缺陷, 进一步提升降解效率, 本研究有效结合不同二元掺杂类型的优势, 采用溶胶凝胶-超声混合法制备得到新型异质结Ce/TiO2/g-C3N4三元复合材料, 使用透射电子显微镜(TEM)、X-射线粉末衍射仪(XRD)、傅里叶变换红外光谱仪(FTIR)和紫外-可见分光光度计(UV-Vis)测定复合材料颗粒的粒径、形状、活性官能团和光吸收带, 评估Ce/TiO2/g-C3N4在可见光照射下对模拟PFOA废水的降解效果, 并探究其降解机理, 以期为各类废水和污水中PFCs的处理提供一种经济、合理、可行的处理技术.
2 材料与方法(Materials and methods) 2.1 实验试剂钛酸四丁酯(TBT, AR级)购自上海Aladdin公司;碳数为2~8的全氟羧酸标准品(PFCAs, C2~C8)购自上海安谱(ANPEL);三聚氰胺(MM, CP级)、六水合硝酸铈(Ce(NO3)3·6H2O, AR级);乙醇(C2H6O, AR级)、乙酸铵(C2H7NO2, AR级)、甲醇(CH4O, GR级)、对苯醌(C6H4O2, AR级)、乙二胺四乙酸二钠(EDTA-2Na, AR级)购自中国国药集团;试验所用水为超纯水.
2.2 Ce/TiO2/g-C3N4三元复合材料的制备采用溶胶凝胶法(Tu et al., 2009)制备Ce/TiO2(Ce/TiO2的质量比为0.1%), 以三聚氰胺为原料制备g-C3N4(夏静芬等, 2018), 将g-C3N4与Ce/TiO2以g-C3N4/TiO2质量比为25%混合, 加入10 mL无水乙醇, 超声30 min使之混合均匀.混合样品经烘箱干燥后置于马弗炉中, 300 ℃下煅烧1 h, 得到Ce/TiO2/g-C3N4异质结复合材料, 用于PFOA的可见光催化反应.
2.3 材料的表征采用透射电子显微镜(TEM, JEM2100, 日本)对不同材料的形状、组成及颗粒粒径范围进行测定;通过X-射线粉末衍射仪(XRD, D8 Advance, 德国)判断材料的晶型;利用傅立叶红外光谱仪(FTIR, Vertex 70, 德国)检测材料表面的官能团;使用紫外-可见光谱仪(UV-Vis, Lambda950, 美国)分析材料的光吸收范围.
2.4 可见光催化性能测试方法配制1、4、7、10 mg·L-1的模拟PFOA废水, 采用实验室自制光催化反应装置(图 1), 在可见光(300 W金卤灯, 波长为380~800 nm, 滤光片滤去波长小于420 nm的紫外光部分)下进行降解试验.光源距离反应液面30 cm, 反应过程持续磁力搅拌, 外接恒温循环水.将反应液置于暗处搅拌0.5 h, 达到吸附-解吸平衡后在光照下进行降解反应, 降解总时长24 h, 每次取样后在6000 r·min-1的转速下离心5 min, 取上清液分析产物.
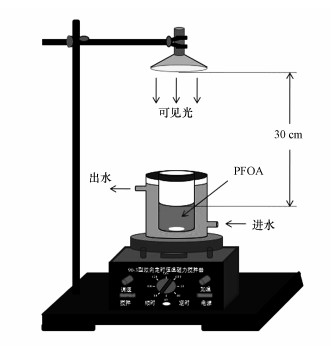 |
| 图 1 可见光光催化反应示意图 Fig. 1 Schematic of visible light illustrated photocatalytic reactor |
采用Acquity/SynaptG2-MS高效液相色谱质谱联用仪(HPLC-MS, 美国Waters公司)分析PFOA及其降解产物.配备UPLC BEH C18色谱柱(2.1 mm×50 mm×1.7 μm), 柱温30 ℃.甲醇(A)和2 mmol·L-1乙酸铵(B)组成流动相, 流速为0.3 mL·min-1.梯度洗脱, 起始时A相比例40%, 保持1 min;1~7 min, A相比例线性增加至100%;保持3.5 min后, A相比例降至40%, 保持3 min.采用自动进样, 进样量为10 μL.使用多反应监测模式进行MS分析, 离子喷雾电压和锥孔电压分别为-4500 V和40 V, 碰撞能量为20 eV, 温度为450 ℃.
降解过程中产生的氟离子采用离子选择性电极法(PXS-270, 上海雷磁)测定其浓度, 线性方程为E=59.1868lgc(F-)-239.8860, R2=0.9996.降解率(R)和脱氟率(D)计算方法为:
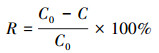
|
(1) |
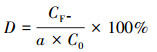
|
(2) |
式中, C0为PFOA初始浓度(mg·L-1);C为不同时刻溶液中PFOA浓度(mg·L-1);CF-为溶液中F-浓度(mg·L-1);a为氟元素在PFOA分子量中所占的百分比, 取值为0.6884.
3 结果与讨论(Results and discussion) 3.1 表征结果 3.1.1 TEM分析不同催化剂材料(TiO2、Ce/TiO2、g-C3N4和Ce/TiO2/g-C3N4)的TEM图像如图 2所示.图 2a为单一TiO2的表面形貌图, 可以看到TiO2呈现出不规则的形状, 尺寸不均, 大部分为微小的球状物, 粒径在20 nm左右, 且有团聚现象.从图 2b中可以看到掺Ce后, Ce/TiO2的外观形状与单一的TiO2相比更为均匀, 形状规则, 团聚现象有所改善.g-C3N4的形貌如图 2c所示, 图中g-C3N4为薄层片状, 大小不均, 片与片之间有部分堆叠, 形成堆垛(Mohini et al., 2016).Ce/TiO2/g-C3N4形貌如图 2d所示, 为颗粒状, 粒径基本小于20 nm, 分散性好, 相比单一g-C3N4的形貌, 片状边缘颜色有所加深, 可能发生卷曲, 相比Ce/TiO2, 团聚现象进一步改善, 从而提升了复合材料的光催化性能(夏静芬等, 2018).
 |
| 图 2 TiO2(a)、Ce/TiO2(b)、g-C3N4(c)及Ce/TiO2/g-C3N4(d)样品的TEM图 Fig. 2 TEM diagram of TiO2(a)、Ce/TiO2(b)、g-C3N4(c)及Ce/TiO2/g-C3N4(d) |
采用X-射线粉末衍射仪分析Ce/TiO2/g-C3N4的晶相结构, 并与TiO2、g-C3N4、Ce/TiO2进行对比, 结果如图 3A所示.图中g-C3N4在13.0°和27.5°处出现两个衍射峰, 分别为g-C3N4的(100)、(002)晶面, 表明合成产物为层状类石墨相氮化碳(Zheng et al., 2012).在Ce/TiO2/g-C3N4复合材料衍射图中, g-C3N4仅保留了27.5°(002)处微弱的特征衍射峰, 说明复合后样品中掺杂的g-C3N4结晶度较低.在TiO2图谱中可以看到, 在2θ为25.4°、37.9°、48.0°、53.9°、55.2°、62.7°处的特征峰分别对应TiO2的锐钛矿相(JCPDS No.21-1272) (Boonprakob et al., 2013).从掺杂后Ce/TiO2和Ce/TiO2/g-C3N4两种催化剂衍射峰的位置来看, 复合后的TiO2仍为锐钛矿型, 晶型不变但峰型有略宽化趋势, 可能与Ce、g-C3N4共掺杂后结晶度变弱有关.由于Ce4+半径大于Ti2+, 掺入的Ce离子绝大多数无法进入到TiO2晶格内部, 而是以CeO2的形式分散在TiO2表面, 图中未发现CeO2的相关衍射峰, 原因可能是Ce元素含量较少且处于高分散状态.TiO2表面高分散的CeO2能够抑制TiO2晶粒的生长及团聚, 通过Scherrer公式(Yan et al., 2012)计算, 所制备的Ce/TiO2/g-C3N4催化剂平均粒径为16.4 nm, 小于TiO2的粒径(20.6 nm), 与TEM的测定结果一致.掺杂后样品的平均粒径变小, 比表面积增大, 活性位点增多, 有助于材料的光催化活性提升.
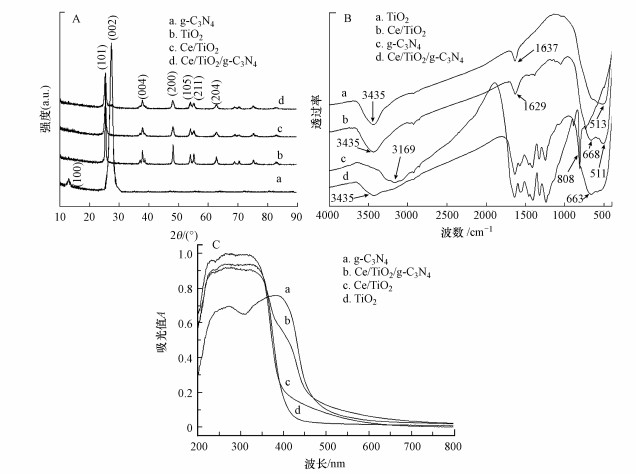 |
| 图 3 TiO2、g-C3N4、Ce/TiO2、Ce/TiO2/g-C3N4样品XRD(A)、FTIR(B)和UV-Vis(C)图谱 Fig. 3 XRD(A), FTIR(B) and UV-Vis(C) absorption spectra of TiO2, g-C3N4, Ce/TiO2 and Ce/TiO2/g-C3N4 |
利用傅立叶红外光谱仪检测TiO2、Ce/TiO2、g-C3N4和Ce/TiO2/g-C3N4表面的官能团, 结果如图 3B所示.图中TiO2的特征吸收峰出现在513、1637和3435 cm-1处, 分别对应Ti—O键的伸缩振动, 以及表面水分子O—H键的弯曲振动和伸缩振动.Ce/TiO2的红外吸收曲线显示二元复合材料中TiO2的特征吸收峰均存在, 1637 cm-1处O—H的弯曲振动峰移至1629 cm-1外, 强度增强, 说明相对于TiO2, 掺杂Ce后有益于产生更多的·OH, 增大了催化剂的活性;668 cm-1处出现较强的吸收峰, 可能是掺杂使得Ce进入晶格形成Ti—O—Ce, 影响了Ti—O的伸缩振动.g-C3N4红外吸收图谱的808 cm-1处为三嗪单元C—N的弯曲振动, 1200~1650 cm-1范围内的系列吸收峰为芳香杂环上C—N和C=N的伸缩振动, 杂环结构中N—H的伸缩振动出现在3100~3400 cm-1.Ce/TiO2/g-C3N4的图谱显示其存在与Ce/TiO2类似的Ti—O伸缩振动峰;与g-C3N4图谱对比发现, 三元复合材料中虽仍存在g-C3N4的C—N、C=N的特征吸收峰, 但碳氮杂环峰发生不同程度的红移, 这表明Ce与g-C3N4共掺杂使TiO2表面的羟基与g-C3N4的N—H基团发生反应形成异质结构, 能级发生改变.
3.1.4 UV-Vis分析TiO2、g-C3N4、Ce/TiO2、Ce/TiO2/g-C3N4的紫外可见吸收曲线如图 3C所示.由图可见, 单一的g-C3N4能吸收小于460 nm的辐射, 而单一的TiO2在可见光区无明显吸收.Ce掺杂后, Ce/TiO2的光吸收带较TiO2发生红移, 在400~500 nm范围内出现一定的吸收.由于g-C3N4的掺入, 与TiO2之间形成异质结构, Ce/TiO2/g-C3N4复合材料叠加了Ce/TiO2和g-C3N4对光的响应, 吸收带红移更明显, 对光的响应范围增大到可见光区.经计算发现, 三元复合材料的禁带宽度为2.4 eV, 较TiO2(3.2 eV)大幅度减小, 这有助于其充分利用可见光, 提高其催化性能.
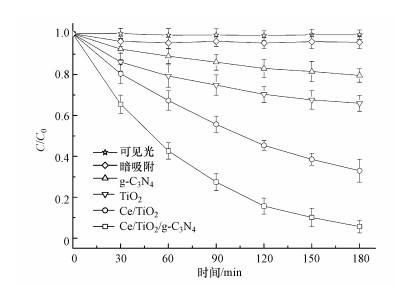
3.2 光催化研究 3.2.1 不同催化剂光催化活性比较设定溶液中PFOA的浓度为4 mg·L-1, pH=2, 催化剂投加量为1 g·L-1, 研究TiO2、g-C3N4、Ce/TiO2和Ce/TiO2/g-C3N4 4种材料在可见光下催化降解PFOA的性能, 并对比直接可见光降解效果和PFOA在Ce/TiO2/g-C3N4表面的暗吸附, 结果如图 4所示.
 |
| 图 4 不同材料光催化活性比较 Fig. 4 Photocatalytic activity of different materials |
PFOA在Ce/TiO2/g-C3N4表面的吸附解吸作用在0.5 h达到平衡, 平均吸附率仅为4.10%, 说明PFOA的主要降解机制并非是吸附作用(Panchangam et al., 2009a).在直接可见光的作用下, PFOA的降解率为0, 可见PFOA具有极强的稳定性, 必须借助光催化剂才能实现降解.加入催化剂后, 反应180 min, g-C3N4在可见光下表现出较低的催化效果, 降解率仅为20.4%;单一TiO2的降解率为34.0%.掺杂Ce后, 二元复合材料对PFOA的降解率提升为67.0%;将Ce与g-C3N4共掺入TiO2形成三元复合材料后表现出更高的催化效果, 降解率可达94.4%.结合表征结果, 认为g-C3N4单一催化效果受限是由于其易快速重组电子-空穴对, 量子效率差, 且光量程相对狭窄所致;单一TiO2在可见光区几乎无吸收, 所以表现出的降解率也不理想.Ce或Ce/g-C3N4掺入TiO2后, 禁带宽度降低, 在可见光区吸收增强, 且使电子-空穴对不易复合, 同时催化剂具有更高的分散性, 降解效果明显提升.相比Ce/TiO2, Ce/TiO2/g-C3N4中由于异质结的生成使电子-空穴对复合率、禁带宽度更低, 吸收强度和分散性更好.
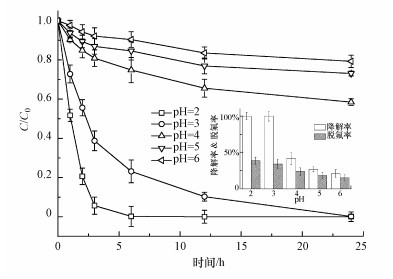
3.2.2 pH对PFOA降解和脱氟的影响酸碱度是光催化反应的重要影响因素之一, 以Ce/TiO2/g-C3N4为催化剂, 研究pH对PFOA降解的影响.在初始浓度为4 mg·L-1的PFOA溶液中, 固定1 g·L-1的催化剂投加量, 降解结果如图 5所示.由图可知, 反应体系的pH值较低时, 降解效果较好.大部分研究者提出pH初始值越低, PFOA越易降解(Ohno et al., 2014), 与本文结果基本一致.在pH为2的溶液中光照3 h, PFOA的降解率可达94.4%;pH为3时, 降解率略低, 为61.3%, 光照24 h后, PFOA均降解完全.当反应体系的pH的升高至4、5和6, 光照24 h后的降解率分别仅为41.5%、26.9%和20.7%, 无法完全降解.同时测定上述反应体系催化降解24 h后PFOA的脱氟率, 其值分别为38.6%、34.1%、23.8%、18.1%和15.3%, 变化规律与降解率一致, 但脱氟率明显低于降解率是由于C—F键能(485 kJ·mol)大于C—C键能(332 kJ·mol)所致.
 |
| 图 5 pH对PFOA降解和脱氟的影响 Fig. 5 Influence of pH on the decomposition and defluorination of PFOA |
在光催化反应中, 体系的最佳pH与催化剂及PFOA的性质均密切相关.复合催化剂中TiO2的等电位为6.3, 在酸性条件下, TiO2表面带正电荷, 容易吸附PFOA阴离子, 目前报道的PFOA的pKa值尚存争议, 一般认为pKa小于2.本反应体系的研究结果中, pH为2时更利于PFOA的降解, 在此pH下TiO2带有更多的正电荷, 同时PFOA以阴离子形式存在, 吸附至催化剂材料表面, 被材料表面的活性基团氧化, 从而促进其降解(Ohno et al., 2014).
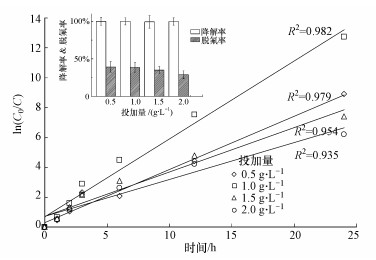
3.2.3 催化剂投加量对PFOA降解和脱氟的影响选择试验条件pH为2, PFOA初始浓度为4 mg·L-1, 研究Ce/TiO2/g-C3N4投加量对PFOA降解的影响, 结果见图 6.催化剂投加量为0.5、1.0、1.5和2.0 g·L-1时, PFOA的降解均符合准一级反应动力学方程, 且线性关系良好, 速率常数分别为0.356、0.522、0.297和0.246 h-1.低投加量范围内(0.5~1.0 g·L-1), 催化剂增多, 就会有更多的活性基团受到可见光的激发, 催化速率随之加快;当继续增大催化剂投加量时, 由于催化剂固体材料对光散射作用不断增加, 光的穿透率降低, 反而导致光利用率下降, 且催化剂材料之间更容易发生团聚现象, 因此, PFOA催化速率有所降低(李明洁等, 2014).
 |
| 图 6 可见光降解PFOA的动力学研究 Fig. 6 Photodegradation kinetics of PFOA |
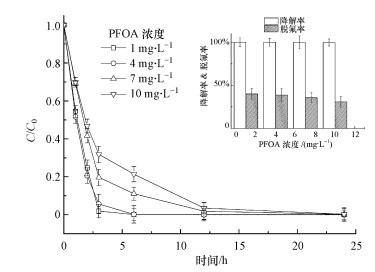
固定催化剂投加量为1.0 g·L-1, 体系pH值为2, 研究PFOA初始浓度对光催化反应的影响, 结果如图 7所示.反应时间为3 h时, 1 mg·L-1 PFOA的降解率可达98.1%, 当PFOA浓度上升为4、7和10 mg·L-1时, 降解率分别为94.4%、80.3%和68.2%.降解率下降的原因是在光能量和催化剂活性位点恒定的情况下, 反应浓度的增加导致有效反应降低, 使其无法及时降解;且降解的中间产物随PFOA初始浓度的增加而增多, 这些中间产物的降解也需消耗光能和活性位点.光照下24 h后, 不同浓度的PFOA均能降解完全.1 mg·L-1的PFOA在可见光下反应24 h的脱氟率为39.8%, 比其他PFOA浓度的脱氟率略大, 即低浓度的反应体系对于脱氟具有更大的优势.
 |
| 图 7 PFOA起始浓度对其降解和脱氟的影响 Fig. 7 Influence of initial concentrations on the decomposition and defluorination of PFOA |
用高效液相色谱质谱联用仪对PFOA光催化反应的中间产物进行测定, 主要检测碳数为2~8的全氟羧酸类化合物(PFCAs, C2~C8).设定反应体系的pH为2, 催化剂投加量为1 g·L-1, PFOA浓度为4 mg·L-1, 降解过程中C2~C8浓度变化如图 8所示.在各降解产物中, C7的浓度先上升后下降, 在反应12 h时达到最大值1.02 mg·L-1, 这表明PFOA降解过程首先生成长链的PFCAs, 再逐步脱去CF2生成碳链更短的PFCAs, 且在PFOA基本降解的同时C7已逐步开始降解.C2~C6的浓度基本呈现逐步增大的趋势, 进一步推断可知, 继续反应C6等短链PFCAs的浓度也将进一步降低.
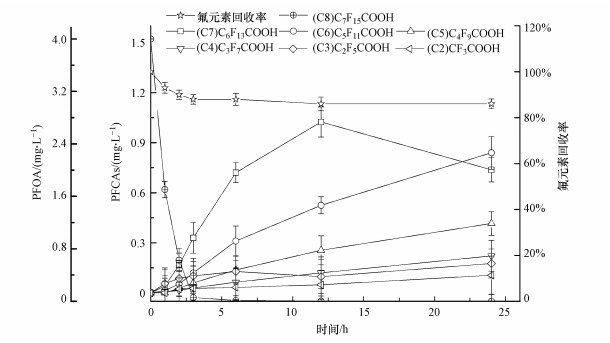 |
| 图 8 PFOA分解产物的浓度变化及氟元素的物料平衡 Fig. 8 Concentration change of PFOA decomposition products and material balance of fluorine elements |
反应体系中氟元素包括降解产生的氟离子, PFOA和其降解的短链全氟羧酸中的有机氟, 以及其他未知形态的氟元素.图 8中反应24 h后的氟元素物料平衡曲线显示, 氟元素的回收率在86.0%, 推测还有部分其他未知形态的含氟中间产物存在.
3.3.2 活性基团捕获剂对PFOA降解的影响为探究PFOA的降解机理, 试验中分别采用甲醇、对苯醌和EDTA-2Na作为羟基自由基(·OH)、超氧自由基(·O2-)和空穴(h+)的捕获剂(Serpone et al., 2000;Dong et al., 2013), 光照反应180 min后, PFOA的降解率由无捕获剂时的94.4%分别降至53.5%、46.9%和75.6%.不同捕获剂对PFOA光降解反应影响的动力学数据见表 1, 表中活性基团的贡献率通过反应速率常数计算所得(苏海英等, 2017).
| 表 1 不同捕获剂对PFOA降解的影响 Table 1 Effects of different capturing agents on the degradation of PFOA |
试验数据表明, 甲醇和对苯醌的加入明显抑制了PFOA的降解, 同时速率常数下降, 半衰期增长, 因此, 该反应体系中·O2-和·OH均为主要活性物质, 而h+作为非主要途径, 也参与了PFOA的降解.
3.3.3 PFOA降解机制根据降解产生的短链PFCAs含量变化、氟元素的物料平衡及活性基团捕获试验结果解释PFOA的降解途径(Estrellan et al., 2010;Chen et al., 2015), 具体如图 9所示.
 |
| 图 9 PFOA光催化降解示意图 Fig. 9 Schematic diagram of photocatalytic decomposition of PFOA |
在Ce/TiO2/g-C3N4复合材料中, TiO2与g-C3N4形成异质结构, 经可见光照射后g-C3N4产生光生电子-空穴对(e--h+).由于g-C3N4导带电势为-1.24 eV, 低于TiO2的导带电势(-0.31 eV), 所以在可见光下, g-C3N4的价带电子吸收光子能量跃迁到导带, e-进而通过异质界面, 从g-C3N4的导带迁移到TiO2的导带中(Zheng et al., 2017), h+则留在g-C3N4的价带上, 从而可以有效降低光生载流子的复合率, 提升复合材料的光催化性能.同时, Ce的掺入可以改善TiO2的表面结构, 并在TiO2的禁带间产生杂质能级, 降低了TiO2的禁带宽度, 使得TiO2的光谱吸收范围产生一定红移, 进一步增强了可见光的利用率, 又由于Ce具有特殊的4f电子层结构, Ce4+可以捕获e-(Ce4++e-→Ce3+), 产生的Ce3+也可与h+结合(Ce3++h+→Ce4+), 从而有效地抑制光生电子-空穴对的复合.根据光催化的机制, e-和h+通过反应可以生成一系列具有强氧化能力的活性基团, e-可与水中的O2反应生成·O2-;h+自身就具有很强的氧化能力, 可直接氧化有机污染物, 也可与H2O反应生成·OH.
活性基团捕获试验结果证明, PFOA的降解反应中, ·O2-和·OH为主要活性物质, 而h+的贡献率较低.由此认为PFOA的降解过程为:PFOA在反应体系中以阴离子形式存在, 复合材料在酸性条件下表面带有大量正电荷, 因此,PFOA较易吸附至材料表面, 在活性基团·O2-和·OH的作用下, 生成较不稳定的C7F15COO·(步骤①), 随之脱羧产生C7F15·与CO2(步骤②), C7F15·继续与·OH反应生成C7F15OH(步骤③), C7F15OH脱氟生成C6F13COF(步骤④), 同时有氟离子生成, C6F13COF易水解生成C6F13COOH(步骤⑤), 氟离子被释放与水中, 此过程完成一个脱CF2单位的阶段, 接着短链全氟羧酸也通过相同的方式逐步脱CF2, 实现中间产物的逐步降解.复合材料的主要活性基团除·O2-和·OH外, 还有氧化性较强的h+, 它也可参与脱CF2单元过程的反应, 但由于PFOA在催化剂表面的吸附的比例并不高, 所以由h+直接氧化PFOA并非降解的主要途径.在催化体系中, 由于反应较为复杂, 从氟回收率的数据上可以说明降解的过程中还会存在其他未检测到的含氟化合物.
4 结论(Conclusions)1) 通过溶胶凝胶-超声混合法制备了Ce/TiO2/g-C3N4三元复合材料, 金属的掺杂及异质结的生成, 使得复合催化剂分散性提高, 禁带宽度减小, 光吸收范围扩大, 吸收强度增强, 且电子-空穴对复合率降低.
2) 在可见光下使用Ce/TiO2/g-C3N4三元复合材料降解模拟PFOA废水, 结果表明, 复合材料的降解效果优于单一的TiO2、g-C3N4及Ce/TiO2;在最佳试验条件下(pH=2、催化剂投加量1 g·L-1、PFOA起始浓度4 mg·L-1), 可见光照射3 h, PFOA降解率可达94.4%, 脱氟率为38.6%.
3) 降解产物分析结合氟元素物料平衡计算, 认为PFOA降解途径为以阴离子形式存在的PFOA吸附至表面带有大量正电荷的复合材料表面后, 以自由基机理逐步脱去CF2生成短链的PFCAs, 同时生成氟离子, 捕获试验证明·O2-和·OH是Ce/TiO2/g-C3N4的主要活性基团.
Behafarid F, Cuenya B R. 2012. Coarsening phenomena of metal nanoparticles and the influence of the support pre-treatment:Pt/TiO2(110)[J]. Surface Science, 606(11/12): 908-918. |
Boonprakob N, Wetchakun N, Phanichphant S, et al. 2013. N-loaded TiO2 for photocatalytic degradation of methyl orange under visible light irradiation[J]. Advanced Materials Research, 622-623: 883-888. |
Cai J H, Huang Z A, Lv K L, et al. 2014. Ti powder-assisted synthesis of Ti3+ self-doped TiO2 nanosheets with enhanced visible-light photoactivity[J]. RSC Advances, 4(38): 19588-19593. DOI:10.1039/C4RA01496K |
Chai B, Peng T Y, Zeng P, et al. 2011. Synthesis of floriated In2S3 decorated with TiO2 nanoparticles for efficient photocatalytic hydrogen production under visible light[J]. Journal of Materials Chemistry, 21(38): 14587-14593. DOI:10.1039/c1jm11566a |
Chen M J, Lo S L, Lee Y C, et al. 2015. Photocatalytic decomposition of perfluorooctanoic acid by transition-metal modified titanium dioxide[J]. Journal of Hazardous Materials, 288: 168-175. DOI:10.1016/j.jhazmat.2015.02.004 |
Chetri P, Basyach P, Choudhury A. 2014. Structural, optical and photocatalytic properties of TiO2/SnO2 and SnO2/TiO2 core-shell nanocomposites:An experimental and DFT investigation[J]. Chemical Physics, 434: 1-10. DOI:10.1016/j.chemphys.2014.02.007 |
Dillert R, Bahnemann D, Hidaka H. 2007. Light-induced degradation of perfluorocarboxylic acids in the presence of titanium dioxide[J]. Chemosphere, 67(4): 785-792. DOI:10.1016/j.chemosphere.2006.10.023 |
Dong R, Tian B, Zhang J, et al. 2013. AgBr@Ag/TiO2 core-shell composite with excellent visible light photocatalytic activity and hydrothermal stability[J]. Catalysis Communications, 38: 16-20. DOI:10.1016/j.catcom.2013.04.006 |
Estrellan C R, Salim C, Hinode H. 2010. Photocatalytic decomposition of perfluorooctanoic acid by iron and niobium co-doped titanium dioxide[J]. Journal of Hazardous Materials, 179(1/3): 79-83. |
方淑红, 岳月, 李成, 等. 2019. 四川省不同地区自来水中全氟化合物的污染特征及健康风险评估[J]. 环境科学学报, 39(4): 1234-1240. |
傅敏, 徐海燕, 吴四维. 2017. 镧掺杂TiO2/g-C3N4复合光催化剂的制备及其可见光催化活性研究[J]. 环境科学学报, 37(3): 994-1002. |
Hori H, Takano Y, Koike K, et al. 2013. Decomposition of environmentally persistent trifluoroacetic acid to fluoride ions by a homogeneous photocatalyst in water[J]. Environmental Science & Technology, 37(2): 418-422. |
Lee Y C, Lo S L, Chiueh P T, et al. 2010. Microwave-hydrothermal decomposition of perfluorooctanoic acid in water by iron-activated persulfate oxidation[J]. Water Research, 44(3): 886-892. |
李明洁, 喻泽斌, 陈颖, 等. 2014. TiO2光催化降解PFOA的反应动力学及机制研究[J]. 环境科学, 35(7): 2612-2619. |
Li X Y, Zhang P Y, Jin L, et al. 2012. Efficient photocatalytic decomposition of perfluorooctanoic acid by indium oxide and its mechanism[J]. Environmental Science & Technology, 46(10): 5528-5534. |
Li Z M, Zhang P Y, Shao T, et al. 2013. Different nanostructured In2O3 for photocatalytic decomposition of perfluorooctanoic acid (PFOA)[J]. Journal of Hazardous Materials, 260: 40-46. DOI:10.1016/j.jhazmat.2013.04.042 |
刘晴, 喻泽斌, 张睿涵, 等. 2015. 钯掺TiO2光催化降解全氟辛酸[J]. 环境科学, 36(6): 2138-2146. |
Mohini R, Lakshminarasimhan N. 2016. Coupled semiconductor nanocomposite g-C3N4/TiO2 with enhanced visible light photocatalytic activity[J]. Materials Research Bulletin, 76: 370-375. DOI:10.1016/j.materresbull.2015.12.034 |
Ohno M, Ito M, Ohkura R, et al. 2014. Photochemical decomposition of perfluorooctanoic acid mediated by iron in strongly acidic conditions[J]. Journal of Hazardous Materials, 268: 150-155. DOI:10.1016/j.jhazmat.2013.12.059 |
Panchangam S C, Lin Y C, Shaik K L, et al. 2009a. Decomposition of perfluorocarboxylic acids (PFCAs) by heterogeneous photocatalysis in acidic aqueous medium[J]. Chemosphere, 77(2): 242-248. DOI:10.1016/j.chemosphere.2009.07.003 |
Panchangam S C, Lin Y C, Tsai J H, et al. 2009b. Sonication-assisted photocatalytic decomposition of perfluorooctanoic acid[J]. Chemosphere, 75(5): 654-660. DOI:10.1016/j.chemosphere.2008.12.065 |
Parshetti G K, Doong R A. 2010. Dechlorination and photodegradation of trichloroethylene by Fe/TiO2 nanocomposites in the presence of nickel ions under anoxic conditions[J]. Applied Catalysis B Environmental, 100(1/2): 116-123. |
Peng H, Wei Q W, Wan Y, et al. 2010. Tissue distribution and maternal transfer of poly- and perfluorinated compounds in Chinese sturgeon (Acipenser sinensis):implications for reproductive risk[J]. Environmental Science & Technology, 44(5): 1868-1874. |
Schultz M M, Barofsky D F, Field J A. 2003. Fluorinated alkyl surfactants[J]. Environmental Engineering Science, 20(5): 487-501. DOI:10.1089/109287503768335959 |
Senevirathna S, Tanaka S, Fujii S, et al. 2011. Adsorption of four perfluorinated acids on non ion exchange polymer sorbents[J]. Water Science & Technology, 63(10): 2106-2113. |
Serpone N, Texier I, Emeline A V, et al. 2000. Post-irradiation effect and reductive dechlorination of chlorophenols at oxygen-free TiO2/water interfaces in the presence of prominent hole scavengers[J]. Journal of Photochemistry & Photobiology A Chemistry, 136(3): 145-155. |
苏海英, 王盈霏, 王枫亮, 等. 2017. g-C3N4/TiO2复合材料光催化降解布洛芬的机制[J]. 中国环境科学, 37(1): 195-202. |
Tu Y F, Huang S Y, Sang J P, et al. 2009. Synthesis and photocatalytic properties of Sn-doped TiO2 nanotube arrays[J]. Journal of Alloys and Compounds, 482(1/2): 382-387. |
Vecitis C D, Park H, Cheng J, et al. 2009. Treatment technologies for aqueous perfluorooctanesulfonate (PFOS) and perfluorooctanoate (PFOA)[J]. Frontiers of Environmental Science and Engineering in China, 3(2): 129-151. |
王世亮, 张丽萍, 张鑫, 等. 2018. 泗河水体及污水厂出水中全氟烷基酸类化合物及其前体物空间分布特征[J]. 环境科学学报, 38(4): 1549-1557. |
Wang W, Liu Y, Qu J F, et al. 2016. Synthesis of hierarchical TiO2-C3N4 hybrid microspheres with enhanced photocatalytic and photovoltaic activities by maximizing the synergistic effect[J]. Chemphotochem, 1(1): 1-12. |
王亚韡, 蔡亚岐, 江桂斌. 2010. 斯德哥尔摩公约新增持久性有机污染物的一些研究进展[J]. 中国科学:化学, 40(2): 99-123. |
夏静芬, 胡煜钗, 常岩航, 等. 2018. TiO2/g-C3N4复合光催化剂的制备及可见光降解罗丹明B研究[J]. 安全与环境学报, 18(6): 2413-2419. |
Yan N N, Zhu Z Q, Zhang J, et al. 2012. Preparation and properties of ce-doped TiO2 photocatalyst[J]. Materials Research Bulletin, 47(8): 1869-1873. DOI:10.1016/j.materresbull.2012.04.077 |
Yang G J, Zhang N, Yang J N, et al. 2020. Interaction between perfluorooctanoic acid and aerobic granular sludge[J]. Water Research, 169: 115249. DOI:10.1016/j.watres.2019.115249 |
Zeng H C, Zhang L, Li Y Y, et al. 2011. Inflammation-like glial response in rat brain induced byprenatal PFOS exposure[J]. Neurotoxicology, 32(1): 130-139. |
Zheng L L, Xiao X Y, Li Y, et al. 2017. Enhanced photocatalytic activity of TiO2 nanoparticles using WS2/g-C3N4 hybrid as co-catalyst[J]. Transactions of Nonferrous Metals Society of China, 27(5): 1117-1126. DOI:10.1016/S1003-6326(17)60130-4 |
Zheng Y, Liu J, Liang J, et al. 2012. Graphitic carbon nitride materials:controllable synthesis and applications in fuel cells and photocatalysis[J]. Energy & Environmental Science, 5(5): 6717-6731. |
Zhou Q, Deng S B, Zhang Q Y, et al. 2010. Sorption of perfluorooctane sulfonate and perfluorooctanoate on activated sludge[J]. Chemosphere, 81(4): 453-458. DOI:10.1016/j.chemosphere.2010.08.009 |
 2020, Vol. 40
2020, Vol. 40


