地下水砷(As)污染问题已经成为国内外热点环境问题.例如, 美国内华达州南部卡尔森沙漠地区地下水砷质量浓度达到2600 μg·L-1 (Welch et al., 1998), 阿根廷某平原地下水中As浓度可高达5300 μg·L-1 (Smedley et al., 2002);巴基斯坦Mailsi地区的地下水As浓度高达11~828 μg·L-1 (Rasool et al., 2016).在我国山西、内蒙、新疆、宁夏、吉林、安徽等省份有超过50万人饮用砷含量超过50 μg·L-1的含砷地下水(Shan et al., 2013).长期饮用或接触高As地下水, 会诱发众多的严重疾病, 如各类皮肤疾病、神经系统和消化系统疾病甚至癌症等(Tapio et al., 2006;丁爱中等, 2007;黄秋婵等, 2009;金阳等, 2015).
施氏矿物(Schwertmannite), 化学式为Fe8O8(OH)8-2x(SO4)x, 1 ≤x≤1.75, 是一种存在于富铁富硫酸盐酸性环境中, 结晶度较差的次生羟基硫酸铁矿物(Burton et al., 2006;刘奋武等, 2013).近年来, 施氏矿物因比表面积大、重(类)金属离子(尤其是As)去除能力强、沉降性能好等优点(王敏等, 2013), 逐渐受到研究者的广泛关注, 进而将其作为吸附剂用于污水As去除领域.在某种程度上, 施氏矿物对水环境中重金属离子的迁移、钝化及生物毒性等行为存在重要影响(廖岳华等, 2007;廖岳华, 2008).然而, 受环境因素的制约, 往往难以从自然界中获得纯度很高的施氏矿物(李浙英等, 2011;朱立超等, 2017).自然水体中存在的阴阳离子可能会对矿物矿相及吸附能力造成一定影响.如有研究表明, 当pH小于3, 且水体中有一价阳离子如K+、Na+、NH4+等存在时, 施氏矿物会转变为结晶度较高的黄铁矾类物质(李浙英等, 2011;朱立超等, 2017), 自然水体温度、pH、Ca2+、Mg2+等因素也会对施氏矿物表面形貌产生明显影响.因此, 纯度很高的施氏矿物常常需要人为调控合成(Liu et al., 2015;Qiao et al., 2017).利用FeCl3·6H2O与Na2SO4合成施氏矿物, 且将矿物进行透析已被证实为是一种行之有效的施氏矿物合成方法, 且透析后施氏矿物比表面积增加(Bigham et al., 1990;刘欢等, 2013;李君菲, 2018).然而本领域仍有部分科学问题需要进一步阐明.例如透析过程是否会改变矿物产生量?不同孔径透析对最终矿物比表面积、孔体积等微观结构存在何种调控?透析后, 施氏矿物除As能力是否会明显提升?
针对上述问题, 本研究在利用FeCl3·6H2O与Na2SO4合成施氏矿物基础上, 采用截留分子量不同的透析袋系统探究不同孔径透析对矿物产生量、矿物比表面积、矿物孔体积、矿物除As能力的影响.研究结果可为施氏矿物高效合成并将其应用于As污染地下水处理领域提供必要的参数支撑.
2 材料与方法(Materials and methods) 2.1 施氏矿物的合成与透析参考Schwertmann与Carlson(2005)与刘欢等(2013)关于化学合成施氏矿物的具体方法, 在一系列有效容积为2 L的玻璃烧杯中, 将10.8000 g FeCl3·6H2O和3.0000 g Na2SO4溶于2 L去离子水, 将整个体系在水浴锅(HHS-21-8型, 上海)中加热到60 ℃, 在该温度下反应约12 min.反应过程中, 用玻璃棒不断进行搅拌.反应后, 将体系溶液冷却至室温, 分别量取400 mL反应后含有施氏矿物的红棕色悬浮液装入截留分子量为100000 Da和20000 Da的透析袋中, 夹子封口后, 置于1.2 L的去离子水体系, 使得去离子水将透析袋全部淹没.每24 h更换一次去离子水, 施氏矿物在两类透析袋中分别透析10、20 d.透析结束后, 用0.45 μm滤膜对透析袋内的溶液进行过滤并收集沉淀, 后将沉淀物在烘箱(BGZ-146型, 上海)中50 ℃条件下烘干至恒重, 过0.149 mm筛备用, 记录所得矿物的质量.同时设置原始施氏矿物直接用0.45 μm滤膜过滤, 且同样温度下烘干的样品作为对照样品.5个处理各做3个重复.对收集的各处理矿物进行比表面积、孔体积分析.
2.2 施氏矿物吸附除As实验参考Liu等(2015)提供的方法配制质量浓度为1 mg·L-1, pH=7.00的As(Ⅲ)标准溶液.准确称取各施氏矿物样品0.0100 g于一系列100 mL具盖塑料瓶中, 依次加入40 mL质量浓度为1 mg·L-1的As(Ⅲ)溶液, 即施氏矿物的质量浓度为0.25 g·L-1.后将各体系置于恒温振荡器(CHA-S型, 常州)在25 ℃与180 r·min-1条件下进行振荡, 并在第0、10、30、60、90、120、180、240 min时, 吸取反应液1 mL过0.22 μm滤膜, 滤液用于As(Ⅲ)浓度的测定, 每个处理设置3个重复.
2.3 测定方法矿物生成量用万分位天平(AX124ZH\E, 美国)准确称量.矿物矿相用X射线衍射仪(MiniFles II, 日本)测定, 测试工作条件为:管电压30 kV, 管电流15 mA, 扫描区间10°~90°(2θ), 步长0.02°, Cu靶(弯晶单色器).矿物形貌采用热场发射扫描电子显微镜(JSM-7001F, 日本)观察分析, 工作距离(样品表面到物镜的距离)9.2~9.7 mm, 加速电压5.0 kV, 同时对矿物进行X射线能谱分析(EDS).采用全自动物理吸附仪(Tristar II 3020, 美国)获得的-195.8 ℃条件下的氮气吸附-脱附等温线, 利用分析软件, 采用计算模型测定合成矿物的比表面积、孔体积及孔径分布.每次测试前, 将合成样品于90 ℃、真空度1.3 Pa条件下真空脱气12 h, 采用Brunauer-Emmett-Teller (BET)方程计算矿物总比表面积;总孔体积由相对压力P/P0 = 0.99时吸附的氮气量计算;采用t-plot模型分析微孔的比表面积与孔体积(Tian et al., 2013);采用Barrett-Joyner-Halenda (BJH)模型对中孔(2~50 nm)比表面积及孔体积进行分析(Zhang et al., 2019).溶液中As(Ⅲ)浓度通过双道原子荧光光度计(AFS-2100, 北京)测定.
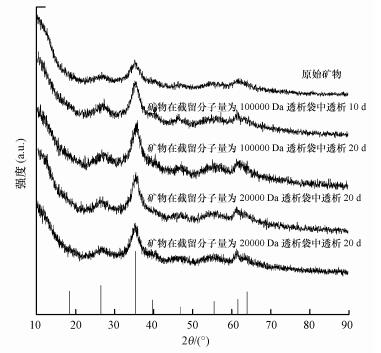
3 结果与讨论(Results and discussion) 3.1 X射线衍射(XRD)分析X射线衍射分析能够区分晶型矿物和非晶型矿物并鉴别矿物种类.图 1为不同透析体系所得施氏矿物XRD图谱.本研究各体系矿物XRD衍射峰分别出现在2θ=18.24°、26.26°、35.16°、39.50°、46.54°、55.30°、61.34°、63.68°的位置, 对比标准施氏矿物XRD衍射峰(JCPDS:PDF 47-1775)及前人合成施氏矿物XRD衍射图谱(Liu et al., 2015;Qiao et al., 2017), 表明本研究各处理所得矿物均为纯施氏矿物.同时从图 1可知, 透析后施氏矿物峰型更为明显, 表明透析过程可提高施氏矿物的结晶程度, 这与刘欢等(2013)的研究结果相类似.
 |
| 图 1 不同透析体系所得施氏矿物XRD图谱 Fig. 1 The XRD patterns of schwertmannite collected from different dialysis treatments |
需要说明的是, 施氏矿物是一种弱晶型矿物, 自然环境中常见于pH为3.0~4.5, SO42-含量为1000~3000 mg·L-1的富铁酸性硫酸盐环境中(Bigham et al., 1994).当体系pH>4.5时, 施氏矿物可转化为针铁矿(Schwertmann et al., 2005;Jönsson et al., 2005), 然而其转化过程非常缓慢.例如, 在pH为7~8的溶液中, 施氏矿物完全转化为针铁矿需要上百天甚至一年的时间(Schwertmann et al., 2005;Kumpulainen et al., 2008).同时, Houngaloune等(2015)却证实了, 体系Fe2+存在会加速施氏矿物向针铁矿转化.本研究施氏矿物在透析过程中体系无Fe2+存在, 透析袋内溶液pH从~1.50增加到最终的~4.50, 整个过程(10~20 d)不足以让施氏矿物发生明显矿相转化.同时, 较多研究人员常把化学合成施氏矿物在去离子水中透析30 d来完成矿物纯化, 也未观察到施氏矿物矿相发生明显转化(Carlson et al., 2002;Schwertmann et al., 2005), 但是本研究不能排除透析体系有很少量施氏矿物逐渐向针铁矿转变的趋势.
3.2 施氏矿物生成量及颜色变化不同透析体系所得施氏矿物的生成量及颜色变化如图 2所示, 未经透析处理合成的施氏矿物颜色为棕褐色, 经截留分子量为100000 Da、20000 Da透析袋透析10 d后, 合成施氏矿物的颜色开始呈现黄色, 这与李浙英等(2011)报道的用二价铁氧化合成的施氏矿物和李君菲(2018)报道的三价铁水解合成施氏矿物的颜色相一致.大量铁离子透析出固相体系可能是矿物颜色变化的主要原因.前人研究证实, 次生铁矿物中铁含量较高时, 矿物颜色呈现红棕色, 当矿物中铁含量逐渐降低时, 矿物颜色逐渐向黄色转变(Gramp et al., 2008;刘奋武等, 2015).矿物生成量是衡量施氏矿物不同合成方法优劣的一个重要参考.本研究中, 未经透析处理矿物生成量为0.6419 g·L-1, 利用截留分子量为100000 Da透析袋透析10 d与20 d后, 矿物合成量增加了69.96%与70.70%.利用截留分子量为20000 Da透析袋透析10 d与20 d后, 矿物合成量增加了77.43%与79.84%.研究结果表明随着透析孔径的变小、透析时间的延长, 矿物生成量呈现增加趋势.可见, 在10~20 d的透析过程中, 施氏矿物仍在不断的合成.同时, 小孔径长期透析(截留分子量为20000 Da透析袋透析20 d)更易增加矿物产生量.
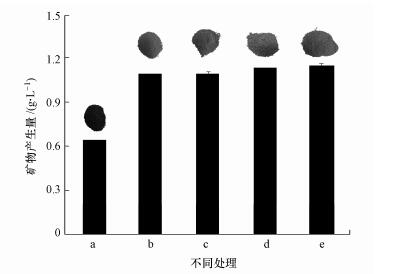 |
| 图 2 不同透析体系所得施氏矿物产生量及颜色变化 (a.原始施氏矿物;b.截留分子量为100000 Da透析袋透析10 d;c:截留分子量为100000 Da透析袋透析20 d;d:截留分子量为20000 Da透析袋透析10 d;e.截留分子量为20000 Da透析袋透析20 d) Fig. 2 The synthetic amount and colour of schwertmannite collected from different dialysis treatments |
透析过程中透析袋溶液pH从~1.50逐渐增加至~4.50可能是导致施氏矿物产生量增加的主要原因.施氏矿物合成是一个产生H+的过程, 体系pH增加可能会加速矿物的合成.与施氏矿物相类似, 黄铁矾是富铁酸性硫酸盐体系一价阳离子(K+、Na+、NH4+)含量较高时存在的又一次生铁矿物(Bai et al., 2011), 且黄铁矾合成也是一产生H+的过程.刘奋武等(2015)研究表明, 当13.4 mmol·L-1 OH-引入施氏矿物与黄铁矾共合成体系时, 体系总铁沉淀率从34.4%增加至43.8%, 换言之, 体系矿物产生量增加.
3.3 矿物形貌及X射线能谱分析图 3为各处理体系所得施氏矿物的扫描电子显微镜照片(SEM)及X射线能谱分析图(EDS).由图可知, 原始施氏矿物呈现明显的不规则块状结构, 棱角分明, 颗粒相对分散.
 |
| 图 3 不同透析体系所得施氏矿物的SEM与EDS Fig. 3 The SEM and EDS of schwertmannite collected from different dialysis treatments |
李浙英等(2011)采用氧化亚铁硫杆菌生物合成施氏矿物, 发现施氏矿物形貌呈现“海胆”毛刺状结构.Liu等(2015)采用亚铁溶液体系滴加双氧水的方法化学合成施氏矿物, 发现矿物形貌为规则的圆球型, 并且随着亚铁氧化速率降低, 球型形貌表面出现丰富的毛刺状结构.可见, 施氏矿物形貌与合成方法有明显的相关性.本研究中, 矿物在60 ℃条件下快速合成可能是导致其形貌呈现不规则块状的主要原因.原始施氏矿物经过透析后, 颗粒表面显得粗糙, 尤其是在截留分子量为100000 Da及20000 Da透析袋中透析20 d, 矿物趋向于细小球形, 并且颗粒间团聚现象明显.不同体系矿物EDS分析结果表明, 原始矿物中主要由Fe、O、S、Cl 4种元素组成, 其质量百分数分别为:54.01%、39.19%、5.61%、1.19%, 但在截留分子量为100000 Da和20000 Da条件透析10~20 d后, 矿物中检测不到Cl元素的存在, 可见透析过程能将原始矿物中Cl元素逐步透析出固相体系, 进而说明透析处理有利于固相体系杂质离子的去除.杂质离子的去除可能能够提高矿物纯度, 进而使得透析后矿物特征衍射峰更加明显(图 1).此外, 原始矿物粒径为~3~40 μm, 经过透析后矿物粒径变小.例如, 矿物在100000 Da与20000 Da条件下透析20 d后, 粒径减少至~0.1~1 μm.值得一提的是, 从图 3各体系矿物EDS图谱提供的Fe与S元素含量进行分析可以推断, 原始矿物化学式可表示为Fe8O8(OH)5.09(SO4)1.45, 矿物在截留分子量为100000 Da透析袋中透析10 d与20 d, 矿物化学式转化为Fe8O8(OH)5.93(SO4)1.04与Fe8O8(OH)6.15(SO4)0.92.矿物在截留分子量为20000 Da透析袋中透析10 d与20 d, 矿物化学式转化为Fe8O8(OH)5.70(SO4)1.15与Fe8O8(OH)6.13(SO4)0.93.可见, 施氏矿物经过透析后, 矿物Fe/S比明显增加.综上所述, 施氏矿物经过透析后, 矿物粒径减少显著, 矿物化学组成发生改变, 矿物形貌发生重构.
3.4 矿物比表面积及孔隙结构分析不同透析体系所得施氏矿物的比表面积与平均孔径见表 1.本研究原始施氏矿物比表面积与刘欢等(2013)报道的施氏矿物比表面积(127.5 m2·g-1)接近.
| 表 1 不同透析体系所得施氏矿物比表面积及平均孔径的变化 Table 1 Specific surface area, and average pore size of schwertmannite collected from different dialysis treatments |
原始矿物总比表面积、微孔比表面积与中孔比表面积分别为156.34、15.25与130.42 m2·g-1.矿物在截留分子量为100000 Da透析袋中透析20 d后, 上述各指标分别增加了68.75%、439.90%与30.63%;在截留分子量为20000 Da透析袋中透析20 d后, 分别增长了45.85%、395.11%与9.96%.可见, 当透析时间为20 d, 增大透析孔径更利于增加矿物的比表面积、微孔比表面积与中孔比表面积.然而, 若透析时间较短(10 d), 减小透析孔径却更有利于矿物比表面积、微孔比表面积与中孔比表面积的增加(表 1).此外, 透析过程提高了矿物的平均孔径.例如, 矿物在截留分子量为100000 Da与20000 Da条件下透析20 d后, 施氏矿物平均孔径由初始的3.25 nm分别增加至10.23 nm与11.19 nm, 增加了214.77%与244.31%.而在截留分子量为100000 Da与20000 Da条件下透析10 d后, 平均孔径增加到10.95 nm与10.89 nm, 增加了236.92%与235.08%.
图 4为不同透析体系所得施氏矿物N2吸附-脱附等温线及孔径分布情况.由图 4吸附-脱附等温线可知, 各个处理吸附脱附等温线上存在明显的回滞环, 而根据国际联盟纯化学和应用化学(IUPAC)对回滞环的分类(Leofanti et al., 1998), 原始矿物吸附脱附等温线上的回滞环形状类似于H2型, 孔型可能包括典型的“墨水瓶”孔、孔径分布不均的管形孔和密堆积球形颗粒间隙孔.而透析矿物的吸附脱附等温线形状和回滞环类似于H3型, 孔型常以狭缝状孔为主.相关结果表明透析处理使得合成矿物的孔隙结构发生明显变化.此外, 各个处理体系孔径分布也在图 4中给出, 原始矿物总孔体积为0.1155 m3·g-1, 微孔孔体积为0.0060 m3·g-1, 中孔孔体积为0.1055 m3·g-1.在截留分子量为100000 Da透析袋中透析20 d后, 分别增长了332.79%、491.61%、220.36%;在截留分子量为20000 Da透析袋中透析20 d后, 分别增长了287.25%、419.92%、211.95%.可见, 当透析时间为20 d时, 增大透析孔径更利于增加矿物总孔体积、微孔体积及中孔体积.与比表面积变化规律相类似, 当缩短透析时间至10 d时, 减小透析孔径却更有利于增加矿物总孔体积、微孔体积及中孔体积.
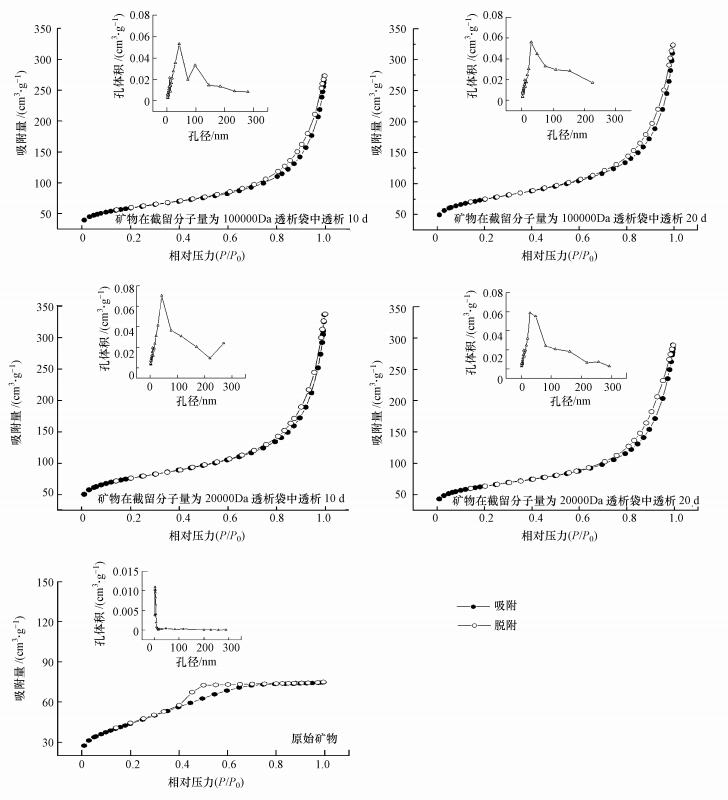 |
| 图 4 不同透析体系所得施氏矿物N2吸附-脱附等温线及孔径分布 Fig. 4 The N2 adsorption-desorption isotherms and pore size distribution of of schwertmannite collected from different dialysis treatments |
综上所述, 采用小孔径透析, 延长透析时间增加了矿物平均孔径, 降低了矿物比表面积与孔体积.采用大孔径透析, 延长透析时间反而降低了矿物平均孔径, 增加了矿物的比表面积与孔体积.本研究中, 施氏矿物在透析过程中, 无机离子(Fe3+、SO42-、Cl-)不断透析出固相体系, 矿物形貌从大的片块状重构为团聚小球状也许是矿物比表面积与孔体积在透析后显著增加的主要原因.
3.5 施氏矿物对As(Ⅲ)的去除效果不同透析处理体系所得施氏矿物对溶液中As(Ⅲ)去除效果如图 5所示.可见, 随着吸附时间的延长, 各体系矿物对As(Ⅲ)的去除呈逐渐增加的趋势, 并且在前10 min吸附去除速率最快, 这与Liao等(2011)报道的结果相类似.
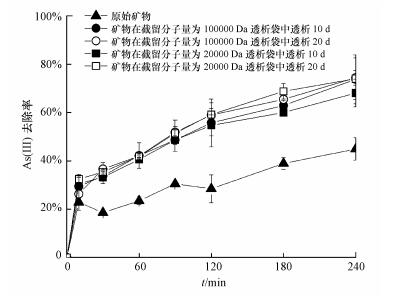 |
| 图 5 不同透析处理所得施氏矿物对As(Ⅲ)吸附去除效果 Fig. 5 Removal of As(Ⅲ) by schwertmannite collected from different dialysis treatments |
在第240 min, 原始施氏矿物对As(Ⅲ)去除率为44.93%, 在截留分子量为100000 Da透析袋中透析10 d与20 d的矿物对As(Ⅲ)去除率达73.76%与74.40%, 较原始矿物提高了64.16%与65.60%.而在截留分子量为20000 Da透析袋中透析10 d与20 d的矿物对As(Ⅲ)的去除率分别为68.07%与74.02%, 较原始矿物提高了51.50%与64.74%.可见, 透析处理能够显著提高施氏矿物对As(Ⅲ)的去除率.其中, 延长透析时间、增大透析孔径对提高矿物除As(Ⅲ)能力尤为明显.Liao等(2011)采用生物合成的施氏矿物吸附去除溶液中As(Ⅲ), 当原始As(Ⅲ)浓度为1 mg·L-1, 施氏矿物加入量为0.25 g·L-1时, 240 min后As(Ⅲ)吸附可达到平衡, 去除率可达到99.1%.本研究采用类似处理条件, 240 min后As(Ⅲ)吸附尚未达到平衡, 去除率不及80%.结合图 5与表 1相关结果, 可见比表面积可能不是调控施氏矿物除As(Ⅲ)的唯一参数, 相关科学问题有待后续探究.施氏矿物吸附除砷呈现出一定的应用潜力, 对施氏矿物进行快速(时间短)、高质(吸附性能高)、低耗(能耗低)合成, 设计高效的施氏矿物除砷反应器, 可能是今后施氏矿物在地下水除砷领域应用的关键瓶颈.
4 结论(Conclusions)FeCl3·6H2O与Na2SO4合成的施氏矿物经透析处理后, 施氏矿物颜色逐渐由棕褐色转变为黄棕色, 矿物生成量明显增加, 小孔径长期透析更易增加矿物产生量.原始矿物中含有的氯离子被完全透析出固相体系, 施氏矿物经不同孔径透析后总比表面积, 微孔比表面积, 中孔比表面积明显增大;总孔体积, 微孔体积, 中孔体积也显著增加, 矿物吸附除砷能力增强.然而, 长期透析(20 d), 大孔径透析更利于增加矿物总孔体积与比表面积.短期透析(10 d), 小孔径透析却更利于增加矿物总孔体积与比表面积.
Burton E D, Bush R T, Sullivan L A. 2006. Sedimentary iron geochemistry in acidic waterways associated with coastal lowland acid sulfate soils[J]. Geochimica et Cosmochimica Acta, 70(22): 5455-5468. DOI:10.1016/j.gca.2006.08.016 |
Bigham J M, Schwertmann U, Carlson L, et al. 1990. A poorly crystallized oxyhydroxysulfate of iron formed by bacterial oxidation of Fe(Ⅱ) in acid mine waters[J]. Geochimica Et Cosmochimica Acta, 54(10): 2743-2758. DOI:10.1016/0016-7037(90)90009-A |
Bigham J M, Carlson L, Murad E. 1994. Schwertmannite a new iron oxyhydrohysulfate from Pyhäsalmi, Finland, and other localities[J]. Mineralogical Magazine, 58: 641-648. DOI:10.1180/minmag.1994.058.393.14 |
Bai S Y, XU Z H, Wang M, et al. 2012. Both initial concentrations of Fe(Ⅱ) and monovalent cations jointly determine the formation of biogenic iron hydroxysulfate precipitates in acidic sulfate-rich environments[J]. Materials Science and Engineering:C, 32: 2323-2329. DOI:10.1016/j.msec.2012.07.003 |
柏双友, 周立祥. 2011. 微生物接种密度和矿物收集时间对生物沥浸中次生铁矿物形成的影响[J]. 微生物学通报, 38(4): 487-492. |
Carlson L, Bigham J M, Schwertmann U, et al. 2002. Scavenging of As from acid mine drainage by schwertmannite and ferrihydrite:A comparison with synthetic analogues[J]. Environmental Science and Technology, 36: 1712-1719. DOI:10.1021/es0110271 |
丁爱中, 杨双喜, 张宏达. 2007. 地下水砷污染分析[J]. 吉林大学学报(地球科学版), 37(2): 319-325. |
Gramp J P, Jones F S, Bigham J M, et al. 2008. Monovalent cation concentrations determine the types of Fe(Ⅲ) hydroxysulfate precipitates formed in bioleach solution[J]. Hydrometallurgy, 94(1/4): 29-33. |
Houngaloune S, Hiroyoshi N, Ito M. 2015. Effect of Fe(Ⅱ) and Cu(Ⅱ) on the transformation of schwertmannite to goethite under acidic condition[J]. International Journal of Chemical Engineering and Applications, 6: 32-37. DOI:10.7763/IJCEA.2015.V6.446 |
黄秋婵, 韦友欢, 吴颖珍. 2009. 砷污染对人体健康的危害效应研究[J]. 微量元素与健康研究, 26(4): 65-67. |
金阳, 姜月华, 李云. 2015. 地下水砷污染研究进展[J]. 地下水, 37(1): 67-69. DOI:10.3969/j.issn.1004-1184.2015.01.027 |
JCPDS, Mineral Powder Diffraction Files[Z]. 2002. International Center for Diffraction Data, Swarthmore, Pennsylvania
|
Jönsson J, Persson P, Sjöberg S, et al. 2005. Schwertmannite precipitated from acid mine drainage:phase transformation, sulphate release and surface properties[J]. Applied Geochemistry, 20: 179-191. DOI:10.1016/j.apgeochem.2004.04.008 |
Kumpulainen S, Räisänen M L, Kammer F V D, et al. 2008. Ageing of synthetic and natural schwertmannites at pH 2~8[J]. Clay Minerals, 43: 437-448. DOI:10.1180/claymin.2008.043.3.08 |
Liao Y H, Liang J R, Zhou L X. 2011. Adsorptive removal of As(Ⅲ) by biogenic schwertmannite from simulated As-contaminated groundwater[J]. Chemosphere, 83(3): 295-301. DOI:10.1016/j.chemosphere.2010.12.060 |
Leofanti G, padovan M, Tozzola G, et al. 1998. Surface area and pore texture of catalysts[J]. Catalysis Today, 41(1): 207-219. |
Liu F W, Zhou J, Zhang S S, et al. 2015. Schwertmannite synthesis through ferrous ion chemical oxidation under different H2O2 supply rates and its removal efficiency for arsenic from contaminated groundwater[J]. Plos One, 10(9): e138891. |
廖岳华, 周立祥. 2007. 极端酸性环境下形成的施威特曼石(schwertmannite)及其环境学意义[J]. 岩石矿物学杂志, 26(2): 177-183. DOI:10.3969/j.issn.1000-6524.2007.02.010 |
廖岳华. 2008.施氏矿物的生物合成及去除水中砷的效果与机理研究[D].南京: 南京农业大学 http://d.wanfangdata.com.cn/Thesis/Y1491990
|
刘奋武, 卜玉山, 田国举, 等. 2013. 温度与pH对生物合成施氏矿物在酸性环境中的溶解行为及对Cu2+吸附效果的影响[J]. 环境科学学报, 33(9): 2445-2451. |
刘奋武, 高诗颖, 王敏, 等. 2015. KOH对富铁富硫酸盐酸性环境中生物成因次生铁矿物合成的影响[J]. 环境科学学报, 35(2): 476-483. |
李君菲. 2018. Cu(Ⅱ)对酸性矿山废水中负载含氧阴离子施氏矿物溶解与相转变的影响[D].广州: 华南理工大学
|
李浙英, 梁剑茹, 柏双友, 等. 2011. 生物成因与化学成因施氏矿物的合成、表征及其对As(Ⅲ)的吸附[J]. 环境科学学报, 31(3): 460-467. |
梁剑茹, 李浙英, 刘奋武, 等. 2012. 预处理后生物成因施氏矿物的矿物学特征及对As(Ⅲ)吸附的影响[J]. 环境科学, 33(10): 3606-3612. |
刘欢, 陆现彩, 欧阳冰洁, 等. 2013. 氯化铁-硫酸钠体系中合成的施威特曼石的稳定性[J]. 硅酸盐学报, 41(5): 663-668. |
Qiao X X, Liu L L, Shi J, et al. 2017. Heating changes bio-schwertmannite microstructure and arsenic(Ⅲ) removal efficiency[J]. Minerals, 7: 9. DOI:10.3390/min7010009 |
Rasool A, Farooqi A, Masood S, et al. 2016. Arsenic in groundwater and its health risk assessment in drinking water of Mailsi, Punjab, Pakistan[J]. Human and Ecological Risk Assessment:An International Journal, 22(1): 187-202. DOI:10.1080/10807039.2015.1056295 |
Schwertmann U, Carlson L. 2005. The pH-dependent transformation of schwertmannite to goethite at 25℃[J]. Clay Minerals, 40(1): 63-66. DOI:10.1180/0009855054010155 |
Shan H M, Dong Y H, He X, et al. 2013. Hydrogeochemical characteristics of high As and high F groundwater in Hangjinhouqi, Hetao Plain, China[J]. Procedia Earth and Planetary Science, 7: 373-376. DOI:10.1016/j.proeps.2013.03.053 |
Smedley P L, Nicolli H B, Macdonald D M J, et al. 2002. Hydrogeochemistry of arsenic and other inorganic constituents in groundwaters from La Pampa, Argentina[J]. Applied Geochemistry, 17(3): 259-284. DOI:10.1016/S0883-2927(01)00082-8 |
Tapio S, Grosche B. 2006. Arsenic in the aetiology of cancer[J]. Mutation Research/Reviews in Mutation Research, 612(3): 215-246. DOI:10.1016/j.mrrev.2006.02.001 |
Tian H, Xiao X M, Wilkins R W T, et al. 2013. A preliminary study on the pore characterization of Lower Silurianblack shales in the Chuandong Thrust Fold Belt, southwestern China using low pressure N2 adsorption and FE-SEM methods[J]. Marine and Petroleum Geology, 48: 8-19. DOI:10.1016/j.marpetgeo.2013.07.008 |
Welch A H, Lico M S. 1998. Factors controlling As and U in shallow ground water, southern Carson Desert, Nevada[J]. Applied Geochemistry, 13(4): 521-539. DOI:10.1016/S0883-2927(97)00083-8 |
王敏, 梁剑茹, 周立祥. 2013. 晶种和钾离子促进生物成因黄铁矾形成的作用机制[J]. 南京农业大学学报, 36(2): 97-102. |
Zhang Z, Guo G L, Li X T, et al. 2019. Effects of hydrogen-peroxide supply rate on schwertmannite microstructure and chromium(Ⅵ) adsorption performance[J]. Journal of Hazardous Materials, 367: 520-528. DOI:10.1016/j.jhazmat.2018.12.116 |
朱立超, 刘元元, 李伟民, 等. 2017. 施氏矿物的化学合成及其对含Cr(Ⅵ)地下水吸附修复[J]. 环境科学, 38(2): 629-639. |
 2020, Vol. 40
2020, Vol. 40


