2. 广州德隆环境检测技术有限公司, 广州 511400
2. Guangzhou Delong Environmental Testing Technology Co., Ltd., Guangzhou 511400
近年来, 由遗传毒性物质引发的环境问题备受关注.由于水体中的遗传毒性物质种类多样, 常产生叠加毒性效应.传统的化学分析方法只能针对单一的已知化合物进行定量分析, 且不能评价样品的综合遗传毒性, 因此需采用生物分析方法来检测水质的遗传毒性(Leusch et al., 2015; Guan et al., 2017).
生物分析方法又分为长期测试和短期测试.短期测试方法通常利用植物、动物或微生物等生物细胞检测化合物对DNA的损伤毒性, 常见的有细菌回复突变试验(Ames试验)、微核试验、染色体畸变试验、单细胞凝胶电泳试验(即彗星试验)(Zeng et al., 2019)和SOS/umu试验(Raman et al., 2012)等.其中SOS/umu试验是目前国际通用的标准方法(ISO/DIS 13829, DIN 38415-3).该技术是在鼠伤寒沙门氏菌(Salmonella typhimurium TA1535)中导入含有SOS响应启动子umuC及报告基因LacZ的质粒pSK1002.由于该系统所用的鼠伤寒沙门氏菌为致病菌, 操作步骤相对繁琐, 且不能排除样品颜色的干扰, 从而制约了其大范围推广.本课题组成员前期构建了一株重组大肠杆菌, 首次在SOS响应启动子下游引入了导致大肠杆菌裂解的基因SRRz基因, 在物理信号(UV)的诱导下, 可启动裂解基因SRRz的表达, 对大肠杆菌的细胞生长和快速裂解实现了物理可控(Li et al., 2007).
本研究首次将上述重组大肠杆菌应用于水质遗传毒性检测中, 先以已知的几种遗传毒性化合物进行阳性实验检测, 验证体系有效性; 随后建立Cr(Ⅵ)等效剂量标准曲线, 以此对3种不同的排污水进行检测以评估其遗传毒性.
2 材料与方法(Materials and methods) 2.1 试剂实验中使用的主要化学药品:两性霉素B(amphotericin B, CAS 1397-89-3)、氯化苄(benzylchloride, CAS 100-44-7)、克菌丹(captan, CAS 133-06-2)、萘啶酮酸(nalidixic acid, CAS 398-08-2)、邻硝基苯β-d-半乳吡喃糖苷(ONPG)和二甲基亚砜(DMSO)均购自于Sigma-Aldrich公司(美国密苏里州圣路易斯).重铬酸钾(分析纯), 由天津市大茂化学试剂厂制造.
2.2 实验菌株重组菌株E. coli BL21/pUC-PST来源于课题组前期构建(Li et al., 2007).该菌株构建过程, 首先是将DNA SOS响应元件(PumuDC)与来源于噬菌体的裂解基因(SRRz)融合, 并在其下游引入终止子, 最终插入大肠杆菌常规质粒pUC18骨架位置, 获得载体pUC-PST.
2.3 环境水样的前处理2017年9月, 实验人员分别从广东省广州市某五金、调味品、光电技术工厂排污口采集了水样, 并将其分别命名为DL201709-A0170F、DL201709-B0131和DL201709-B0135.分别采集2 L水样, 经1.2 μm Whatman GF/C玻璃纤维纸过滤后, 再用HLB柱(500 mg, OASIS, USA)富集, 富集前HLB柱依次加入6 mL正己烷, 6 mL丙酮, 6 mL甲醇和6 mL超纯水进行活化, 然后用20 mL丙酮洗脱固相萃取后的样品.洗脱液用氮吹仪进行干燥后置换溶剂为DMSO, 定容至10 mL, 于-20 ℃保存.
2.4 遗传毒性物质对菌体密度影响的测定当毒性物质接触菌液后, 会导致菌体密度下降.在96孔板内分别加入198 μL菌液和2 μL样品, 设置3个平行, 用DMSO溶剂作为对照.置于摇床内(37 ℃, 250 r·min-1)培养0.5 h后, 每隔一段时间用酶标仪测定菌体密度(OD600值).以加入药品后在特定时间测得的OD600值与加入溶剂对照(DMSO)的OD600值进行对比来判断化学物质是否具有遗传毒性.
2.5 重组菌株β-半乳糖苷酶酶活检测以β-半乳糖苷酶作为检测菌体裂解效率的报告蛋白.酶活测定参照文献方法进行(Miller et al., 1972).反应结束后在10 min内, 分别用酶标仪测定其在420 nm和550 nm波长的吸光度, 酶活计算公式如下:

|
(1) |
式中, Abs420、Abs550和Abs600为吸光度值, t为加入反应底物后的反应时间, V为样品稀释后的体积(mL).
2.6 重组菌株裂解效率的测定在30 ℃, 250 r·min-1的条件下摇瓶培养重组菌株至OD600值约0.4~0.5, 加入终浓度为0.1 mmol·L-1 IPTG诱导报告蛋白表达, 继续培养至OD值约为0.6~0.8, 加入不同浓度的药品后继续培养.2 h(暴露时间)后, 测定OD600值.同时取出5 mL菌液于5000 r·min-1、4 ℃条件离心15 min, 上清用于胞外酶活(Eextra)测定, 菌体于冰水混合物中超声破碎, 取上清液, 用于胞内酶活(Eintra)测定.菌体裂解效率计算公式如下:
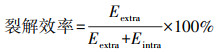
|
(2) |
对每种药品设置不同的浓度梯度, 并以DMSO为空白对照, 根据裂解效率与药品浓度的关系, 用Graphpad软件计算各药品的剂量-效应标准曲线.由于Cr(Ⅵ)能与DNA相互作用, 具有公认的致突变性(Nickens et al., 2010), 本研究选其作为标准毒性物质, 根据Cr(Ⅵ)的剂量-效应标准曲线, 测算其他化学混合物的Cr(Ⅵ)等效浓度, 用于评价其遗传毒性.
2.7 检测限(LOD, limit of detection)为了估算各药品的最低检出浓度, 本研究采用文献(Armbruster et al., 1994; Armbruster et al., 2008)给出的检测限定义和公式, 即LOD由空白对照(DMSO)的平均值(Mean)和标准差(SD)确定, 计算公式如下:
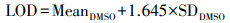
|
(3) |
由于未加药品也会存在菌体裂解现象, DMSO对菌体裂解有轻微影响, 因此要扣除该背景噪声.利用Graphpad软件计算DMSO对应的各裂解效率的均值和标准差, 利用以上公式计算出DMSO的背景噪声值, 将该值代入各药品的剂量-效应曲线中, 即得出各药品的检测限.
3 结果与讨论(Results and discussion) 3.1 菌株对已知遗传毒性化合物的定性检测该大肠杆菌重组菌株E. coli BL21/pUC-PST在UV的诱导下能快速裂解, 为了测试该菌株是否对其他具有遗传毒性的化合物产生SOS响应, 本研究选取了4种已知毒性的化学药品对本菌进行评估.
由文献可知(Milic et al., 2004; 朴瑛等, 2013), 两性霉素B、氯化苄、克菌丹和萘啶酮酸, 均具有不同程度的遗传毒性.根据经典SOS/umu测试确定的这4种化药的检测限(Reifferscheid et al., 1991), 先采用约10倍检测限浓度的药品作用于重组菌株, 即使用5 mmol·L-1两性霉素B, 2 mmol·L-1氯化苄, 3.5 μmol·L-1克菌丹和5 μmol·L-1萘啶酮酸.DMSO为药品空白对照, 大肠杆菌E. coli BL21为菌株空白对照.由于处于DNA复制期的菌群对遗传毒性最为敏感, 因此本研究选择处于对数生长期的细菌进行实验(Hughes et al., 2017), 此时的菌体密度在0.4~0.6左右.由图 1a可知, 大肠杆菌E. coli BL21菌株接触这4种药品2 h后并未观察到菌体密度下降, 与空白对照(DMSO)的一致, 说明在此浓度下, 药品不会对细菌生长产生细胞毒性引起细胞死亡.由图 1b~1e可知, 重组菌株E. coli BL21/pUC-PST接触这4种药品之后, 与DMSO对照相比, 其菌体密度在0.5 h就出现明显下降, 且在加药接近2 h降到最低点, 之后菌体密度不再下降.说明重组菌株菌体密度的显著下降是由于化学药品诱导了SOS启动子的响应, 导致其下游的裂解基因SRRz表达, 大肠杆菌细胞壁/膜被破坏.
 |
| 图 1 不同药品对菌株生长的影响 Fig. 1 Cell density changes when E. coli cells incubated with different chemicals (a. E. coli BL21/pUC18, b~e. E. coli BL21/pUC18-PST, f.细胞浊度照片) |
本文进一步将5 mL菌液与各药品(浓度同上)在室温下孵育, 0.5 h后可肉眼观察到菌液变澄清(图 1f).与经典的SOS/umu相比(Oda et al., 1995), 由于该检测方法不需要依赖先进的仪器设备, 不需要繁琐的操作流程, 且响应时间快速, 非常适用于对环境样品进行大规模的初筛.由此可知, 该重组菌株携带的SOS响应启动子能对化学信号产生响应并引起裂解基因SRRz的表达.在早期基于SOS响应的毒性检测中, 主要的宿主菌为鼠伤寒沙门氏菌, 有致病的风险, 应用大肠杆菌作为宿主菌可以规避此风险.其次, 早期的检测系统采用的报告蛋白多为β-半乳糖苷酶(Oda et al., 1985), 荧光素酶(Davidov et al., 2000), 碱性磷酸酶(Biran et al., 2011)和绿色荧光蛋白(Althorpe et al., 1999), 酶活测定所用底物较昂贵, 荧光强度测定需要借助先进仪器, 而本方法的报告基因是促使细菌膜裂解的蛋白, 仅靠肉眼就能辨别样品是否具有毒性, 操作成本大幅度降低, 操作非常简便, 有望用于制造简易的便携式装置用于现场监测.
3.2 菌株对已知遗传毒性化合物的定量检测为了便于对遗传毒性进行评估, 本文进一步对药品的剂量-响应效果做定量研究.考虑到细胞浊度易受外界颗粒状物质影响, 为了更准确地表征菌体的裂解效率, 本研究采用因细胞裂解而释放到细胞外的β-半乳糖苷酶作为标志物, 测定菌体裂解效率.并绘制各药品的剂量效应曲线(图 2).拟合结果显示, 拟合曲线R2值接近1, 可以较好地反映测试药品浓度和所致的菌体裂解百分比之间的关系, 说明重组菌株E. coli BL21/pUC-PST对4种化学药品均呈现明显的剂量依赖性.各药品的剂量效应曲线方程分别为:两性霉素B:Y=100.16/1+100.278517-1.059x-27.76;氯化苄:Y=58.94/1+100.7410308-3.466x+4.93;克菌丹:Y=64.201/1+103.025728-3.06x+5.689;萘啶酮酸:Y=70.03/1+100.7226947-1.043x.
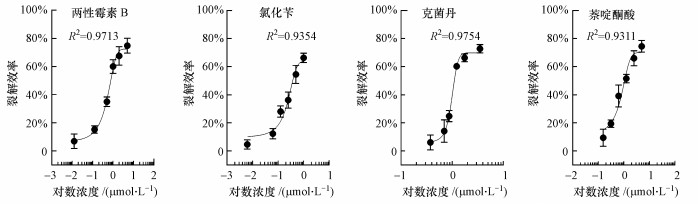 |
| 图 2 4种药品的剂量效应曲线 Fig. 2 Dose-response curves of E. coli BL21/pUC-PST when incubated with four chemicals, separately |
通过剂量效应曲线方程, 推演出该菌株对两性霉素B、氯化苄、克菌丹和萘啶酮酸的最低检出限(LOD)分别为0.32 mmol·L-1, 0.11 mmol·L-1, 0.07 μmol·L-1和2.14 μmol·L-1(表 1), 这4种药品的检出限均在μmol·L-1和mmol·L-1级别, 说明该体系具有较好的灵敏性, 与经典SOS/umu方法相比(Reifferscheid et al., 1991), 4种药品的检测限均更低, 特别是克菌丹, 检出限约为经典方法的1/5, 说明其远优于经典的检测方法.综上结果可知, 本文检测方法的灵敏性优于经典的SOS/umu测试, 可以实现遗传毒性物质的定量检测.
| 表 1 4种毒性药品检测限 Table 1 The LOD of four drugs |
水体中的遗传毒性物质成分非常复杂, 某一化学品是否具有遗传毒性物质, 现在标准尚未完全建立, 近些年不断有新的化合物被发现具有遗传毒性物质.目前国内外研究也未建立可以通过某一个或某几个设备组合完全检测出全部的遗传毒性物质的方法, 只能针对其中某一类化合物进行有限检测(Ivask et al., 2002; Chai et al., 2018).此外, 环境样品中, 通常多种化合物并存, 相互之间可能存在交互影响.因此单独检出某种化合物的存在, 并不能全面反映待测样品的、真实的遗传毒性强弱.基于此, 近些年发展起来的基于对样品全局遗传毒性物质的生物检测方法, 因其快速、具有筛查混合样品遗传毒性物质的潜力, 而获得了学者的关注(Tang et al., 2013; Veyrand et al., 2017).
Cr(Ⅵ)化合物是强氧化剂, 在国内外工农业生产中有着广泛应用.20世纪90年代, 国际癌症研究所已将Cr(Ⅵ)化合物列为人类确定的致癌物(Mattagajasingh et al., 2008; Xiaohua et al., 2012).而我国也将职业接触Cr(Ⅵ)所致的肺癌列为法定职业肿瘤之一.鉴于此, 本研究拟选用Cr(Ⅵ)作为遗传毒性物质的等效试剂(Das et al., 2010), 通过监测样品所含毒性物质能够引起的细胞响应, 根据剂量效应曲线计算出样品中的等效Cr(Ⅵ)浓度, 以此表征样品中的遗传毒性强弱.
绘制Cr(Ⅵ)的剂量-效应标准曲线, 如图 3所示.该曲线的R2值反映出裂解效率和药物浓度之间呈现明显的剂量-响应关系.随着药物浓度增加, 裂解效率逐渐增加, 直到达到最大裂解效率为约70%, 且得到Cr(Ⅵ)的检测限为0.03 μmol·L-1, 优于饮用水标准中的极限值, 同时根据曲线拟合方程推出Cr(Ⅵ)的剂量效应曲线方程为:
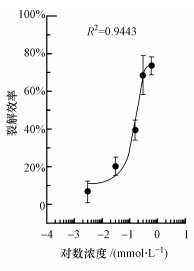 |
| 图 3 重组菌株在Cr(Ⅵ)作用下的剂量效应曲线 Fig. 3 The dose-response curve of recombinant strain to Cr(Ⅵ) |

|
(4) |
本文选取了3个水样进行遗传毒性测试, 其中某光电科技公司的水样(DL201709-B0135)检测结果为阳性, 结果如表 2所示, 水样经前处理后浓缩了200倍, 在此基础上进行倍比稀释, 分别检测相应的裂解效率, 随着水样浓缩倍数的增加, 菌体裂解效率显著增加, 表明水样中存在遗传毒性物质.将裂解效率代入Cr(Ⅵ)标准曲线, 可得到该水样的遗传毒性强度相当于水中存在0.08 μmol·L-1 Cr(Ⅵ).
| 表 2 环境水样中遗传毒性物质含量表 Table 2 Inventory of genotoxic substances in environmental water sample |
利用Cr(Ⅵ)等效浓度换算, 可实现对水样等复杂混合物的半定量毒性分析, 并具有良好的灵敏性.由此可知, 本方法具有成本低, 耗时短, 无需先进设备等优点, 能快速对环境样品的遗传毒性进行定性与定量分析, 优于目前常用的SOS/umu经典方法, 因而在环境检测中具有广泛的应用前景.
4 结论(Conclusions)1) E. coli BL21/pUC-PST重组菌株具有对遗传毒性化合物快速响应的能力, 接触0.5 h后可凭裸眼观察菌液浊度是否发生明显降低, 作为定性判断受试物是否具有遗传毒性的初步标准.
2) 与经典的SOS/umu显色法相比, 该检测方法具有更高的灵敏性.
3) 该方法适用于检测环境水样中的直接遗传毒性.根据Cr(Ⅵ)的剂量效应曲线, 可实现对复杂水样的遗传毒性进行半定量分析.
Althorpe N J, Chilley P M, Thomas A T, et al. 1999. Transient transcriptional activation of the Incl1 plasmid anti-restriction gene (ardA) and SOS inhibition gene (psiB) early in conjugating recipient bacteria[J]. Molecular Microbiology, 1(31): 133-142. |
Armbruster D A, Terry P. 2008. Limit of blank, limit of detection and limit of quantitation[J]. The Clinical Biochemist, Suppl 1(29): S49-S52. |
Armbruster D A, Tillman M D, Hubbs L M. 1994. Limit of detection (LOD)/limit of quantitation (LOQ):comparison of the empirical and the statistical methods exemplified with GC-MS assays of abused drugs[J]. Clinical Chemistry, 7(40): 1233-1238. DOI:10.0000/PMID8013092 |
Biran A, Ben Yoav H, Yagur-Kroll S, et al. 2011. Microbial genotoxicity bioreporters based on sulA activation[J]. Analytical and Bioanalytical Chemistry, 9(400): 3013-3024. |
Chai Q, Hu A, Qian Y, et al. 2018. A comparison of genotoxicity change in reclaimed wastewater from different disinfection processes[J]. Chemosphere, 191: 335-341. DOI:10.1016/j.chemosphere.2017.10.024 |
Das A P, Mishra S. 2010. Biodegradation of the metallic carcinogen hexavalent chromium Cr(Ⅵ) by an indigenously isolated bacterial strain[J]. Journal of Carcinogenesis, 9: 6-6. DOI:10.4103/1477-3163.63584 |
Davidov Y, Rozen R, Smulski D R, et al. 2000. Improved bacterial SOS promoter:lux fusions for genotoxicity detection[J]. Mutation Research, 1(466): 97-107. DOI:10.1016/s1383-5718(99)00233-8 |
Hughes R A, Ellington, Andrew D. 2017. DNA synthesis and assembly:Putting the synthetic in synthetic biology, [M]. Cold Spring Harbor Laboratory Press, 12-24
|
Ivask A, Virta M, Kahru A. 2002. Construction and use of specific luminescent recombinant bacterial sensors for the assessment of bioavailable fraction of cadmium, zinc, mercury and chromium in the soil[J]. Soil Biology & Biochemistry, 10(34): 1439-1447. DOI:10.1016/s0038-0717(02)00088-3 |
Li S, Xu L H, Hua H, et al. 2007. A set of UV-inducible autolytic vectors for high throughput screening[J]. Journal of Biotechnology, 4(127): 647-652. |
Mattagajasingh S N, Misra B R, Misra H P. 2008. Carcinogenic chromium(Ⅵ)-induced protein oxidation and lipid peroxidation:Implications in DNA-protein crosslinking[J]. Journal of Applied Toxicology, 28(8): 987-997. DOI:10.1002/jat.1364 |
Miller J H. 1972. Experiments in Molecular Genetics[M]. Cold Spring Harbor Laboratory
|
Milic M, Kopjar N. 2004. Evaluation of in vitro genotoxic activity of bleomycin and mitomycin C in human lymphocytes using the alkaline comet assay[J]. Arh Hig Rada Toksikol, 4(55): 249-259. |
Nickens K P, Patierno S R, Ceryak S. 2010. Chromium genotoxicity:A double-edged sword[J]. Chemico-Biological Interactions, 2(188): 276-288. |
Oda Y, Nakamura S, Oki I, et al. 1985. Evaluation of the new system (umu-test) for the detection of environmental mutagens and carcinogens[J]. Mutation Research, 5(147): 219-229. DOI:10.1016/0165-1161(85)90062-7 |
Oda Y, Yamazaki H, Watanabe M, et al. 1995. Development of high sensitive umu test system:rapid detection of genotoxicity of promutagenic aromatic amines by Salmonella typhimurium strain NM2009 possessing high O-acetyltransferase activity[J]. Mutation Research, 2(334): 145-156. DOI:10.1016/0165-1161(95)90005-5 |
朴瑛, 柳云恩, 谢晓冬. 2013. 95%克菌丹原药对大鼠90d经口毒性研究[J]. 毒理学杂志, 4(27): 291-297. |
Raman N V V S S, Prasad A V S S, Reddy K R, et al. 2012. Determination of genotoxic alkyl methane sulfonates and alkyl paratoluene sulfonates in lamivudine using hyphenated techniques[J]. Journal of Pharmaceutical Analysis, 4(2): 314-318. DOI:10.1016/j.jpha.2012.03.003 |
Reifferscheid G, Heil J, Oda Y, et al. 1991. A microplate version of the SOS/umu-test for rapid detection of genotoxins and genotoxic potentials of environmental samples[J]. Mutation Reserch, 3: 215-222. DOI:10.1016/0165-1161(91)90134-t |
Tang J Y, McCarty S, Glenn E, et al. 2013. Mixture effects of organic micropollutants present in water:Towards the development of effect-based water quality trigger values for baseline toxicity[J]. Water Research, 10(47): 3300-3314. DOI:10.1016/j.watres.2013.03.011 |
Veyrand J, Marin-Kuan M, Bezencon C, et al. 2017. Integrating bioassays and analytical chemistry as an improved approach to support safety assessment of food contact materials[J]. Food Additives & Contaminants. Part A, Chemistry, Analysis, Control Exposure & Risk Assessment, 10(34): 1807-1816. |
Warr A R, Klimova A N, Nwaobasi A N, et al. 2019. Protease-deficient SOS constitutive cells have RecN-dependent cell division phenotypes[J]. Molecular Microbiology, 111(2): 405-422. DOI:10.1111/mmi.14162 |
Xiaohua L, Yanshuang S, Li W, et al. 2012. Evaluation of the correlation between genetic damage and occupational chromate exposure through BNMN frequencies[J]. Journal of Occupational and Environmental Medicine, 54(2): 166-170. DOI:10.1097/JOM.0b013e31823d86b4 |
Zeng G M, Zhang M L, Wang P, et al. 2019. Genotoxicity effects of Phanerochaete chrysosporium against harmful algal bloom species by micronucleus test and comet assay[J]. Chemosphere, 218: 1031-1041. DOI:10.1016/j.chemosphere.2018.11.148 |
 2020, Vol. 40
2020, Vol. 40


