农田生态系统是陆地生态系统的重要组成部分, 也是固碳潜力最大的碳库之一, 其中固碳细菌分布广泛, 环境适应能力强, 能够较好地反映土壤肥力变化特征(袁红朝等, 2011).近年来, 由于人类过度开垦和不合理使用, 致使生态系统严重受损, 农田土壤退化现象极为严重, 土壤中的固碳细菌群落结构极有可能产生了较大变化, 进而影响其固碳功能, 并最终对陆地生态系统土壤碳库产生一定影响(Smith, 2004;韩冰等, 2005).碳源材料具有高度的生物化学稳定性和较强的吸附性能, 能够改善土壤质量、持留土壤养分, 同时也对土壤微生物群落结构产生一定的影响(Awad et al., 2012).研究不同碳源对土壤固碳细菌群落结构、多样性的影响, 分析引起固碳细菌群落变化的主控土壤理化因子, 对明晰农田土壤生态系统固碳机制具有一定的意义.
碳源添加会对农田土壤理化性质及微生物活性产生一定的影响.研究发现, 秸秆添加可以改善土壤结构, 使土壤土质疏松多孔, 提高土壤中的微生物及酶活性(Alison et al., 2000;Sapkota et al., 2012);生物炭添加可以减少土壤养分流失, 提高细菌群落结构丰富度及多样性(侯建伟等, 2018), 并使土壤生物活性得到明显改善(Karhu et al., 2011);纳米碳是一种新型的碳材料, 施用纳米碳可以维持土壤有机质的稳定性, 其小尺寸效应强化了肥料吸附性能, 可防止肥料在土壤中流失, 避免对土壤造成污染, 在改善土壤肥力、提高作物产量等方面具有一定的作用(高荣广等, 2018;史妍君等, 2018).高通量测序(Illumina Miseq)技术具有测序深度深、获得数据量大等优点, 能更加真实地揭示微生物群落的复杂性和多样性(Shokralla et al., 2012).将cbbL作为标记基因, 已被国内外学者广泛应用于生物固碳分子生态学研究中, 并已取得了一定的进展(Yuan et al., 2012;Selesi et al., 2015).现有的研究主要集中于农田土壤中秸秆、生物炭添加后土壤细菌群落的变化, 对纳米碳添加后土壤细菌群落的变化研究较少, 尤其是对东北退化农田区添加3种碳源(秸秆、生物炭、纳米碳)后土壤固碳细菌群落结构及多样性的变化研究鲜见报道.因此, 本文以秸秆、生物炭和纳米碳为添加材料, 以16S rRNA基因为标靶, 借助荧光定量PCR技术和Illumina MiSeq高通量测序平台, 分析3种碳源添加对退化农田土壤固碳细菌群落结构多样性的影响及与土壤理化性质间的关系, 以期为退化农田土壤改良和碳源的合理利用提供理论参考.
2 材料与方法(Materials and methods) 2.1 试验材料秸秆为当季作物秸秆(玉米秸秆), 碳含量为40%;生物炭为溧阳活性炭公司生产的由作物(玉米)秸秆制成的混合碳粉, 碳含量为79.68%;纳米碳为溧阳活性炭公司生产的由柱状活性炭、椰鞘活性炭、纳米矿晶混合生产而成的颗粒碳, 碳含量为14.06%.试验所用肥料为红四方复合肥料, N+P2O5+K2O≥45%.
2.2 试验设计与样品采集试验土壤选自黑龙江省嫩江县中储粮北方农业开发有限公司科技园区内的退化农田, 地理位置为北纬49°33′、东经125°27′, 属温带大陆性季风气候.区域年平均气温为-1 ℃, 年均无霜期为110 d, 年平均降水量为450 mm, 土壤类型为黑土, pH为5.97, 有机碳含量为6.61 g·kg-1, 主要种植玉米、大豆和小麦.
于2016年8月在试验区域选择面积约为99 m2(9 m×11 m)的田块单元作为本试验的研究样地, 先将样地平均分成4部分, 每部分面积约为4 m×5 m, 中间间隔宽1 m、深50 cm的长沟,不种植作物, 作为隔离带.于2016年10月秋整地后以“等碳量”原则添加3种碳源, 共计4个处理, 每个处理3次重复, 其中, 秸秆(S)7500 kg·hm-2、生物炭(B)3764.71 kg·hm-2、纳米碳(N)21333.33 kg·hm-2, 并且施入深度为20 cm, 未施碳源处理的样地作为对照样地(CK), 各处理均施用250 g复合肥.2016年、2017年种植作物均为玉米.
添加3种碳处理2年后于2018年10月(2016—2018年无其他对土壤有影响的活动), 取作物收获后耕层(0~20 cm)土壤, 每个小区随机取5个样点混合成1个样品, 现场挑选出杂质(石子、作物根系残体等), 然后用聚乙烯塑料袋分装, 并在袋上做好标记, 放进干冰保温箱中, 运回实验室后保存于-80 ℃的冰箱, 用于土壤微生物分析.用于土壤理化性质测定的土样, 通过风干过2 mm筛后, 于干燥环境中常温保存.
2.3 土壤理化性质测定土壤pH采用电位法测定(水土比为2.5 : 1);有机碳(Soil organic carbon, SOC)采用浓硫酸-重铬酸钾消煮-硫酸亚铁滴定法测定;全氮(Total nitrogen, TN)采用半微量凯氏定氮法测定;全磷(Total phosphorus, TP)采用NaOH熔融-钼锑抗比色法测定;碱解氮(Active nitrogen, AT)采用碱解扩散法测定, 有效磷(Active phosphorus, AP)采用钼锑抗比色法测定.上述测定具体方法参见《土壤农化分析》(鲍士旦, 2000).
2.4 DNA提取、PCR扩增及MiSeq测序DNA提取及高通量测序时取0.5 g土壤样品, 用土壤DNA提取试剂盒Power Soil DNA Isolation Kit(MoBio Laboratories, Carlsbad, CA)提取总DNA, 在0.8%琼脂糖凝胶上检测基因组DNA的纯度和质量, 取适量的样品于离心管中测浓度后置于-80 ℃冰箱保存.
对16S rRNA基因的V4~V5高变区片段进行PCR扩增, 引物序列为cbbL-F:5′-GACTTCACCAA AGACGACGA-3′和cbbL-R:5′-TCGAACTTGATTTC TTTCCAC-3′;cbbL-F:5′-CAT CATGTTCGACCA GGACT-3′和cbbL-R:5′-TCGAACTTGATTTCTT TCCA-3′(季凤云等, 2016).PCR扩增条件为:94 ℃预变性5 min;94 ℃变性60 s, 52 ℃退火60 s, 72 ℃延伸60 s, 共30个循环;72 ℃延伸7 min, 4 ℃保存.每个样本3次重复, 将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测, 使用Axy Prep DNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物, Tris HCl洗脱;2%琼脂糖电泳检测.根据电泳初步定量结果, 对PCR产物进行定量检测, 按照每个样本的测序量要求, 进行相应比例的混合.DNA样品送至北京Allwegene公司Illumina MiSeq PE300平台上机测序.
2.5 数据处理与分析通过MiSeq PE300测序平台获得双端序列数据, 为了保证后续生物信息分析的准确性, 在Trimmomatic和FLASH软件平台上对测序数据进行过滤和拼接:过滤Read尾部质量值20以下的碱基;根据PE reads之间的overlap关系, 将成对reads拼接(merge)成1条序列, 最小overlap长度为10 bp;拼接序列的overlap区允许的最大错配比率为0.1, 不符合序列直接成对过滤掉;根据序列首尾两端的barcode和引物区分样品, 并调整序列方向, barcode允许的错配数为0.
基于97%相似度水平, 在Usearch(vsesion7.0)平台上进行OTU聚类分析, 并在门、纲、目、科、属水平上统计并分析各个样品的细菌群落组成(Edgar, 2013);根据OTU分析结果利用R语言工具, 作图并分析样品稀释性曲线(Rarefaction Curve), 绘制goods coverage、Observed species、Chao1指数及Shannon指数的曲线(Yu et al., 2012);利用韦恩图比较样本间OTU相似性;利用LefSe分析方法设定显著差异的LDA值为4.0, 寻找组间丰度差异显著物种.
利用Excel软件对数据进行整理、汇总;利用SAS9.2软件进行差异显著性分析(p < 0.05为差异显著)及主成分分析(PCA);利用Qiime软件计算Unifrac距离, 并基于WeightedUnifrac方法构建UPGMA样品聚类树(Jiang et al., 2013);利用CANOCO 4.5软件进行冗余分析.
3 结果与分析(Results and analysis) 3.1 不同碳添加后的土壤理化性质变化3种碳源添加对土壤理化性质的影响如表 1所示, 秸秆添加后土壤有机碳、全磷、有效磷含量无显著变化(p>0.05), 土壤pH显著升高, 升高率为1.71%, 土壤全氮、碱解氮含量显著降低(p < 0.05), 降低率分别为10.71%、10.05%;生物炭添加后土壤有机碳、碱解氮、有效磷含量无显著变化(p>0.05), pH、全磷含量显著升高(p < 0.05), 升高率分别为2.80%、6.32%, 全氮含量显著降低(p < 0.05), 降低率为5.95%;纳米碳添加后土壤pH、全磷含量无显著变化(p>0.05), 有效磷含量显著升高(p < 0.05), 升高率为15.53%, 有机碳、全氮、碱解氮含量显著降低(p < 0.05), 降低率分别为10.76%、21.43%、14.06%.
| 表 1 不同碳添加后的土壤理化性质 Table 1 Soil physical-chemical characteristics under different carbon treatments |
在97%相似度水平下, 稀释曲线均趋于平缓(图 1), 表明所测序列已经基本覆盖到土壤样品中的所有物种, 测序数据量合理.从图 1a可以看出, 土壤固碳细菌群落分析获得的有效序列覆盖率达98%以上, 可以满足解释土壤细菌群落多样性的需要.土壤固碳细菌群落结构丰富度和多样性主要是由OTUs统计的Observed species、表征菌群丰度的Chao1指数及反映菌群多样性的Shannon指数来表示.从图中可以看出, 秸秆、生物炭添加后土壤中固碳细菌的Observed species指数(图 1b)、Chao1(图 1c)指数及Shannon指数(图 1d)均高于纳米碳添加的土壤样品, 说明秸秆、生物炭的添加有利于提高土壤固碳细菌群落多样性.
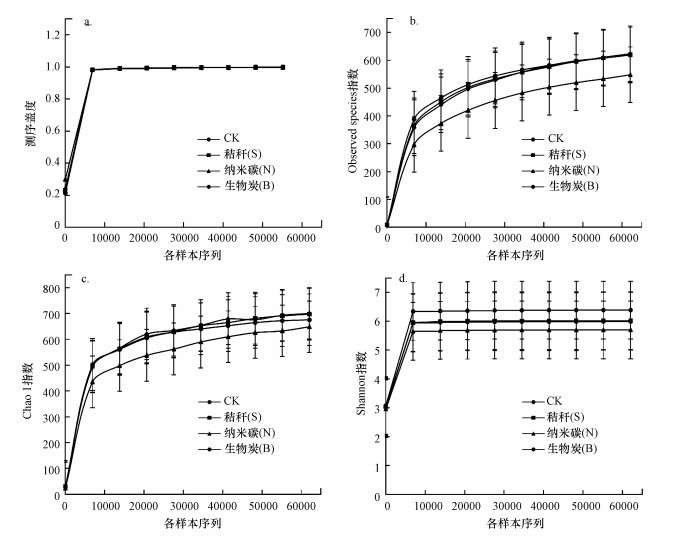 |
| 图 1 不同碳源添加后的土壤固碳细菌群落多样性 Fig. 1 Community diversity of CO2-assimilating soil bacteria with different carbon treatments |
不同碳源添加后土壤OTU数量关系韦恩图如图 2所示, 3种碳源添加和无碳添加的土壤样品共产生857个OTUs, 共同包含632个OTUs, 占总体OTU个数的73.75%.其中, CK共得到759个OTUs, 秸秆添加土壤共得到740个OTUs, 生物炭添加土壤共得到777个OTUs, 纳米碳添加土壤共得到734个OTUs.说明秸秆和纳米碳添加后土壤固碳细菌物种丰度减少, 而生物炭添加后土壤固碳细菌物种丰度增加.
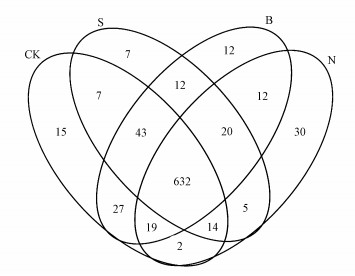 |
| 图 2 不同碳源添加的土壤固碳细菌Venn图(CK:对照样地, S:秸秆, B:生物炭, N:纳米碳) Fig. 2 OTUs venn of soil CO2-assimilating bacteria in different carbon treatments |
研究所得的序列被归为个3门、4个纲、7个目、11个科和15个属, 如图 3所示, 这些微生物大多只能归类到分类水平比较高级的变形菌门(Proteobacteria)和放线菌门(Actinobacteria)的细菌类群中.以门作为分类学水平, 变形菌门(Proteobacteria)为优势菌门, 在生物炭添加后的相对丰度最高, 为94.35%;在纲水平上, γ-变形菌纲(Gammaproteobacteria)为优势菌纲, 在纳米碳添加后的相对丰度最高, 为67.45%;在目水平上, 着色菌目(Chromatiales)为优势菌目, 在纳米碳添加后的相对丰度最高, 为50.83%;在科水平上, 节外硫红螺菌科(Ectothiorhodospiraceae)为优势菌科, 在纳米碳添加后的相对丰度最高, 为34.34%;在属水平上, 硫碱弧菌(Thioalkalivibrio)、Sulfurifustis、Thiobacillus为优势菌属, 分别在生物炭、纳米碳和秸秆添加后的相对丰度最高, 相对丰度分别为17.02%、16.40%、13.03%.说明在门水平上, 生物炭添加是影响固碳细菌群落结构的重要因素, 而在纲、目、科水平上, 纳米碳添加是影响固碳细菌群落结构的重要因素, 在属水平上, 秸秆、生物炭和纳米碳添加是影响固碳细菌群落结构的重要因素.
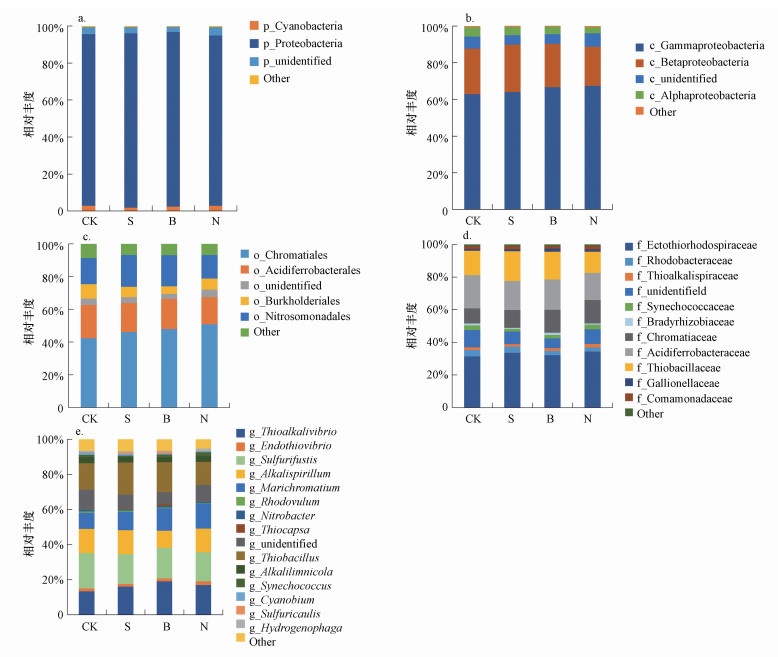 |
| 图 3 不同碳源添加下土壤固碳细菌群落在门(a)、纲(b)、目(c)、科(d)、属(e)水平上的组成及相对丰度 Fig. 3 Soil CO2-assimilating bacteria community composition and relative abundance at phylum(a), class(b), order(c), family(d) and genus(e) level with different carbon treatments |
基于OTU的层次聚类分析结果显示, 不同碳源添加后土壤固碳细菌群落结构差异明显, 树枝长度代表样本间的距离, 越是相似的样本越能聚到一起, N1与B1、B2、B3, CK3与S1、S2、S3距离较近(图 4a).主成分分析进一步证实了不同碳源添加后固碳细菌群落结构差异明显, 第一、二主成分轴对细菌群落结构变异的解释量分别为33.79%和18.21%.其中, CK3与S1、S2、S3聚集在一起, 而N1、N2、N3与B1、B2、B3相距较远(图 4b).说明纳米碳和生物炭添加的土壤样本中固碳细菌群落差异显著.
 |
| 图 4 不同碳处理固碳细菌群落结构的层次聚类树(a)和主成分分析(b) Fig. 4 Hierarchical clustering tree(a) and principal components analysis(b) of the soil CO2-assimilating bacteria community structure in different carbon treatments |
进一步通过LEfSe分析, 可以找出组间具有显著差异的物种(Biomarker), 以及显著影响组间差异性的物种或群落.不同碳源添加后土壤固碳细菌群落组间差异LEfSe分析柱状图如图 5所示, 不同碳源添加对应不同的物种, 从图中可以看出生物炭添加后显著性差异物种最多, 主要为硫碱弧菌(Thioalkalivibrio)和硫腺菌(Thiocystis)间的差异最为显著, 对照处理次之, 秸秆和纳米碳添加后群落组间无显著差异物种.
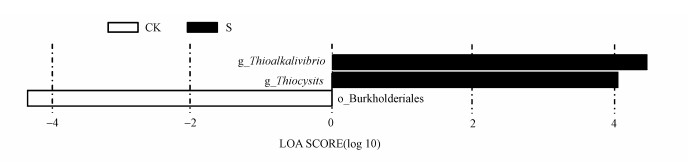 |
| 图 5 不同碳源添加下土壤固碳细菌物种差异分析(Lefse分析) Fig. 5 Lefse analysis on species difference of soil CO2-assimilating bacteria with different carbon treatments |
对不同碳源添加后土壤固碳细菌群落结构与土壤理化性质进行冗余分析(图 6), 第一排序轴对土壤固碳细菌群落变化解释最多, 达40.69%;第二排序轴仅解释了固碳细菌群落变化的10.09%, 前两轴共解释了固碳细菌群落总变异的50.78%, 在对固碳细菌群落变异的解释中起主导作用.结果显示, 第一排序轴与pH(相关系数为0.767)、TN(0.787)、AN(0.650)、SOC(0.199)呈正相关, 与AP(-0.472)呈负相关(p < 0.05);第二排序轴与pH(0.354)、AP(0.751)呈正相关, 与SOC(-0.391)、TN(-0.456)、AN(-0.523)、TP(-0.764)呈负相关(p < 0.05).说明土壤固碳细菌的群落结构受土壤pH、有机碳、全氮、全磷、碱解氮及有效磷含量的综合影响, 土壤pH和全氮是影响碳添加后土壤固碳细菌群落结构的主要理化性质.
 |
| 图 6 土壤理化性质对固碳细菌群落结构影响的冗余分析 Fig. 6 Redundancy analysis between soil physical and chemical properties and the CO2-assimilating bacteria community structure |
生物固碳是陆地生态系统中最直接有效的二氧化碳固定途径, 其中, 具有固碳功能的微生物分布广泛, 环境适应能力强, 从整个生物圈的物质能量流来看, 二氧化碳的微生物固定是一支不容小觑的生物固碳力量(袁红朝等, 2011).本研究采用MiSeq高通量测序技术, 对比研究3种碳源添加后土壤固碳细菌群落结构及多样性的差异.结果表明, 3种碳源添加后变形菌门(Proteobacteria)和放线菌门(Actinobacteria)为研究菌群所属的两大门类, 变形菌门在土壤中所占比例最大, 这与以往学者的研究结论一致(季凤云等, 2016;刘琼等, 2017).但本研究发现变形菌门的γ-变形菌纲(Gammaproteobacteria)为土壤中的优势纲, 与以往学者研究发现变形菌门的α-变形菌纲(α-Proteobacteria)和β-变形菌纲(β-Proteobateria)为土壤中的优势纲(戴雅婷等, 2017)存在差异, 可能是由于本研究的供试土壤为退化农田土壤, γ-变形菌纲细菌具有一定降解能力, 因此为本研究土壤中的优势菌纲.研究还发现, 3种碳源添加后节外硫红螺菌科(Ectothiorhodospiraceae)为γ-变形菌纲中的优势菌科, 这是研究发现的一个新现象, 节外硫红螺菌科微生物具有利用光能固定CO2的显著作用, 说明碳添加后土壤中固定CO2的微生物菌群数量增多, 有利于减少CO2等温室气体的排放, 在3种碳源中, 纳米碳添加后节外硫红螺菌科微生物的数量最多, 说明纳米碳在土壤固碳作用中有一定优势.
3种碳源添加相比, 秸秆添加后土壤固碳细菌物种丰度无明显变化, 层次聚类分析结果也发现秸秆添加与无碳添加的土壤中固碳细菌群落相似性高, 说明秸秆添加对土壤固碳细菌群落结构及多样性影响不大, 这与Yuan等(2012)对水稻田土壤固碳细菌的研究结果一致, 但也有研究发现秸秆和化肥共同施用能提高土壤固碳细菌多样性(Yuan et al., 2013), 因此, 在生产上如何利用秸秆达到固碳的效果还需结合生产情况进行深入研究.生物炭添加后在门水平上土壤中固碳细菌群落的平均相对丰度最高, 土壤固碳细菌群落组间差异物种也最多, 这与武爱莲等(2016)研究发现随着生物炭施用量的增加土壤细菌多样性呈增加趋势, 以及Jin(2010)研究发现土壤细菌群落多样性随着生物炭的增加而变大的结论一致, 说明生物炭相较于其他碳源来说, 能够提高土壤固碳细菌群落的多样性;但也有学者持相反意见, 如Pietikainen等(2000)研究发现生物炭施用对总体微生物量影响不大, Marris(2006)研究发现生物炭的施用会降低土壤微生物的多样性.这是由于生物炭产品种类多样, 其组分和结构存在差异, 因而造成微生物群落对生物炭添加的响应不同, 在实际生产中要明晰不同生物炭的特性, 并基于前期的调研和小区试验工作, 结合土壤特性进行合理施用.纳米碳具有特殊的物理性质, 其小尺寸和大表面积具有明显吸附作用(薛文强等, 2018).本研究中虽然纳米碳添加后土壤中固碳细菌群落多样性最低, 在纲、目、科这3个水平上, 纳米碳添加后土壤固碳细菌群落相对丰度最高, 这与以往学者研究发现纳米材料对特定微生物类群丰度具有显著的影响的结果一致(刘安勋等, 2017), 说明纳米碳对土壤固碳细菌的影响具有一定的特异性.但也有学者研究发现, 纳米碳添加对土壤养分循环转化具有一定的抑制作用(Lehmann et al., 2011), 且由于纳米材料的成本问题, 在生产上的应用还需进一步研究.
众所周知, 土壤微生物群落结构与土壤理化性质存在一定相关关系(刘琼等, 2017), 本研究通过冗余分析发现, 3种碳源添加后土壤固碳细菌群落与土壤各理化性质均有一定的相关关系(p < 0.05), 说明土壤固碳细菌群落结构受土壤理化性质的综合影响, 其中, 土壤pH和全氮对细菌群落的影响最显著, 这与Liu等(2014)的研究结果一致.土壤固碳细菌群落的第一与第二排序轴分别解释了样本40.69%和10.09%的总变异, 说明除了土壤性质外还有其他因素引起了固碳微生物群落结构的变化, 如植被的变化同样会引起固碳微生物群落的变化(梁雪, 2017), 其具体情况还需在今后的工作中进一步研究.
5 结论(Conclusions)3种碳源添加后对退化农田土壤固碳细菌群落结构及多样性影响不同, 添加秸秆对土壤固碳细菌群落结构及多样性影响较小;生物炭添加显著提高了土壤固碳细菌群落多样性, 对土壤养分循环具有一定的促进作用;纳米碳添加对土壤固碳细菌的影响具有一定的特异性, 且其添加后土壤中固定CO2的微生物菌群数量显著增多, 有利于减少CO2等温室气体的排放.土壤固碳细菌群落结构受土壤pH、有机碳、全氮、全磷、碱解氮及有效磷的综合影响, 其中, pH和全氮对土壤固碳细菌群落结构的影响最大.
Alison J E, Jeffrey A B, Wiliam R H, et al. 2000. Rice yield and nitrogen utilization efficiency under alternative straw management practices[J]. Agronomy Journal, 92: 1096-1103. DOI:10.2134/agronj2000.9261096x |
Awad Y M, Blagodatskaya E, Ok Y S, et al. 2012. Effects of polyacrylamide, biopolymer, and biochar on decomposition of soil organic matter and plant residues as determined by 4C and enzyme activities[J]. European Journal of Soil Biology, 48: 1-10. |
鲍士旦. 2000. 土壤农化分析[M]. 北京: 中国农业科技出版社.
|
戴雅婷, 闫志坚, 解继红, 等. 2017. 基于高通量测序的两种植被恢复类型根际土壤细菌多样性研究[J]. 土壤学报, 54(3): 35-748. |
Edgar R C. 2013. UPARSE:Highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 10(10): 996-1000. DOI:10.1038/nmeth.2604 |
高荣广, 赵鑫, 高晓兰, 等. 2018. 纳米碳对桃园土壤肥力及植株养分吸收的影响[J]. 落叶果树, 50(3): 11-14. |
韩冰, 王效科, 欧阳志云. 2005. 中国农田生态系统土壤碳库的饱和水平及其固碳潜力[J]. 农村生态环境, 21(4): 6-11. |
侯建伟, 邢存芳, 卢志宏, 等. 2018. 不同秸秆生物炭对贵州黄壤细菌群落的影响[J]. 中国农业科学, 51(23): 4485-4495. DOI:10.3864/j.issn.0578-1752.2018.23.008 |
Jiang X T, Peng X, Deng G H, et al. 2013. Illumina sequencing of 16S rRNA tag revealed spatial variations of bacterial communities in a mangrove wetland[J]. Microbiology Ecology, 66: 96-104. DOI:10.1007/s00248-013-0238-8 |
Jin H.2010.Characterization of microbial life colonizing biochar and biochar-amended soils[D].New York: Cornell University, Ithaca
|
季凤云, 明红霞, 李洪波, 等. 2016. 南海表层海水参与卡尔文循环的固碳基因多样性研究[J]. 环境科学学报, 36(11): 4037-4043. |
Karhu K, Mattilab T, Brgstroma I, et al. 2011. Biochar addition to agricultural soil increased CH4 uptake and water holding capacity-results from a short-term pilot field study[J]. Agriculture, Ecosystem and Environment, 140: 309-313. DOI:10.1016/j.agee.2010.12.005 |
Lehmann J, Rillig M C, Thies J, et al. 2011. Biochar effects on soil biota-A review[J]. Soil Biology and Biochemistry, 43(9): 1812-1836. DOI:10.1016/j.soilbio.2011.04.022 |
Liu J J, Sui Y Y, Yu Z H, et al. 2014. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China[J]. Soil Biology & Biochemistry, 70(2): 113-122. |
刘安勋, 卢其明, 曹玉江, 等. 2017. 纳米复合材料对水稻生长发育的影响[J]. 植物营养与肥料学报, 13(2): 344-347. |
刘琼, 魏晓梦, 吴小红, 等. 2017. 稻田土壤固碳功能微生物群落结构和数量特征[J]. 环境科学, 38(2): 760-768. |
梁雪.2017.毛竹入侵阔叶林对土壤固碳功能菌群落特征的影响及其机制[D].杭州: 浙江农林大学 http://cdmd.cnki.com.cn/Article/CDMD-10341-1017273797.htm
|
Marris E. 2006. Putting the carbon back:Black is the new green[J]. Nature, 442(3): 624-626. |
Pietikainen J, Kiikkila O, Fritze H. 2000. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus[J]. Oikos, 89(5): 231-242. |
Sapkota T B.2012.Conservation Tillage Impact on Soil Aggregation, Organic Matter Turnover and Biodiversity//Organic Fertilisation, Soil Quality and Human Health[M].Dordrecht: Springer.141-160
|
Selesi D, Schmid M, Hartmann A. 2005. Diversity of green-like and red-like ribulose, 5-bisphosphate carboxylase oxy-genase large-subunit genes (cbbL) in differently managed agricultural soils[J]. Applied and Environmental Micro-biology, 171(1): 175-184. |
Shokralla S, Spall J L, Gibson J F, et al. 2012. Next-generation sequencing technologies for environmental DNA research[J]. Molecular Ecology, 21(8): 1794-1805. DOI:10.1111/j.1365-294X.2012.05538.x |
Smith P. 2004. Carbon sequestration in croplands:the potential in Europe and the global context[J]. European Journal of Agronomy, 20(3): 229-236. DOI:10.1016/j.eja.2003.08.002 |
史妍君, 钟建, 黄占斌, 等. 2018. 纳米碳增效剂对柑橘产量及土壤细菌种群结构的影响[J]. 中国土壤与肥料, (4): 40-47. |
武爱莲, 丁玉川, 焦晓燕, 等. 2016. 玉米秸秆生物炭对褐土微生物功能多样性及细菌群落的影响[J]. 中国生态农业学报, 24(6): 736-743. |
薛文强, 周蓓蓓, 毛通, 等. 2018. 纳米碳混合层对土壤水分入渗特性及水分分布影响[J]. 水土保持学报, 32(3): 152-159. |
Yuan H Z, Ge T, Wu X, et al. 2012. Long-term field fertilization alters the diversity of autotrophic bacteria based on the ribuose, 5-biphosphate carboxylase/oxygenase (Rubis CO) large-subunit genes in paddy soil[J]. Applied Microbiology and Biotechnology, 95(4): 1061-1071. |
Yuan M Z, Ge T D, Zou S Y, et al. 2013. Effect of land use on the abundance and diversity of autotrophic bacteria as measured by ribulose, 5-biphosphate carboxylase/oxygenase (Rubis CO) large subunit gene abundance in soils[J]. Biology and Fertility of Soils, 49(5): 609-616. DOI:10.1007/s00374-012-0750-x |
Yu W, Hua A F S, Yan H, et al. 2012. Comparison of the Levels of Bacterial diversity in fresh water, intertidal wetland, and marine sediments by using millions of Illumina Tags[J]. Applied Environmental Microbiology, 78(23): 8264. DOI:10.1128/AEM.01821-12 |
袁红朝, 秦红灵, 刘守龙, 等. 2011. 固碳微生物分子生态学研究[J]. 中国农业科学, 44(14): 2951-2958. DOI:10.3864/j.issn.0578-1752.2011.14.012 |
 2020, Vol. 40
2020, Vol. 40


