2. 太原师范学院生物系, 太原 030619;
3. Annandale-on-Hudson Bard College, New York, America 12504
2. Biology Department, Taiyuan Normal University, Taiyuan 030619;
3. Annandale-on-Hudson Bard College, New York, America 12504
现代硬骨鱼类大部分都具有鱼鳔, 它是一个充满气体的囊状结构, 位于鱼体肠道的背部(Xu et al., 2017).除少数鱼(如肺鱼、总鳍鱼)的鱼鳔具有呼吸作用外, 大部分鱼的鱼鳔借鳔内气体的改变以帮助调节身体的浮沉, 可以最大限度地减少鱼类维持在水中垂直位置所需的能量(Stinckens et al., 2016).有研究表明, 鱼类鱼鳔的发育缺失或受损可影响鱼类动物的游泳性能和浮力, 间接影响鱼类动物的生长发育、捕食、繁殖等基本行为(Lindsey et al., 2010; Villeneuve et al., 2014).
工程纳米材料在食品、化妆品、医药和电子产品等各行业领域得到了广泛应用(Grillo et al., 2015), 尤其在食品抗菌包装膜、食品添加剂、饲料添加剂上的大量使用(Raja et al., 2018), 导致环境中残留的纳米材料逐年增多, 但目前有关纳米材料的环境风险评估仍然不足.已有研究证明, nano-TiO2、nano-ZnO等纳米金属材料可引起斑马鱼胚胎心包水肿、脊椎畸形、鱼鳔缺损、生长停滞等不良发育, 甚至导致斑马鱼胚胎的死亡(Bai et al., 2010; Zhao et al., 2013; Choi et al., 2016; 陈展明等, 2017).但目前鲜有研究关注nano-ZnO对斑马鱼胚胎鱼鳔发育及充气的影响.
斑马鱼的孵化时间一般在48~72 hpf(hour post fertilization)之间(Samaee et al., 2015), 在孵化前鱼鳔组织开始发育(斑马鱼鱼鳔分前室和后室, 先形成后室, 然后鱼鳔充气完成后, 约在20 d内在再慢慢形成前室, 本实验主要指鱼鳔后室的出芽和充气), 120 hpf内鱼鳔后室充气功能完成(韩建等, 2016).因此, 本研究选用斑马鱼作为试验生物, 采用不同浓度的nano-ZnO对斑马鱼胚胎和幼鱼鱼鳔发育和功能形成的5个不同阶段(0 hpf~孵化前、0~120 hpf、0~168 hpf、孵化后~120 hpf、120~168 hpf)进行暴露, 以死亡率、鱼体形态组织损伤特征、鱼鳔缺损率和鱼鳔面积大小等作为毒性效应终点指标, 研究不同浓度的nano-ZnO对鱼鳔出芽阶段、充气阶段和充气完成后阶段造成的毒性效应, 以确定nano-ZnO对鱼鳔造成毒性损伤的敏感时间和毒性效应特征, 揭示nano-ZnO对斑马鱼胚胎鱼鳔发育损伤的潜在毒性机理, 为有鳔鱼类种群的生存保护和污染物的环境健康风险评价提供有力的科学依据.
2 材料和方法(Materials and methods) 2.1 试验药品nano-ZnO购自上海麦克林公司(纯度99.9%), 呈干燥粉末状, 粒径为(30±10) nm, 3-乙氧酰基苯胺甲磺酸盐购自上海阿拉丁生化科技公司, CaCl2·2H2O、MgSO4·7H2O、NaHCO3、KCl等试剂均为分析纯.
2.2 培养液的制备将11.76 g CaCl2·2H2O、4.93 g MgSO4·7H2O、2.59 g NaHCO3、0.23 g KCl分别溶于去离子水中并稀释至1 L, 将以上4种溶液各取25 mL混合并用去离子水稀释至1 L, 使pH为7.8±0.2, 硬度为250 mg·L-1左右(以CaCO3计), 将制备好的溶液曝气至溶解氧浓度达到空气饱和值(ASV), 即为斑马鱼胚胎和幼鱼培养液.
2.3 nano-ZnO悬浮液的制备与表征准确称量0.01 g nano-ZnO颗粒, 加入100 mL培养液制备成0.1 g·L-1的nano-ZnO悬浮液(现用现配), 使用磁力搅拌器搅拌15 min后超声波超声30 min, 按浓度梯度法稀释得到实验用nano-ZnO悬浮液.
使用场发射扫描电镜(SEM)观察nano-ZnO悬浮液中纳米颗粒的形貌特征, 使用纳米粒度分析仪(DLS)分析nano-ZnO悬浮液中纳米颗粒的分散情况和粒径大小分布.
2.4 斑马鱼培养和胚胎挑选斑马鱼取自广东省微生物研究所, 在自循环培养箱中驯养2个月, 早晚喂食2次丰年虫.试验前一天停止喂食, 挑选健康成年斑马鱼以雌雄比2:1分别放入孵化器中两端, 中间用隔板分开, 温度控制在26~28 ℃, 在14 h(光):10 h(暗)的光照周期下培养.待第2 d开启光照, 抽出隔板, 斑马鱼产卵和鱼卵受精同时发生, 1~2 h后收集斑马鱼胚胎, 用体式显微镜挑选健康并受精成功的斑马鱼胚胎, 培养液冲洗后转移至光照培养箱.
2.5 nano-ZnO与Zn2+对斑马鱼胚胎的毒性测试采用原子吸收法对各浓度组的nano-ZnO悬浮液中的Zn2+进行测定, 根据结果配制相同Zn2+浓度的硫酸锌溶液, 对斑马鱼胚胎进行暴露测试, 比较nano-ZnO与Zn2+对斑马鱼胚胎的毒性.
2.6 nano-ZnO对斑马鱼胚胎和幼鱼阶段性暴露试验和测定指标斑马鱼鱼鳔的不同发育阶段分别为:0~72 hpf为鱼鳔组织出芽(BP)和预充气(Pre-IP)阶段(Ⅰ阶段), 72~120 hpf为鱼鳔的充气阶段(Ⅱ阶段), 120 ~168 hpf为鱼鳔的充气完成后阶段(Ⅲ阶段), 具体见图 1.基于预实验结果, 采用1、5、10、15 mg·L-1 4个nano-ZnO浓度梯度对不同发育时间(0 hpf~孵化前、0~120 hpf、0~168 hpf、孵化后~120 hpf、120~168 hpf)斑马鱼胚胎进行暴露处理.
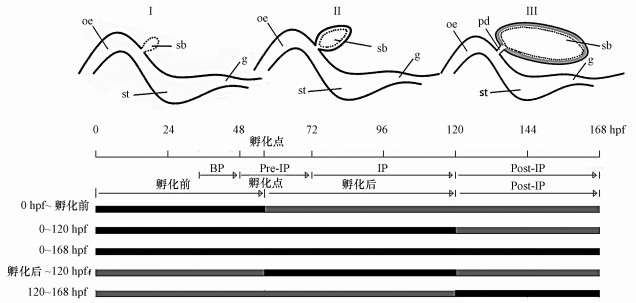 |
| 图 1 0~168 hpf斑马鱼鱼鳔发育充气过程及nano-ZnO暴露处理阶段 (sb:鱼鳔, oe:食道, pd:鳔管, st:腹部, g:肠道, BP:鱼鳔组织出芽, Pre-IP:预充气, IP:充气, Post-IP:充气完成后, 孵化点(胚胎孵化的时间点)在48~72 hpf之间, 黑色线段表示为nano-ZnO悬浮液对斑马鱼进行暴露的时间段, 灰色线段表示为培养液培养的时间段) Fig. 1 The inflatable process of 0~168 hpf zebrafish swim bladder development and the time stages of nano-ZnO exposure treatment |
鱼鳔组织出芽阶段(0 hpf~孵化前), 胚胎从0 hpf直接暴露于nano-ZnO悬浮液至孵化前, 当胚胎孵化成幼鱼后, 立即把幼鱼转移至培养液继续培养;部分延迟孵化的胚胎, 在72 hpf时同样转移至培养液继续培养.
鱼鳔组织出芽和充气阶段(0~120 hpf), 将胚胎从0 hpf暴露于nano-ZnO悬浮液至120 hpf鱼鳔(后室)充气完成, 随后把幼鱼转移至培养液继续培养.
从胚胎到幼鱼暴露7 d阶段(0~168 hpf), 即斑马鱼胚胎从0 hpf暴露nano-ZnO至168 hpf.
鱼鳔充气阶段(孵化后~120 hpf), 当胚胎孵化成幼鱼后, 把幼鱼转移至nano-ZnO悬浮液中暴露至120 hpf, 120 hpf后再转移至培养液培养至168 hpf.
鱼鳔充气完成后(120~168 hpf), 即斑马鱼胚胎从0 hpf在培养液中培养至120 hpf, 随后把幼鱼转移至nano-ZnO悬浮液中暴露至168 hpf.
每个暴露阶段的测试均在168 hpf结束, 同时测定并统计斑马鱼的死亡率、鱼鳔缺损率、鱼鳔面积大小(鱼鳔侧面的平面面积大小)等.鱼类死亡判定参照中华人民共和国国家标准GB/T 21807-2008.
2.7 数据统计分析在体式显微镜下观察胚胎发育, 拍照, 记录, 统计死亡率、鱼鳔缺损率、鱼鳔面积等毒理学终点指标.使用SPSS进行回归计算, 得出LC50(50%死亡率发生的非线性回归浓度)、EC50(50%鱼鳔缺损率非线性回归估计浓度), 用Origin 8.5进行作图.使用Image J对体视显微镜拍摄的斑马鱼幼鱼图片进行鱼鳔面积统计.鱼鳔缺损率按照公式(1)计算确定.
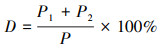
|
(1) |
式中, D为鱼鳔缺损率;P1为鱼鳔发育缺损、萎缩个数(个);P2为鱼鳔充气不完全个数(个);P为暴露斑马鱼的总个数(个).
3 结果(Results) 3.1 nano-ZnO形貌表征及纳米粒径对nano-ZnO进行电镜形貌观察, 并通过DLS测试其颗粒分散情况和粒径大小分布, 结果如图 2所示.从图 2a可见, nano-ZnO悬浮液中颗粒团聚现象明显, 颗粒形态多为棒状和块状, 且颗粒大小不一;平均直径在30 nm以上, 最大颗粒直径达到400~500 nm.从图 2b可见, nano-ZnO悬浮液中颗粒的光强粒度分布在30~50 nm之间, 但其分散指数(PDI)为1.000, 证明其分散性能极差, 颗粒分布不均匀, 所以nano-ZnO颗粒的平均直径大于30 nm.
 |
| 图 2 nano-ZnO悬浮液中纳米颗粒的表面形貌(a)和光强粒度分布图(b) Fig. 2 Surface morphology of nanoparticles (a) and size distribution (b) by intensity in nano-ZnO suspension |
nano-ZnO对斑马鱼胚胎的毒性效应有可能与其悬浮液中释放的Zn2+有关.采用原子吸收法对各浓度组的nano-ZnO悬浮液中的Zn2+进行测定, 结果显示, 1、5、10、15 mg·L-1的nano-ZnO悬浮液中, 其溶解的Zn2+浓度分别为0.53、1.91、3.37、3.56 mg·L-1.配制相同Zn2+浓度的硫酸锌溶液, 对斑马鱼胚胎进行暴露测试, 结果如图 3所示.
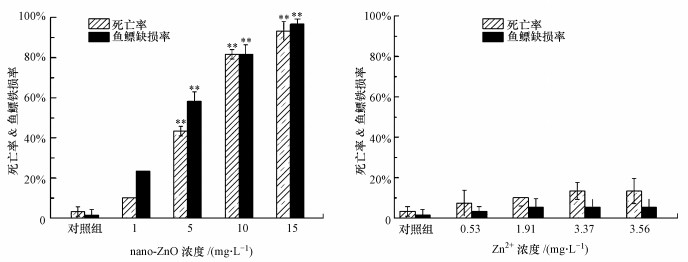 |
| 图 3 nano-ZnO(a)与Zn2+(b)对168 hpf斑马鱼死亡率和鱼鳔缺损率的影响 (**p < 0.01, 表示与对照组之间有极显著性差异, n=4) Fig. 3 Effects on the mortality(a) and swim bladder defect rate(b) of 168 hpf zebrafish treated by nano-ZnO and Zn2+ |
从图 3a可见, 斑马鱼的死亡率和鱼鳔缺损率均随着nano-ZnO处理浓度的升高而升高, 呈现一定的浓度-效应关系.5、10、15 mg·L-1处理组中, 斑马鱼的死亡率和鱼鳔缺损率均与对照组相比具有显著的统计学差异(**p < 0.01).相反地, 从图 3b可见, 各浓度下nano-ZnO对应溶解的Zn2+浓度(0.53、1.91、3.37、3.56 mg·L-1)均对斑马鱼死亡率和鱼鳔缺损率影响较小, 与对照组相比, 没有显著差异.这说明nano-ZnO悬浮液中溶解的Zn2+可能有助于nano-ZnO的毒性效应, 但并不是导致斑马鱼死亡的唯一或主要原因.
3.3 nano-ZnO对不同处理组斑马鱼胚胎死亡率的影响在不同暴露阶段nano-ZnO对斑马鱼的168 hpf死亡率如图 4、图 5所示.从图 4可见, 对照组斑马鱼的死亡率不超过5%, 实验条件满足要求.在3个阶段的nano-ZnO处理组中, 斑马鱼的死亡率均随着处理浓度的升高而升高, 呈现一定的浓度-效应关系.浓度为15 mg·L-1的nano-ZnO在这3个暴露阶段对斑马鱼造成的168 hpf死亡率均超过了90%.采用线性回归法获得3个暴露阶段的168 hpf斑马鱼胚胎死亡的LC50分别为6.613、4.803、4.419 mg·L-1.这表明nano-ZnO从0 hpf的斑马鱼胚胎开始暴露, 斑马鱼死亡率随着暴露时间的增加而增加, 存在时间-效应关系.从图 5可见, 3个暴露阶段(0 hpf~孵化前、孵化后~120 hpf、120~168 hpf)分别对应了斑马鱼鱼鳔的出芽阶段、充气阶段、充气完成后阶段.在同一暴露时段内, 低浓度(1 mg·L-1)的nano-ZnO对出芽阶段斑马鱼的168 hpf死亡率影响较小, 尤其是在鱼鳔充气阶段或完成充气后阶段, 斑马鱼的168 hpf死亡率与对照组相比没有统计学差异.在同等浓度nano-ZnO暴露下(5、10、15 mg·L-1), 在鱼鳔出芽阶段(0 hpf~孵化前)斑马鱼死亡率最高, 对充气阶段(孵化后~120 hpf)的幼鱼暴露, 斑马鱼的死亡率与孵化前相比均明显下降.出芽阶段、充气阶段、完成充气后阶段斑马鱼168 hpf死亡率的LC50分别为6.613、11.847、488.984 mg·L-1.
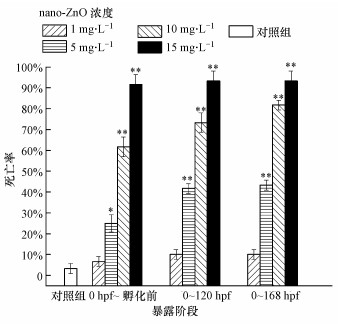 |
| 图 4 168 hpf斑马鱼在3个暴露阶段 (0hpf~孵化前、0~120 hpf、0~168 hpf)的死亡率(*p < 0.05, **p < 0.01, 分别表示与对照组之间有显著性和极显著性差异, n=4) Fig. 4 The mortality of 168 hpf zebrafish in the exposure range of 0 hpf~before hatching, 0~120 hpf, 0~168 hpf |
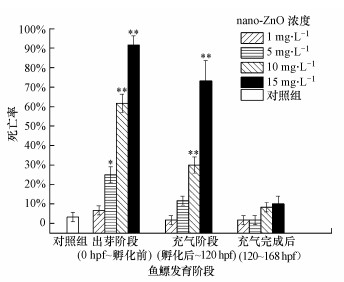 |
| 图 5 nano-ZnO对斑马鱼鱼鳔发育各阶段处理后168 hpf的死亡率 (*p < 0.05, **p < 0.01, 分别表示与对照组之间有显著性和极显著性差异, n=4) Fig. 5 The swim bladder defect rate of 168 hpf zebrafish at various swim bladder developmental stages treated by nano-ZnO |
对nano-ZnO染毒后斑马鱼鱼鳔发育情况进行了形态学特征观察, 结果如图 6所示.由图 6a和图 6d对比发现, nano-ZnO暴露的斑马鱼胚胎在72 hpf时仍未能孵化, 而对照组的斑马鱼已孵化成幼鱼, 这与Chen等(2014)报道的nano-ZnO抑制斑马鱼胚胎的孵化时间结果一致.图 6d为处理组72 hpf斑马鱼胚胎的暗视场显微镜观察结果, 可明显观察到有白色颗粒覆盖在胚胎的上半部分, 其他实验组斑马鱼也可看到相同的状况.从图 6b和6e对照组和处理组96 hpf斑马鱼幼鱼比较可见, 在nano-ZnO处理组幼鱼的头部和腹部也积聚了明显的颗粒物.推测可能是nano-ZnO颗粒沉降并覆盖在胚胎绒毛膜的表面或者幼鱼的体表.图 6c中对照组的斑马鱼在120 hpf已完成鱼鳔的充气, 而图 6f中nano-ZnO暴露下的斑马鱼的鱼鳔明显没有充气现象, 但可以看到鱼鳔的存在.这表明nano-ZnO处理不仅延迟了鱼胚胎的孵化, 而且影响了鱼鳔的发育和充气过程.
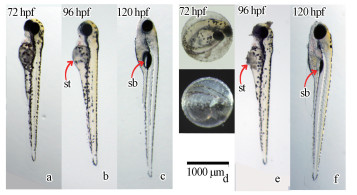 |
| 图 6 nano-ZnO对斑马鱼发育的影响 (a、b、c分别为对照组斑马鱼72、96、120 hpf的发育状态, d、e、f分别为暴露在5 mg·L-1 nano-ZnO的斑马鱼发育状态, sb为鱼鳔、st为腹部) Fig. 6 Effects on zebrafish development treated by nano-ZnO |
从图 7可见, 168 hpf斑马鱼正常发育的幼鱼鱼鳔已经发育和充气完成, 浮在水面或腹部贴着容器壁.而nano-ZnO处理组168 hpf斑马鱼出现部分鱼鳔畸形和脊椎弯曲的毒性效应特征, 主要表现为斑马鱼鱼鳔的充气不足(即鱼鳔体积明显小于对照组鱼鳔体积), 且斑马鱼会出现不同程度的脊椎弯曲, 部分幼鱼的腹部(即肠道部分)会出现灰色的团聚物.鱼鳔的发育缺损与充气不足会导致斑马鱼幼鱼的游泳活动性能受损, 不能在水体中垂直移动.大部分鱼鳔缺损或充气不足的幼鱼在静水状态下会侧身躺在容器的底部, 幼鱼仍然存活(保持心跳)并不会立即死亡, 但基本上活动性能受阻, 严重的已经无法活动(用解剖针轻轻触碰幼鱼尾部, 没有任何活动现象), 最终导致其死亡.
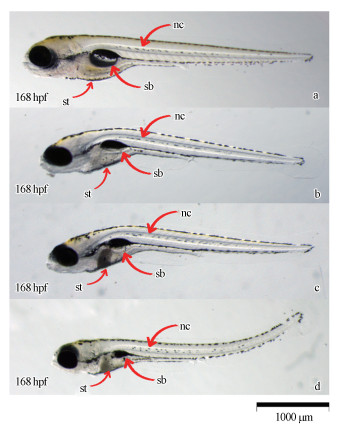 |
| 图 7 nano-ZnO对斑马鱼造成的鱼鳔缺损的形态特征 (a为对照组斑马鱼, b、c、d为nano-ZnO引起斑马鱼鱼鳔畸形和脊椎弯曲的3种形态特征, nc为脊椎, sb为鱼鳔, st为腹部) Fig. 7 Characteristic of zebrafish′s swim bladder defect treated by nano-ZnO |
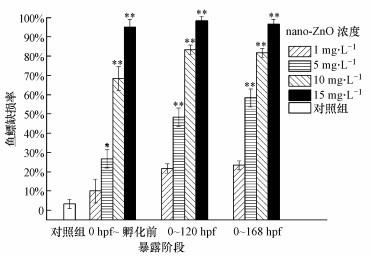
对不同暴露阶段nano-ZnO暴露处理后斑马鱼鱼鳔发育的缺损率进行统计, 结果如图 8、图 9所示.从图 8可见, 对照组斑马鱼胚胎的鱼鳔缺损率不超过5%, 而nano-ZnO处理组斑马鱼鱼鳔缺损率均呈现一定的时间-效应和剂量-效应关系.15 mg·L-1 nano-ZnO对0 hpf~孵化前、0~120 hpf、0~168 hpf阶段斑马鱼均造成90%以上的鱼鳔缺损率.根据浓度效应拟合法获得nano-ZnO悬浮液对斑马鱼胚胎0 hpf~孵化前、0~120 hpf、0~168 hpf进行暴露, 引起斑马鱼鱼鳔发育缺损的EC50分别为5.682、3.236、2.895 mg·L-1.
 |
| 图 8 168 hpf斑马鱼在3个暴露阶段下 0 hpf~孵化前、0~120 hpf、0~168 hpf)的鱼鳔缺损率(*p < 0.05, **p < 0.01, 分别表示与对照组之间有显著性和极显著性差异, n=4) Fig. 8 The swim baldder defect rate of 168 hpf zebrafish at different exposure periods of 0 hpf-before hatching, 0~120 hpf, 0~168 hpf |
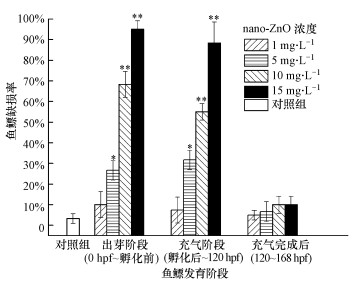 |
| 图 9 nano-ZnO对斑马鱼鱼鳔发育各阶段处理后168 hpf的鱼鳔缺损率 (*p < 0.05, **p < 0.01, 分别表示与对照组之间有显著性和极显著性差异, n=4) Fig. 9 The swim bladder defect rate of 168 hpf zebrafish at different exposure periods treated by nano-ZnO |
从图 9可见, 在相同暴露浓度下, nano-ZnO在鱼鳔出芽阶段、鱼鳔充气阶段和充气完成后阶段对斑马鱼鱼鳔缺损率的影响不同.nano-ZnO浓度越高, 出芽阶段和充气阶段斑马鱼鱼鳔的缺损率越高, 呈现一定的浓度-效应关系.1 mg·L-1 nano-ZnO低浓度处理, 在斑马鱼鱼鳔出芽阶段、充气阶段和充气完成后阶段对鱼鳔缺损率的影响均很小, 没有统计学差异.对于5、10、15 mg·L-1的nano-ZnO处理组, 斑马鱼在出芽阶段(0 hpf~孵化前)和充气阶段(孵化后~120 hpf)的鱼鳔缺损率均很高, 与对照组相比, 具有显著性的统计学差异(*p < 0.05, **p < 0.01).在同等浓度下, 斑马鱼在鱼鳔充气完成后阶段(120~168 hpf)暴露, 鱼鳔缺损率最低, 与对照组无统计学差异.鱼鳔3个发育阶段nano-ZnO悬浮液引起斑马鱼鱼鳔发育缺损的EC50分别为5.682 mg·L-1、6.239 mg·L-1、9.107 g·L-1.对所有处理组斑马鱼的死亡率和鱼鳔缺损率进行总的相关分析, 发现两者之间存在显著的相关性(r=0.978, p < 0.01).
3.6 nano-ZnO暴露对斑马鱼鱼鳔尺寸的影响实验对168 hpf斑马鱼鱼鳔面积进行测量, 结果如图 10所示.15 mg·L-1 nano-ZnO处理组中斑马鱼168 hpf的死亡率高达90%, 由于没有足够的样品量, 故只对另外其他组斑马鱼进行测定.
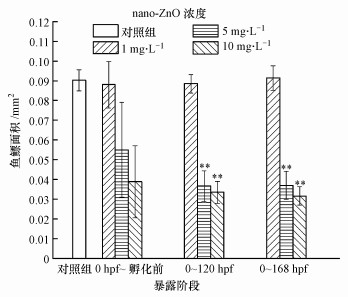 |
| 图 10 0 hpf~孵化前、0~120 hpf、0~168 hpf暴露阶段和对照组的168 hpf斑马鱼鱼鳔的面积 (**p < 0.01, 表示与对照组之间有极显著性差异, n=4) Fig. 10 The area of 168 hpf zebrafish swim bladders in the 3 exposure ranges(0 hpf~before hatching、0~120 hpf、0~168 hpf) and the control group |
从图 10可见, 对照组斑马鱼168 hpf的鱼鳔面积为0.085~0.095 mm2, 0 hpf ~孵化前、0~120 hpf、0~168 hpf暴露阶段内斑马鱼幼鱼鱼鳔面积随着5、10 mg·L-1 nano-ZnO暴露时间的延长, 依次减小, 呈现时间-效应关系.但浓度为1 mg·L-1 nano-ZnO处理组的鱼鳔面积与暴露时间无关, 并不会对鱼鳔面积造成显著影响.10 mg·L-1处理组斑马鱼在0~168 hpf暴露处理后其鱼鳔平均面积最小, 约为0.025 mm2, 与对照组相比缩小了70%.同一暴露阶段内, 随着处理浓度的升高, 斑马鱼的鱼鳔面积降低.但由于0 hpf~孵化前暴露阶段中, 鱼鳔面积的误差较大, 所以并不能很好地说明nano-ZnO暴露处理与鱼鳔面积之间呈现出显著的剂量-效应关系.
从图 11各处理组斑马鱼鱼鳔面积可见, 在斑马鱼出芽阶段和充气阶段, 5、10 mg·L-1 nano-ZnO处理组斑马鱼的个体鱼鳔面积误差较大, 其原因可能是nano-ZnO延迟了鱼鳔的发育时间, 出芽阶段(0 hpf~孵化前)、充气阶段(孵化后~120 hpf)这两个阶段进行nano-ZnO暴露后, 会将斑马鱼转移至培养液继续培养(即无毒培养)至168 hpf, 在无毒培养的阶段(孵化后~168 hpf、120~168 hpf), 斑马鱼鱼鳔有可能从损伤中得到恢复, 但恢复的情况个体差异较大, 因此, 鱼鳔的面积会有较大的误差.有关nano-ZnO对鱼鳔面积造成影响的规律还需要进一步详细研究.充气完成后阶段(120~168 hpf), 斑马鱼处理组与对照组幼鱼的鱼鳔面积无显著差异, 这表明nano-ZnO对完成鱼鳔充气的斑马鱼幼鱼造成的毒性影响较小.
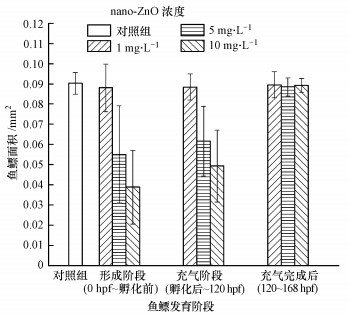 |
| 图 11 nano-ZnO对斑马鱼鱼鳔发育各阶段处理后的168 hpf鱼鳔面积 Fig. 11 The area of 168 hpf zebrafish′s swim bladder at different exposure periods treated by nano-ZnO |
鱼鳔是大部分硬骨鱼类的重要功能器官.若在鱼鳔发育过程中受到污染物影响而失去正常的生理功能, 会给鱼类的生存带来很大的威胁, 因此, 有学者建议将鱼鳔毒性评价纳入鱼类胚胎毒性测试方案中, 作为必要的常规检测指标(Li et al., 2011).本研究证明了nano-ZnO悬浮液中释放的Zn2+可能有助于nano-ZnO的毒性效应, 但并不是导致斑马鱼死亡和鱼鳔缺损的唯一或主要原因.本研究发现, nano-ZnO暴露后斑马鱼胚胎和幼鱼的死亡率与暴露浓度之间呈现一定的剂量-效应和时间-效应关系.同等浓度nano-ZnO(5、10、15 mg·L-1)暴露下, 在鱼鳔出芽阶段(0 hpf~孵化前)引起的斑马鱼死亡率最高, 充气阶段(孵化后~120 hpf)的幼鱼死亡率较低.同时, nano-ZnO处理组的斑马鱼孵化延迟, 胚胎表面和幼鱼体表会有颗粒物粘附, 且鱼鳔发育和充气的生理过程受到影响, 主要表现为斑马鱼鱼鳔发育受损和鱼鳔充气不足.nano-ZnO处理组斑马鱼鱼鳔的缺损率与暴露时间和浓度之间均呈现一定的时间-效应和剂量-效应关系.15 mg·L-1的nano-ZnO引起出芽阶段和充气阶段斑马鱼鱼鳔缺损率达90%以上.nano-ZnO对孵化前鱼鳔的出芽阶段影响最大, 而出芽阶段发生在胚胎孵化前, 根据Yu等(2011)的研究, nano-ZnO可以透过绒毛膜进入到胚胎体内, 被胚胎吸收最终导致胚胎部分细胞的凋亡, 导致斑马鱼鱼鳔功能受损.本研究结果也发现nano-ZnO暴露后, 缺损的斑马鱼鱼鳔面积减小或者充气功能受损, 10 mg·L-1nano-ZnO持续暴露后的168 hpf, 斑马鱼幼鱼鱼鳔平均面积最小, 约为0.025 mm2, 约为对照组的1/4.在实验研究的时间和浓度范围内, nano-ZnO对鱼鳔充气完成后(120~168 hpf)的幼鱼鱼鳔缺损率影响较小.根据Stinckens等(2018)的研究, 完成了鱼鳔充气的幼鱼具备了较好的游泳活动性能, 多数时间会在接近液面的高度活动而获得氧气, 并减少了游泳活动的能量损耗, 而nano-ZnO的沉降性导致其在溶液中的分布不均匀, 靠近悬浮液液面部分其实际浓度相对较低(Majedi et al., 2014; Sigg et al., 2014; Choi et al., 2018).因此, 斑马鱼幼鱼的活动性能增强可能在一定程度上也协助个体主动避开了高浓度nano-ZnO带来的损害.
经相关性分析, 斑马鱼鱼鳔缺损率和死亡率有显著相关性, 说明鱼鳔的发育缺损或者充气不足是造成胚胎死亡的主要原因之一.鱼鳔是由食道上皮组织的外翻形成的(Ao et al., 2011), nano-ZnO对鱼鳔发育阶段的影响表明, nano-ZnO很有可能是通过消化系统进入体内.本研究也发现nano-ZnO处理组, 部分胚胎和幼鱼的腹部(即肠道部分)会出现灰色的团聚物, 这些团聚物与nano-ZnO的处理浓度和时间有关.因此, 水体中nano-ZnO很有可能在消化系统内形成团聚物, 从而堵塞了鳔管或者导致鳔管发育停止, 进而影响了鱼鳔的发育和充气.根据Winata等(2009)的研究, 鱼鳔发育的3个阶段都由相应的信号通道调控, 并且由信号通过组织层之间的串扰发生协调的生长和组织, 关于nano-ZnO是否通过干扰信号的传递或信号与受体组织的结合从而影响了鱼鳔的发育值得进一步研究.
另外, 对nano-ZnO暴露下斑马鱼形态学特征观察发现, nano-ZnO引起部分斑马鱼鱼鳔缺损的同时, 多数斑马鱼会伴有一定概率的脊椎弯曲, 这与Hagenaars等(2014)的研究中全氟辛烷磺酸引起斑马鱼毒性效应的影响结果相似.斑马鱼鱼鳔的发育与脊椎发育两种效应在时间上是一致的(Panzica-kelly et al., 2010), 鱼鳔的缺损和损伤可能会继发斑马鱼胚胎的发育畸形(如心包水肿心力衰竭、脊椎弯曲等)(Yue et al., 2015), 而鱼鳔发育的缺损导致脊椎弯曲的可能性很大, 其作用的途径和机理还有待详细研究.
5 结论(Conclusions)1) nano-ZnO会造成斑马鱼鱼鳔发育的缺损或充气不足, 伴随有骨骼弯曲, 肠道有灰色团聚物等症状.
2) nano-ZnO悬浮液中溶解的Zn2+可能有助于nano-ZnO的毒性效应, 但并不是导致斑马鱼死亡和鱼鳔缺损的唯一或主要原因.
3) nano-ZnO对斑马鱼孵化前鱼鳔出芽阶段的影响最大, 对完成鱼鳔充气后的幼鱼影响最小.
4) nano-ZnO暴露引起斑马鱼致死率和鱼鳔缺损率与暴露浓度之间均存在一定的剂量-效应和时间-效应关系, 且两者之间存在显著的相关性(r=0.978, p < 0.01).
5) nano-ZnO暴露对鱼鳔发育尺寸有很大影响, 处理组鱼鳔的面积明显低于对照组, 但由于斑马鱼个体差异的影响, 暴露鱼鳔面积误差较大, 不确定nano-ZnO与鱼鳔面积之间是否存在剂量-效应关系.
Ao Y, Svitlana K, Winata C L, et al. 2011. Wnt signaling is required for early development of zebrafish swimbladder[J]. Plos One, 6(3): e18431. DOI:10.1371/journal.pone.0018431 |
Bai W, Zhang Z, Tian W, et al. 2010. Toxicity of zinc oxide nanoparticles to zebrafish embryo:a physicochemical study of toxicity mechanism[J]. Journal of Nanoparticle Research, 12(5): 1645-1654. DOI:10.1007/s11051-009-9740-9 |
Chen T H, Lin C C, Meng P J. 2014. Zinc oxide nanoparticles alter hatching and larval locomotor activity in zebrafish (Danio rerio)[J]. Journal of Hazardous Materials, 277(4): 134-140. |
Choi J S, Kim R O, Yoon S, et al. 2016. Developmental toxicity of zinc oxide nanoparticles to zebrafish (Danio rerio):A transcriptomic analysis[J]. Plos One, 11(8): e160763. DOI:10.1371/journal.pone.0160763 |
Choi J S, Song J, Yoon S, et al. 2018. Predicting ZnO nanoparticle and ZnSO4 toxicity from zebrafish embryo gene expression[J]. Molecular & Cellular Toxicology, 14(1): 19-26. DOI:10.1007/s13273-018-0003-7 |
陈展明, 杜青平, 刘倩, 等. 2017. 纳米二氧化钛致日本青鳉鱼胚胎毒性效应特征[J]. 环境化学, 36(12): 2729-2737. DOI:10.7524/j.issn.0254-6108.2017032004 |
Grillo R, Rosa A H, Fraceto L F. 2015. Engineered nanoparticles and organic matter:A review of the state-of-the-art[J]. Chemosphere, 119: 608-619. DOI:10.1016/j.chemosphere.2014.07.049 |
Hagenaars A, Stinckens E, Vergauwen L, et al. 2014. PFOS affects posterior swim bladder chamber inflation and swimming performance of zebrafish larvae[J]. Aquatic Toxicology, 157: 225-235. DOI:10.1016/j.aquatox.2014.10.017 |
韩建, 何秋霞, 韩利文, 等. 2016. 化学污染物对鱼鳔的毒理学研究进展[J]. 生态毒理学报, 11(6): 37-43. |
Li J, Liang Y, Zhang X, et al. 2011. Impaired gas bladder inflation in zebrafish exposed to a novel heterocyclic brominated flame retardant tris(2, 3-dibromopropyl) isocyanurate[J]. Environmental Science & Technology, 45(22): 9750-9757. DOI:10.1021/es202420g |
Lindsey B W, Smith F M, Croll R P. 2010. From inflation to flotation:contribution of the swimbladder to whole-body density and swimming depth during development of the zebrafish (Danio rerio)[J]. Zebrafish, 7(1): 85-96. DOI:10.1089/zeb.2009.0616 |
Majedi S M, Kelly B C, Lee H K, et al. 2014. Combined effects of water temperature and chemistry on the environmental fate and behavior of nanosized zinc oxide[J]. Science of the Total Environment, 496(496C): 585-593. |
Panzica-Kelly J M, Zhang C X, Danberry T L, et al. 2010. Morphological score assignment guidelines for the dechorionated zebrafish teratogenicity assay[J]. Birth Defects Research Part B Developmental & Reproductive Toxicology, 89(5): 382-395. DOI:10.1002/bdrb.20260 |
Raja A, Ashokkumar S, Marthandam R P, et al. 2018. Eco-friendly preparation of zinc oxide nanoparticles using Tabernaemontana divaricata and its photocatalytic and antimicrobial activity[J]. Journal of Photochemistry and Photobiology B Biology, 181: 53-58. DOI:10.1016/j.jphotobiol.2018.02.011 |
Samaee S M, Rabbani S, Jovanovic' B, et al. 2015. Efficacy of the hatching event in assessing the embryo toxicity of the nano-sized TiO2 particles in zebrafish:A comparison between two different classes of hatching-derived variables[J]. Ecotoxicology & Environmental Safety, 116: 121-128. DOI:10.1016/j.ecoenv.2015.03.012 |
Sigg L, Behra R, Groh K, et al. 2014. Chemical aspects of nanoparticle ecotoxicology[J]. CHIMIA International Journal for Chemistry, 68(11): 806-811. DOI:10.2533/chimia.2014.806 |
Stinckens E, Vergauwen L, Ankley G T, et al. 2018. An AOP-based alternative testing strategy to predict the impact of thyroid hormone disruption on swim bladder inflation in zebrafish[J]. Aquatic Toxicology, 200: 1-12. DOI:10.1016/j.aquatox.2018.04.009 |
Stinckens E, Vergauwen L, Schroeder A L, et al. 2016. Impaired anterior swim bladder inflation following exposure to the thyroid peroxidase inhibitor 2-mercaptobenzothiazole part Ⅱ:Zebrafish[J]. Aquatic Toxicology, 173: 204-217. DOI:10.1016/j.aquatox.2015.12.023 |
Villeneuve D, Volz D C, Embry M R, et al. 2014. Investigating alternatives to the fish early-life stage test:a strategy for discovering and annotating adverse outcome pathways for early fish development[J]. Environmental Toxicology & Chemistry, 33(1): 158-169. DOI:10.1002/etc.2403 |
Winata C L, Korzh S, Kondrychyn I, et al. 2009. Development of zebrafish swimbladder:The requirement of Hedgehog signaling in specification and organization of the three tissue layers[J]. Developmental Biology, 331(2): 222-236. DOI:10.1016/j.ydbio.2009.04.035 |
Xu J P, Zhang R T, Zhang T, et al. 2017. Copper impairs zebrafish swimbladder development by down-regulating wnt signaling[J]. Aquatic Toxicology, 192: 155-164. DOI:10.1016/j.aquatox.2017.09.018 |
Yu L P, Fang T, Xiong D W, et al. 2011. Comparative toxicity of nano-ZnO and bulk ZnO suspensions to zebrafish and the effects of sedimentation, ·OH production and particle dissolution in distilled water[J]. Journal of Environmental Monitoring, 13(7): 1975-1982. DOI:10.1039/c1em10197h |
Yue M S, Peterson R E, Heideman W. 2015. Dioxin inhibition of swim bladder development in zebrafish:Is it secondary to heart failure?[J]. Aquatic Toxicology, 162: 10-17. DOI:10.1016/j.aquatox.2015.02.016 |
Zhao X, Wang S, Wu Y, et al. 2013. Acute ZnO nanoparticles exposure induces developmental toxicity, oxidative stress and DNA damage in embryo-larval zebrafish[J]. Aquatic Toxicology, 136(14): 49-59. |
 2020, Vol. 40
2020, Vol. 40


